Abstract
Status epilepticus is a severe neurological disease associated with substantial mortality and health-care cost. Treatment of status epilepticus should proceed without delay even in the pre-hospital setting because prolonged generalized convulsive seizures may lead to neuronal injury, pharmacoresistance, and poor prognosis. These concepts have led to the establishment of an updated treatment algorithm emphasizing a more rapid escalation to third-line therapy for refractory convulsive status epilepticus. This article reviews the guidelines and current evidence for the management of status epilepticus.
Go to : 
뇌전증지속상태는 심한 후유증이 발생할 수도 있는 응급 질환으로 환자 상태에 대한 빠른 판단과 처치가 필요하다. 초기의 빠른 경련조절이 환자의 예후에 큰 영향을 미치기 때문에 내원 전 처치에 대한 중요성이 대두되고 있으며, 내원 후에도 경련이 조절되지 않으면 60분 이내에 삼차약제까지 약물 치료가 시작되어야 한다. 이러한 치료경향은 최근 발표된 미국 뇌전증 협회의 경련성 뇌전증지속상태 치료 지침에도 반영되었다[1]. 본 논문에서는 현재까지 발표된 뇌전증지속상태의 치료지침에 대해 알아보고, 최근 바뀌고 있는 치료 동향에 대해 살펴보도록 한다.
Go to : 
뇌전증지속상태는 경련 시간이 길어질수록 약물저항성이 높아지고 신경손상이 발생하기 때문에 빨리 치료를 시작할수록 치료효과가 좋으며 예후도 개선된다[2,3]. 뇌전증지속상태로 확인되면 지체 없이 치료를 시작해야 하며, 이러한 이유로 내원 전 처치의 중요성이 대두되고 있다[4,5]. 소아 난치성 뇌전증 환자에서 경련이 길게 지속될 경우 보호자나 간병인이 직접 병원 내원하기 전 직장 내로 diazepam을 투여하여 경련을 멈추도록 하는 치료가 효과가 있음이 이미 1970년대에 보고되었다[6,7]. 뇌전증 지속상태 환자에서 병원 내원 전 benzodiazepines (lorazepam, diazepam) 투여의 효과와 안전성에 대한 무작위대조시험 이 있었으며, 병원 전 정맥 내 benzodiazepines 투여는 뇌전증지속상태 치료효과가 위약보다 우수했으며, 병원 도착 후 기관내삽관율을 감소시켰다[8].
내원 전 처치가 뇌전증지속상태 치료에 우수하다는 것이 연구를 통해 밝혀 지면서 비의료인이 시행할 수 있는 내원 전 처치의 중요성이 대두되었으며 정맥 내 투여 외에 비의료인이 쉽게 시행할 수 있는 다른 투여방법에 대한 연구가 진행되었다. 내원 전 경련조절에 있어서 구강 내 midazolam 투여가 직장 내 diazepam 투여와 효과가 비슷하거나 더 좋으며, 호흡저하의 빈도도 증가하지 않았다[9,10]. Rapid Anticonvulsant Medications Prior to Arrival Trial (RAMPART) 연구는 무작위대조시험으로, 내원 전 정맥 내 lorazepam 투여와 midazolam의 근육 내 주사를 비교한 연구로, 근육 내 midazolam 투여가 정맥 내 lorazepam 투여에 비해 합병증 및 치료효과에서 비슷한 결과를 보였다[11]. 이러한 내원 전 치료의 노력들은, 가족을 포함한 환자의 주 보호자 및 응급구조사가 빠른 처치를 할 수 있게 하여 합병증 및 신경손상을 감소 시킬 수 있다.
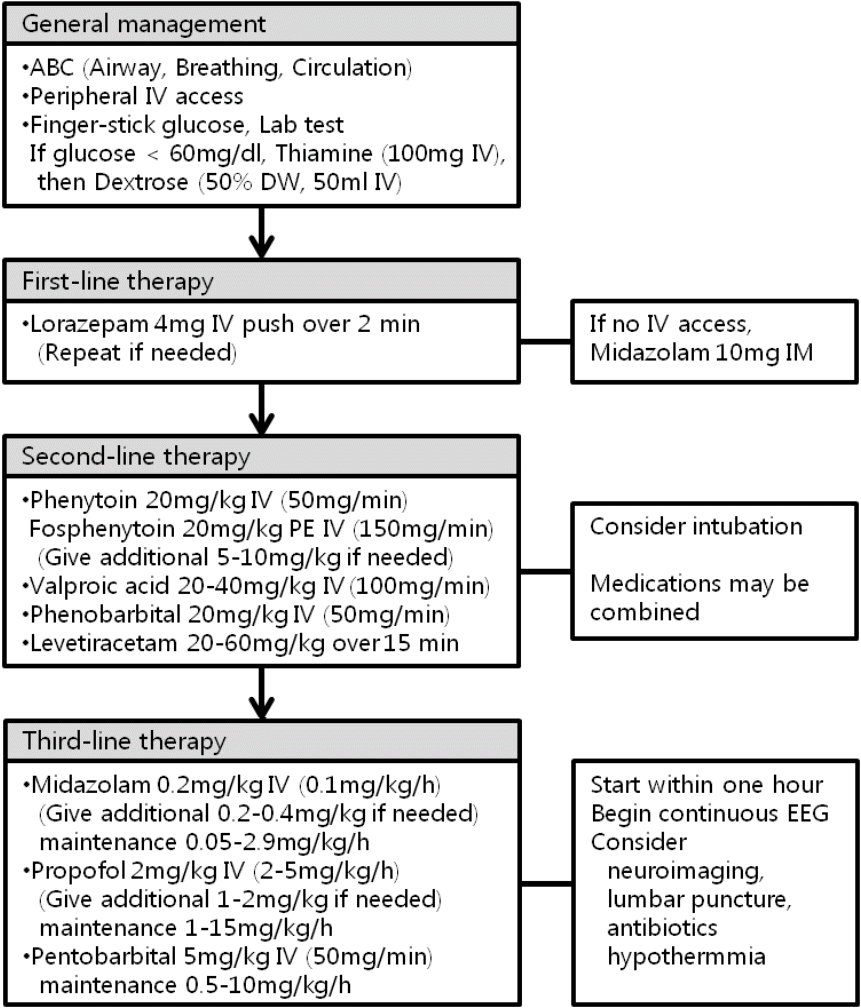
경련성 뇌전증지속상태는 응급질환으로, 다른 의식저하가 동반된 응급질환의 처치와 마찬가지로 기도확보 및 정맥로 확보가 빨리 이루어져야 한다[12,13]. 대부분의 환자는 기도확보만 되어 있으면 경련 도중에도 호흡이 가능하나, 전신 근간대성 경련은 무호흡, 청색증, 대사성 산증을 일으킬 수 있기 때문에 코삽입관이나 안면마스크 등으로 산소 공급을 해야 하며 임상적으로 호흡부전이 관찰될 경우에는 기관내삽관을 시도해야 한다. 만약 기관내삽관이 필요한 경우는 근육 경련을 잠시 멈추기 위해 단기 작용 근육이완제를 사용해야 한다. 응급실에 환자가 내원하였을 경우에는 혈당검사가 필수적이며 포도당 투여 시에는 베르니케 뇌병증을 예방하기 위해 포도당 투여와 함께 티아민 정주가 필요하다[14]. 혈당검사 외에 전해질 이상이 있는지 확인해야 하며 경련유발약물이나 독극물을 사용하고 있으면 끊도록 한다. 고열이 있는 경우 빠르게 교정한다[15].
환자의 활력징후가 안정화된 이후에는 경련이 오래 지속될수록 신경손상 및 약물 저항성이 커져서 예후가 나빠질 수 있기 때문에 경련을 빨리 멈추기 위한 처치가 즉각적으로 필요하다[4,5]. 현재까지 뇌전증지속상태의 일차약제는 benzodiazepine으로 그중에서도 lorazepam을 정맥 내 투여한다[3,8,16]. 이전 RAMPART 연구에서 midazolam 근육주사와 lorazepam의 정맥주사가 비슷한 효과를 보였지만 이 연구는 병원 내원 전 처치에 대한 연구로, 병원 내에서 정맥확보만 빨리 된다면 lorazepam 정맥 내 주사부터 실시해야 한다[11]. 경련성 뇌전증지속상태에서 1998년도에 발표된 이중맹검 무작위 대조연구에 의하면, lorazepam 단독투여, phenobarbital 단독 투여, diazepam과 phenytoin 동시투여, phenytoin 단독 투여로 네 가지 치료법을 비교하였을 때 lorazepam 투여가 phenytoin 단독 투여보다 효과적 이였으며, phenobarbital 단독 투여 및 diazepam과 phenytoin 동시 투여와 경련 조절 효과 면에서는 비슷한 결과를 보였으나, lorazepam의 정맥 내 주입이 신속하고 편리하며 경제적인 이유로 가장 선호된다[3]. 2 mg 에서 4 mg을 투여할 수 있으며 경련이 신속하게 멈추지 않는 경우 한 번 더 투여할 수 있다.
Lorazepam 투여 이후에는 경련이 조절되던 조절되지 않던 이차약제를 투여한다. 경련이 조절되었다 하더라도, benzodiazepines의 효과가 떨어지면 경련이 다시 발생하는 것을 막아야 하기 때문이다. 이차약제는 정맥 내 투여가 가능하고 치료 효과 농도로 빨리 부하투여가 가능한 phenytoin/fosphenytoin, valproic acid, levetiracetam, phenobarbital 등을 고려한다. 이전까지 지침은 phenytoin/fosphenytoin을 투여 후 호전되지 않는 경우 valproic acid, phenobarbital, levetiracetam, lacosamide 등의 이차약제를 사용하는 것이나, 처음부터 phenytoin 대신에 다른 약물을 사용해도 효과가 비슷한 결과를 보인 소규모 연구 들이 많이 발표되어 현재 대규모 연구가 진행 중이다[17]. 36명을 대상으로 diazepam과 phenytoin을 동시 투여한 그룹과 phenobarbital 단독투여 그룹을 비교한 무작위 비맹검 임상연구에서 두 그룹의 경련 감소 효과는 비슷하였으며, phenobarbital 투여가 phenytoin 투여에 비해 신속하고 편리하였다. Valproic acid과 phenytoin의 비교는 비교적 연구가 많이 되었으며 대부분의 연구에서 valproic acid가 phenytoin과 효과가 비슷하였으며[18-20], valproic acid의 치료효과가 phenytoin에 비해 우수하게 나타난 연구도 있었다[21]. 따라서, lorazepam 투여 후 이차약제의 선택은 phenytoin/fosphenytoin으로 고정하지 않고, 뇌전증지속상태의 원인과 동반질환을 고려해 결정해야 한다. 특발성 전신뇌전증 환자에서 약물금단증상으로 뇌전증지속상태가 발생하였을 때는 valproic acid나 levetiracetam을 사용하고 phenytoin/fosphenytoin은 사용하면 안 된다. 또한 심장전도지연이 있는 환자에서는 심장전도지연을 악화시킬 수 있는 phenytoin은 피하는 것이 좋다. 간부전, 혈소판 감소증 등이 있는 환자에서는 간독성 및 혈액응고장애를 일으킬 수 있는 valproic acid는 지양해야 하며, phenobarbital은 진정효과가 길게 지속되는 등의 부작용으로 최근에는 잘 사용하지 않는 추세이다[15].
Phenytoin/fosphenytoin은 뇌전증지속상태의 이차치료약제로 현재까지 가장 많이 사용하는 약물로, 비용이 다소 비싸더라도 fosphenytoin을 사용하는 것이 바람직하다. Fosphenytoin은 phenytoin의 수용성 전구물질로, fosphenytoin을 phenytoin 비해 빨리 투여하더라도 부정맥 및 저혈압의 발생빈도가 낮으며, 혈관외유출시 발생하는 purple glove syndrome도 줄일 수 있다[22]. 인산염이 부하되면서 50% 환자에서 가려움증을 일으킬 수 있으나, 알레르기 반응이 아니며 주입속도를 늦추면 증상이 호전된다. Phenytoin은 20 mg/kg를 50 mg/min 속도로 정주해야 하며 fosphenytoin은 20 mgPE (phenytoin equivalents)/kg를 150 mg/min 속도로 투여할 수 있어 세 배 빨리 투여할 수 있다. 그래도 경련이 멈추지 않을 경우 5-10 mg/kg 를 추가로 투여하여 약물농도를 치료범위 이상으로 유지한다[3]. Valproic acid를 사용하는 경우에는 통상용량 보다 고용량을 사용하는 것이 추천되며 (~40 mg/kg), 최대 6 mg/kg/min 속도로 정맥주사 할 수 있다[13,23]. 진정 및 심폐기능에 영향을 거의 주지 않는 장점이 있으나, 간독성 및 혈소판감소증 등이 발생할 수 있으므로 유의한다[18,21]. Levetiracetam은 새로운 항경련제 중에서 정맥주사가 가능하며, 상대적으로 부작용이 적고 다른 약물과 상호작용이 없어 많이 사용되고 있는 추세이다. 하지만 뇌전증지속상태 치료 효과에 대한 valproic acid 와의 비교연구에서는 valproic acid에 비해 효과가 떨어지는 것으로 발표되었다[20].
난치성 뇌전증지속상태는 benzodiazepines에 의한 일차 약제나, phenytoin, valproic acid, levetiracetam 같은 이차 약제에 경련이 멈추지 않는 경우를 말한다[24]. 난치성 뇌전증지속상태는 약물투여 후에도 임상적으로 경련이 관찰되거나, 임상적으로 경련이 관찰되지 않더라도 뇌파검사상 무증상 경련이 지속되는 경우이다. 전체 뇌전증지속상태 환자에서 대략 30-40% 환자가 난치성 뇌전증지속상태로 나타나고, 난치성 뇌전증지속상태의 사망률은 17%에서 39%로 비난치성 뇌전증지속상태에 비해 현저하게 높다[24-28].
동물실험에서 연구된 바에 따르면, 뇌전증지속상태의 급성기에는 GABA (γ-aminobutyric acid) 작용제가 효과가 좋으나, 경련 발생 5분이 지나가면서 GABA 수용체가 세포 내로 이동하면서 GABA 작용제의 효과는 점차 떨어진다[29-31]. 이로 인해 GABA receptor에 주로 작용하는 benzodiazepines의 효과는 점차 감소할 수 밖에 없으며, 이차약제에도 반응하지 않는 경우에는 빠른 경련 중지가 환자의 예후에 중요한 요인으로 인식되면서 경련 발생 후 60분 이내에 삼차약제를 시작하는 것이 바람직한 것으로 인식되고 있다[32].
뇌전증지속상태에서 가장 많이 사용되는 삼차약제로는 midazolam, propofol, pentobarbital 이다. 삼차약제 모두 부하 용량을 정맥 내 대량주입 후 일정농도로 유지한다[33]. 세 가지 약물 중에 더 효과적이거나 사망률을 낮추는 약물은 현재까지 연구로 밝혀져 있지 않다[27,34]. Midazolam은 처음에는 반감기가 짧지만, 사용하는 기간이 길어질수록 반감기도 길어진다[35]. Midazolam 같은 benzodiazepines은 사용할수록 경련에 내성이 생기는 단점이 있으며 pentobarbital에 비해 치료도중 돌발경련이 발생할 가능성이 높아 경련조절 시 약물농도의 조절이 지속적으로 필요하다. Propofol은 GABAA 수용체 활동성을 증가시키고, 나트륨 통로 차단제로 작용한다. 짧은 반감기를 가지고 있으나, propofol 사용시에는 propofol 정맥 주입 증후군을 유의하여야 한다. Propofol 정맥주입 증후군은 드물게 발생하지만, propofol을 용량을 높게 (5 mg/kg/h 이상), 길게 (48시간 이상) 사용할수록, 환자가 젊은 나이거나, 급성 신경학적 질환이 있는 경우 자주 발생하며, 횡문근융해, 대산성산증, 고칼륨혈증, 신부전, 심부전 등을 일으켜 사망에 이르게 하는 치명적인 질환이다[36]. Pentobarbital은 지방조직에 침착하는 성질이 있어 앞의 두 약제에 비해 반감기가 훨씬 길다. 일반적으로 pentobarbital은 midazolam과 propofol에 비해 경련 억제 효과는 좋으나 저혈압, 폐렴 등의 합병증은 더 빈번하게 발생한다[34-38].
난치성 뇌전증지속상태의 치료에서는 겉으로 나타나는 임상적 경련 없이 뇌파상 경련만 지속될 수 있기 때문에 적절한 약물 치료를 위하여 지속적인 뇌파 감시가 필수적이다. 돌발파억제가 어느 정도여야 하는지, 치료기간이 얼마여야 하는지에 대한 정확한 지침 및 뒷받침하는 연구는 없으나, 대개 1-2초의 돌발파 사이에는 10초 정도의 뇌파억제가 필요하다. 치료 도중 돌발 경련이 발생할 경우에는 추가용량을 일시적으로 주사하거나, 유지용량을 증량한다. 경련 발생 없이 돌발파 억제가 하루에서 이틀간 잘 유지되면 항경련제는 유지 또는 증량하면서 삼차약제의 감량을 고려해 볼 수 있다[13].
삼차약제 사용에도 경련이 조절되지 않는 경우, 악성[39] 또는 초난치성[40] 뇌전증지속상태라고 일컫는 경우가 있으며 주로 젊은 환자에서 뇌염에 의한 뇌전증지속상태가 발생한 경우에 많으며 난치성 뇌전증지속상태에서 20% 정도를 차지한다[24,39]. 이러한 경우에는 다른 삼차약제로 바꿔서 사용하거나, 두 가지 이상의 삼차약제를 함께 사용하기도 하며, N-methyl-D-aspartate 수용체에 작용하는 ketamine을 추가로 투여해 볼 수 있다. 현재까지 기술한 약물들을 제외하고, 스테로이드나 면역글로불린 등의 면역요법을 고려할 수 있으며, 케톤식이, 저체온요법, 신경외과적 수술 및 전기경련요법 등을 시도해 볼 수 있다(Table 1)[23,40,41].
Treatment of super-refractory status epilepticus
비경련성 뇌전증지속상태의 치료에 대해서는 연구보고가 별로 없고 특별한 지침도 마련되어 있지 않다. 경련성 뇌전증지속상태와 다르게 생명을 위협하는 전신 기능이상을 동반하지 않아 경련성 뇌전증지속상태에 비해서는 비응급성 질환이다. 하지만 비경련성 뇌전증지속상태에서도 경련이 오래 지속되면, 신경손상이 나타나기 때문에 빨리 진단하여 치료해야 한다[42,43]. 초기치료는 경련성 뇌전증지속상태와 마찬가지로 benzodiazepines을 사용하며, benzodiazepines에 반응이 없는 경우 추가로 이차약제를 사용한다[44]. 이차 항경련제에 반응이 없는 경우 경련성 뇌전증지속상태와는 달리 삼차약제 치료를 시작하는 것이 아니라 다른 항경련제 추가를 고려하는데, 이는 마취제 사용에 의한 합병증이 환자의 예후에 더 나쁜 영향을 끼칠 수 있기 때문이다[44,45].
Go to : 
REFERENCES
1. Glauser T, Shinnar S, Gloss D, Alldredge B, Arya R, Bainbridge J, et al. Evidence-based guideline: Treatment of convulsive status epilepticus in children and adults: Report of the guideline committee of the american epilepsy society. Epilepsy Curr. 2016; 16:48–61.

2. Young GB, Jordan KG, Doig GS. An assessment of nonconvulsive seizures in the intensive care unit using continuous EEG monitoring: an investigation of variables associated with mortality. Neurology. 1996; 47:83–9.
3. Treiman DM, Meyers PD, Walton NY, Collins JF, Colling C, Rowan AJ, et al. A comparison of four treatments for generalized convulsive status epilepticus. Veterans affairs status epilepticus cooperative study group. N Engl J Med. 1998; 339:792–8.
4. Kapur J, Macdonald RL. Rapid seizure-induced reduction of benzodiazepine and Zn2+ sensitivity of hippocampal dentate granule cell gabaa receptors. J Neurosci. 1997; 17:7532–40.
5. Jones DM, Esmaeil N, Maren S, Macdonald RL. Characterization of pharmacoresistance to benzodiazepines in the rat Li-pilocarpine model of status epilepticus. Epilepsy Res. 2002; 50:301–12.

6. Knudsen FU. Rectal administration of diazepam in solution in the acute treatment of convulsions in infants and children. Arch Dis Child. 1979; 54:855–7.

7. Hoppu K, Santavuori P. Diazepam rectal solution for home treatment of acute seizures in children. Acta Paediatr Scand. 1981; 70:369–72.

8. Alldredge BK, Gelb AM, Isaacs SM, Corry MD, Allen F, Ulrich S, et al. A comparison of lorazepam, diazepam, and placebo for the treatment of out-of-hospital status epilepticus. N Engl J Med. 2001; 345:631–7.

9. Scott RC, Besag FM, Neville BG. Buccal midazolam and rectal diazepam for treatment of prolonged seizures in childhood and adolescence: A randomised trial. Lancet. 1999; 353:623–6.

10. McIntyre J, Robertson S, Norris E, Appleton R, Whitehouse WP, Phillips B, et al. Safety and efficacy of buccal midazolam versus rectal diazepam for emergency treatment of seizures in children: A randomised controlled trial. Lancet. 2005; 366:205–10.

11. Silbergleit R, Durkalski V, Lowenstein D, Conwit R, Pancioli A, Palesch Y, et al. Intramuscular versus intravenous therapy for prehospital status epilepticus. N Engl J Med. 2012; 366:591–600.

12. Meierkord H, Boon P, Engelsen B, Gocke K, Shorvon S, Tinuper P, et al. EFNS guideline on the management of status epilepticus in adults. Eur J Neurol. 2010; 17:348–55.

13. Brophy GM, Bell R, Claassen J, Alldredge B, Bleck TP, Glauser T, et al. Guidelines for the evaluation and management of status epilepticus. Neurocrit Care. 2012; 17:3–23.

14. Sechi G, Serra A. Wernicke’s encephalopathy: new clinical settings and recent advances in diagnosis and management. Lancet Neurol. 2007; 6:442–55.

15. Lawrence JH, Gaspard N. Status epilepticus. Continuum (Minneap Minn). 2013; 19:767–94.
16. Leppik IE, Derivan AT, Homan RW, Walker J, Ramsay RE, Patrick B. Double-blind study of lorazepam and diazepam in status epilepticus. JAMA. 1983; 249:1452–4.

17. Cock HR, Group E. Established status epilepticus treatment trial (ESETT). Epilepsia. 2011; 52 Suppl 8:50–2.

18. Agarwal P, Kumar N, Chandra R, Gupta G, Antony AR, Garg N. Randomized study of intravenous valproate and phenytoin in status epilepticus. Seizure. 2007; 16:527–32.

19. Gilad R, Izkovitz N, Dabby R, Rapoport A, Sadeh M, Weller B, et al. Treatment of status epilepticus and acute repetitive seizures with i.v. valproic acid vs phenytoin. Acta Neurol Scand. 2008; 118:296–300.

20. Alvarez V, Januel JM, Burnand B, Rossetti AO. Second-line status epilepticus treatment: comparison of phenytoin, valproate, and levetiracetam. Epilepsia. 2011; 52:1292–6.

21. Misra UK, Kalita J, Patel R. Sodium valproate vs phenytoin in status epilepticus: a pilot study. Neurology. 2006; 67:340–2.

22. Browne TR, Kugler AR, Eldon MA. Pharmacology and pharmacokinetics of fosphenytoin. Neurology. 1996; 46(6 Suppl 1):S3–7.

23. Foreman B, Hirsch LJ. Epilepsy emergencies: diagnosis and management. Neurol Clin. 2012; 30:11–41. vii.

24. Mayer SA, Claassen J, Lokin J, Mendelsohn F, Dennis LJ, Fitzsimmons BF. Refractory status epilepticus: frequency, risk factors, and impact on outcome. Arch Neurol. 2002; 59:205–10.
25. Holtkamp M, Othman J, Buchheim K, Meierkord H. Predictors and prognosis of refractory status epilepticus treated in a neurological intensive care unit. J Neurol Neurosurg Psychiatry. 2005; 76:534–9.

26. Novy J, Logroscino G, Rossetti AO. Refractory status epilepticus: a prospective observational study. Epilepsia. 2010; 51:251–6.

27. Rossetti AO, Logroscino G, Bromfield EB. Refractory status epilepticus: effect of treatment aggressiveness on prognosis. Arch Neurol. 2005; 62:1698–702.
28. Betjemann JP, Josephson SA, Lowenstein DH, Burke JF. Trends in status epilepticus-related hospitalizations and mortality: redefined in US practice over time. JAMA Neurol. 2015; 72:650–5.
29. Mazarati AM, Wasterlain CG. N-methyl-d-asparate receptor antagonists abolish the maintenance phase of self-sustaining status epilepticus in rat. Neurosci Lett. 1999; 265:187–90.

30. Goodkin HP, Yeh JL, Kapur J. Status epilepticus increases the intracellular accumulation of GABAA receptors. J Neurosci. 2005; 25:5511–20.

31. Naylor DE, Liu H, Wasterlain CG. Trafficking of GABA(A) receptors, loss of inhibition, and a mechanism for pharmaco[-resistance in status epilepticus. J Neurosci. 2005; 25:7724–33.

32. Riviello JJ Jr, Claassen J, LaRoche SM, Sperling MR, Alldredge B, Bleck TP, et al. Treatment of status epilepticus: an international survey of experts. Neurocrit Care. 2013; 18:193–200.

34. Claassen J, Hirsch LJ, Emerson RG, Mayer SA. Treatment of refractory status epilepticus with pentobarbital, propofol, or midazolam: a systematic review. Epilepsia. 2002; 43:146–53.

35. Claassen J, Hirsch LJ, Emerson RG, Bates JE, Thompson TB, Mayer SA. Continuous EEG monitoring and midazolam infusion for refractory nonconvulsive status epilepticus. Neurology. 2001; 57:1036–42.

36. Vasile B, Rasulo F, Candiani A, Latronico N. The pathophysiology of propofol infusion syndrome: a simple name for a complex syndrome. Intensive Care Med. 2003; 29:1417–25.

37. Rossetti AO, Milligan TA, Vulliemoz S, Michaelides C, Bertschi M, Lee JW. A randomized trial for the treatment of refractory status epilepticus. Neurocrit Care. 2011; 14:4–10.

38. Sutter R, Marsch S, Fuhr P, Kaplan PW, Rüegg S. Anesthetic drugs in status epilepticus: risk or rescue? A 6-year cohort study. Neurology. 2014; 82:656–64.

39. Holtkamp M, Othman J, Buchheim K, Masuhr F, Schielke E, Meierkord H. A “malignant” variant of status epilepticus. Arch Neurol. 2005; 62:1428–31.

40. Shorvon S. Super-refractory status epilepticus: an approach to therapy in this difficult clinical situation. Epilepsia. 2011; 52 Suppl 8:53–6.

41. Zeiler FA, Zeiler KJ, Teitelbaum J, Gillman LM, West M. Therapeutic hypothermia for refractory status epilepticus. Can J Neurol Sci. 2015; 42:221–9.

42. Krsek P, Mikulecka A, Druga R, Kubova H, Hlinak Z, Suchomelova L, et al. Long-term behavioral and morphological consequences of nonconvulsive status epilepticus in rats. Epilepsy Behav. 2004; 5:180–91.
43. Claassen J. How I treat patients with EEG patterns on the ictal-interictal continuum in the neuro ICU. Neurocrit Care. 2009; 11:437–44.

44. Meierkord H, Holtkamp M. Non-convulsive status epilepticus in adults: Clinical forms and treatment. Lancet Neurol. 2007; 6:329–39.

45. Ferguson M, Bianchi MT, Sutter R, Rosenthal ES, Cash SS, Kaplan PW, et al. Calculating the risk benefit equation for aggressive treatment of non-convulsive status epilepticus. Neurocrit Care. 2013; 18:216–27.

46. Wijdicks EF, Hijdra A, Young GB, Bassetti CL, Wiebe S; Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the quality standards subcommittee of the american academy of neurology. Neurology. 2006; 67:203–10.

Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download