Abstract
Paroxysmal sympathetic hyperactivity (PSH) is a well-known clinical syndrome, which is frequently encountered in treating patients with severe brain injury including traumatic brain injury, hypoxic ischemic injury and severe stroke in the neuroICU. PSH is characterized by episodic hypertension, tachycardia, tachypnea, excessive diaphoresis, fever, and pathologic posturing. Although its pathophysiology is still not clearly understood, its early recognition and prompt management is mandatory in patients with brain injury. Herein, we briefly reviewed the diagnosis, prognosis and treatment of PSH.
발작교감과활성증(paroxysmal sympathetic hyperactivity)은 발작적으로 교감신경의 활성도가 증가하면서 다양한 임상증상이 발생하는 증후군으로, 심한 뇌손상 환자에서 잘 발생하기 때문에 중환자를 치료하는 신경중환자 전문의는 반드시 알고 있어야 하는 질환이다. 발작교감과활성증이 발생한 환자는 중환자실의 재원기간이 늘어나고 예후가 불량하므로, 증상을 일찍 발견하여 적절하게 치료할 필요가 있다.
1929년 Wilder Penfield에 의해 처음 문헌에 보고되었다[1]. 제3뇌실 근처의 종양을 앓고 있던 환자는 발작적으로 두통과 혈압상승, 발한 및 동공확장 증세가 발생하였고, 치료 과정 중에 결국 사망하게 되었다. 당시는 증상이 발작적으로 발생하였기 때문에 비전형적인 경련발작으로 판단하였고, 병변의 위치가 간뇌(diencephalon)에 있었기 때문에 간뇌발작(diencephalic fit or seizure)로 명명하였으나, 그 후 비슷한 증상을 보인 환자들에서 연구가 진행되면서 증상이 있을 때 뇌파를 촬영하여도 뇌전증모양방전(epileptiform discharge)은 확인된 적이 없어, 간질발작과는 관련이 없는 것으로 확인되었다. 그 이후 이 질환이 잘 알려지게 되면서 다양한 이름으로 보고되는데, 교감신경의 항진증상이 발현되므로, 자율신경이상증(dysautonomia)이라고도 하고, 발작자율신경불안정증 및 근긴장이상증(paroxysmal autonomic instability with dystonia: PAID), 교감신경폭풍(sympathetic storming), 자율신경폭풍(autonomic storming) 및 시상하부-중뇌조절증후군(hypothalamic midbrain regulation syndrome) 등으로 주로 문헌에 기술되어 있지만, 최근에는 ‘발작교감과활성증’이란 명칭이 가장 많이 사용되므로, 본 논문에서도 이 명칭을 사용하도록 한다[2,3].
교감신경의 과활성증상은 다양한 신체증상으로 발현된다. 빈맥(분당 120회 이상), 과호흡(분당 30회 이상), 발열(38.5°C 이상), 혈압상승(수축기압 160 mmHg이상) 및 동공이 확장되고, 불안초조 증상, 발한과 다양한 형태의 이상운동증상이 발생한다(Fig. 1). 이상운동증상은 근긴장이상증(dystonia)처럼 발현될 수도 있지만, 제뇌강직(decerebrated rigidity)이나 제피질강직(decorticated rigidity) 같은 병적 자세반사 (pathologic posturing reflex) 형태로 표현되기도 한다[2,4]. 심한 뇌손상 환자를 치료하면서 적절한 진정제를 사용하다가, 안정적인 상태에 있을 때 진정제 용량을 줄이면 비슷한 증상이 발현될 수 있어 임상적인 면에서 혼동할 수 있는 여지가 있고, 중환자실에서 흔히 발생하는 패혈증 및 전신염증반응증후군(systemic inflammatory response syndrome)에 의한 증상과 감별이 어려운 경우도 있다. 하지만 진정제 감량에 의한 경우는 진정제 중단 직후, 매우 짧은 기간에만 일시적으로 발생하고, 패혈증이나 염증반응과 관련되는 경우는 주로 혈압이 감소되는 형태로 나타나기 때문에 발작교감과활성증과 감별이 가능하다. 발작교감과활성증을 진단하려면, 위에 기술한 교감신경의 과활성 증상 중 4가지 이상이 발생하고, 비슷한 양상을 유발할 수 있는 패혈증, 저산소증, 통증, 저혈당증 등이 배제된 상태여야 한다[5]. 최근에는 진단의 모호성을 줄이기 위해서 정량적 지표를 이용한 표준화점수표를 사용하여 진단하려는 시도가 이루어지고 있다(Table 1)[6]. 객관적 진단지표에는 위에 기술한 임상 양상인 호흡수, 체온, 맥박, 혈압, 발한 및 병적 자세반사의 여섯 가지 증상을 중증도에 따라 개별적으로 점수화하여 합산하는 방식을 취한다.
한편 드물게는 부교감신경의 활성에 의한 증상이 주로 나타나면서 발작적으로 저혈압 및 저체온증이 발생하는 비전형적인 형태도 있는데, 대체로 뇌량무형성증(corpus callosum agenesis)이 동반된 선천뇌기형 환자에서 주로 나타난다[7-9]. 요약하면, 발작교감과활성증은 주로 교감신경계의 과활성에 의한 증상이 발현되는 경우가 훨씬 많고, 드물게는 부교감신경계의 과활성증상으로 인해 서맥, 호흡수 감소, 저체온, 동공축소 증상이 발생하는 경우도 있다. 부교감증상이 있는 경우는 하품, 한숨, 딸꾹질 등의 부가적 증상이 주기적으로 발현되며, 때로는 두 가지 종류가 상황에 따라 교대로 나타나는 경우도 있다[10].
발작교감과활성증은 심한 뇌손상 환자에서 주로 발생한다. 문헌에 가장 많이 보고된 뇌질환은 외상뇌손상(traumatic brain injury: TBI)이다[2]. 정확한 발생률은 연구에 따라 다르지만, 대체로 외상뇌손상 환자의 치료경과 중 약 7.7% 내지 많게는 33%에서 발작교감과활성증이 발생한다고 알려져 있다[11]. 그 외에도 심한 저산소뇌손상(hypoxic brain injury), 심한 뇌출혈, 특히 거미막밑출혈이나 교뇌출혈(pontine hemorrhage) 환자에서 종종 발생한다[12]. 때로는 수두증 환자에서도 발생하고[13], 뇌간에 발생한 뇌종양 환자에서도 발생한 보고가 있다[14]. 특히 자율신경계 증상이 잘 발생하는 항NMDA수용체뇌염 환자에서도 드물게 발생한다[15].
주로 증상이 발현되는 시기는 중환자실에 입실한 입원 초기와 급성기 치료가 종료되고 재활치료를 시작하는 아급성 회복기에 발생하는 두 가지 경우로 알려져 있지만, 발생 시점에 따라 원인과 병태생리가 다르지는 않다.
발작교감과활성증 진단을 내리는 데 있어 꼭 배제하여야 할 패혈증 및 저산소증, 저혈당증 이외에도 교감신경 항진증상을 일으키는 다양한 질환 증후군이 있기 때문에, 진단을 내릴 때는 매우 주의하여야 한다(Table 2).
도파민D2수용체에 길항효과를 가지는 항정신병약제를 투여한 후 약 3일 내지 9일이 경과한 환자에서 도파민 신경전달이 급격히 감소되면, 근긴장도가 증가하고 의식이 저하되며, 발열반응과 자율신경항진 증상이 발생하게 된다. 반대로, 파킨슨병 환자에서 도파민작용제를 갑자기 중단하는 경우도 비슷한 임상증상을 보일 수 있는데, 이를 파킨슨-고열증후군(Parkinsonian-hyperpyrexia syndrome)이라 하고, 신경이완제 악성증후군과 동일한 발생 기전을 갖는다. 도파민 신경전달은 시상하부의 체온조절중추인 시각전핵(preoptic nucleus)에 중요한 영향을 미치므로, 도파민 전달이 저하되면 체온조절에 이상이 있어 발열반응이 발생하고, 근 긴장도가 증가하면서 근육의 수축에 의해 근 세포의 손상이 발생하면서, 혈중에 근육손상을 반영하는 수치인 크레아틴인산활성효소(creatine phosphokinase: CPK)가 상승하고, 소변에서 미오글로빈이 검출된다. 할로페리돌이나 클로르프로마진 등의 고전적 항정신병약제를 사용한 경우에 더 흔하지만, 새로 개발된 비전형항정신병약제도 유발시킬 수 있기 때문에 주의하여야 한다. 신경이완제악성증후군 환자는 발작교감과활성증과는 달리 동공은 대체로 정상이며, 심부건반사가 느리고 저하되며, 근육 효소 수치가 증가하는 점이 감별이 도움된다. 정확한 진단을 위해서는 도파민길항제를 투약하였거나, 도파민작용제를 갑자기 중단한 병력이 있는 지를 잘 파악하여야 한다[16].
세로토닌의 활성도가 증가되어 발생하는 증상으로서, 세로토닌의 농도를 증가시키는 약물, 즉 선택적세로토닌재흡수억제제(selective serotonin reuptake inhibitor: SSRI)나 항우울제, 모노아민산화억제제(monoamine oxidase [MAO] inhibitor) 혹은 식욕억제제나 감기약 또는 트립탄계 편두통약물 등의 복용력이 있는 환자들에서 약물 상호작용에 의해 세로토닌 분해가 억제되면 과활성된 세로토닌에 의해 발생하는 질환이다[17]. 이러한 질환은 신경과 및 정신과 약물 이외에도 리네졸리드 등의 항균제나 온단세트론(ondansetron) 등의 항구토제 복용 후에도 발생할 수 있기 때문에 주의하여야 한다. 소화기계 증상으로 장운동이 항진되고 설사가 발생할 수 있고, 초조 불안과 발한, 빈맥, 혈압상승, 체온상승 및 동공 확장도 발생하여 발작교감과활성증과 혼동될 수 있다. 기본적으로 세로토닌증후군은 과운동반응(hyperkinetic)질환으로서 진전이나 근간대(clonus) 등의 증상과 함께 하지에 신전근반사(extensor stretch reflext)가 항진되지만 추체외로(extrapyramidal tract) 증상은 동반되지 않는 것이 특징이다. 정확한 감별을 위해서는 유발할 만한 약물을 투약한 적이 있는지 잘 확인하여야 한다.
악성고열은 민감도가 있는 환자에서 휘발성 흡입마취제(volatile inhalation agent)나 탈분극근이완제(depolarizing muscle relaxant)를 사용한 후에 드물게 발생하는 질환이다. 기능적으로 근형질세망(sarcoplasmic reticulum)으로부터 칼슘을 세포내로 분비되게 하여 근수축을 유도하고, 이로 인한 고열반응이 발생하는 질환이다. 주로 유발하는 약물로는 할로테인(halothane) 및 석시닐콜린(succinylcholine)이 있는데, 최근에는 사용 빈도가 줄어들면서 발생도 감소하고 있다. 증상으로는 빈맥, 저작근을 포함한 전신근육의 긴장도가 항진되면서 횡문근융해증(rhabdomyolysis)과 발열반응이 발생하며, 전신대사가 항진되어 혈중 이산화탄소농도가 증가 하고, 저산소증 및 대사성산증이 동반된다.
주로 호주 근해에 서식하는 해파리에 쏘여서 발생하는 증상으로, 연접전(presynaptic) 나트륨이온통로 활성작용을 가지는 독소 때문에, 독소에 노출된 사지의 긴장도가 증가하고 교감신경과활성 증상으로 인해 심할 경우 사망에 이르기도 한다[18]. 해파리에 쏘인 부위의 통증이 동반되므로, 특정 해역에서 해파리에 노출된 병력이 있는 지의 여부가 감별에 중요하며 국내에는 발생한 적이 없는 질환이므로 참고만 하도록 한다.
척수손상을 받은 환자에서 주로 발생하는 질환이다. 손상된 척수신경의 이하 부위에서는 신경 재생의 과정으로 탈신경과민성(denervation hypersensitivity)과 함께 교감신경절이전신경세포(sympathetic preganglionic neuron)와 체성감각신경의 뒤뿌리신경절(dorsal root ganglion) 사이에 다양한 신경연결이 발생하게 되는데, 이러한 신경의 새로운 연결과정이 자율신경이상조절증 발생의 신경학적 기전이 된다[19]. 척수손상이 발생한 후 한달 정도 경과된 후 주로 발생하는데, 그 이유는 위에 기술한 신경연결의 재배열이 이루어지기까지의 시간이 필요하기 때문이다. 손상이 발생한 척수 분절 하부에서 자극이 발생하면, 과도한 운동반사 및 교감신경 반사에 의해서 혈압상승, 두통, 시력감소, 빈맥, 발한 등의 증상이 발생한다. 원인은 주로 방광이나 대장의 자극에서 유도되는 경우가 많고, 일단 한 번 증상이 발생하면, 발생 역치가 낮아져서 약 3일 동안은 작은 자극으로도 비슷한 증상이 잘 재발한다. 손상된 척수의 하부분절에는 교감신경의 과민증상이 발생하여 피부가 창백해지지만, 손상 척수의 상부분절은 보상기전에 의해 부교감신경이 항진되면서 발한, 털세움(piloerection), 홍조(flushing) 및 반사성서맥이 발생하는 경우도 있기에, 발작교감항진증과 감별할 수 있는 임상적 참고점이 된다.
정확한 발병 기전은 알려져 있지 않다. 가장 흔하게 제시되는 가설은 간뇌의 자율신경센터와 피질, 피질하부 및 뇌간 사이에 자율신경 연결 이상이 생겨 발생하는 것으로 추정되고 있다[3,20]. 외상성뇌손상이 발생하면 피질하백색질의 미만성축삭손상(diffuse axonal injury)이 잘 동반되는데, 이러한 경우 피질하부의 교감신경흥분구조(sympathoexcitatory structure)가 탈억제(disinhibition) 되어 증상이 발생한다고 알려져 있다[21] 또한, 간뇌부위의 손상이 발생하면 그 주변 부위로의 신경연결이 기능적으로 차단되면서 주요 핵심센터인 수도관주위회색질(periaqueductal gray matter), 뇌실곁시상하부핵(paraventricular hypothalamic nucleus)이 기능이상이 발생하면서 증상이 발현한다는 가설이다. 하지만, 하부 뇌간(brainstem)의 입배가쪽연수(rostralventrolateral medulla)의 자극에 의해서도 혈압상승, 빈맥 등의 교감신경항진 증세가 발생하므로, 해부학적 병변이 꼭 뇌간상부에 있어야 하는 것은 아니다[22]. 혈압 상승, 빈맥, 과호흡등의 증상이 증상이 있을 때 측정한 혈중 카테콜아민 농도는 대개 증가되어있지만, 그 상승된 정도와 증상의 중증도는 직접 비례하지는 않는다[23].
또 다른 발병 가설로는, 정상적인 자극에 대하여 비정상적으로 과도한 반응으로 인해 증상이 유발된다는 흥분-억제 비율모델(excitatory-inhibitory ratio model) 가설이 있다[24]. 이 가설은 발작교감과활성증 뿐만 아니라 척수손상후에 발생하는 자율신경이상증을 설명하는 데에도 사용되는데, 상부 뇌로부터 하부로 전달되는 교감신경 억제신호가 뇌병변에 의해 단절되면 탈억제되고, 정상적인 체성감각 자극이나 통증자극으로도 양성되먹임(positive feedback)기전에 의해서 교감신경 활성도가 점층적으로 증가하게 된다는 가설이다[24-26]. 치료부분에서 기술되겠지만 모르핀 등의 약제의 치료 효과가 좋은 점을 설명하는 이론적 근거가 되기도 한다.
문헌에 보고된 약제는 매우 다양하고, 약제마다의 장단점과 효과가 다르므로 개별환자에 있어서 상황에 맞는 적절한 치료가 필요하다[27]. 일반적으로 모르핀을 일차적으로 선택하며, 혈압증상이 주된 증상일 경우는 연접전알파2수용체작용제나 베타차단제를, 발열 증상이 주 된 경우에는 브로모크립틴 계열의 약물을 추가하여 치료한다. 개별 약물 별 특징은 다음과 같다.
치료제로 가장 많이 쓰이는 약물이며, 모르핀이 주로 사용된다[12]. 강력한 진통효과는 통증자극으로 유발되는 교감신경의 과활성도 증상을 차단하는 데에 도움이 되며, 연수의 미주신경핵을 자극하여 부교감신경 효과가 나타나고, 콜린성 작용을 통해 서맥을 유도하여, 교감신경항진 증상을 완화시키는 효과가 있다. 개별 환자에서 효과를 보이는 약물의 용량은 매우 다양하므로, 초기 약물에서 효과가 없으면 용량을 조절해 보아야 한다. 일반적으로 황산모르핀(morphine sulfate) 경구제를 사용한다.
클로니딘(clonidine)이나 덱스메데토미딘(dexmedetomidine) 등의 중추 알파2수용체작용제는 음성되먹이기(negative feedback)에 의해 교감신경 활성도를 감소시키는 작용이 있다. 상승된 혈압을 낮추는 데에 효과가 좋으므로, 혈압상승이 주된 증상일 때에 선택할 수 있는 약물이 된다. 뇌손상 환자에서 투약하면 혈중 카테콜아민이 감소한다고 알려져 있다[28]. 하지만, 혈압 이외의 발한, 빈맥, 과호흡 등의 증상에는 효과가 적기 때문에 다른 작용을 가지는 약물들을 함께 사용하는 것을 고려해야 한다. 덱스메데토미딘은 주사제로 사용할 수 있어 중환자실 환자들에게 투약할 수 있는 범위가 넓지만, 약물 사용에 대한 보고가 많지 않다.
주된 증상인 빈맥과 혈압 상승 증상을 조절하는 목적으로 사용되고, 교감신경절에서의 신경전달을 억제하여 교감신경 활성도를 낮추므로 혈중 카테콜아민 농도를 감소시킨다고 알려져 있다[29]. 주로 사용되는 프로프라놀롤(propranolol)은 뇌손상후 발열반응을 감소시키는 데에 효과가 있는 것으로 알려져, 발작교감과활성증 환자에서 사용할 때에 선택할 수 있는 약물이 된다.
일반적으로 디아제팜, 아티반, 클로나제팜등의 벤조다이아제핀 계열의 약물이 해당된다. 교감 신경 항진에 동반되어서 발생하는 불안 초조반응, 혈압상승, 빈맥 등의 증상을 조절하는 데에는 효과적이지만 근원적인 치료제는 아니므로 선택에 주의하여야 한다.
가바펜틴은 가바수용체 유사물질로서 항뇌전증약으로 개발되었지만, 근긴장도와 경직을 조절하는 목적으로 사용될 수 있다.
바클로펜(baclofen)이 해당된다. 주로는 근긴장도를 억제하는 목적으로 개발된 약물이므로, 근긴장도가 주된 증상을 보이는 환자들에게 사용해 볼 수 있다. 경구제로 반응이 적은 경우는 척수강내 주사로 투약하면 전신의 근긴장도를 낮추는 데에 도움이 되기도 한다. 주사제는 희귀의약품센터를 통해서 구입할 수 있다.
브로모크립틴(bromocriptin)이 해당하며 시상하부의 도파민2형수용체를 자극하고, 1형수용체를 길항하는 효과를 낸다. 기전상으로는 신경이완제악성증후군을 치료하는 데에 적절한 약물이지만, 발작교감과활성증에도 효과가 있다. 정확한 기전은 밝혀지지 않았고, 단독 사용요법보다는 모르핀 등 아편양제제와 함께 부가적으로 사용하는 것이 일반적이다[20]. 용량도 개별차이가 있지만 보통 2.5 mg를 하루 세 번 사용하는 것으로 시작하여 환자에 따라 적절히 용량을 조절한다.
대체로 전향적 코호트연구에 따르면, 발작교감과활성증이 동반되었던 환자들은 입원기간이 길고, 예후가 불량한데, 질환자체에 의한 영향인지, 예후가 좋지 않을 환자들이 발작교감과활성증이 더 많이 발생하는지는 불분명하다. 다만, 발작교감과활성증이 있으면 신체의 대사가 항진되고, 체중이 29% 정도 감소하며, 면역이 억제되고, 재원기간이 증가한다[32,33]. 또한 교감신경 이상에 의해서 이차적으로 신경성폐부종이 발생할 수 있고, 고혈당, 신기능저하, 폐분비물 증가 및 혈중 나트륨농도도 증가한다[34]. 외상뇌손상 환자를 대상으로 발작교감 과활성증의 여부에 따라 예후와 임상적 양상을 비교한 연구에 따르면, 발작교감과활성증이 있는 환자에서 단기 예후는 좋지 않지만, 적절한 치료를 받으면 회복되는 질환이므로, 장기 예후는 큰 차이가 없는 것으로 알려져 있다[35]. 하지만, 증상을 잘 치료하지 않으면 이차적 뇌손상을 초래할 수 있는 질환이므로, 조기에 발견하여 적절한 치료가 필요하다.
ACKNOWLEDGMENTS
This study was partly supported by a research grant (0620144510) from Chong Kun Dang
REFERENCES
2. Lv LQ, Hou LJ, Yu MK, Ding XH, Qi XQ, Lu YC. Hyperbaric oxygen therapy in the management of paroxysmal sympathetic hyperactivity after severe traumatic brain injury: A report of 6 cases. Arch Phys Med Rehabil. 2011; 92:1515–8.

3. Blackman JA, Patrick PD, Buck ML, Rust RS Jr. Paroxysmal autonomic instability with dystonia after brain injury. Arch Neurol. 2004; 61:321–8.

4. Perkes IE, Menon DK, Nott MT, Baguley IJ. Paroxysmal sympathetic hyperactivity after acquired brain injury: a review of diagnostic criteria. Brain Inj. 2011; 25:925–32.

5. Rabinstein AA, Benarroch EE. Treatment of paroxysmal sympathetic hyperactivity. Curr Treat Options Neurol. 2008; 10:151–7.

6. Baguley IJ, Perkes IE, Fernandez-Ortega JF, Rabinstein AA, Dolce G, Hendricks HT; Consensus Working Group. Paroxysmal sympathetic hyperactivity after acquired brain injury: consensus on conceptual definition, nomenclature, and diagnostic criteria. J Neurotrauma. 2014; 31:1515–20.

7. Shapiro WR, Williams GH, Plum F. Spontaneous recurrent hypothermia accompanying agenesis of the corpus callosum. Brain. 1969; 92:423–36.

8. LeWitt PA, Newman RP, Greenberg HS, Rocher LL, Calne DB, Ehrenkranz JR. Episodic hyperhidrosis, hypothermia, and agenesis of corpus callosum. Neurology. 1983; 33:1122–9.

9. Carr-Locke D, Millac P. Diencephalic epilepsy in a patient with agenesis of the corpus callosum confirmed by computerised axial tomography. J Neurol Neurosurg Psychiatry. 1977; 40:808–14.

10. Perkes I, Baguley IJ, Nott MT, Menon DK. A review of paroxysmal sympathetic hyperactivity after acquired brain injury. Ann Neurol. 2010; 68:126–35.

11. Baguley IJ, Heriseanu RE, Nott MT, Chapman J, Sandanam J. Dysautonomia after severe traumatic brain injury: evidence of persisting overresponsiveness to afferent stimuli. Am J Phys Med Rehabil. 2009; 88:615–22.
12. Ko SB, Kim CK, Lee SH, Bae HJ, Yoon BW. Morphine-sensitive paroxysmal sympathetic storm in pontine intracerebral hemorrhage. Neurologist. 2010; 16:384–5.

13. Bhigjee AI, Ames FR, Rutherford GS. Adult aqueduct stenosis and diencephalic epilepsy. A case report. J Neurol Sci. 1985; 71:77–89.
14. Goh KY, Conway EJ, DaRosso RC, Muszynski CA, Epstein FJ. Sympathetic storms in a child with a midbrain glioma: a variant of diencephalic seizures. Pediatr Neurol. 1999; 21:742–4.

15. Hinson HE, Takahashi C, Altowaijri G, Baguley IJ, Bourdette D. Anti-NMDA receptor encephalitis with paroxysmal sympathetic hyperactivity: an under-recognized association? Clin Auton Res. 2013; 23:109–11.

16. Tse L, Barr AM, Scarapicchia V, Vila-Rodriguez F. Neuroleptic malignant syndrome: a review from a clinically oriented perspective. Curr Neuropharmacol. 2015; 13:395–406.

17. Dosi R, Ambaliya A, Joshi H, Patell R. Serotonin syndrome versus neuroleptic malignant syndrome: a challenging clinical quandary. BMJ Case Rep. 2014; 2014.

18. Carrette TJ, Underwood AH, Seymour JE. Irukandji syndrome: a widely misunderstood and poorly researched tropical marine envenoming. Diving Hyperb Med. 2012; 42:214–23.
19. Baguley IJ. Autonomic complications following central nervous system injury. Semin Neurol. 2008; 28:716–25.

20. Choi HA, Jeon SB, Samuel S, Allison T, Lee K. Paroxysmal sympathetic hyperactivity after acute brain injury. Curr Neurol Neurosci Rep. 2013; 13:370.

21. Diamond AL, Callison RC, Shokri J, Cruz-Flores S, Kinsella LJ. Paroxysmal sympathetic storm. Neurocrit Care. 2005; 2:288–91.

22. Talman WT. Cardiovascular regulation and lesions of the central nervous system. Ann Neurol. 1985; 18:1–13.

23. Wang VY, Manley G. Recognition of paroxysmal autonomic instability with dystonia (PAID) in a patient with traumatic brain injury. J Trauma. 2008; 64:500–2.

24. Baguley IJ. The excitatory: inhibitory ratio model (EIR model): an integrative explanation of acute autonomic overactivity syndromes. Med Hypotheses. 2008; 70:26–35.
25. Baguley IJ, Nott MT, Slewa-Younan S, Heriseanu RE, Perkes IE. Diagnosing dysautonomia after acute traumatic brain injury: evidence for overresponsiveness to afferent stimuli. Arch Phys Med Rehabil. 2009; 90:580–6.

26. Raithel DS, Ohler KH, Porto I, Bicknese AR, Kraus DM. Morphine: an effective abortive therapy for pediatric paroxysmal sympathetic hyperactivity after hypoxic brain injury. J Pediatr Pharmacol Ther. 2015; 20:335–40.

27. Bower RS, Sunnarborg R, Rabinstein AA, Wijdicks EF. Paroxysmal sympathetic hyperactivity after traumatic brain injury. Neurocrit Care. 2010; 13:233–4.

28. Payen D, Quintin L, Plaisance P, Chiron B, Lhoste F. Head injury: clonidine decreases plasma catecholamines. Crit Care Med. 1990; 18:392–5.
29. Welle S, Schwartz RG, Statt M. Reduced metabolic rate during beta-adrenergic blockade in humans. Metabolism. 1991; 40:619–22.
31. Velamoor VR. Dantrolene sodium in neuroleptic malignant syndrome and hepatic impairment. Can J Psychiatry. 1990; 35:364–5.

32. Chelly H, Chaari A, Daoud E, Dammak H, Medhioub F, Mnif J, et al. Diffuse axonal injury in patients with head injuries: an epidemiologic and prognosis study of 124 cases. J Trauma. 2011; 71:838–46.

33. Mehta NM, Bechard LJ, Leavitt K, Duggan C. Severe weight loss and hypermetabolic paroxysmal dysautonomia following hypoxic ischemic brain injury: the role of indirect calorimetry in the intensive care unit. JPEN J Parenter Enteral Nutr. 2008; 32:281–4.

Figure 1.
Change of physiological variables in a patient with paroxysmal sympathetic hyperactivity. Marked tachycardia and hyperthermia was observed in a patient with pineal teratoma on hospital day 17 (A). As soon as the initiation of treatment (blue arrow) with clonidine, morphine and propralonol, all the physiologic variables were stabilized (B). (Brackets, purple and blue line represent blood pressure, heart rate and body temperature, respectively).
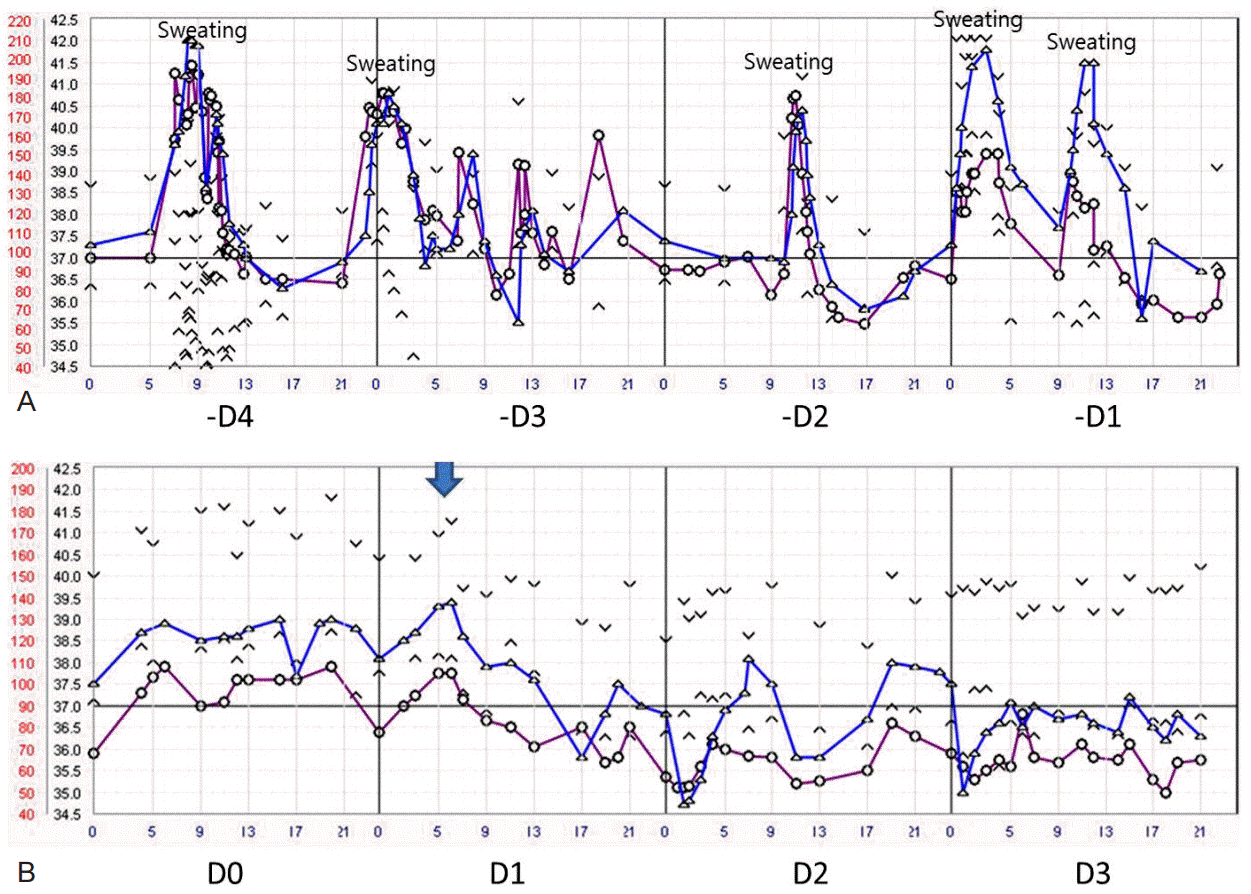
Table 1.
Paroxysmal sympathetic hyperactivity assessment measure




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download