Abstract
Severe sepsis and septic shock are common health care problem with high mortality. In 2001, Early goal directed therapy was introduced, early appropriate therapy impact on the outcome. In 2012, the “Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2012” was updated. Since then, several landmark studies recently demonstrated that modified guidelines. We review the treatment guidelines of severe sepsis and septic shock.
중증 패혈증은 임상에서 흔히 접할 수 있는 문제이며 종종 치명적인 상황을 유발할 수 있는 질환이다. 미국에서 중증 패혈증은 거의 100,000 인구당 300예 정도 발생하며 연령에 따라 빈도가 증가하여 85세 이상의 노인에서는 어린이에 비하여 약 100배 이상 발생한다[1]. 중증 패혈증의 약 25%는 병원에서 치료를 받는 동안 사망하고 패혈쇼크까지 진행하는 경우 사망률은 50%에 이른다. 장기부전의 개수와 정도가 증가할수록 사망의 강력한 예측인자가 될 수 있다.
2001년 조기목표지향치료(early goal directed therapy)가 소개된 이후, 2012년 패혈증 국제 가이드라인(surviving sepsis campaign)에 따른 표준화된 치료 지침이 발표되었고 패혈증 환자의 생존률 및 예후 향상에 도움이 된다고 알려져 있다[2-4]. 이 국제 가이드라인을 바탕으로 패혈증의 치료에 대하여 정리하였고 최근 발표된 이슈에 대하여 언급하였다. 특히 가이드라인을 지식적으로 아는 것과 실제 임상 현장에서 적용되는 것에는 큰 차이가 있으므로 각 병원에서는 어떻게 이 가이드라인을 적용할 것인가는 매우 중요한 문제이다. 병원마다 관심있는 의료진이 실제 각 병원의 패혈증 진단 및 치료 상태를 모니터하고 문제점을 개선하는 활동이 아주 중요하겠다.
패혈증은 감염이 추정 또는 증명된 상황에서 감염에 의한 전신적 증상이 나타날 때로 정의할 수 있으며 중증 패혈증은 장기부전이 또는 조직 관류저하가 동반된 상태를 말한다(Table 1, 2)[2,5]. 감염을 진단하기 위해 미생물학적 영상의학적 증거가 반드시 필요하지는 않으며 임상적 추정만으로도 할 수 있다. 임상적, 혈역학적, 생화학적 징후들을 종합적으로 판단해야 하며 임상적 징후로는 전형적으로 저혈압이 나타나며 저혈압이 동반되지 않았더라도 부적절한 조직관류는 세 가지 창으로 예측해 볼 수 있다.
첫 번째 창은 피부이다. 관류가 부적절할수록 피부징후가 달라지는데 모세혈관 재충만시간(capillary refill time)이 연장되며 이는 재현성이 매우 뛰어난 검사이다[6]. 두 번째 창은 신장이며 시간당 나오는 소변량을 측정하여 패혈증, 패혈쇼크를 조기에 알아차릴 수 있다. 세 번째 창은 뇌이다. 패혈증에 의한 뇌병증은 감염에 의한 이차적인 반응으로 의식상태가 변화되는데 섬망부터 혼수, 발작, 국소 신경학적 이상까지 다양하게 나타난다. 신경염증(neuroinflammation)을 비롯하여 여러 기전들이 제시되어 있으며 면역억제상태에서 더 가속화되는 것으로 알려져 있다. 진단은 비특이적이며 사망률 증가, 인지장애, 면역억제상태 지속, 대사 및 전해질 불균형 등의 심각한 예후를 보일 수도 있다[7]. 패혈증 환자에서 비정상적인 뇌파나 유발전위를 보인다는 몇몇 연구들이 있었고 어떤 특정 뇌파가 불량한 예후를 예측하는 데 도움을 줄 수도 있다고 제시되었다. 그러나 뇌파나 유발전위 등으로 패혈증에 의한 뇌병증을 진단하고 예후를 평가하기 위하여는 좀 더 많은 연구가 필요한 상태이다[8].
패혈증에 의해 발생하는 조직 관류저하 상태에 대하여 표준화된 정량적 수액 구조용법을 적용한다. 조직 관류저하 상태란 초기 수액치료를 한 이후에도 지속적으로 저혈압상태이거나 혈중 젖산 농도가 4 mmol/L 이상일 때를 말한다.
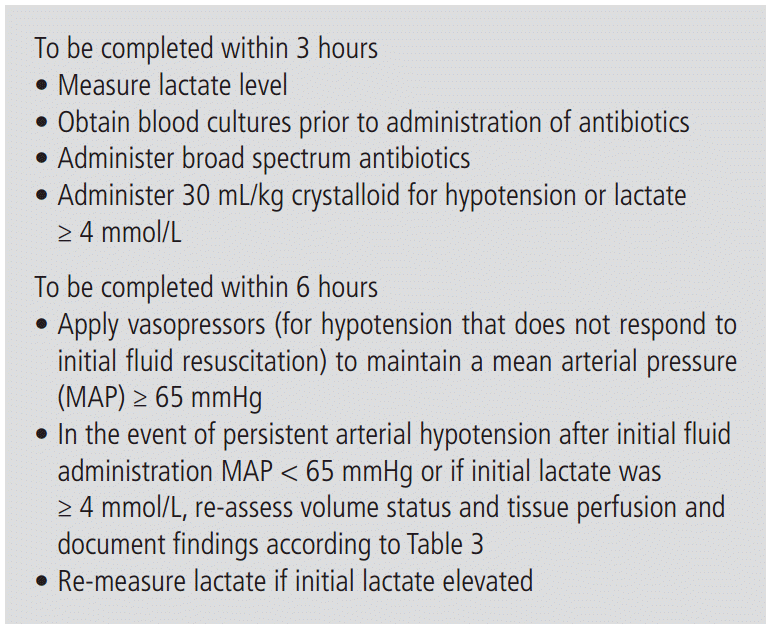
초기 3시간 이내에 혈중 젖산 농도 측정, 항생제 투여 전 혈액 배양 실시, 광범위한 항생제 투약, 저혈압이 있거나 혈중 젖산 농도가 4 mmol/L 이상일 때 결정질용액(crystalloid)을 30 mL/kg로 투여한다.
초기 6시간 동안 초기 수액치료에 반응이 없이 저혈압이 지속된다면 평균동맥압 ≥65 mmHg 유지하기 위해 혈압상승제를 투여한다. 위 환자들과 혈중 젖산 농도가 4 mmol/L 이상인 환자들에서는 적절한 혈관 내 용적과 관류상태를 이루었는지 재평가해야 하며 초기 젖산 농도가 상승되어 있는 환자에서는 6시간 이내에 젖산농도를 재측정을 해야 한다(Fig. 1)[9]. 2012년 패혈증 국제 가이드라인에 적절한 혈관 내 용적과 관류상태를 이루었는지 평가하기 위해 중심정맥압, 중심정맥 산소포화도를 이용하는 방법이 소개되었는데 초기 6시간 치료에서 이전에 권유한 중심정맥관 삽입 및 중심정맥압 측정은 삭제되었다. 최근에는 생체징후, 심폐 징후, 모세혈관 재충만시간, 피부 징후 등을 이용하여 반복적인 평가를 시행하고 중심정맥압, 중심정맥 산소포화도, 심혈관초음파, 수동적으로 다리를 올리거나 수액을 투여하여 반응을 평가하는 방법 중 두개 이상을 이용하여 적절한 혈관 내 용적과 관류상태를 이루었는지 평가한다(Table 3)[9]. 중심정맥압 ≥8 mmHg, 중심정맥산소포화도 ≥70%, 혈중 젖산 농도는 정상화되는 것을 목표로 교정한다[3,4]. 초기 수액치료로 적절한 혈관내용적을 이루었다고 판단됨에도 불구하고 지속적으로 상대정맥 산소포화도가 70% 미만, 혼합 정맥 산소포화도가 65% 미만이라면 도부타민(dobutamine, 최대용량 20 ug/kg/min) 투여와 헤마토크리트 30% 이상으로 농축적혈구를 수혈할 수 있다.
최근 초기소생술을 할때 전부하와 수액치료에 대한 반응을 평가하기 위한 여러 동적 지표들(맥압 변화, 일회박출량 변화 등)이 소개가 되었다. 이는 기계환기를 적용하고 있으며 진정제로 조절되고 있는 환자에게서 유용한 지표로써 적용할 수 있는 환자들이 제한되어 있지만 중심정맥압에 비하여 그 정확도가 높다. 심근 기능, 혈역학적 상태를 평가하기 위해 심초음파가 매우 유용하게 사용되며 혈관 외 폐 내 수분(extravascular lung water) 등을 평가하기 위한 경폐적 열희석 장치(transpulmonary thermodilution devices) 등도 상용화되고 있다. 이는 특히 급성호흡곤란증후군을 동반한 환자에서 유용하다[10].
혈액배양은 항생제 투여 전 시행되어 하며 2쌍의 표본을 채취한다[15]. 통상적인 경피적 혈액표본 외에 삽입된 지 48시간 이상 경과된 혈관장치가 있다면 하나는 반드시 이곳에서 시행한다. 경피적 혈액표본과 혈관장치에서 혈액배양을 실시할 때 양쪽 모두 같은 균이 증명된다면 이는 중증 패혈증을 일으키는 원인균이라고 생각할 수 있으며 특히 혈관장치에서 경피적 혈액표본에서보다 약 2시간 이상 더 빨리 양성반응이 나올 경우 이는 혈관장치가 감염의 원인이라고 생각할 수 있는 증거가 될 수 있다[15-17]. 소변, 뇌척수액, 상처, 호흡기 분비물 등의 감염의 원인으로 의심되는 경우 항생제 투여 전 이곳에서도 배양검사를 시행하여야 한다. 하지만 검사를 위해 항생제 투여가 지연되면 안된다.
중증 패혈증, 패혈쇼크를 인지하기 시작한 첫 1시간 이내에서 효과적인 항생제를 정주한다. 초기 경험적 항생제는 가능한 모든 병원체에 효과적인 약제를 1가지 이상 선택을 하며 감염을 일으키는 조직에 적절한 농도로 도달할 수 있어야 한다. 하지만 원인균이 증명되면 원인균에 따른 적절한 항생제 요법으로 변경하여야 한다. 또한 항생제의 저항성, 독성 예방과 항생제 비용경감을 위해 매일 항생제 용법을 평가하여야 한다. 낮은 프로칼시토닌 수치는 지속적으로 감염의 증거가 없을 때 경험적 항생제 중단을 결정하는 데 도움을 줄 수 있다[18,19].
경험적 항생제는 환자의 상태와 감염의 지역적 특성을 고려하여 선택하여야 하며 호중구 감소증에 동반된 중증 패혈증, 아시네토박테르(Acinetobacter)와 녹농균(Pseudomonas) 등 다제내성균에 의한 감염, 호흡부전에 동반된 패혈쇼크 등에서는 항생제 병합요법을 권고한다. 특히 녹농균(Pseudomonas) 균혈증에서는 광범위 베타락탐계열(beta-lactam) 항생제와 아미노글리코시드(aminoglycoside) 또는 플루오르퀴놀론(fluoroquinolone) 병합요법을 권고하며 폐렴사슬알균(Streptococcus pneumoniae) 감염에서는 베타락탐계열 항생제와 마크롤라이드(macrolide) 병합요법을 권고한다. 하지만 이 병합요법은 3-5일 이상은 추천하지 않으며 가능한 빨리 감수성 결과에 따른 단독요법을 고려해야 한다. 일반적으로 항생제 치료기간은 7-10일 정도이며 임상적 반응이 천천히 호전되거나 외과적 배액을 할 수 없는 감염원이 있거나 황색포도알균(Staphylococcus aureus) 균혈증, 진균, 바이러스 감염, 면역저하상태가 동반될 때는 더 오래 항생제를 투여해야 한다. 항바이러스제제는 패혈증의 원인으로 바이러스 감염이 의심되면 가능한 빨리 투약을 시작한다. 인플루엔자가 의심되는 경우, 이로 인한 높은 합병증이 예상될 경우 오셀타미비르(oseltamivir) 또는 자나미비르(zanamivir)를 투약할 수 있다.
감염의 원인으로 의심되는 부위에 대한 검사를 빠른 시간 내에 시행하여 이를 확인하거나 배제한다. 괴사성 연조직 감염, 복막염, 담관염, 장 경색 등 감염병소에 대한 응급 중재술이 필요한 경우도 있으며 진단 12시간 이내에서 처치를 해야 한다. 췌장주변 괴사는 잠재적으로 감염을 일으킬 수 있는 병변이나 치료적 중재술은 괴사조직과 살아있는 조직을 구별할 수 있을 때까지 연기하는 것을 추천한다. 중재술은 생리적 손상이 적은 방법을 권고한다. 예를 들면, 농양 배액 시 외과적 배액보다는 경피적 배액술을 선택한다. 혈관내장치가 감염의 원인이라면 즉시 제거한다[20-24].
투여하는 수액의 종류는 결정질용액이며 하이드록시에틸전분(hydroxyethyl starches)등의 콜로이드 용액(colloids)은 권고하지 않는다[25-28]. 결정질용액이 매우 많은 양이 필요할 때 알부민을 사용하는 것을 권고한다. 수액의 투여량은 30 mL/kg 이상을 주며 수액투여는 기존에 알려진 정적변수들(동맥압, 심박동수)과 동적변수들[(맥압 변화(pulse pressure variation), 일회박출량 변화(stroke volume variation)]을 기반으로 한 혈역학적 반응평가 지표를 이용하여 개선이 유지될 때까지 투여한다[29,30].
초기 혈압상승제에 대한 치료의 목표는 평균동맥압 65 mmHg이며 이때 조직의 관류가 유지되지만[31] 환자에 따라서는 목표 평균동맥압을 개별화해야 한다. 동맥경화, 고혈압 환자에서는 목표 평균동맥압을 높게 유지하며 조직의 관류가 적절한지 감시하기 위해 혈압, 혈중 젖산 농도, 피부 관류, 의식 상태, 소변량을 확인한다. 노르에피네프린(norepinephrine)을 첫 번째 혈압상승제로 추천한다[32-36]. 필요 시 에피네프린(epinephrine)을 노르에피네프린에 추가하여 사용할 수 있으며 바소프레신(vasopressin, 최대 0.03 U/min)의 추가적인 투여는 평균동맥압을 올리는 것 외에도 노르에피네프린의 용량을 감소시키는 효과가 있다. 도파민(Dopamine)을 노르에피네프린 대신 빠른 부정맥의 위험이 낮거나 서맥이 있을 때 선별적으로 사용할 수 있으며 신 보존을 위한 목적으로 저 용량 dopamine을 더 이상 투여하지 않는다. 페닐에프린(Phenylephrine)의 투여는 노르에피네프린이 심각한 부정맥과 연관이 있을 때, 심박출량은 높으나 혈압이 낮을 때, 바소프레신까지 함께 투여함에도 불구하고 목표 평균동맥압에 도달하지 못하였을 때를 제외하고 일차적으로 추천하지 않는다. 혈압상승제가 필요한 모든 환자는 동맥 카테터를 잡는다.
적절한 수액 요법 및 혈압상승제치료를 통해 혈역학적으로 안정된 상태를 유지할 수 있다면 패혈쇼크치료에서 히드로코르티손(hydrocortisone)은 사용을 권고하지 않는다. 다만, 이러한 상태를 달성하지 못하는 경우에 200 mg/일의 히드로코르티손을 정주할 수 있다[39-46]. 스테로이드를 투여할 때 반복적으로 정맥주입을 하는 것보다 연속적으로 주입하는 것을 권고하며 스테로이드에 대한 반응이 있는 군을 확인하기 위해 부신피질자극호르몬 검사를 시행할 필요는 없으며 혈압상승제가 더 이상 필요하지 않은 시점에서 점진적으로 사용을 줄일 수 있다. 또한 히드로코르티손은 바소프레신의 요구량, 사용기간을 줄일 수 있다고도 보고된 바 있다[47].
조기목표지향치료는 시대가 변하면서 수정되고 있지만 중증 패혈증, 패혈쇼크는 사망률, 이환율이 여전히 높은 질환으로 조기 진단과 치료는 임상의사들에게 매우 중요하다. 표준화된 지침을 잘 숙지하고 치료에 이용하되 패혈증과 관련된 임상양상은 매우 다양하기 때문에 환자에게 보이는 임상양상을 잘 관찰해야 한다. 조기 진단 및 치료를 위해서는 일차적으로 환자를 담당하는 병실 및 응급실 간호사 및 전공의들에 대한 패혈증 교육이 지속적으로 이루어져야 된다. 조기 진단을 위한 선별검사지(screening sheet) 및 컴퓨터를 이용한 선별검사 도구(computer based screening tool) 등을 이용하는 것을 추천한다.
표준환된 지침은 이전 연구를 바탕으로 작성이 되었지만 아직도 추가적인 연구를 통해 논의해야 할 점이 많고 지침의 임상적 효과에 대해서도 지속적인 연구가 필요하다는 것을 기억해야 한다.
REFERENCES
1. Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MR. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 2001; 29:1303–10.

2. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013; 38:165–228. Epub 2013 Jan 30.

3. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early Goal-Directed Therapy Collaborative Group. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001; 345:1368–77.
4. Early Goal-Directed Therapy Collaborative Group of Zhejiang Province. The effect of early goal-directed therapy on treatment of critical patients with severe sepsis/septic shock: a multi-center, prospective, randomized, controlled study [Article in Chinese]. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue. 2010; 22:331–4.
5. Levy MM, Fink MP, Marshall JC, Abraham E, Angus D, Cook D, et al. SCCM/ESICM/ACCP/ATS/SIS.; SCCM/ESICM/ACCP/ATS/SIS: 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003; 31:1250–6.
6. Ait-Oufella H, Bige N, Boelle PY, Pichereau C, Alves C, Bertinchamp R, et al. Capillary refill time exploration during septic shock. Intensive Care Med. 2014; 40:958–64. doi: 10.1007/s00134-014-3326-4. Epub 2014 May 9.

7. Zhang QH, Sheng ZY, Yao YM. Septic encephalopathy: when cytokines interact with acetylcholine in the brain. Mil Med Res. 2014; 1:20. doi: 10.1186/2054-9369-1-20. eCollection 2014.

8. Hosokawa K, Gaspard N, Su F, Oddo M, Vincent JL, Taccone FS. Clinical neurophysiological assessment of sepsisassociated brain dysfunction: a systematic review. Crit Care. 2014; 18:674. doi: 10.1186/s13054-014-0674-y.

9. Society critical care medicine “Surviving Sepsis Campaign”. http://www.survivingsepsis.org/SiteCollectionDocuments/SSC_Bundle.pdf (accessed May 15, 2015).
10. Cecconi M, De Backer D, Antonelli M, Beale R, Bakker J, Hofer C, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014; 40:1795–815.

11. Angus DC, Barnato AE, Bell D, Bellomo R, Chong CR, Coats TJ, et al. A systematic review and meta-analysis of early goal-directed therapy for septic shock: the ARISE, ProCESS and ProMISe Investigators. Intensive Care Med. 2015; May. 8. 370:1683–93. DOI 10.1007/s00134-015-3822-1.

12. ProCESS Investigators, Yealy DM, Kellum JA, Huang DT, Barnato AE, Weissfeld LA, et al. A randomized trial of protocol-based care for early septic shock. N Engl J Med. 2014; 370:1683–93.

13. ARISE Investigators; ANZICS Clinical Trials Group, Peake SL, Delaney A, Bailey M, Bellomo R, et al. Goal-directed resuscitation for patients with early septic shock. N Engl J Med. 2014; 371:1496–506.

14. ProMISe trial investigators, Mouncey PR, Osborn TM, Power GS, Harrison DA, et al. Trial of early, goal-directed resuscitation for septic shock. N Engl J Med. 2015; DOI: 10.1056/NEJMoa1500896.

15. Weinstein MP, Murphy JR, Reller LB, Lichtenstein KA. The clinical significance of positive blood cultures: A comprehensive analysis of 500 episodes of bacteremia and fungemia in adults. I. Laboratory and epidemiologic observations. Rev Infect Dis. 1983; 5:35–53.

16. Jansen TC, van Bommel J, Schoonderbeek FJ, Sleeswijk Visser SJ, van der Klooster JM, Lima AP, et al. LACTATE study group: Early lactate-guided therapy in intensive care unit patients: A multicenter, open-label, randomized controlled trial. Am J Respir Crit Care Med. 2010; 182:752–61.
17. Blot F, Schmidt E, Nitenberg G, Tancrède C, Leclercq B, Laplanche A, et al. Earlier positivity of centralvenous-versus peripheral-blood cultures is highly predictive of catheter-related sepsis. J Clin Microbiol. 1998; 36:105–9.
18. Tang BM, Eslick GD, Craig JC, McLean AS. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: Systematic review and metaanalysis. Lancet Infect Dis. 2007; 7:210–17.

19. Heyland DK1, Johnson AP, Reynolds SC, Muscedere J. Procalcitonin for reduced antibiotic exposure in the critical care setting: A systematic review and an economic evaluation. Crit Care Med. 2011; 39:1792–9.

20. Moss RL, Musemeche CA, Kosloske AM. Necrotizing fasciitis in children: Prompt recognition and aggressive therapy improve survival. J Pediatr Surg. 1996; 31:1142–6.

21. Boyer A, Vargas F, Coste F, Saubusse E, Castaing Y, Gbikpi-Benissan G, et al. Influence of surgical treatment timing on mortality from necrotizing soft tissue infections requiring intensive care management. Intensive Care Med. 2009; 35:847–53.

22. Bufalari A, Giustozzi G, Moggi L. Postoperative intraabdominal abscesses: Percutaneous versus surgical treatment. Acta Chir Belg. 1996; 96:197–200.
23. O’Grady NP, Alexander M, Dellinger EP, Gerberding JL, Heard SO, Maki DG. Guidelines for the prevention of intravascular catheter-related infections. Centers for Disease Control and Prevention. MMWR Recomm Rep. 2002; 51:1–29.
24. O’Grady NP, Alexander M, Dellinger EP, Gerberding JL, Heard SO, Maki DG, et al. Guidelines for the prevention of intravascular catheter-related infections. Clin Infect Dis. 2002; 35:1281–307.

25. Guidet B, Martinet O, Boulain T, Philippart F, Poussel JF, Maizel J, et al. Assessment of hemodynamic efficacy and safety of 6% hydroxyethylstarch 130/0.4 vs. 0.9% NaCl fluid replacement in patients with severe sepsis: The CRYSTMAS study. Crit Care. 2012; 16:R94.

26. Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, 6S Trial Group; Scandinavian Critical Care Trials Group, et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N Engl J Med. 2012; 367:124–34.

27. Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, CHEST Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Group, et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med. 2012; 367:1901–11.

28. Brunkhorst FM, Engel C, Bloos F, Meier-Hellmann A, Ragaller M, Weiler N, German Competence Network Sepsis (SepNet), et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med. 2008; 358:125–39.

29. Marik PE, Monnet X, Teboul JL. Hemodynamic parameters to guide fluid therapy. Ann Intensive Care. 2011; 1:1.

30. Marik PE, Cavallazzi R, Vasu T, Hirani A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: A systematic review of the literature. Crit Care Med. 2009; 37:2642–7.

31. LeDoux D, Astiz ME, Carpati CM, Rackow EC. Effects of perfusion pressure on tissue perfusion in septic shock. Crit Care Med. 2000; 28:2729–32.

32. Martin C, Viviand X, Leone M, Thirion X. Effect of norepinephrine on the outcome of septic shock. Crit Care Med. 2000; 28:2758–65.

33. Ruokonen E, Takala J, Kari A, Saxén H, Mertsola J, Saxén H. Regional blood flow and oxygen transport in septic shock. Crit Care Med. 1993; 21:1296–303.
34. Marik PE, Mohedin M. The contrasting effects of dopamine and norepinephrine on systemic and splanchnic oxygen utilization in hyperdynamic sepsis. JAMA. 1994; 272:1354–7.

35. Patel GP, Grahe JS, Sperry M, Singla S, Elpern E, Lateef O, et al. Efficacy and safety of dopamine versus norepinephrine in the management of septic shock. Shock. 2010; 33:375–80.

36. De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, et al. SOAP II Investigators: Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010; 362:779–89.
37. Gattinoni L, Brazzi L, Pelosi P, Latini R, Tognoni G, Pesenti A, et al. A trial of goal-oriented hemodynamic therapy in critically ill patients. Svo2 Collaborative Group. N Engl J Med. 1995; 333:1025–32.
38. Hayes MA, Timmins AC, Yau EH, Palazzo M, Hinds CJ, Watson D. Elevation of systemic oxygen delivery in the treatment of critically ill patients. N Engl J Med. 1994; 330:1717–22.

39. Annane D, Sébille V, Charpentier C, Bollaert PE, François B, Korach JM, et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA. 2002; 288:862–71.

40. Briegel J, Forst H, Haller M, Schelling G, Kilger E, Kuprat G, et al. Stress doses of hydrocortisone reverse hyperdynamic septic shock: A prospective, randomized, double-blind, singlecenter study. Crit Care Med. 1999; 27:723–32.
41. Bollaert PE, Charpentier C, Levy B, Debouverie M, Audibert G, Larcan A. Reversal of late septic shock with supraphysiologic doses of hydrocortisone. Crit Care Med. 1998; 26:645–50.

42. Sprung CL, Annane D, Keh D, Moreno R, Singer M, Freivogel K, CORTICUS Study Group, et al. Hydrocortisone therapy for patients with septic shock. N Engl J Med. 2008; 358:111–24.

43. Sligl WI, Milner DA Jr, Sundar S, Mphatswe W, Majumdar SR. Safety and efficacy of corticosteroids for the treatment of septic shock: A systematic review and meta-analysis. Clin Infect Dis. 2009; 49:93–101.

44. Patel GP, Balk RA. Systemic steroids in severe sepsis and septic shock. Am J Respir Crit Care Med. 2012; 185:133–9.

45. Oppert M, Schindler R, Husung C, Offermann K, Gräf KJ, Boenisch O. Low-dose hydrocortisone improves shock reversal and reduces cytokine levels in early hyperdynamic septic shock. Crit Care Med. 2005; 33:2457–64.

46. Yildiz O, Doganay M, Aygen B, Güven M, Keleştimur F, Tutuû A. Physiological-dose steroid therapy in sepsis [ISRCTN36253388]. Crit Care. 2002; 6:251–9.
47. Gordon AC, Mason AJ, Perkins GD, Stotz M, Terblanche M, Ashby D, et al. The interaction of vasopressin and corticosteroids in septic shock: a pilot randomized controlled trial. Crit Care Med. 2014; 42(6):1325–33.
Table 1.
Diagnostic criteria for sepsis
Table 2.
Severe sepsis
Table 3.
Document reassessment of volume status and tissue perfusion with




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download