서 론
대상 및 방법
대상
시각신경집지름의 측정 방법
자기공명영상 촬영
자료처리와 통계
결 과
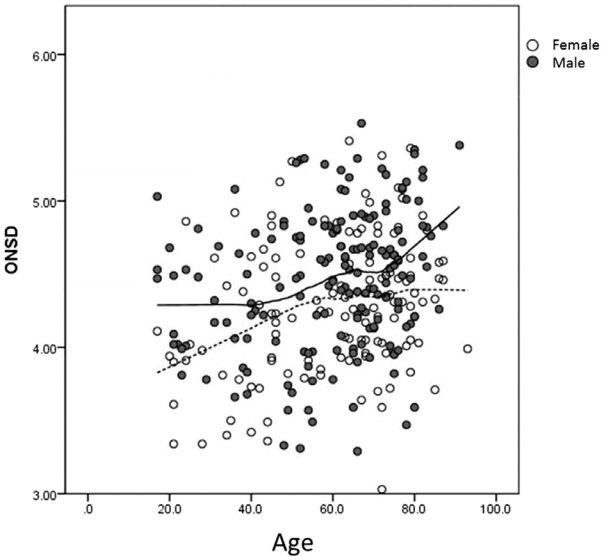 | Figure 2.Scatterplot of optic nerve sheath diameter (ONSD) among the included patients. There was no direct relationship between ONSD and age in both genders. |
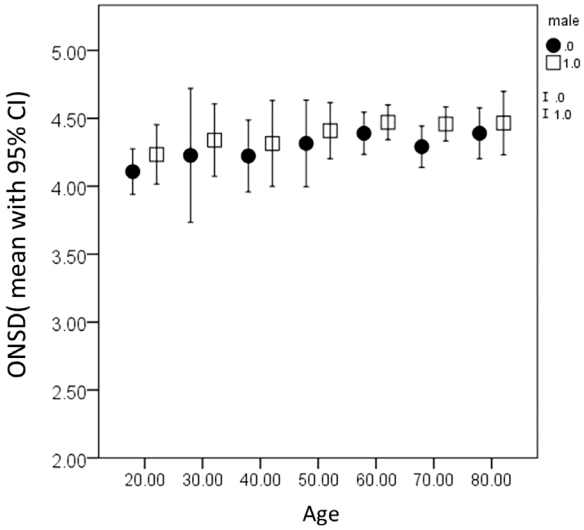 | Figure 3.Optic nerve sheath diameter is not different among all age groups. (the number of patients with age below 20 and above 90 were small and merged the 20s and 80s, respectively). Values were presented with mean with 95% confidence intervals (circle and square represent female and male, respectively). ONSD, optic nerve sheath diameter; CI, confidence interval. |
고 찰
Table 1.
| Author | Modality | Patient population | Main finding regarding ONSD | |
|---|---|---|---|---|
| Hansen et al [25] | US | Post mortem | Baseline range (2.1 to 4.8 mm), diameter enlarged after volume injection | |
| Helmke et al [26] | US | Post mortem | 3 mm behind the papilla would be best target | |
| Helmke et al [27] | US | Children in the NICU | Patients with IICP had higher value (up to 6.8 mm) compared to control (2.7-4.0 mm) | |
| Mashima et al [9] | FSE coronal MR | 21 patients, 16 healthy control | MR evaluation is feasible | |
| Hansen et al [28] | US | 12 patients | when ICP >30 mmHg, ONSD definitely enlarged (> 5 mm) | |
| Ballantyne et al [29] | US | Normal 102 children | Mean ONSD 3.08±0.36 (range 2.1-4.3 mm), No difference in gender, laterality | |
| Age related cut-off value: 4 mm in infants <1 yr, 4.5 mm in older children | ||||
| Helmke et al [30] | US | 22 children with liver failure | High ONSD had poor prognosis | |
| Newman et al [31] | US | Children with shunted hydrocephalus | Normal ICP: 2.9±0.5 mm (range 2.1–3.6 mm) | |
| Age: 10 days-16 years | Increased ICP without shunt revision: 3.1±0.4 mm (range 2.6–3.8 mm) | |||
| ICP increased with shunt revision required: 5.9±0.6 mm (range 4.5–7.0 mm) | ||||
| Ballantyne et al [32] | US | 67 normal adult | Negligible inter-observer variability | |
| Blaivas et al [33] | US | 35 patients with suspected ICP elevation | Normal CT: 4.42 mm (95% CI=4.15 to 4.72) | |
| Patients with abnormal CT: 6.27 mm (95% CI=5.6 to 6.89) | ||||
| Garcia et al [24] | 3D US | 32 healthy adults | Mean ONSD; 4.8±0.6 mm (range: 3.9-5.9), | |
| 4.9 mm (male), 4.5 mm (female), | ||||
| 5.0 mm (subjects younger than 50 years), and 4.6 mm (subjects 50 and older) | ||||
| Körber et al [34] | US | 483 children with IICP (M:287) | Normal: 3.4 mm (mean)±0.7 mm | |
| IICP, 5.6 mm (mean)±0.9 mm | ||||
| More than 4.5 mm is definitely pathologic. | ||||
| Garcia et al [35] | 3D US | 4.8 mm (standard deviation=0.6; range, 3.9 to 5.9 mm) | ||
| 5.4 mm (standard deviation=0.4; range, 4.4 to 6.0 mm) | ||||
| Romagnuolo et al [36] | US | 10 healthy control | Mean 4.6 +/- 0.71 (SD) | |
| No change in Trendelenburg’s or reverse Trendelenburg’s position | ||||
| Weigel et al [15] | High resolution MR | 32 healthy control | High resolution MR is feasible | |
| Tayal et al [12] | US | 59 patients with suspected IICP | ONSD >5.0 mm in IICP, SN 100%, (68% to 100%) | |
| SP 63% (95% CI 50% to 76%) | ||||
| Lagreze et al [16] | US and HASTE MR | 33 adults | MR had low coefficients of variation | |
| Geeraerts et al [37] | US | 31 patients with IICP and 31 controls | High ICP 6.3±0.6 vs. normal ICP 5.1±0.7 mm vs. 4.9±0.3 mm in control patients ONSD was under 5.7 mm, SN and negative predictive values for high ICP: 100%. | |
| Fagenholz et al [38] | US | 5 HAPE | 5.7±0.44 mm and for controls was 4.7±0.56 mm (P=0.003) | |
| Sutherland et al [39] | US | 13 mountaineers | ONSD was well correlated with acute mountain sickness | |
| Kimberly et al [40] | US | 38 adults patients with IICP | ONSD >5 mm was ICP >20 cm H2O with SN of 88% and SP of 93% | |
| Watanabe et al [17] | MR | 3 patients with CSF HoV | Subarachnoid space is decreased in patients with CSF hypovolemia | |
| Blehar et al [41] | US | 27 healthy volunteer | Coronal axis: 3.4 mm, visual axis 4.32 mm at 3 mm | |
| Goel et al [42] | US | 100 patients with head injury | IICP: 5.8±0.57 mm, normal: (3.5±0.75 mm) | |
| Criteria >5.0 mm, SN was 98.6%, SP 92.8%, PPV 97.26%, NPV 96.3% | ||||
| Soldatos et al [43] | US | 76 patients in the ICU | Severe injury: 6.1±0.7 mm, moderate injury; 4.2±1.2 mm, control: 3.6±0.6 mm Cutoff for ICP was 5.7 mm (SN=74.1% and SP=100%). | |
| Geeraerts et al [44] | US | 37 patients with ICP monitoring | ONSD was less than 5.86 mm, the negative likelihood for raised ICP was 0.06. | |
| Watanabe et al [18] | Orbital thinslice MR | 20 patients with CSDH | 6.1±0.7 mm was significantly reduced after surgery (4.8±0.9 mm) | |
| Geeraerts et al [19] | T2-weighted TSE MR | 38 Patients with ICP monitor and 36 healthy volunteer | High ICP: 6.31±0.50 mm, Moderate ICP: 5.29±0.48 mm, | |
| healthy; 5.08±0.52 mm | ||||
| McAuley et al [45] | US | 160 pediatric patients | Measuring is feasible | |
| Beare et al [46] | US | 14 children | IICP: 5.4 mm (range 4.3-6.2 mm) | |
| No ICP 3.6 mm (range 2.8-4.4 mm) | ||||
| 30 controls; 3.5 mm (range 2.5-4.1 mm) | ||||
| 4.2 mm is taken as the upper limit of normal, SN 100%, SP 86% | ||||
| Moretti et al [6] | US | 53 adults with ICH/SAH | IICP: 6.2±0.6 mm, No IICP: 5.0±0.5 mm, | |
| control group: 4.9±0.4 mm | ||||
| 5.2 mm as a predictor of ICP >20 mmHg, SN 94%, SP 76% | ||||
| Fagenholz et al [47] | US | 287 patients with AMS | AMS; 5.34 mm (95% CI; 5.18-5.51 mm) | |
| Normal; 4.46 mm (95% CI 4.39-4.54 mm) | ||||
| Le et al [48] | US | 64 children with IICP | Abnormal threshold: ONSD >4.0 mm in <1 year, ONSD >4.5 mm in children | |
| SN for IICP 83%, SP 38% | ||||
| Moretti et al [49] | US | 63 patients with ICH/ | ONSD >5.2 mm: cut-off point to predict raised ICP (>20 mmHg) | |
| SAH | SN 93.1%, SP 73.85% | |||
| Skoloudík et al [50] | US | 31 patients with ICH | Relative ONSD enlargement of >0.66 mm (>21 %), with 90.3% accuracy | |
| Major et al [51] | US | 26 patients with IICP | ONSD >5.0 mm for IICP: SN 86%, SP 100% | |
| Bauerle et al [5] | US | 10 with IIH/ 25 controls | IICP: 6.4±0.6 mm, control: 5.4±0.5 mm, | |
| Cut off 5.8 mm: SN 90%, SP 84% | ||||
| Strumwasser et al [52] | US | 10 trauma patients | ONSD for IICP: SN 36%, SP 38% | |
| Haratz et al [53] | US | 42 fetus | ONSD increased from 1.2 mm at 23 weeks to 2.6 mm at 36 weeks | |
| Dubost et al [54] | US | 10 patients with lumbar puncture HA | ONSD increased from 4.8 mm to 5.2 mm at 10 min, 5.5 mm (5.1-6.0) at 2 hr 5.8 mm (5.2-6.3) at 20 hr | |
| Rajajee et al [55] | US | 65 patients with ICP monitor | ICP >20 mmHg was >4.8 mm: SN 96%, SP 94% | |
| Cammarata et al [56] | US | 11 patients with head trauma | IICP; 7.0 mm±0.58 mm, No IICP: 5.52 mm±0.36 mm | |
| Control: 5.51 mm±0.32 mm | ||||
| Shofty et al [10] | Axial T2 MR | 115 pediatric patient IIH vs controls | 12-18 years: 4.69 mm vs. 3.56 mm | |
| 6-12 years: 4.25 mm vs. 3.55 mm | ||||
| Roque et al [57] | US | 150 patients with HT | ONSD measurement is feasible in patient with HT | |
| Dubost et al [58] | US | 26 eclampsia vs. 25 controls | 5.4 mm (95% CI: 5.2, 5.7) vs. 4.5 mm (95% CI: 4.3, 4.8), | |
| Qayyum et al [59] | US | 24 patients | ONSD > 5 mm: SN 100%, SP 75% | |
| Amini et al [4] | US | 50 patients requiring LP | IICP: 6.66±0.58 mm vs. control 4.60±0.41 mm | |
| Singhal et al [11] | T2-weighted axial MR | 16 children for ETV | 6.21 mm versus 5.71 mm postoperative | |
| Keyes et al [60] | US | 57 patients with AMS | ONSD was correlated with AMS | |
| Hall et al [61] | US | Pediatrics with shunt | Without Shunt failure: 4.5±0.9 mm, with shunt failure: 5.0±0.6 mm | |
| Seo et al [62] | US | 20 patients with liver TPL | ONSD was correlated with PaCO2 | |
| Kalantari et al [14] | MR and CT | 100 patients | CT/MR feasibility | |
| Bauerle et al [20] | US and HASTE MR | 25 volunteer | Well correlated; r=0.72, P=0.00 | |
| Maude et al [22] | US | 136 subjects (87.5% adults) | 4.41 mm with 95% of subjects in the range 4.25-4.75 mm | |
| No gender, head circumference | ||||
| Launey et al [63] | US | 13 patients with ICP crisis | Baseline: 6.3 mm, decreased after mannitol | |
| Kim et al [64] | US | Patients with laparoscopic surgery | Increased 12.5% in ONSD during CO2 pneumoperitoneum | |
| Ragauskas et al [65] | US/2 depth TCD | 108 patients | ONSD at 5-0 mm and found to be 37.0%, 58.5% | |
| Vaiman et al [8] | US | 400 adults | ONSD: not correlated with age and gender | |
| Correlated with eyeball transverse diameter | ||||
| Kim et al [66] | US | Cardiac arrest | Good outcome group: 5.6 (±0.3) mm | |
| Poor outcome group: 6.3 (±0.5) mm |
Values are presented as mean±SD unless otherwise indicated.
ONSD, optic nerve sheath diameter; US, ultrasound; NICU, neonatal intensive care unit; IICP, increased intracranial pressure; FSE, fast spin echo; MR, magnetic resonance; SD, standard deviation; SN, sensitivity; SP, specificity; HASTE, half-fourier acquired single-shot turbo spin-echo; HAPE, high altitude pulmonary edema; HoV, hypovolemia; CSDH, chronic subdural hemorrhage; TSE, turbospin echo; ICH, intracerebral hemorrhage; SAH, subarachnoid hemorrhage; AMS, acute mountain sickness; IIH, idiopathic intracranial hypertension; HA, headache; HT, hypertension; LP, lumbar puncture; ETV, endoscopic third ventriculostomy; TPL, transplantation; TCD, transcranial Doppler; CSF, cerebrospinal fluid; PPV, positive predictive value; NPV, negative predictive value; ICU, intensive care unit; AMS, altered mental status; CI, confidence interval; HT, hypertension.
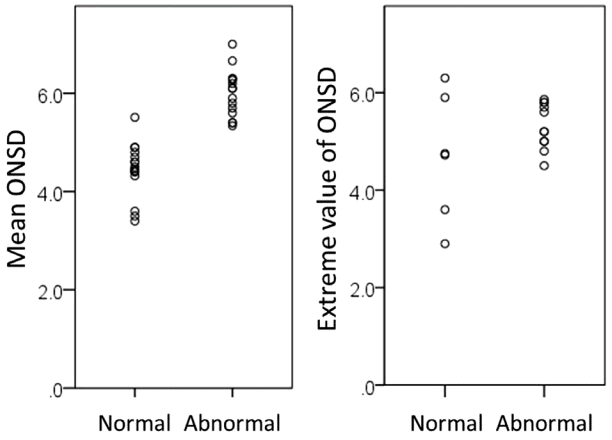 | Figure 4.Distribution of optic nerve sheath diameter (ONSD) in the literature. (A) average values of ONSD. (B) Extreme values of ONSD. Each dot represents the highest ONSD in each study in the normal group and the lowest ONSD in the abnormal group. The highest reported ONSD in the normal population overlaps with the lowest value in the abnormal population (based on the data from references in the Table 1). |




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download