Abstract
Tuberculous meningitis (TBM) is the most fatal form among various types of tuberculosis. It is also the most difficult form for diagnosis. The prevalence of TBM is still high in South Korea compared to that in Western countries. TBM should be differentiated from viral or bacterial meningitis. However, diagnosing TBM is challenging. Clinical samples obtained from cerebrospinal fluid (CSF) are paucibacillary that decreases the sensitivity of mycobacterial diagnostic tests such as acid-fast bacilli (AFB) and Mycobacterium tuberculosis culture. Adenosine deaminase (ADA) is widely used as an adjunct diagnosis of TBM. However, ADA is not a specific marker for TBM. Therefore, more specific test is urgently needed for the confirmation of TBM. Recently, IFN-gamma releasing assay using peripheral blood mononuclear cells and CSF-mononuclear cells as well as the newly-developed Xpert MTB/RFP showed promising results in the rapid diagnosis of TBM. In general, anti-tuberculous therapy for patients with TBM except adjuvant steroid use is similar to that for patients with pulmonary tuberculosis. However, treatment of TBM can be occasionally complicated due to paradoxical response during anti-tuberculous therapy.
결핵성 수막염은 전체 결핵 중에서 가장 진단이 어렵고 예후가 좋지 않은 형태로 알려져 있다[1]. 특히 결핵성 수막염은 치료하지 않는 경우 대부분 4-6주 내에 사망하기 때문에 적절하게 진단하고 치료하지 않을 경우 치명적인 결과를 초래한다[1]. 그러나, 결핵성 수막염의 증상은 비특이적인 경우가 많고, 뇌자기공명영상과 같은 영상의학적 소견도 비특이적인 경우가 많으며, 진단에 가장 중요한 뇌척수액에서 결핵균의 양이 적기 때문에 여러 가지 미생물 검사의 민감도가 높지 않다. 이러한 이유로 진단이 늦어지거나 또는 다른 질환이 결핵성 수막염으로 잘못 진단되어 치료가 되기도 한다. 또한, 결핵성 수막염의 치료 도중에 역설적 반응이 생기면서 적절하게 항결핵제를 사용함에도 불구하고 임상적 악화를 보이는 경우도 있어 치료 도중 경과 관찰에 많은 어려움이 발생하기도 한다. 여기서는 결핵성 수막염의 진단과 치료에 대한 최신 지견을 중심으로 다루고자 한다.
우리나라는 현재 경제 수준에 비해서 아주 높은 결핵 유병률을 유지하고 있는 상황이다. 2012년 WHO 자료에 따르면 우리나라의 결핵발생률은 인구 10만명당 108명으로 이웃 타이완 10만명당 68명, 일본 10만명당 19명보다도 높으며, 미국 10만명당 3.6명에 비해서 약 30배 높은 유병률을 보이고 있다[2]. 결핵은 크게 폐결핵과 폐외결핵으로 분류한다. 전체 결핵 중에서 폐외결핵이 차지하는 비율은 보고에 따라서 적게는 5%에서 많게는 35% 이상으로 보고하고 있다[1]. 우리나라의 결핵 감시체계를 통하여 보고된 결핵 환자 중 23%가 각각 폐외결핵으로 보고하고 있다[3]. 이러한 폐외결핵 중에서 중추신경계를 침범하는 경우는 5-10%정도로 알려져 있다[4]. 우리나라에서 결핵성 수막염의 유병률은 조사된 연구자료가 부족하지만, 상기 기술한 데이터를 바탕으로 추정하면 10만명당 2.5명정도로 추정한다(결핵 유병률 * 폐외결핵 비율 * 뇌수막염 비율 = 108/105 * 0.23 * 0.10). 즉 우리나라에서는 결핵성 수막염의 유병률이 이와 같이 높기 때문에 세균성 또는 바이러스성 뇌수막염이 의심되는 경우 결핵성 수막염을 감별진단해야한다. 세균성 수막염을 예를 들면, 일반적인 세균성 수막염의 유병률은 10만 명당 4-7명 정도로 알려져 있고[4] 우리나라도 이와 비슷할 것으로 추정한다. 미국과 같은 결핵 유병률이 낮은 지역에서는 세균성 수막염이 의심되는 경우 결핵성 수막염은 아주 특별한 경우에 감별진단으로 포함되지만, 우리나라는 수치상으로 세균성 수막염 유병률의 약 1/2-1/3 정도까지도 결핵성 수막염이 가능하므로 감염에 의한 뇌수막염이 의심되는 경우 중요한 감별진단 대상이 되어야 한다.
임상증상은 아주 다양하고 비특이적이여서 증상만으로 결핵성 수막염을 의심하고 진단하기는 무척 어렵다. 그러나, 증상 발현 시점과 증상의 진행양상 등은 감별진단에 도움을 줄 수 있다. 일반적으로 세균성 수막염에 비해서 증상 발현 기간이 5-7일정도로 긴 경우가 많다. 뇌신경 마비도 약 30% 정도로 알려져 있으며, 약 10%에서는 척수를 침범하는 것으로 알려져 있다. 경련은 어른에서 비교적 드문 것으로 알려져 있다[1].
결핵성 수막염 환자의 약 50%에서 중추신경 이외에서 결핵의 증거가 있는 경우가 있으므로[6] 결핵성 수막염이 의심되는 환자에서 반드시 다른 곳에 결핵의 증거가 있는지 확인해야 한다. 특히, 흉부방사선 촬영에서 활동성 결핵이 있거나 과거에 결핵을 앓았던 흔적이 있는 경우가 있으므로 여기에 대한 검사가 꼭 필요하다. 뇌 CT의 경우 뇌바닥수조(basal cistern)에 수막조영증강(meningeal enhancement), 수두증, 결절성 병변, 뇌경색 소견이 흔하게 관찰되는 소견이다. 일반적으로 CT보다는 뇌자기공명영상이 결핵성 수막염이 의심될 때 더 많은 정보를 제공하므로 더 선호되는 검사이다. 한가지 흥미로운 점은 결핵성 수막염에서 주로 뇌바닥수조 부위에 염증이 생기면서 이 부위를 지나가는 중간대뇌동맥(middle cerebral artery, MCA)에서 분지되는 시상관통동맥 또는 렌즈핵줄무늬체동맥가 손상되어 MCA 영역에 뇌경색이 생기는 경우가 많아서 이 부위를 결핵영역(TB zone)이라고 불리기도 한다[7]. 연구에 따라서는 결핵성 수막염 환자의 약 20%에서 뇌경색이 동반되는 것으로 보고하고 있다[7]. 그러나, 이러한 영상의학적 소견은 결핵에서만 나타나는 특징적인 소견이 아니므로 영상의학적 소견만으로 결핵을 확진(rule-in)하기가 힘들다. 그러나, 결핵성 수막염 환자에서 약 10-15% 정도에서만 CT 또는 뇌자기공명영상에서 정상소견을 보인다고[8] 알려져 있으므로 정상 영상의학적 소견은 결핵을 배제하는(rule-out) 검사로 유용하게 활용할 수 있다. 그러나, 이러한 영상소견이 초기의 결핵성 수막염이 의심되는 상황에서도 적용할 수 있는 지에 대한 연구는 부족하므로 해석에 주의가 필요하다. 여기에 대해서는 추가적인 연구가 필요할 것으로 생각한다.
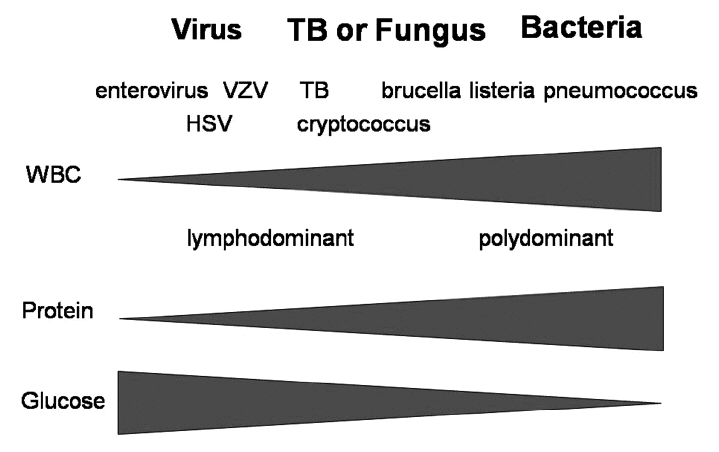
결핵성 수막염 환자에서 일반적인 뇌척수액의 백혈구 수치는 100-1000 cells/mm이고 림프구가 우월하게 나오는 것으로 알려져 있다[8]. 그러나, 약 1/3의 환자에서 결핵성 뇌수막염의 초기에는 호중구가 우세하게 나오는 경우가 있다[8]. 뇌척수액의 단백질 수치는 150-500 mg/dL이 일반적이지만[8] 아주 높은 농도를 보이는 경우가 진단 당시 또는 치료 도중에 발견되는 경우도 있다. 뇌척수액의 당 수치는 45-50 mg/dL인 경우가 일반적이고, 혈액과의 비율이 0.5 이하인 경우가 많다. 우리나라에서 시행한 한 연구에 따르면 뇌척수액 당 비율(glucose ratio)의 결정점(cut-off)을 0.44로 하였을 때 결핵성 수막염에 대한 민감도 74%, 특이도 69%로 보고하였다[9].
결핵성 수막염 환자에서 뇌척수액에서 AFB (Acid-Fast Bacillus) 도말 양성률은 5-25% 정도로 알려져 있다[8]. 즉, 양성으로 나온 경우는 특이도가 아주 높으므로 진단에 결정적인 역할을 하지만, 민감도가 높지 않은 문제가 있다. 뇌척수액 배양 검사는 배양기간이 2주에서 6주까지로 길기 때문에 항결핵제를 시작해야 하는 시점에는 도움을 주지 않지만, 추후에 미생물학적 확진을 가능하게 하고 배양이 되었을 때 약제감수성 검사를 통해서 내성 결핵을 감별할 수 있게 하므로 진단을 위해서는 필수적인 검사이다. 뇌척수액에서 결핵균 배양 양성률은 25-85%로 다양하게 보고되고 있지만, 실제로 임상에서는 여러 가지 이유로 배양 양성률은 훨씬 낮은 것으로 생각한다[9]. 특히 뇌척수액의 양은 배양 양성률과 연관관계가 있는 것으로 알려져 있어서 뇌척수액 양은 최소 6 mL 정도를 배양으로 의뢰하는 것이 추천된다[10]. 객담배양검사에서는 3회까지 반복하는 것이 진단율을 향상시키는데 도움이 되는 것으로 알려져 있지만, 결핵성 수막염이 의심되는 경우 몇 번까지 반복하는 것이 추가적인 도움이 되는지에 대한 연구는 부족하다. 그러나, 결핵성 수막염이 의심될 때는 반복적인 뇌척수액 검사가 진단에 추가적인 도움을 줄 수 있는 것으로 알려져 있다.
결핵성 수막염 환자에서 뇌척수액에서 M. tuberculosis polymerase chain reaction (PCR) 검사의 진단성 유용성은 연구에 따라서 다양하게 보고되지만, 최근에 메타분석에 의하면 민감도는 56%, 특이도는 98%로 보고되어 진단을 확진(rule-in)하는 것에는 유용하지만 진단을 배제(rule-out)하기는 힘든 단점이 있다[11].
최근에 개발된 Xpert MTB/RIF 검사는 rpoB gene을 타켓으로 자동화된 기계에 의한 semi-nested PCR (통상적인 nested PCR은 outer primer set로 시행한 첫번재 PCR 산물을 2번째 inner primer set으로 PCR을 하기 위해서 옮기는 과정이 필요하지만, semi-nested PCR의 경우 inner & outer primer sets을 합쳐서 한번에 PCR을 수행하기 때문에 non-stop, single-tube PCR이 가능함) 방법을 이용하는 검사이다. 배양 양성 폐결핵 환자를 대상으로 시행한 대규모 연구에서 도말 양성 환자에서 민감도 98%, 도말 음성 환자에서 민감도 73%로 특히 도말 음성 폐결핵 환자를 빨리 진단할 수 있는 유용한 검사이다[12]. 최근 메타분석에서 폐외결핵의 여러 검체에서 적용했을 때 전체적으로 민감도, 특이도가 각각 81%, 99%로 보고하여 폐외결핵의 빠른 진단에 도움이 될 가능성이 있다[13]. 그러나, 결핵성 수막염에서 Xpert MTB/RIF 검사의 유용성에 대한 연구는 제한적으로 보고되고 있는데, 최근 남아프리카 공화국에서 보고한 연구에 따르면 결핵성 수막염에서 민감도는 62%로 보고하여 진단을 배제하기에는 힘든 것으로 보고하였다[14]. 이에 대해서는 향후 추시 연구가 필요할 것으로 생각한다.
Adenosine deaminase (ADA)는 5-10 IU/L를 결정점으로 했을 때 민감도가 44-100%, 특이도가 75-100%로 연구에 따라서 다양하게 보고되고 있다[15]. 그러나, 뇌척수액에서 ADA는 신경 브루셀라증, 신경 리스테리아증, 크립토코쿠스 뇌수막염, 림프종 등에서도 결핵성 뇌수막염만큼 높은 수치로 상승할 수 있고, 바이러스성 뇌수막염 중 대상포진바이러스 뇌수막염의 경우는 ADA 수치가 약간 상승하는 경우가 있어 위양성이 문제가 될 수 있으므로 해석에 주의가 필요하다.
최근 interferon-gamma releasing assay (IGRA)가 폐외결핵 환자의 진단에 보조적인 진단방법으로 도움을 줄 수 있다는 보고가 있다. 최근에 20개의 폐외결핵환자에서 IGRA를 시행한 연구를 메타분석한 자료에 따르면 QuantiFERON-GOLD or QuantiFERON-In-Tube와 T-SPOT.TB의 민감도가 각각 72%, 90%이고, 특이도가 각각 82%, 68%로 보고하였다[16]. 그러나, 결핵성 림파선염이나 결핵성 골관절염과 같은 만성경과를 거치는 결핵의 경우는 민감도가 더욱 높고, 결핵성 수막염과 같은 급성경과를 거치는 결핵의 경우는 민감도가 더욱 낮다는 보고도 있어서 해석에 주의가 필요하다[17]. IGRA 검사의 또 다른 문제는 우리나라와 같이 잠복결핵의 유병률이 높은 지역에서는 양성으로 나왔다고 하더라도, 잠복결핵 때문에 양성으로 나온 것과 결핵성 수막염과 같은 활동성 결핵에 의한 양성인지를 구별할 수 없는 점이다. 활동성 결핵에서는 감염 부위에 결핵에 특이한 림프구가 국소화된다는 점에 착안하여 결핵성 복막염, 결핵성 흉막염, 결핵성 심낭염에서 복수[18], 흉수[19], 심낭액에[20] 존재하는 림프구를 이용한 T-SPOT.TB 검사가 이를 감별하는데 도움이 된다는 보고가 있다. 결핵성 수막염에서도 뇌척수액에 존재하는 림프구를 이용하여 IGRA 검사를 시행한 연구가 보고되고 있는데, 뇌척수액에 국소화된 림프구에 의해서 IGRA 검사가 양성인 경우는 특이도가 높기 때문에 진단을 확진(rule in)하는데 도움이 되지만 이 검사 역시 민감도가 떨어지기 때문에 주의 깊은 해석이 필요하다[9,21].
통상적으로 감염성 수막염이 의심되는 경우 뇌척수액 검사를 통해서 바이러스성 수막염과 세균성 수막염을 감별한다. 즉, 뇌척수액세포증가증에서 호중구가 우세, 뇌척수액에서 높은 단백질 농도와 낮은 당농도 등의 소견이 있을 때 세균성 수막염의 가능성이 더 높은 것으로 판단한다. 그러나, 우리나라와 같이 결핵성 수막염의 유병률이 높은 지역에서는 결핵성 수막염이 중요한 감별 진단이 되고, 이러한 결핵성 수막염의 뇌척수액 소견은 바이러스와 세균성 수막염의 중간 정도의 이상소견을 보이면서 바이러스성 또는 세균성 수막염과 유사한 뇌척수액 소견을 보이는 경우가 많다(Fig. 1). 앞서 설명한 바와 같이 결핵성 수막염 진단에 민감도가 높은 검사가 없고, 뇌척수액 이상 소견 또한 바이러스성 또는 세균성 수막염과 겹치는 부분이 많기 때문에 여러 가지 임상양상을 조합해서 결핵성 수막염 추정하는 임상 예측 모델에 대한 연구가 있다. Thwaites [22]가 발표한 연구에 따르면, 나이가 36세 이상이면 2점, 말초혈액에서 백혈구 수치가 15,000 이상이면 4점, 6일 이상 증상이 지속된 경우는 -5점, 뇌척수액 백혈구가 750 이상이면 3점, 뇌척수액세포증가증에서 호중구가 90% 이상이면 4점으로 점수를 계산해서 4점 이하이면 결핵성 수막염이 가능성이 높은 것으로 보고하였다. 이 모델에 따르면 결핵성 수막염을 세균성 수막염과 구별할 수 있는 민감도 86%, 특이도 79%로 보고하였다.
결핵성 수막염에서는 일차약 용량은 폐결핵과 동일한 용량을 사용한다. 결핵성 뇌수막염의 급성기에는 수막의 염증이 심하기 때문에 결핵 약제들이 혈액뇌장벽을 잘 통과할 수 있지만, 염증이 소실되면 일부 약제들은 통과를 하지 못하여 효과가 떨어지는 것으로 알려져 있다. Isoniazid (INH), pyrazinamide (PZA)는 혈액뇌장벽을 잘 통과하며, rifampicin (RFP), streptomycin (SM)은 혈액뇌장벽을 잘 통과하지 못하지만 수막에 염증이 있을 때는 치료수준에 도달한다. 용량은 INH의 경우 5 mg/kg 이상 사용을 추천하는 경우도 있지만, 통상적인 INH 용량으로 뇌척수액에서 결핵의 MIC에 10-15배 이상이 유지되고, 고용량의 INH를 사용했을 때 결핵성 수막염 환자의 예후가 향상된다는 연구가 부족하다. 그러므로, 결핵성 수막염에서는 INH 용량은 폐결핵과 동일한 용량이 추천된다. Moxifloxacin의 경우 혈액뇌장벽을 비교적 잘 투과한다. 최근 결핵성 수막염 환자를 대상으로 고용량 moxifloxacin (400 mg vs. 800 mg)과 RFP(450 mg vs. 600 mg)의 안정성과 생존율 향상을 평가한 임상 2상 연구에서 두 약제 모두 고용량 투여 시 안정성에 문제가 없었고, 특히 고용량 RFP(600 mg)를 정맥으로 투여했을 때 증명하였다[23]. 그러므로, 중환자에서 고용량의 RFP 정맥투여를 고려해 볼 수 있다.
기본적인 치료 처방은 결핵약제에 감수성이라면 폐결핵과 동일하다. 즉 결핵성 수막염 환자에서 첫 2개월 동안은 INH, RFP, PZA 그리고 EMB를 주며, 약제 감수성결핵으로 확인된 환자에서는 INH와 RFP 두 가지 약제를 7-10개월 동안 유지하는 것을 추천한다. 한편, 스테로이드 보조적 사용의 이득에 대해서는 논란이 있지만, 이전에 베트남에서 시행한 결핵성 수막염에서 스테로이드 사용에 대한 무작위 대조연구에서 스테로이드 사용의 이득이 증명되면서 모든 단계의 결핵성 수막염환자에서 스테로이드 사용을 권장한다[24]. 특히 의식변화, 정신착란, 국소적 신경장애, 하반신 마비증세 등이 있거나 CT에서 뇌부종의 증거가 있을 경우에는 적극적인 스테로이드 사용이 추천된다. 용량은 성인에게는 dexamethasone 12 mg/day or 0.4 mg/kg/day 용량으로 첫 3주 동안 투여하고, 그 후 3주 동안에 증상의 호전을 보아가면서 서서히 감량해 나가다가 중지한다.
폐외 결핵의 경우 감수성이 있는 항결핵제를 씀에도 불구하고 치료 도중 기존의 결핵 병변이 커지거나 새로운 결핵 병변이 생기는 현상, 즉 역설적 반응(paradoxical response)이 20-30%에서 발생할 수 있는 것으로 알려져 있다[25]. 이와 같은 역설적 반응은 가장 흔한 폐외결핵인 림프절 결핵에서 비교적 잘 연구가 되어 있고, 이정점 분포(bimodal distribution)으로 나타나는 것으로 알려져 있다[26]. 즉, 처음 항결핵제를 시작하고 1-2개월째 역설적 반응이 집중적으로 생기고(early paradoxical response, early PR), 항결핵제를 중단하는 시점인 6-9개월 째 역설적 반응이 생기는 경우가 있다(late PR). 역설적 반응이 나타난 경우는 우선 내성 결핵, 불규칙한 약물 복용으로 인한 치료 실패를 먼저 감별해야 한다. 이러한 감별진단을 위해서는 약제 감수성 검사 결과가 중요하기 때문에 처음에 적절한 검체를 얻어서 약제감수성 검사를 시행하는 것이 치료에 중요하다. 또한, 항결핵제를 중단하고 나서 평균 4개월째 역설적 반응이 나타날 수 있는데 이를 치료 후 역설적 반응(post-therapy paradoxical response, PTPR)이라고 부른다[27]. 즉, 결핵성 림파선염을 적절히 치료하고 나서 약제를 끊고 다시 림프절이 커졌을 때 미생물학적 재발뿐만 아니라 면역학적 기전에 의한 PTPR이 나타날 수 있으므로 치료 후에 림프절이 다시 커진 모든 환자에서 항결핵제를 다시 사용해야 하는 것은 아니다. 결핵성 수막염에서도 이러한 림파선 결핵에서 발생하는 역설적 반응과 비슷한 패턴을 따를 것으로 생각하지만, 특히 PTPR은 결핵성 수막염의 경우 치료가 늦어졌을 때 생길 수 있는 신경학적 후유증이 심각할 수 있고, 아직 결핵성 수막염에서 PTPR에 대한 연구가 부족하기 때문에 재치료를 시작하는 역치점은 훨씬 낮게 설정해야 한다고 생각한다[27].
폐외 결핵 중에서 결핵성 수막염에서도 이러한 역설적 반응이 나타날 수 있는 것으로 알려져 있다. 결핵성 수막염의 빈도는 역설적 반응의 정의와 면역저하 환자인지 등에서 따라서 다양하게 빈도가 보고되고 있다. 결핵성 수막염에서 역설적 반응은 (1) 뇌기저 삼출액(basal cerebral exudate) 형태 (2) 뇌혈관염과 경색(cerebral vasculitis and infarctions) 형태 (3) 수두증(hydrocephalus) 형태 (4) 결핵결절(tuberculoma) 형태로 나눌 수 있다[28]. 저자가 경험한 각각의 전형적인 임상 증례는 Fig. 2-5에 기술하였다. 또 다른 형태의 역설적 반응으로 항결핵제 사용 후 추적 뇌척수액 검사상 뇌척수액세포증가증이 증가하거나, 단백질이 증가하는 형태로 뇌척수액 검사소견이 나빠지는 형태가 있을 수 있다. 최근 61명의 HIV 음성 결핵성 뇌수막염 환자를 대상으로 수행한 연구에서 20명(33%)에서 이러한 형태의 뇌척수액 소견상 역설적 반응이 나타나는 것으로 보고하였다[29]. 이러한 뇌척수액 소견의 역설적인 반응은 임상적인 악화와 연관성이 있다는 보고가 있지만, 반드시 임상적 악화를 동반하는 것은 아니다. 특이할 만한 사실은, 항결핵제 사용 후 2-3주째에 림프구 우세형에서 호중구 우세형으로 뇌척수액세포증가증이 변하는 것을 “치료적 역설(therapeutic paradox)”이라고 부르는데, 이러한 치료적 역설은 결핵의 특징적인 반응으로 알려져 있다[30].
결핵성 뇌수막염에서 역설적 반응이 나타났을 때, 앞서 언급한 바와 같이 내성 결핵이나 약물 순응도 문제가 배제된다면 항결핵제를 교체할 필요는 없고 면역조절약제(immunemodulating drug)을 경우에 따라서 사용해 볼 수 있다. 일반적으로 결핵성 수막염 환자에서는 스테로이드를 보조적으로 사용하는 것이 추천되고, 이러한 스테로이드 사용이 초기에 생길 수 있는 역설적 반응을 완화시키는데 도움을 줄 것이라고 간주되어왔다. 그러나, 실제로 이러한 통상적인 스테로이드 사용이 역설적 반응의 빈도를 낮추는지, 또는 역설적 반응이 생겼을 때 스테로이드를 다시 사용하거나 증량하는 것이 도움을 줄 수 있는지에 대해서는 논란이 있다. 실제로 스테로이드 투여와 위약을 투여하면서 항결핵제를 사용한 후 뇌자기공명영상 변화를 추적한 무작위 투여 임상연구에서 양군간에 뇌자기공명영상상 결핵결절(tuberculoma) 형성은 동일한 것으로 보고하였다[31]. 반면, 소아에서 수행한 연구에서는 스테로이드 사용이 역설적 반응의 빈도를 줄이는 것으로 보고하였다[32]. 최근에는 infliximab으로 스테로드-저항성 역설적 반응을 보인 결핵성 수막염(steroid-refractory paradoxical TB meningitis)에서 이 약제 투여로 호전되었다는 증례 보고가 있고[33], adalimumab으로 스테로이드-의존형 역설적 반응을 보인 결핵성 수막염(steroid-dependent paradoxical TB meningitis)에서 효과가 있었다는 증례 보고가 있다[34]. 일반적으로 tumor necrosis factor (TNF) 길항제 사용은 잠복결핵 환자에서 결핵을 재활성화시키는 위험을 증가시키는 것으로 알려져 있지만, 역설적으로 결핵이 발생한 환자에서 강력한 항결핵제와 TNF 길항제 사용은 결핵균을 사멸화하는데 도움이 된다는[35] 이론적인 근거가 이와 같은 약제 사용을 뒷받침하는 근거로 제시되고 있다. Thalidomide의 경우도 비슷한 개념으로 사용할 수 있다는 보고가 있지만, 최근 결핵성 뇌수막염 환자를 대상으로 thalidomide를 무작위 투여한 연구에서 thalidomide 투여군에서 부작용이 증가하면서 연구가 조기 종료되었다[36].
결핵성 수막염은 여전히 우리나라에서 세균성 또는 바이러스성 수막염이 의심되는 환자에서 중요한 감별진단이다. 최근 여러 감염질환의 진단기술의 발달에도 불구하고 아직까지 결핵성 수막염의 진단을 위한 민감도와 특이도가 높은 검사법은 부족하다. 최근 개발된 Xpert TB/RIF 검사와 혈액과 뇌척수액에 존재하는 림프구를 이용한 IGRA 검사가 도움이 되는지에 대해서는 추시 연구가 필요한 상황이다. 결핵성 수막염 치료는 일반 결핵 치료와 유사하지만, 스테로이드를 보조적으로 사용하는 것이 추천된다. 또한, 결핵성 수막염은 치료 도중 여러 형태의 역설적 반응이 드물지 않게 나타나게 되고 이러한 경우 면역조절제를 보조적으로 투여하는 것이 도움이 되는 경우가 있다.
REFERENCES
1. Schlossberg D. Tuberculosis and nontuberculous mycobacterial infections. 6th ed. ASM Press;Washington, DC:
2. World Health Organization. Available at http://apps.who.int/globalatlas/dataQuery/(accessed Oct 27, 2014).
3. 2011 Annual report on the nortified tuberculosis patients in Korea.
4. Rieder HL, Snider DE Jr, Cauthen GM. Extrapulmonary tuberculosis in the United States. Am Rev Respir Dis. 1990; 141:347–51.

5. Domingo P, Pomar V, de Benito N, Coll P. The spectrum of acute bacterial meningitis in elderly patients. BMC ID. 2013; 13:108.

6. Schaaf HS, Zumla A. Tuberculosis: A comprehensive clinical reference. 1st ed. Saunders Elsevier;US:
7. Lammie GA, Hewlett RH, Schoeman JF, Donald PR. Tuberculous cerebrovascular disease: a review. J Infect. 2009; 59:156–66.

8. Rom WN, Garay SM. Tuberculosis. 2nd ed. Lippincott Williams & Wilkins;Philadelphia, PA:
9. Kim SH, Cho OH, Park SJ, Lee EM, Kim MN, Lee SO, et al. Rapid diagnosis of tuberculous meningitis by T cell-based assays on peripheral blood and cerebrospinal fluid mononuclear cells. Clin Infect Dis. 2010; 50:1349–58.

10. Cloud JL, Shutt C, Woods G. Evaluation of a modified gen-probe amplified direct test for detection of Mycobacterium tuberculosis complex organisms in cerebrospinal fluid. J Clin Microbiol. 2004; 42:378–9.
11. Pai M, Flores LL, Pai N, Hubbard A, Riley LW, Colford JM Jr. Diagnostic accuracy of nucleic acid amplification tests for tuberculous meningitis: a systemic review and meta-analysis. Lancet Infect Dis. 2003; 3:633–43.
12. Anderson ST, Kaforou M, Brent AJ, Wright VJ, Banwell CM, Chagaluka G, et al. Diagnosis of childhood tuberculosis and host RNA expression in Africa. N Engl J Med. 2014; 370:1712–23.

13. Denkinger CM, Schumacher SG, Boehme CC, Dendukuri N, Pai M, Steingart KR. Xpert MTB/RIF assay for the diagnosis of extrapulmonary tuberculosis: a systemic review and meta-analysis. Eur Respir J. 2014; 44:435–46.
14. Patel VB, Theron G, Lenders L, Matinyena B, Connolly C, Singh R, et al. Diagnostic accuracy of Quantitative PCR (Xpert MTB/RIF) for tuberculous meningitis in a high burden setting: a prospective study. PLoS Med. 2013; 10:e1001536.

15. Rock RB, Olin M, Baker CA, Molitor TW, Peterson PK. Central nervous system tuberculosis: pathogenesis and clinical aspects. Clin Microbiol Rev. 2008; 21:243–61.

16. Fan L, Chen Z, Hao XH, Hu ZY, Xiao HP. Interferon-gamma releasing assays for the diagnosis of extrapulmonary tuberculosis: a systemic review and meta-analysis. FEMS Immunol Med Microbiol. 2012; 65:456–66.
17. Cho OH, Park KH, Kim SM, Kim SM, Park SJ, Moon SM, et al. Diagnostic performance of T-SPOT.TB for extrapulmonary tuberculosis according to the site of infection. J Infect. 2011; 63:362–9.

18. Lee JY, Kim SM, Park SJ, Lee SO, Choi SH, Kim YS, et al. A rapid and non-invasive 2-step algorithm for diagnosing tuberculous peritonitis using a T cell-based assay on peripheral blood and peritoneal fluid mononuclear cells together with peritoneal fluid adenosine deaminase. J Infect. 2014; in press.

19. Liao M, Yang Q, Zhang J, Zhang M, Deng Q, Liu H, et al. Gamma interferon immunospot assay of pleural effusion mononuclear cells for diagnosis of tuberculous pleurisy. Clin Vaccine Immunol. 2014; 21:347–53.

20. Om SY, Kim SH, Choi SW, Choi HO, Kim YG, Song JM, et al. T cell-based assay on pericardial fluid mononuclear cells for the diagnosis of tuberculous pericardial effusion. J Am CollCardiol. 2014; in press.
21. Park KH, Cho OH, Lee EM, Lee SO, Choi SH, Kim YS, et al. T cell-based assays on cerebrospinal fluid and PBMCs for rapid diagnosis of TB meningitis in non-HIV patients. Eur Respir J. 2012; 39:768–70.
22. Thwaites GE. Tuberculous meningitis: many questions, too few answers. Lancet Neurol. 2005; 4:160–70.

23. Rusalmi R, Ganiem AR, Dian S, Apriani L, Achmad TH, van der Ven AJ, et al. Intesified regimen containing rifampicin and moxifloxacin for tuberculous meningitis: an open-label, randomized controlled phase 2 trial. Lancet Infect Dis. 2013; 13:27–35.
24. Thwaites GE, Nguyen DB, Nguyen HD, Hoang TQ, Do TT, Nguyen TC, et al. Dexamethasone for the treatment of tuberculous meningitis in adolescents and adults. N Engl J Med. 2004; 351:1741–51.
25. Cho OH, Park KH, Kim T, Kim T, Song EH, Jang EY, et al. Paradoxical responses in non-HIV-infected patients with peripheral lymph node tuberculosis. J Infect. 2009; 59:56–61.

26. Kim SH. Diagnosis and treatment of extrapulmonary tuberculosis. J Korean Med Assoc. 2014; 57:34–40.

27. Park KH, Lee MS, Lee SO, Choi SH, Kim YS, Woo JH, et al. Incidence and outcomes of paradoxical lymph node enlargement after anti-tuberculosis therapy in non-HIV patients. J Infect. 2013; 67:408–15.

28. Garg RK, Malhotra HS, Kumar N. Paradoxical reaction in HIV negative tuberculous meningitis. J Neurol Sci. 2014; 340:26–36.

29. Sutlas PN, Unal A, Forta H, Senol S, Kirbas D. Tuberculous meningitis in adults: review of 61 cases. Infection. 2003; 31:387–91.
30. Kim SH, Kim YS. Immunologic paradox in the diagnosis of tuberculous meningitis. Clin Vaccine Immunol. 2009; 16:1847–9.

31. Thwaites GE, Macmullen-Price J, Tran TH, et al. Serial MRI to determine the effect of dexamethasone on the cerebral pathology of tuberculous meningitis: an observational study. Lancet Neurol. 2007; 6:230–6.

32. Schoeman JF, Van Zyl LE, Laubscher JA, Donald PR. Effect of corticosteroids on intracranial pressure, computed tomographic findings, and clinical outcome in young children with tuberculous meningitis. Pediatrics. 1997; 99:226–31.

33. Blackmore TK, Manning L, Taylor WJ, Wallis RS. Therapeutic use of infliximab in tuberculosis to control severe paradoxical reaction of the brain and lymph nodes. Clin Infect Dis. 2008; 47:e83–5.

34. Lee HS, Lee Y, Lee SO, Choi SH, Kim YS, Woo JH, et al. Adalimumabtreatment may replace or enhance the activity of steroids in steroid-refractory tuberculous meningitis. J Infect Chemother. 2012; 18:555–7.
Figure 2.
Paradoxical response of base cerebral exudates type. A 47-year-old non-HIV-infected patient was diagnosed for microbiologic confirmed TB meningitis. After 12-week anti-TB therapy, visual impairment occurred. Coronal (A) and axial (B) enhanced T1-weighted image revealed a diffuse enhancement in the suprasellar cistern. Paradoxical TB optochiasmatic arachnoiditis was diagnosed and her visual acuity was partially improved without change of anti-TB therapy except ethambutol.
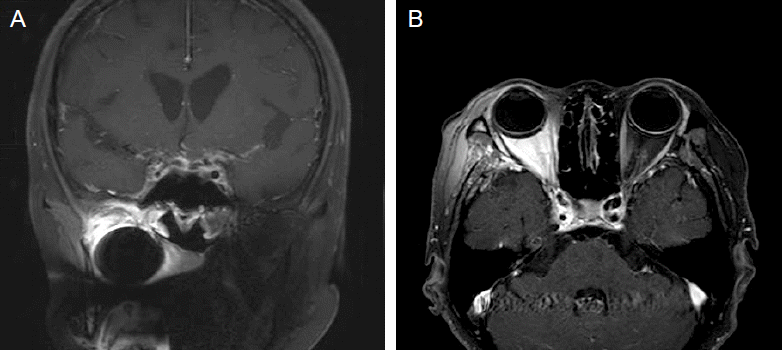
Figure 3.
Paradoxical response of cerebral vasculitis and infarction type. A 55-year-old HIV-infected patient was diagnosed for microbiologic confirmed TB meningitis. After 8-week anti-TB therapy with anti-retrovial therapy, he was presented with acute onset left hemiplegia. Enhanced T1-weighted image revealed a diffuse enhancement in the suprasellar cistern (A). Diffusion image showed right internal capsular infarction (B). Paradoxical cerebral infarction associated with TB meningitis was diagnosed and his neurologic deficit was partially improved with adjuvant steroid use but neurologic sequelae remained.
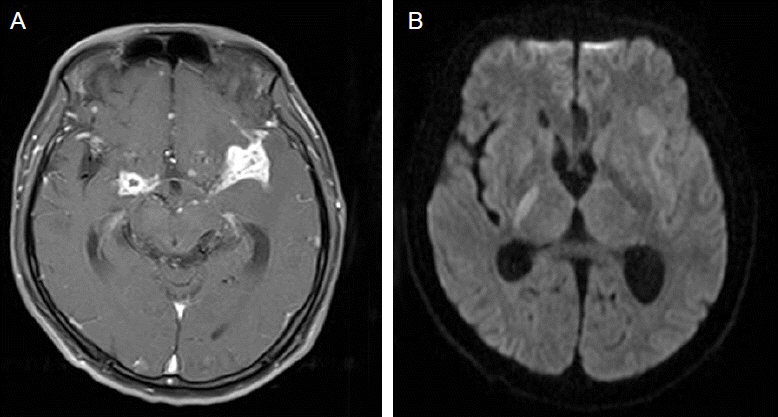
Figure 4.
Paradoxical response of hydrocephalus type. A 51-year-old non-HIV-infected patient was diagnosed for microbiologic confirmed TB meningitis. After 1-week anti-TB therapy with adjuvant steroid, hydrocephalus occurred (A). Paradoxical hydrocephus associated with TB meningitis was diagnosed. Despite of extraventricular drainage and anti-TB therapy with adjuvant steroid, her consciousness was deteriorated and eventually died at 10-week anti-TB therapy (B).
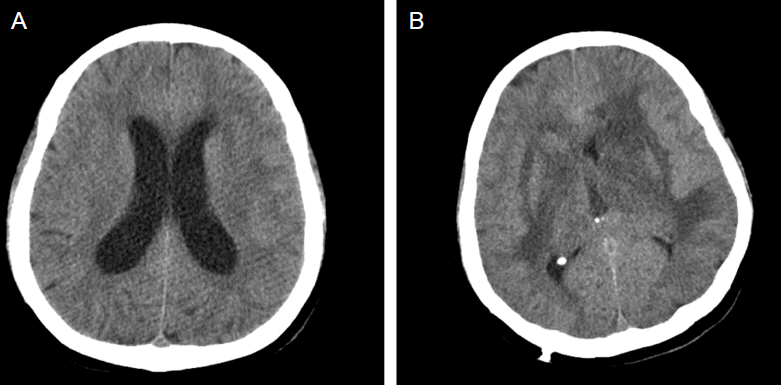
Figure 5.
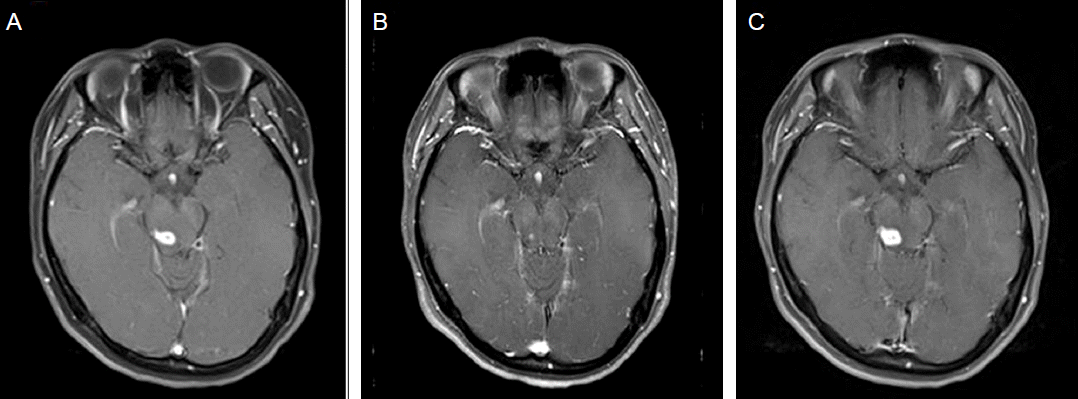
Paradoxical response of granuloma type. A 40-year-old non-HIV-infected patient was diagnosed for probable relapsed TB meningitis. Initial enhancement T1-weighted image revealed TB granuloma at posterior midbrain before anti-TB therapy (A). After 12-month anti-TB therapy, follow-up enhancement T1-weighted image showed decreased TB granuloma (B). After 15-month anti-TB therapy, diplopia developed again and follow-up enhancement T1-weighted image exhibited the reappearance of TB granuloma at posterior midbrain (C). Paradoxical granuloma formation during anti-TB therapy was diagnosed. Contiunation of anti-TB therapy without additional steroid use eventually resolved her neurologic deficit.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download