서 론
바스타®(Bayer, Leverkusen, Germany)는 일본에서 개발되어 1994년에 우리나라에 소개된 비선택성 제초제로서, 우리나라에서는 이로 인한 음독 환자가 점점 증가되고 있다. 바스타 중독의 임상적 특징은 초기에는 점막자극에 의해 구역, 구토, 설사, 복통 등의 위장관계 증상을 주로 보이고, 혈액화학적 분석상 백혈구 및 간효소 등이 증가하게 된다. 이후 중추성 호흡저하, 열 및 난치성 저혈압 등이 발생하며[1,2], 중독 후 치사율은 26% 정도로 알려져 있다[3]. 다른 제초제와는 달리 바스타® 중독에서는 환자에게 심각한 문제를 일으킬 수 있는 다양한 신경학적 증상을 관찰할 수 있는데, 이는 주로 glufosinate ammonium (GLA)에 의한 것으로 설명하고 있으며, 동물 실험에서도 GLA 투여 이후 바스타®중독과 유사한 신경학적 증상이 확인되었다[4,5]. 바스타®중독으로 인한 신경학적 증상으로는 의식변화, 경련, 기억상실, 외전신경마비, 뇌병증 등을 들 수 있다[6,7]. 바스타® 중독 이후의 영상학적 소견으로는 해마 부위의 세포독성부종이 주로 발견되며, 이외에도 뇌의 외측 백질, 일차체성감각피질에 허혈 병변 등이 보고되었다[8,9]. 저자들은 바스타 중독 이후 시행한 자기공명영상에서 해마 병변이 없는 양측 바닥핵 병변을 동반한 증례를 경험하였다. 바스타 중독의 경우 해마의 세포독성부종을 동반한 양측바닥핵 병변이 보고되었으나 양측바닥핵의 혈관성부종만을 동반한 보고는 없어 증례보고와 함께 바스타 중독의 기전에 대해 고찰하고자 한다.
Go to : 
증 례
48세 남자 환자가 의식저하를 주소로 응급실에 내원하였다. 기저질환으로 조현병이 있어 risperidone과 zolpidem을 규칙적으로 복용 중이었다. 환자는 평소 술을 전혀 하지 않았으나 내원 전일 혼자서 소주를 마시고 있는 것을 보호자들이 목격하였고, 내원 당일 오전까지 깨워도 일어나지 않는 소견이 1시간 이상 지속되어 응급실로 내원하였다. 발견 당시 환자 주변으로 배뇨 흔적이 보였으나 경련발작은 없었다고 하였으며, 보호자가 환자의 방 밖에서 바스타® 500 mL 빈 병이 있는 것을 확인하였으나 평소 복용하던 약제의 과량 복용 흔적은 없었다고 진술하였다.
초기 활력징후는 혈압 160/90 mmHg, 맥박 114회/분, 호흡 10회/분, 체온 36.8℃로 확인되었다. 내원 시 의식은 혼미 상태였고, 동공 반사는 보존되어 있었다. 강한 자극에 사지에서 대칭적인 굽힘반응을 보였고, 심부건반사는 1+로 저하되어 있었으며 병적 반사는 관찰되지 않았다. 내원 시부터 의식저하와 함께 호흡부전의 소견이 있어 응급실에서 기관내삽관을 시행하였다. 일반혈액검사, 일반화학검사 및 소변검사는 정상이었으며, 동맥혈가스분석검사에서 pH 6.920, pCO2 112.0 mmHg, pO2 22 mmHg, HCO3 23.0 mmol/L, 염기과잉(base excess) -9.9 mmol/L, 음이온차이(anion gap) 22.0 소견을 보였다. 입원 후 자발호흡이 약하여 기계적환기를 유지하였고, 내원 10시간 이후 38.9℃의 열이 있어 흡인폐렴 의심 하에 항생제 치료를 시작하였다. 바스타®중독 의심하에 intravenous lipid emulsion과 함께 중심정맥영양을 입원 당일 시작하였고, 혈액 화학 검사에서 CK, myoglobin 및 BUN/Cr 등이 안정화되는 추세를 보이고 시간당 소변배출량이 적정 수준으로 유지되어 혈액투석은 시행하지 않았다.
입원 2일째, 기존에 복용하고 있던 약제들은 중단한 상태로 경과를 관찰하였다. 의식은 자발적 개안반응이 있는 상태이나 눈을 감으라는 지시에 적절한 반응을 보이지 않았으며 사지 및 몸통에서 경련반응은 관찰되지 않았다. 입원 2일 째 시행한 뇌파에서 뇌전증모양방전은 없었고 전반적인 지속서파가 관찰되었다. 입원 10일 째 기계적환기를 제거하고 자발호흡을 유지할 수 있는 상태로 뇌자기공명영상 촬영을 시행하였다. 확산 강조영상(diffusion weighted image, DWI), T1 강조영상(T1 weighted image), T2 강조영상(T2-weighted image) 및 액체감쇠역전회복(fluid attenuated inversion recovery)영상에서 양쪽 바닥핵에 대칭적으로 고신호강도가 관찰되었으며, 양측 해마부위에서는 이상 병변이 관찰되지 않았다(Fig. 1). 또한 자기공명혈관촬영술에서 특이소견은 없었다. 입원 2주 후 기관내삽관을 제거하였으며 의식은 명료하였으나 언어지시에 전혀 반응하지 못하는 무운동함구증이 관찰되었다. 환자는 입원 49일째에 퇴원하여 재활병원으로 전원되었고 퇴원 3개월 이후 의식은 명료하고 언어지시에 적절한 반응을 보일 수 있는 상태였다. 근력은 MRC G5로 호전되었으나 사지의 전반적인 강직과 함께 운동완만이 있는 상태로 독립적인 보행은 불가능한 상태였다. 퇴원 6개월 째 언어기능은 정상으로 회복되었고, 조현병과 관련된 이전의 이상행동은 관찰되지 않아 기존에 사용하고 있던 riperidone은 사용하지 않고 경과관찰하였다.
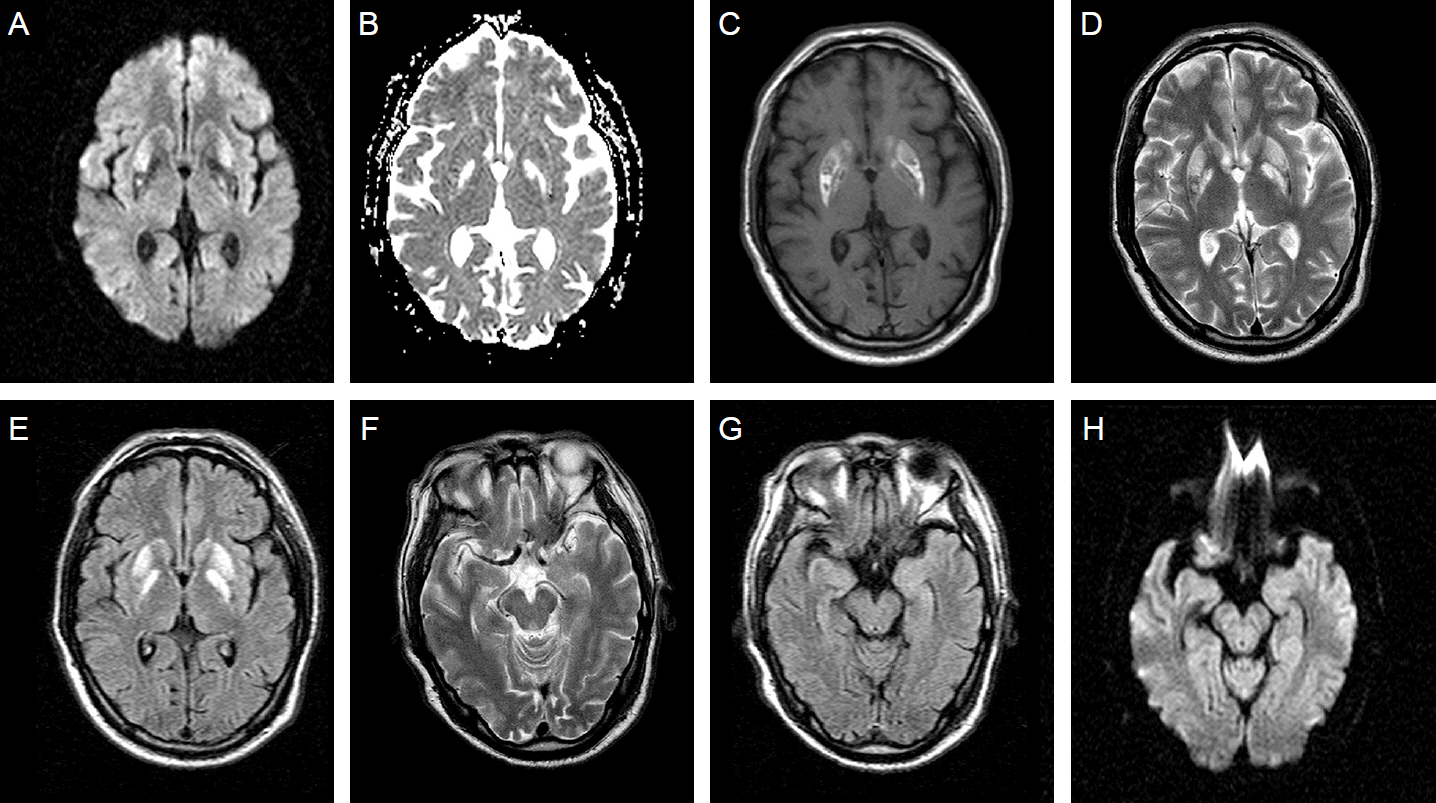 | Figure 1.Brain magnetic resonance imaging of the patient on the 10th day of admission. High signal intensities were demonstrated in bilateral basal ganglia on diffusion weighted image(A), apparent diffusion coefficient (B), T1-(C) and T2-weighted image (D) and fluid attenuated inversion recovery image (E). However, abnormal signal intensities in bilateral hippocampus were not observed (F-H). |
Go to : 
고 찰
시중에서 시판되고 있는 바스타®는 글루포시네이트암모늄(glufosinate ammonium) 18%, 표면활성제와 전착제를 포함하고 있다. GLA의 사람에서의 반수치사용량(LD50)은 300-350 mg/kg으로 알려져 있으며 위장관 흡수가 비교적 빠르기 때문에 1시간 이내에 혈중 최고 농도에 도달하며 보조제와 함께 흡수될 경우 25-30% 정도가 흡수된다[4]. 배설은 신장을 통해 빠져나가는 것이 90%이며, 97%가 초기 24시간 이내에 몸에서 배출되게 된다. 본 환자의 경우 최대 500 mL의 바스타®를 음독하였을 것으로 추정되며, 시중에서 시판되는 바스타® 제품이 균일하게 섞인 농도가 증류수와 같은 용액이라고 가정하면 54 mg의 GLA를 복용한 것으로 추정할 수 있다. 환자의 체중이 87 kg이었고 사람에서의 급성 독성용량이 1.6-1.8 mg/kg임을 가정해볼 때, 환자에게는 139.2-156.6 mg 정도의 GLA가 급성독성용량임을 추정해볼 수 있다[1]. 이전의 보고에서도 적은 용량의 바스타® 음독으로 중독증상이 발생한 증례도 보고되었다[9]. 본 증례의 환자도 급성독성용량의 절반에도 미치지 못하는 용량의 바스타®를 음독한 상황으로 이는 지금까지 우리가 흔히 알고 있는 GLA에 의한 바스타®의 중독 기전 외에 신경독성에 대한 다른 작용기전이 있음을 추측해 볼 수 있다.
GLA는 글루탐산과 구조적으로 유사하여 글루탐산수용체를 과도하게 자극하므로, 중독 환자는 주로 흥분독성(excitotoxicity)에 의한 세포손상이 일어난다. 이 때문에 흥분아미노산 수용체가 포함되어 있는 해마에 영향을 미쳐 기억상실 및 경련을 잘 일으키는 것으로 알려져 있다[6]. 지금까지 GLA 음독 후 뇌영상에 대한 연구는 대부분 해마에 이상신호가 있었으며, GLA 중독이 뇌의 별아교세포에 구조변화를 일으켜 해마에 영향을 준 것으로 추정하고 있다[10]. 본 증례는 양측 바닥핵에 특징적으로 이상신호가 확인된 경우로 GLA 중독에 취약한 뇌 구조물이 해마뿐만이 아니라는 것을 시사한다.
더불어 바스타®의 또 다른 중요 성분인 표면활성제에 대해서 지금까지는 혈관에서 nitric oxide 생성을 유도하여 혈관을 확장시킴으로써 저혈압을 일으키고 고농도에서 심장억제 효과를 타나내 불응성 저혈압을 일으킨다고 알려져 있다[11]. 하지만 증례에서와 같이 알려진 급성중독용량보다 적은 양으로 심한 증상을 일으킨 환자의 경우에는 저혈압에 의한 저산소성 뇌손상 및 GLA에 의한 직접적인 세포흥분독성 이외에도 표면활성제 자체의 독성 및 GLA 와의 상승효과에 대해서 고려해볼 필요가 있다. 실제로 세계적으로 많이 사용하는 글라이포세이트(glyphosate) 중독 환자를 대상으로 한 조사에서는 마신 표면활성제의 양이 8 mL를 넘으면 47%의 환자에서 저혈압 증상이 발생하는 것으로 보고되었다[12]. 표면활성제에 대한 다른 연구들에 의하면 심장세포, 폐세포, 기타 섬유소세포 등을 대상으로 표면활성제의 세포막독성(membrane integrity)과 대사활성도(metabolic activity), 미토콘드리아 독성(mitochondrial activity) 및 총단백합성능력(total protein synthesis rate) 등을 조사하였는데 이 결과 표면활성제 중 SLES, LE-2S, LE-2 등은 중등도 독성을 보였고, TN-20, LN-10, PE-61 등은 심한 독성이 관찰되었다[13].
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download