Abstract
Integrated post-resuscitation treatment has improved the outcome of the unconscious patients with cardiac arrest after introduction of the therapeutic hypothermia, which had shown promising results in the two pivotal randomized trials. Early assessment of neurological function and prognostication in these comatose patients has been challenging problem, and the introduction of therapeutic hypothermia made the problem more confusing. Various clinical situations, the results of the clinical neurologic examination, neurophysiologic monitoring including electroencephalography and somatosensory evoked potentials, various biomarkers, and neuroimaging can be used in predicting early prognosis. No single test is allowed to predict the prognosis with certainty, and a multimodal strategy is generally recommended. The previous practice guideline of the American Academy of Neurology in 2006 may not be appropriate anymore in the era of therapeutic hypothermia. In this review, the author introduces various neuromonitoring methods currently used in the therapeutic hypothermia and evaluate the their role in the prognostication with available evidences.
심정지 환자는 미국에서만 1년에 32만 명 이상 발생하는 것으로 추정되며 그 중 약 80%는 병원 외에서 발생하고 생존율은 약 20-30%로 보고되고 있다[1-5]. 중환자의학의 발달, 응급구조체계의 개선, 공공 교육의 강화, 자동제세동기의 보급 등에 힘입어 심정지 환자의 생존율은 증가하고 있으나 대부분의 생존자들은 심각한 신경학적 후유증을 앓게 되어 스스로 활동할 수 있는 정도의 의미 있는 회복은 생존자의 약 10%-20%에 불과하다[1,2]. 이러한 환자들의 치료를 위해 바르비투르산염, 글루코코르티코이드, 칼슘통로차단제 등의 다양한 약물 요법이 시도되었으나 대규모 무작위 대조군 연구들에서 그 효과를 입증하지 못하였다[6-8]. 하지만 2002년에 각각 유럽과 호주에서 시행된 두개의 다기관 무작위 대조군 연구에서 치료적 저체온요법이 심정지 후 사망율을 감소시키고 의미 있게 신경학적 예후를 향상시킴을 보고한 이후[9,10], 2003년 국제심폐소생협력기구(International Liaison Committee on Resuscitation, ILCOR)에서 저체온요법을 시행할 것을 강력히 권유하였고[11] 2010년 미국심장협회(American Heart Association, AHA)의 권고안에는 표준치료로 채택되어[12], 현재 저체온요법은 심정지 환자에 있어 기본치료가 되고 있다.
이러한 환자들에서 신경학적 회복 여부를 예측하는 것은 신경과 의사들에게 실제로 많이 요청되는 중요한 문제이다. 특히 저산소성 뇌손상 환자에서의 예후 예측은 뇌사판정이나 환자 존엄성을 위한 생명유지장치 중단 결정 등의 이유로 조기에 그리고 매우 정확한(위양성률이 0에 가까운) 예후 예측을 요구한다[5,13,14]. 이러한 요청에 따라, 2006년에 미국신경과학회(American Academy of Neurology, AAN)에서 지금까지 나온 여러 임상결과를 종합하여 근거중심의 예후 예측 권고안(recommendation)을 발표하였다[15]. 이 권고안은 심정지 72시간 후에도 뇌간반사가 없거나, 대뇌제거자세(decerebrate posture) 이상의 운동반응이 없을 때, 조기에 근간대성 뇌전증지속상태가 발생하였을 때, 체감각 유발전위검사에서 반응이 없을 때, 그리고 neuron specific enolase (NSE)가 >33 μg/L으로 높을 때 0%-8.8%의 위양성률로 나쁜 예후를 예측할 수 있다고 하였다(Fig. 1) [15]. 하지만 2006년 AAN 권고안의 가장 큰 문제점은 치료적 저체온요법 이전의 연구들을 대상으로 하였기 때문에 치료적 저체온요법 이후에 변화된 점을 반영하고 있지 못한다는 점이다. 심정지 후 치료적 저체온요법은 대개 24시간 동안 약 33℃의 저체온을 유도하는 것이다. 대개 환자의 불편과 고통을 없애고 떨림(shivering)을 방지하기 위해 정맥 마취제와 근이완제를 투여하게 되며 저체온 자체가 간대사 및 신장배출을 감소시켜 이러한 약제의 효과를 증가시키는 효과가 있다. 이는 신경학적 예후 평가를 위한 여러 가지 검사의 결과에 영향을 미치기 때문에 그 해석에 유의하여야 한다. 또한 치료적 저체온요법이 뇌손상을 줄이고 지연 회복을 유도할 수 있는 점도 고려해야 하는데, 실제로 72시간째에 나쁜 예후를 예측받은 환자들이 이후 시간이 지나 의식을 회복하는 보고가 다수 있으므로 반드시 72시간째에 판정해야 하는지에 대한 의문이 생겨나고 있다[13,14]. 치료적 저체온요법이 점차 확산되고 이에 따른 경험과 연구 결과가 축적됨에 따라 2010년 AHA에서는 이러한 기존의 권고안의 신뢰도가 조금씩 떨어짐을 지적하였고[12] 새로운 권고안에 대한 요구가 점차 증가하고 있는 실정이다.
본 논문에서는 심정지 환자에서 저체온요법 이후 어떻게 신경학 검사를 시행하고 예후 판정을 하여야 할지에 대해 좀 더 자세히 알아보도록 하겠다.
심정지 후 치료적 저체온요법은 기관들마다 조금씩 차이는 있으나, 큰 틀에서는 차이가 없다. 먼저 대상 환자군은 2003년 ILCOR 권고안에서는 병원 외 심정지 환자에서 초기 심전도가 심실세동인 경우 의식회복이 없는 환자들을 대상으로 저체온요법을 권장하였다[11]. 이는 2002년 당시 두 연구[9,10]의 대상환자들의 조건이 그러하였기 때문이며, 따라서 ILCOR는 초기 심전도가 심방세동이 아니거나 병원 내 심정지인 경우에도 고려할 수 있다는 언급을 하였고[11], 현재 대부분의 연구들에서는 초기 심전도 결과에 상관없이 저체온요법을 시행하고 있는 것으로 보인다[16-18]. 저자의 병원에서는 2011년부터 여러 과(응급의학과, 심장내과, 호흡기내과, 신경과, 마취통증의학과)가 협력하여 통합된 치료적 저체온요법(Critical leaders, Optimal care Of Life threatening Post CPR, COOL)을 운영하고 있는데, 선정기준은 1) 18세 이상의 성인, 2) 심정지 후 자발순환이 회복된 후 20분이 지나도 안정적으로 유지, 3) 자발순환 회복 후에도 Glasgow Coma Scale (GCS) 8점 이하로 의미있는 반응이 없는 환자를 대상으로 한다. COOL에서의 목표 체온은 33℃이며, 3시간 이내에 저체온을 유도하고 24시간 동안 저체온을 유지하며 시간 당 0.25℃로 서서히 체온을 올리는 재가온(rewarming)기간을 가진다. 저체온 유도는 차가운 생리식염수를 30 mL/kg, 100 mL/min로 주입하면서 시작하며 저체온 유지는 다양한 기기가 있으나 본원에서는 cooling gel pad를 이용하는 표면냉각 방식을 사용하고 있다. 환자 진정을 위해 미다졸람과 remifentanil을 각각 1.66 μg/kg/min과 0.02 μg/kg/min의 속도로 지속적으로 주입한다. 다수의 환자들이 떨림을 보이는데 간헐적인 vecuronium 투여를 하고 있다. 지나친 떨림은 저체온 치료의 효과를 저하시키므로 적절한 조절이 반드시 필요하다.
신경학적 평가 역시 기관들마다 경험과 가용자원에 따라 조금씩 차이가 있다. 저체온요법의 도입 이후, AAN 권고안의 72시간을 고집하기보다는 좀 더 판정시기를 연장하는 추세이며 보다 정확한 판정을 위해 다양한 방법을 통합해서 판단하는 것이 중요하다. 본원에서는 응급실에서 신경과 협진을 통해 초기 신경학적 진찰을 하고 뇌전산화 단층촬영 촬영을 시행한다. 응급 뇌전산화 단층촬영 촬영의 이유는 첫째, 뇌출혈과 같은 심정지의 다른 원인을 배제하고 조기치료를 위함이며 둘째 환자들에 따라 저산소 손상에 이은 조기 뇌부종이 관찰되는 경우가 있는데 이 경우 만니톨 사용과 같은 감압치료를 추가로 고려하여야 하기 때문이다. 저체온요법 대상환자는 중환자실에 우선 순위로 입실하게 되며 이후 가능한 이른 시기에 지속적 뇌파 모니터링을 시작하여 48시간 동안 유지하고 있다. 뇌전증지속상태(status epilepticus)가 약 1/3의 환자에서 발생하는데 이 경우 치료 기간에 따라 연장 적용한다. 본원에서는 통상적인 뇌파와 함께 amplitude-integrated EEG (aEEG) 및 compressed spectral array (CSA), 두 개의 quantitative EEG를 시행하고 있다. 심정지 24시간째에 정맥혈 NSE를 측정하며 72시간을 전후하여 SSEP와 자기공명영상을 시행하고 있다. 퇴원 시에 다시 신경과 협진을 통해 환자의 신경학적 상태를 Glasgow-Pittsburgh Cerebral Performance Categories (CPC)(Table 1) [19]를 이용하여 판정하고 있다. 일반적으로 CPC 1, 2를 좋은 예후로 판정한다. 다음에서는 각각의 평가방법에 따른 예후 판정에 대해 알아보기로 한다.
심정지 시간이 얼마나 오래 되었는지, 환자의 나이가 얼마인지, 심정지의 원인이 심인성인지 비심인성인지, 초기 심전도 소견이 심실세동인지 아니면 무수축 상태(asystole)인지, 초기 신경학적 상태가 얼마나 나빴는지에 따라 예후가 결정되느냐 하는 것은 의사들이 가지고 있는 일반적인 생각일 뿐 아니라 여러 연구에서도 이 문제를 다루고 있다[17,20-23]. 일반적으로 예후가 좋지 못한 환자군은 예후가 좋은 군에 비해 심정지 시간이 길고 초기 심전도 소견이 심실세동이 아닌 경우가 많으며, 초기 GCS 점수가 나쁠 수록 예후가 좋지 못하다고 보고되고 있다[17,20-22]. 하지만 이러한 사실은 좋은 예후군과 나쁜 예후군의 비교에서 드러난 문제이지, 실제로 개개인의 환자의 예후를 예측하는 데 있어서는 위양성률이 높기 때문에 별다른 도움을 주지 못한다. 이는 AAN 권고안에도 반영되어 있으며[15] 저체온요법 이후의 연구들에서도 공통된 소견이다. 즉 이러한 임상 상황은 참조할 수는 있으나 실제 예후 예측에는 사용하지 말아야 할 것이다[5].
일반적으로 동공반사, 각막반사, 통증자극에 대한 운동반응 등이 가장 많이 사용되는 검사이며 2006년 AAN 권고안에도 심정지 후 72시간이 지나도 동공 및 각막 반사가 안나오거나 통증자극에도 운동반응이 없거나 대뇌제거반응만이 나올 경우 나쁜 예후를 예측할 수 있으며 위양성률이 0%-3%에 불과할 정도로 높은 신뢰도를 가진다고 하였다[15].
치료적 저체온요법 이후, 이러한 신뢰도는 전반적으로 떨어지는 것으로 보고되고 있으며[5,14,16,17,20,24] 특히 운동반응의 경우, 72시간째에 의미 있는 반응이 없어도 향후 좋은 예후로 회복되는 비율이 14.3%에서 24%까지도 보고되고 있어 그 신뢰도가 크게 저하되었다[17,23,24]. 뇌간반사의 경우, 나쁜 예후에 대한 위양성률이 0%-4.5%로 조금 증가되었으나 여전히 신뢰할만한 수준으로 평가된다[16,17,24]. 다만 대뇌제거반응 이상의 운동반응(통증자극에 굽힘회피 반응 이상)이 나타나는 경우에는 매우 높은 신뢰도로 좋은 예후를 예측할 수 있다는 보고[17,23]도 있어 운동반응의 경우, 좋은 예후인자로서의 가능성에 대해 좀 더 평가가 필요하다.
결론적으로 저체온요법을 받은 경우 통증자극에 운동반응이 없다고 해서 나쁜 예후를 예측할 수 없으며 판정에 신중을 요한다. 다만 굽힘반응 이상의 운동반응이 나타날 경우 좋은 예후의 가능성을 시사할 수 있다. 뇌간반사가 없는 경우 나쁜 예후를 예측할 수 있으나 이 경우에도 드물게 회복할 수 있음을 주지하여야 할 것이다.
근간대성 경련(myoclonus)은 심정지 이후 매우 흔한 현상으로서 간헐적으로 나타나는 근간대성 경련은 예후적 가치가 거의 없다. 하지만 24시간 이내에 발생하는 조기의 근간대성 뇌전증지속상태(myoclonic status epilepticus)의 경우, 위양성률이 0%에 가까운 나쁜 예후인자로 잘 알려져 있다[5,13-15]. 저체온요법 이후 이러한 신뢰도는 조금 떨어지기는 했으나(위양성률 -3%) 여전히 나쁜 예후인자로 여겨지고 있다[16,17,22,24]. 조기 근간대성 뇌전증지속상태는 심정지 회복 이후 수일 수주 후에 나타나는 만성 근간대성 경련과는 조금 다른데 후자의 경우 대개 의식의 회복이 있는 환자에서 수년 까지도 지속되며 Lance-Adams 증후군으로 잘 알려져 있다. 이러한 뇌전증지속상태, 혹은 저산소성 뇌전증지속상태는 심정지 환자의 약 1/3에서 나타나는 흔한 증상이며. 대개 근간대성 경련이 많고 때로 근강직성-간대성 경련을 보이기도 한다. 대개 항뇌전증약물에 불응하는 경우가 많으며, 아직까지 이 저산소성 뇌전증지속상태에 대한 정확한 정의가 없는 실정이다. 저체온요법의 도입과 함께 이러한 뇌전증지속상태 이후 약 3%에서 8%까지 좋은 회복을 보였다는 보고들이 있다[17,25]. 하지만 그 반대로 거의 위양성률 0%에 가까운 나쁜 예후인자로 보고하는 연구들이 더 많다[16,18,22,24,26,27]. Kaplan 그룹에서는 이러한 뇌전증지속상태가 나쁜 예후를 보이기는 하나, 뇌간반사가 보존되고 체감각유발전위가 나타나며 뇌파상 배경파의 반응성(reactivity)이 있을 때는 회복 될 가능성이 있다고 하였다[25]. 이에 반해 Wijdicks 그룹은 조기 뇌전증지속상태는 대부분 치료가 힘들고 예외없이 예후가 나쁘며 일부 호전된 환자들은 조기 뇌전증지속상태가 아닌 재가온 시기에 발생하는 뇌전증지속상태이며 이들은 정상에 가까운 배경파에서 뇌전증발작이 일어난다고 주장하였다[26]. 이러한 주장은 Ritternberger 등[27]의 연구에서 비경련성 뇌전증지속상태 환자들은 모두 12시간 내에 발작이 시작되었으며, 모두 나쁜 예후를 보였다고 하여 이를 뒷받침하였으나 환자 수가 12명에 불과하고 후향적 연구라는 한계가 있다. 이에 반해 Lucas 등[28]은 3명의 매우 좋은 예후 (2명 정상, 1명은 미약한 후유증)를 보인 환자들을 보고했는데, 모두 4시간 이내에 경련 발작이 시작되었고 심한 근간대성 경련을 보였다고 하였다.
뇌파는 오랫동안 혼수 환자의 예후판정에 사용되어 왔다. 뇌파는 여러 약물이나 수면 상태, 내과적 문제 등에 의해 많은 영향을 받으며 다양한 소견을 보이기 때문에 2006년 AAN 권고안에서는 하나의 기준으로 포함되지 않았다[15]. 하지만 뇌파는 뇌기능을 실시간으로 볼 수 있는 거의 유일한 방법으로 저체온요법 시 예후 판정에 필수적인 검사이다.
저체온요법 시 뇌파 검사에서 고려할 점이 몇 가지가 있다. 첫째, 저체온요법은 반드시 진정제를 사용하게 되므로 뇌파 판독을 할 때에는 진정효과를 반드시 고려하여야 한다. 둘째, 저체온기, 재가온기, 유지기로 나뉘는 기간(48시간 정도)에 걸쳐 진정 및 저체온 치료가 달라지면서 뇌파에 미치는 영향이 달라질 수 있다. 통상적인 간헐적 이동형 뇌파검사는 대개 30-40분 내의 단면만을 볼 수 있으므로 이러한 면에서 제한점이 있다. 셋째, 심정지 후 뇌전증지속상태는 비경련성(non convulsive)인 경우가 많으며 대부분 12시간 내에 발생하는 것으로 보고되고 있다[27]. 따라서 조기 치료를 위해서는 가능한 이른 시기에 뇌파 검사를 시작할 필요가 있다. 이를 반영해, 2010년 유럽소생협회(European Resuscitation Council)의 권고안[29]에는 저체온요법을 받는 환자는 심정지 후 가능한 이른 시기에 지속적 뇌파를 시행할 것을 권유하고 있다. 즉 저체온요법에서 지속적 뇌파의 목적은 조기에 뇌전증지속상태를 진단하여 조기에 적극적인 치료를 하는 것이며 항뇌전증약물치료를 하면서 그 치료 반응을 모니터하고 예후를 판정하는 데 있다.
뇌파의 예후 판정에 있어 일반적으로 좋은 예후는 알파파(alpha wave)나 베타파(beta wave)가 우세한 경우, 혹은 방추파(spindle activity) 같은 진정 양상의 뇌파, 그리고 자극에 반응성(reactivity)이 있는 경우 들이다. 반대로 돌발파억제양상(burst suppression) 혹은 억제(suppression)양상, 알파혼수(alpha coma), 그리고 전신뇌전증모양방전(generalized epileptiform discharge)의 경우 예후가 좋지 않다[3,14,30]. 하지만 개개의 파형에서 그 예후 예측은 그 신뢰도가 조금 떨어지기 때문에 여러 그룹에서 좋은 파형과 나쁜 파형을 그룹으로 묶어 등급을 정해서 예후 판정에 사용한다(Fig. 2) [3,6,31-33].
통상적인 뇌파는 판독에 전문가의 도움을 요하며 지속적인 관리에 많은 노력을 요한다. 따라서 보다 간단한 형태인 aEEG를 심정지 후 예후 판정에 사용하는 경우가 최근에 늘어나고 있다. aEEG는 quantitative EEG의 일종으로 좌우 2개씩의 전극을 붙여 기록되는 뇌파의 파워만을 시간에 따라 기록한 것이며 이미 neonatal ICU에서 저산소 뇌손상을 받은 신생아의 예후 판정에 주로 사용되고 있다(Fig. 3) [13,14]. 성인에 있어 아직은 통일된 판독 기준이 없으나 여러 보고들에서 연속유형(continuous pattern)은 좋은 예후, 비연속유형(discontinuous [돌발파억제양상 혹은 전신뇌전증모양방전] pattern)은 나쁜 예후를 예측하는데 90% 이상의 positive predictive value를 보인다고 보고하고 있다[18,34,35]. 저자의 경험에도 aEEG의 나쁜 예후 예측은 90% specificity와 95% positive predictive value를 보이고 있으며 좋은 예후 예측은 조금 더 떨어지는 것으로 보인다. 물론 aEEG는 통상 뇌파에 비해 반응성을 볼 수 없고, 알파혼수와 같은 특정파형 분석을 할 수 없으며, 뇌전증모양방전의 판정에 한계점이 분명히 있으므로 통상 뇌파와 보완해서 사용하는 것이 좋다.
결론적으로 지속적 뇌파는 실시간으로 뇌상태를 볼수 있는 장점이 있으며 특히 저체온요법 이후 뇌전증지속상태를 조기 진단하고 치료하는 데 필수적이므로 조기 시행을 권고하고 있다. 예후 판정을 위해 일련의 파형을 등급별로 나누어 분석하는 노력을 하고 있으며 aEEG와 같은 quantitative EEG의 사용이 점차 늘어나고 있다. 특히 뇌파는 나쁜 예후뿐 아니라 좋은 예후를 예측하는 데 도움이 되는 지표 중 하나이다.
체감각 유발전위(SSEP)는 심정지 후 예후 예측에 있어 중요한 역할을 하며 2006년 권고안[15]에도 포함되어 있다. 뇌파와 달리 마취제의 영향을 미미하게 받으며 저체온 시에 잠복기(latency)가 느려지기는 하나 32-34℃에서는 그 크기(amplitude)는 영향을 크게 받지 않으므로[36] 저체온요법에도 그 장점이 부각되고 있다. 대개 정중신경자극을 하는데 양측 N20 potential이 관찰되지 않을 경우, 나쁜 예후를 보일 가능성이 매우 높아서 위양성률이 0%에 가깝고 이는 치료적 저체온요법 이후에도 큰 변화가 없는 것으로 보인다[13,14,17,20,22,24]. 때로 말초신경에 문제가 있는 경우에 위양성을 보일 수 있으므로 이에 조심하여야 하며 온도에 영향을 받으므로 재가온 이후에 시행하는 것이 좋다. 매우 드물게 정상 기능을 회복한 증례보고가 있다[37].
체감각 유발전위는 나쁜 예후를 예측하는 데 있어 매우 신뢰도가 높으나 그 민감도는 50% 정도에 그친다[3,31,32]. 즉, 실제 예후가 나쁜 환자임에도 50% 정도에서만이 체감각유발전위검사 양성, 즉 N20 potential이 나타나지 않는다는 것이다. 따라서 N20 potential이 나타나지 않으면 100%에 가깝게 나쁜 예후를 예측할 수 있으나 반대로 N20 potential이 나타나더라도 이것이 좋은 예후를 반영하는 것이 아니며 나쁜 예후를 보일 가능성이 50%에 가깝다는 단점이 있다. 아마도 체감각유발전위는 피질의 기능을 주로 반영하므로 뇌간이나 피질하구조의 기능저하에 따른 혼수 상태를 예측하기 어려워서 그럴것으로 생각되고 있다. 따라서 좋은 예후 예측에는 사용할 수 없다.
영상 소견은 아직 연구가 부족하여 2006년 권고안에서는 포함되지 않았다[15]. CT는 다른 뇌병변을 감별하여야 하므로 조기에 반드시 시행하여야 하는 검사이나, 조기에 저산소성 뇌손상을 보이는 경우는 많지 않다. 따라서 예후 예측에는 잘 사용하지 않지만 최근 연구에서 조기 뇌부종이 보이는 경우에는 예후가 좋지 않은 것으로 보고되고 있고[24] 이는 저자의 경험에도 마찬가지다.
자기공명영상은 CT에 비해 저산소성 뇌손상을 발견하는 데 훨씬 더 민감하다(Fig. 4). 특히 DWI/ADC의 경우, 이러한 저산소성 뇌손상을 발견하는 데 더 유리한 것으로 보고되고 있으며, 대략 80% 내외의 특이도와 60%-70%의 민감도를 보인다고 보고되고 있다[38-40]. 특히 ADC 값이 650×10-6mm2/s 미만인 경우 예후가 좋지 않다고 보고되었다[40]. 하지만 자기공명영상의 문제점은 그 뇌손상의 심한 정도에 대해 연구자마다 다른 기준을 갖고 있어서 어느 정도의 소견이 나쁜 것인지에 대한 기준이 없으며, 심한 정도와 예후와의 상관관계에 대한 연구도 없다. ADC 값 또한 시간에 따라 큰 변화를 보이며, 어느 뇌 부위를 포함시키냐에 따라 그 차이가 크다.
아직까지 자기공명영상은 예후 예측에 있어 좀 더 많은 연구 결과가 필요할 것으로 보인다.
2006년 AAN 권고안에 생물학적 지표(biomarker)로는 유일하게 NSE가 포함되었으며 >33 μg/L으로 증가하였을때 예후가 나쁘다[15]. S-100의 경우, 저체온요법 이후에도 여전히 논란거리이며 아직은 예후 예측에 사용할 수 없다[5,13,14]. 이러한 차이는 아마도 검사 방법의 한계와 차이에 의한 것으로 생각되고 있다[13,14].
저체온요법 이전에는 NSE의 위양성률이 0%-8.8%였으나 저체온요법 이후의 연구들에서는 위양성률이 0%에서 많게는 24%-29%로 보고되고 있다[17,23,24,30,41,42]. 따라서 일부 저자들은 24시간 측정치에 비해 48시간 이후 측정치가 상승하거나[41,42], 더 높은 cut-off 값(41.1-78.9 μg/L)에서 높은 신뢰도로 나쁜 예후를 예측할 수 있다고 주장하기기도 한다[23].
따라서 치료적 저체온요법 이후, NSE의 결과로 나쁜 예후를 예측할 수 없게 되었으며 아마도 새로운 cut-off 값이 필요할 것으로 보인다. 생물학적 지표로는 좋은 예후를 예측할 수는 없다.
치료적 저체온요법은 심정지 이후 의식이 회복되지 않은 환자에 있어 표준치료로 자리잡았다. 이러한 환자에 있어 신경과 의사의 역할을 이른 시기에 정확한 예후 예측을 하는 것이며 때로는 뇌전증지속상태를 조기에 발견하여 적극적인 치료를 하여야 한다. 저체온요법을 함으로써 진정제와 근이완제를 사용하게 되고 이는 이전의 접근에 비해 좀 더 주의를 요한다. 따라서 저체온 치료가 끝나고 정상체온이 돌아온 후, 그리고 진정효과가 사라졌다고 생각될 때 판정을 고려해야 할 것이다.
저체온요법 이전의 결과를 주로 반영한 2006년에 AAN 권고안에 비해, 저체온요법은 예후 예측에 일부 변화를 가져왔다. 현재 나쁜 예후를 예측하는 데 확실히 도움이 되는 것은 뇌간반사의 소실과 양측 체감각전위의 소실이다. 그리고 뇌파의 돌발파억제양상, 억제양상, 전신뇌전증모양방전, aEEG의 discontinuous pattern소견은 역시 나쁜 예후를 예측할 가능성이 높다. 좋은 예후를 예측할 수 있는 것은 굽힘반응 이상의 운동반응과 뇌파와 aEEG의 좋은 예후 소견들이나 그 신뢰도는 확실한 정도는 아니다. 가장 큰 변화는 3일 째 운동반응의 소실과 >33 μg/L 이상의 NSE 값이 더이상 확실한 나쁜 예후의 지표가 아니라는 점이며, 뇌전증지속상태의 경우 역시 호전을 보이는 환자가 늘어남에 따라 보다 적극적인 치료를 요구한다는 점이다. 또한 72시간이라는 전통적인 시간대를 고집하지 말고 상황에 따라 좀 더 기다려 보아야 할 필요성이 있다. 자기공명영상의 역할에 대해서는 좀 더 많은 결과가 필요하다.
결론적으로 심정지 후 치료적 저체온요법의 도입으로 의미있는 신경학적 회복의 가능성이 늘어나게 되었으며 이는 반대로 예후 판정에 있어 좀 더 신중한 접근을 해야 한다는 것을 의미한다. 저체온요법 이후의 새로운 가이드 라인이 발표되기를 기대한다.
REFERENCES
1. Safar P. Cerebral resuscitation after cardiac arrest: a review. Circulation. 1986; 74:138–53.
2. Edgren E, Hedstrand U, Nordin M, Rydin E, Ronquist G. Prediction of outcome after cardiac arrest. Crit Care Med. 1987; 15:820–5.

3. Koenig MA, Kaplan PW, Thakor NV. Clinical neurophysiologic monitoring and brain injury from cardiac arrest. Neurol Clin. 2006; 24:89–106.

4. Nichol G, Thomas E, Callaway CW, Hedges J, Powell JL, Aufderheide TP, et al. Regional variation in out-of-hospital cardiac arrest incidence and outcome. JAMA. 2008; 300:1423–31.

5. Young GB. Clinical practice. Neurologic prognosis after cardiac arrest. N Engl J Med. 2009; 361:605–11.
6. A randomized clinical study of a calcium-entry blocker (lidoflazine) in the treatment of comatose survivors of cardiac arrest. Brain Resuscitation Clinical Trial II Study Group. N Engl J Med. 1991; 324:1225–31.
7. Randomized clinical study of thiopental loading in comatose survivors of cardiac arrest. Brain Resuscitation Clinical Trial I Study Group. N Engl J Med. 1986; 314:397–403.
8. Jastremski M, Sutton-Tyrrell K, Vaagenes P, Abramson N, Heiselman D, Safar P. Glucocorticoid treatment does not improve neurological recovery following cardiac arrest. Brain Resuscitation Clinical Trial I Study Group. JAMA. 1989; 262:3427–30.

9. Hypothermia after Cardiac Arrest Study G. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 2002; 346:549–56.
10. Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, et al. Treatment of comatose survivors of outof-hospital cardiac arrest with induced hypothermia. N Engl J Med. 2002; 346:557–63.

11. Nolan JP, Morley PT, Vanden Hoek TL, Hickey RW, Kloeck WG, Billi J, et al. Therapeutic hypothermia after cardiac arrest: an advisory statement by the advanced life support task force of the International Liaison Committee on Resuscitation. Circulation. 2003; 108:118–21.
12. Peberdy MA, Callaway CW, Neumar RW, Geocadin RG, Zimmerman JL, Donnino M, et al. Part 9: post-cardiac arrest care: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010; 122:S768–86.
13. Blondin NA, Greer DM. Neurologic prognosis in cardiac arrest patients treated with therapeutic hypothermia. Neurologist. 2011; 17:241–8.

14. Friberg H, Rundgren M, Westhall E, Nielsen N, Cronberg T. Continuous evaluation of neurological prognosis after cardiac arrest. Acta Anaesthesiol Scand. 2013; 57:6–15.

15. Wijdicks EF, Hijdra A, Young GB, Bassetti CL, Wiebe S; Quality Standards Subcommittee of the American Academy of N. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006; 67:203–10.

16. Crepeau AZ, Rabinstein AA, Fugate JE, Mandrekar J, Wijdicks EF, White RD, et al. Continuous EEG in therapeutic hypothermia after cardiac arrest: prognostic and clinical value. Neurology. 2013; 80:339–44.

17. Rossetti AO, Oddo M, Logroscino G, Kaplan PW. Prognostication after cardiac arrest and hypothermia: a prospective study. Ann Neurol. 2010; 67:301–7.

18. Rundgren M, Westhall E, Cronberg T, Rosen I, Friberg H. Continuous amplitude-integrated electroencephalogram predicts outcome in hypothermia-treated cardiac arrest patients. Crit Care Med. 2010; 38:1838–44.

19. Morrison LJ, Visentin LM, Kiss A, Theriault R, Eby D, Vermeulen M, et al. Validation of a rule for termination of resuscitation in out-of-hospital cardiac arrest. N Engl J Med. 2006; 355:478–87.

20. Oddo M, Ribordy V, Feihl F, Rossetti AO, Schaller MD, Chiolero R, et al. Early predictors of outcome in comatose survivors of ventricular fibrillation and non-ventricular fibrillation cardiac arrest treated with hypothermia: a prospective study. Crit Care Med. 2008; 36:2296–301.

21. Rogove HJ, Safar P, Sutton-Tyrrell K, Abramson NS. Old age does not negate good cerebral outcome after cardiopulmonary resuscitation: analyses from the brain resuscitation clinical trials. The Brain Resuscitation Clinical Trial I and II Study Groups. Crit Care Med. 1995; 23:18–25.
22. Rossetti AO, Urbano LA, Delodder F, Kaplan PW, Oddo M. Prognostic value of continuous EEG monitoring during therapeutic hypothermia after cardiac arrest. Crit Care. 2010; 14:R173.

23. Zellner T, Gartner R, Schopohl J, Angstwurm M. NSE and S-100B are not sufficiently predictive of neurologic outcome after therapeutic hypothermia for cardiac arrest. Resuscitation. 2013; 84:1382–6.

24. Fugate JE, Wijdicks EF, Mandrekar J, Claassen DO, Manno EM, White RD, et al. Predictors of neurologic outcome in hypothermia after cardiac arrest. Ann Neurol. 2010; 68:907–14.

25. Rossetti AO, Oddo M, Liaudet L, Kaplan PW. Predictors of awakening from postanoxic status epilepticus after therapeutic hypothermia. Neurology. 2009; 72:744–9.

26. Rabinstein AA, Wijdicks EF. The value of EEG monitoring after cardiac arrest treated with hypothermia. Neurology. 2012; 78:774–5.

27. Rittenberger JC, Popescu A, Brenner RP, Guyette FX, Callaway CW. Frequency and timing of nonconvulsive status epilepticus in comatose post-cardiac arrest subjects treated with hypothermia. Neurocrit Care. 2012; 16:114–22.

28. Lucas JM, Cocchi MN, Salciccioli J, Stanbridge JA, Geocadin RG, Herman ST, et al. Neurologic recovery after therapeutic hypothermia in patients with post-cardiac arrest myoclonus. Resuscitation. 2012; 83:265–9.

29. Deakin CD, Nolan JP, Soar J, Sunde K, Koster RW, Smith GB, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. Resuscitation. 2010; 81:1305–52.

30. Cronberg T, Lilja G, Rundgren M, Friberg H, Widner H. Long-term neurological outcome after cardiac arrest and therapeutic hypothermia. Resuscitation. 2009; 80:1119–23.

31. Bassetti C, Bomio F, Mathis J, Hess CW. Early prognosis in coma after cardiac arrest: a prospective clinical, electrophysiological, and biochemical study of 60 patients. J Neurol Neurosurg Psychiatry. 1996; 61:610–5.

32. Kaplan PW. Electrophysiological prognostication and brain injury from cardiac arrest. Semin Neurol. 2006; 26:403–12.

33. Scollo-Lavizzari G, Bassetti C. Prognostic value of EEG in post-anoxic coma after cardiac arrest. Eur Neurol. 1987; 26:161–70.

34. Rundgren M, Rosen I, Friberg H. Amplitude-integrated EEG (aEEG) predicts outcome after cardiac arrest and induced hypothermia. Intensive Care Med. 2006; 32:836–42.

35. Oh SH, Park KN, Kim YM, Kim HJ, Youn CS, Kim SH, et al. The prognostic value of continuous amplitude-integrated electroencephalogram applied immediately after return of spontaneous circulation in therapeutic hypothermia-treated cardiac arrest patients. Resuscitation. 2013; 84:200–5.

36. Stecker MM, Cheung AT, Pochettino A, Kent GP, Patterson T, Weiss SJ, et al. Deep hypothermic circulatory arrest: I. Effects of cooling on electroencephalogram and evoked potentials. Ann Thorac Surg. 2001; 71:14–21.

37. Leithner C, Ploner CJ, Hasper D, Storm C. Does hypothermia influence the predictive value of bilateral absent N20 after cardiac arrest? Neurology. 2010; 74:965–9.

38. Jarnum H, Knutsson L, Rundgren M, Siemund R, Englund E, Friberg H, et al. Diffusion and perfusion MRI of the brain in comatose patients treated with mild hypothermia after cardiac arrest: a prospective observational study. Resuscitation. 2009; 80:425–30.

39. Wijman CA, Mlynash M, Caulfield AF, Hsia AW, Eyngorn I, Bammer R, et al. Prognostic value of brain diffusion-weighted imaging after cardiac arrest. Ann Neurol. 2009; 65:394–402.

40. Wu O, Sorensen AG, Benner T, Singhal AB, Furie KL, Greer DM. Comatose patients with cardiac arrest: predicting clinical outcome with diffusion-weighted MR imaging. Radiology. 2009; 252:173–81.

Figure 1.
Decision algorithm for outcome prediction for comatose survivors after cardiac arrest by American Academy of Neurology, 2006. Modified from Wijdicks et al. Neurology 2006;67:203-10. SE: status epilepticus, FPR: false positive rate, NSE: neuron specific enolase, SSEP: somatosensory evoked potential.
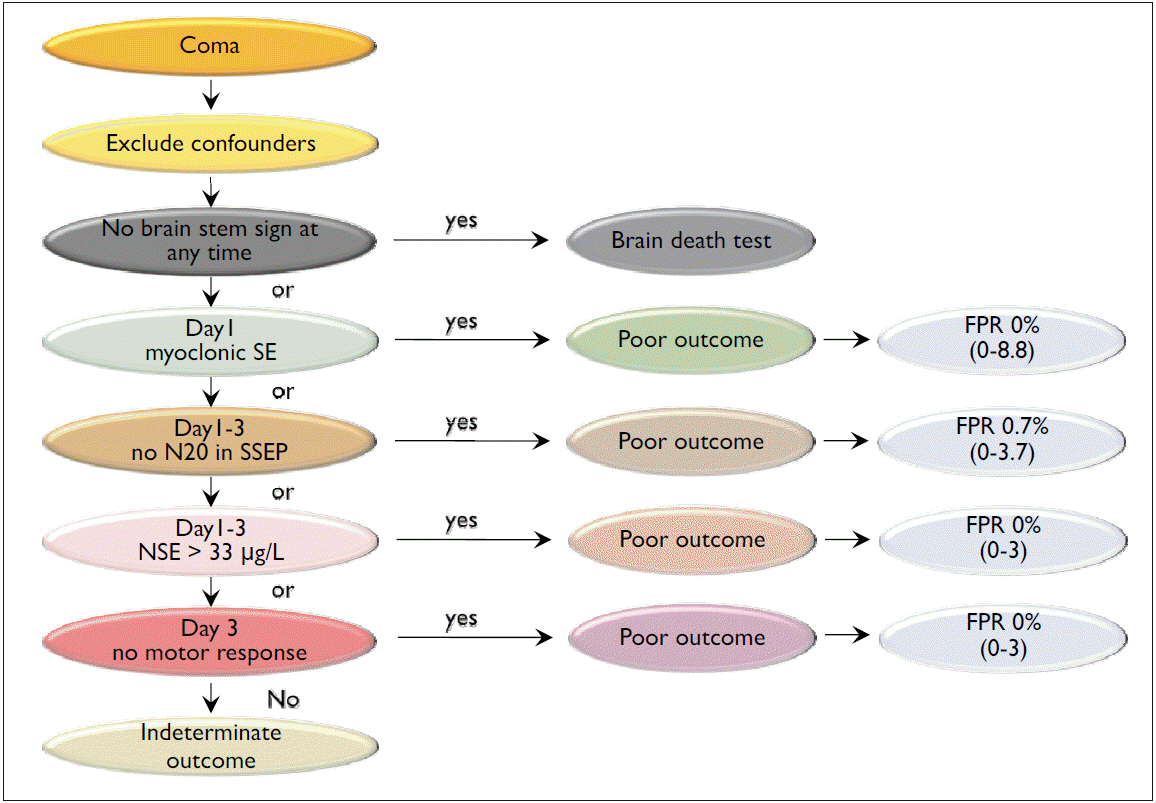
Figure 2.
EEG findings of the patients after cardiac arrest. (A) Relatively rhythmic alpha and beta dominant background activity with EMG artifact in a patient with CPC 1 prognosis. (B) Continuous polyspike and slow wave complexes and background suppression in a patient with myoclonic status epilepticus. The CPC grade was 4. (C) Burst suppression pattern EEG in a patient with CPC 4 prognosis. (D) Generalized tonic clonic status epilepticus in a patient with CPC 1 prognosis after successful AED treatment. CPC: cerebral performance categories, AED: antiepileptic drug.
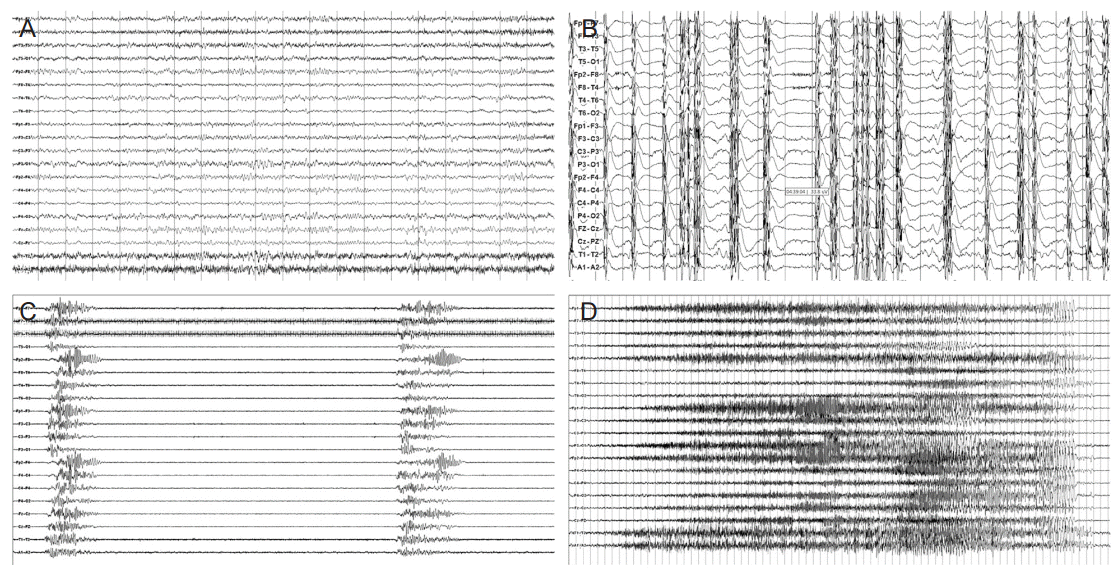
Figure 3.
aEEG and CSA findings of the same patients in the figure 2. (A) aEEG shows continuous pattern (relatively condensed) of background activity with low limit above 10 μV, and CSA showed intermittent high power vertical lines of beta frequency with strong background activities suggesting EMG artifacts. (B) aEEG and CSA in a patient with myoclonic status epilepticus. Discontinuous pattern but relatively high amplitude background activity suggests status epilepticus rather than burst suppression. (C) Burst suppression pattern of aEEG and CSA. The background activity is very low amplitude (or power). (D) Generalized tonic clonic status epilepticus and successful treatment. Frequent bursts with relatively higher background activities of irregular intervals suggest status epilepticus rather than burst suppression. Treatment with antiepileptic drug dramatically improved aEEG and CSA pattern similar to the findings in a patient with good prognosis. aEEG: amplitude-integrated EEG, CSA: compressed spectral array.
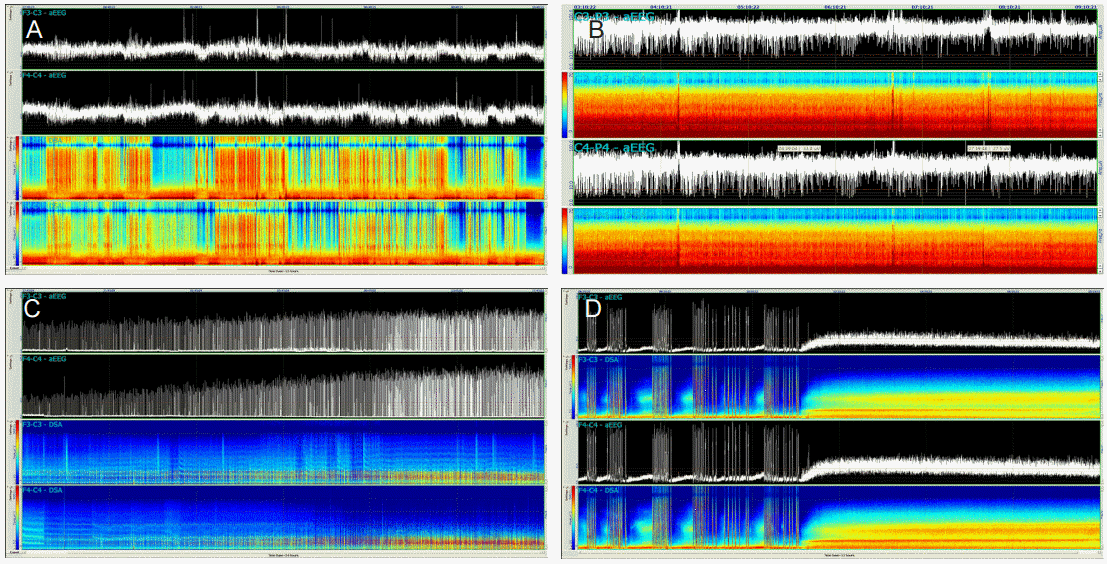
Figure 4.
MRI findings of severely injured hypoxic-ischemic encephalopathy patients after cardiac arrest. (A) Comparison of diffusion weighted image (DWI) and apparent diffusion coefficient (ADC) maps with low and high b-value. High b-value DWI/ADC shows more sensitive ischemic change than low b-value image. (B) Transcerebral and cortical vein signs on gradient echo image (GRE) or susceptibility-weighted image (SWI) may suggest severe hypoxic-ischemic injury of the brain in the selective patients.
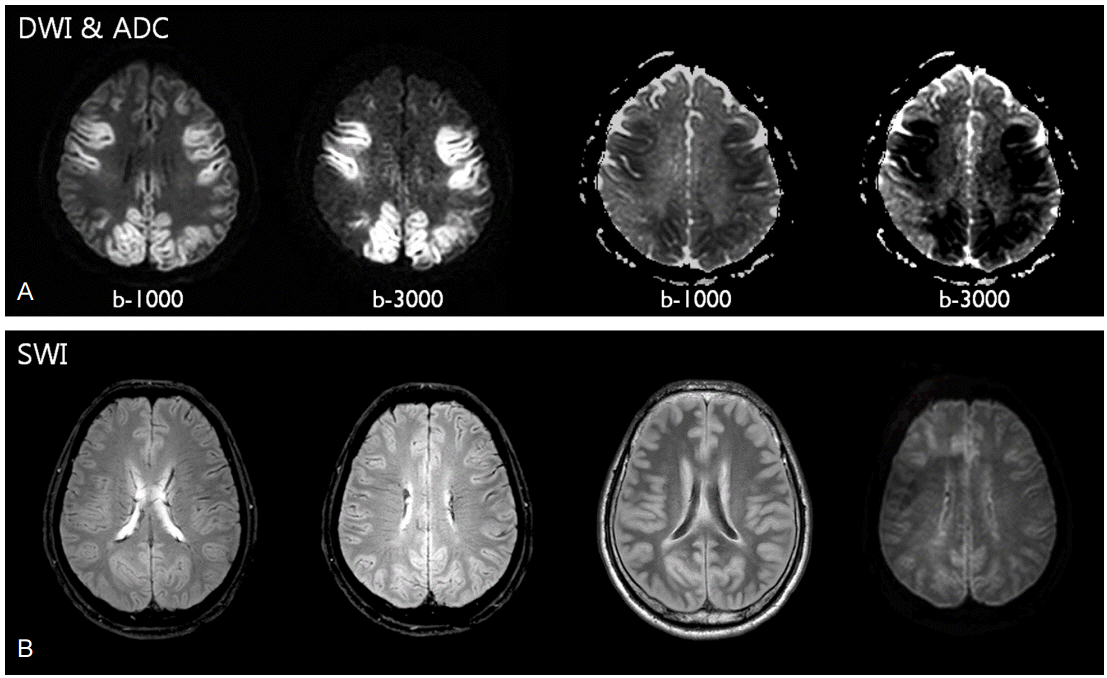
Table 1.
Cerebral performance categories
Adapted from Morrison et al. N Engl J Med 2006;355:478-87 [19].




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download