Abstract
Background
New-onset refractory status epilepticus (NORSE) occurs in people without a history of seizures. In these cases, the seizure causes are unclear, and the seizures are not controlled by standard treatment. Autoimmune encephalitis (AIE) can be a cause of NORSE. Cryptogenic NORSE may be associated with AIE, but antibodies associated with the condition have not yet been identified. Primary immunotherapy may not be effective for AIE. Rituximab has improved the prognosis in some cases.
Case Report
We treated a cryptogenic NORSE patient with a combination of antiepileptic drugs and immunotherapy. On the 13th hospital day, the seizures were controlled, but the patient remained in a coma. The patient rapidly recovered after administration of rituximab started on the 26th hospital day.
뇌전증지속상태(status epilepticus)가 발생하면 치료 방향을 빨리 결정해야 예후가 좋아진다. 따라서 초기에 적극적으로 뇌전증지속상태의 원인을 파악해야 하는데 원인 파악이 쉽지만은 않다. 원인 파악이 어려운 경우로 신발현난치뇌전증지속상태(new-onset refractory status epilepticus, NORSE)를 언급할 수 있다. 뇌전증지속상태를 설명할 수 있는 명백한 원인을 찾기가 어려워야 NORSE라고 하지만, 진료를 하는 과정에서 바이러스나 자가면역이 원인으로 밝혀지는 경우도 NORSE에 포함된다. 원인을 결국 찾지를 못하는 경우를 잠복 NORSE (cryptogenic NORSE)라고 한다[1]. NORSE와 관련이 있는 항체가 발견되었으며, 뇌전증발생(epileptogenesis)에 염증이 관여한다는 것이 알려지고 나서 NORSE의 치료에 면역치료가 추가되었다. 자가면역뇌염이 NORSE의 원인인 경우에 우선적으로 선택할 수 있는 면역치료는 고용량스테로이드, 면역글로불린 그리고 혈장교환술이다. 이 면역치료들이 효과가 없거나 충분하지 않은 경우에 고려할 수 있는 치료가 리툭시맙(rituximab)이나 시클로포스파미드(cyclophosphamide)이다[1-4].
Gaspard 등[1]은 13개의 교육의료기관에서 6년 동안 후향적으로 수집한 130명의 NORSE 환자를 대상으로 NORSE의 원인을 조사하여 2015년에 발표하였다. 이 조사를 통하여 NORSE가 발생한 환자에서 찾을 수 있는 원인의 윤곽이 파악되었다. 가장 흔한 원인으로는 자가면역뇌염과 신생물딸림뇌염이었는데 각각 19%와 18%였다. 52%의 NORSE 환자는 여전히 원인불명이었다. 그러나 현재까지 밝혀지지 않은 자가항체가 더 존재할 가능성이 있다. 따라서 잠복NORSE 중에 일부는 자가면역기전에 의하여 발생할 가능성이 있다.
잠복NORSE라고 정의할 수 있는 본 증례에서 저자들은 병의 경과 초기부터 항뇌전증약 치료와 함께 면역치료로 고용량스테로이드, 면역글로불린을 사용하였다. 치료 후에 발작이 조절되었지만 환자의 의식은 회복이 되지 않았다. 자가면역뇌염을 시사하는 항체가 이 환자에서 검출되지 않았지만 저자들은 추가 면역치료로 리툭시맙을 사용하였다.
건강하게 지내다가 4일 전부터 발열과 근육통을 앓던 53세 남자가 자던 중 새벽에 발작을 하였다. 발작이 멈추고 30분이 지난 시각에 환자는 응급실에 도착하였다. 응급실에 도착한 환자는 의식을 회복하지 못하고 혼동상태를 유지하다가 다시 발작을 하였다. 환자의 발작은 부분발작으로 시작하여 전신발작으로 번졌다. 안구와 머리가 오른쪽으로 돌아가면서 발작이 시작되고 오른쪽 얼굴에 연축이 나타났다. 이어서 오른쪽 팔과 다리에 강직간대발작이 발생하였고 전신강직강대발작으로 확대되었다. 전체 지속 시간은 2분 정도였다. 아티반(ativan) 4 mg을 정맥으로 주사하고 나서 발작은 멈추었으나 환자는 의식을 회복하지 못하였다. 의식을 회복하지 못한 상태에서 같은 양상의 발작이 한 번 더 발생하여 아티반 4 mg을 추가로 정맥주사하였고, 뇌전증지속상태로 판단하고 레비티라세탐(levetiracetam) 부하용량 3 g을 정맥으로 주사하였다.
응급실에서 기록한 환자의 두피뇌파에서는 머리 전반에 걸쳐서 서파가 관찰되었다. 혈액검사에서는 백혈구의 수가 11,360/mm3로 약간 증가되었고 C-반응단백은 정상 범위였다. 뇌척수액검사 결과에서 개방압력은 12.5 cmH2O, 백혈구수는 4/mm3, 포도당은 62 mg/dL (혈청 132 mg/dL)였고, 단백질은 74.9 mg/dL였다. 뇌자기공명영상에서 뇌실질과 뇌막은 모두 정상이었다. 종양표지자로 carcinoembryonic antigen, carbohydrate antigen 19-9, prostate specific antigen 그리고 alpha fetoprotein를 검사하였는데 입원하고 나서 모두 음성으로 보고되었다.
입원 후 2일 동안 환자에게 발작은 없었고 환자는 기면(drowsy) 상태로 깨우면 지남력이 있었다. 그러나 입원 3일째가 되면서 처음과 같은 양상의 발작이 환자에게 발생하였다. 발작은 20초 정도 지속되었고 1-10분 간격으로 여섯 번 반복적으로 발생하였다. 발작을 조절하기 위하여 발프로산(valproic acid) 2 g을 정맥으로 투여하여도 5-20분 간격으로 발작이 반복되어 토피라메이트(topiramate) 200 mg을 비위관을 통하여 투여하고 8시간 간격으로 같은 용량을 반복하여 투여하였다. 토피라메이트 치료로 발작이 1-1.5시간 간격으로 빈도가 줄었으나 의식은 호전되지 않았다. 하루가 지나도 발작이 더 이상 줄지 않아 지속적 비디오-뇌파감시 장치로 환자를 모니터링하기 시작하면서 미다졸람(midazolam)을 정맥으로 주사하였다. 미다졸람은 부하용량으로 0.2 mg/kg을 2 mg/min의 속도록 주사하고 유지용량은 0.2 mg/kg/hr로 시작하여 경과를 관찰하면서 1시간 간격으로 배수로 속도를 증량하였다. 입원 5일째 돌발파억제양상(burst-suppression pattern)이 나타날 때까지 미다졸람을 증량하고 나서 환자의 발작이 조절되었다. 이 때 미다졸람의 용량은 0.8 mg/kg/hr였다.
저자들은 환자의 상태를 NORSE라고 판단하였다. 원인을 찾지는 못하였지만 발열이 선행하였고 악화가 빠르다는 것을 고려하여 환자에게 자가면역뇌염이 발생하였을 가능성이 있다고 판단하였다. 그래서 입원 4일째 미다졸람을 투여하기 시작할 때 면역치료도 같이 시작하였다. 매일 메틸프레드니솔론(methylprednisolone) 1 g을 3시간에 걸쳐서 천천히 정맥으로 투여하였고 5일간 유지하였다.
입원 5일째에 발작이 조절되고 그 이후 24시간 동안 발작이 없어 미다졸람 감량을 고려하였다. 그러나 입원 6일째부터 전기도발작(electrographic seizure)이 뇌파에서 다시 관찰되었다. 돌발파억제양상이 선행되어 나타나는 전기도발작은 왼쪽 측두엽에서 시작하여 인접한 부위로 확대되었고(Fig. 1A), 일부는 오른쪽 뇌반구를 포함하여 양쪽 뇌반구에 광범위하게 확대되었다. 발작이 없는 뇌파구간에는 돌발파억제양상이 관찰되었다(Fig. 1B). 발작이 30분 간격으로 반복되어 미다졸람 용량을 2.0 mg/kg/hr까지 증량하였으나 효과가 없었다. 입원 7일째에 추가로 페노바비탈(phenobarbital) 20 mg/kg을 30분 동안 정맥으로 주사하고 10 mg/kg을 4시간 간격으로 두 번 더 정맥으로 주사하였다. 전기도발작이 1시간에 한 번 정도로 빈도가 감소하였으나 완전히 멈추지는 않았다.
입원 8일째에 다시 케타민(ketamine)을 추가하여 부하용량으로 1.5 mg/kg을 투여하고 이후 1 mg/kg/hr로 정맥으로 투여하기 시작하였다. 자가면역뇌염의 가능성을 고려하여 입원 12일째부터는 케타민과 병행하여 면역글로불린 400 mg/kg/day을 정맥으로 주사하였다. 케타민의 용량을 4 mg/kg/hr까지 증량하고 나서야 전기도발작이 완전히 소실되었는데 이때가 입원 13일째였다. 비디오-뇌파감시를 지속적으로 하여 48시간 동안 발작이 없는 것을 확인하고, 이후 24시간에 걸쳐 케타민 용량을 서서히 감량하여 중단하였다. 면역글로불린은 발작이 멈추고 이틀을 더 유지하여 입원 1일째까지 5일간 사용하였다.
케타민과 면역글로불린 치료로 발작이 조절된 후에도 환자는 혼수상태였다. 두피뇌파에서는 머리 전반에 관찰되는 다형서파가 지속되었다. 진정약물을 모두 중단해도 통증자극에 반응이 없고 자발호흡도 회복되지 않았다. 케타민과 면역글로불린의 투여가 끝나고 나서부터 10일이 지나도 환자의 의식은 변함없이 회복되지 않았다.
이 시기에 감염의 원인을 감별하기 위하여 보내진 검사 결과들을 확인할 수 있었다. 뇌척수액 검체를 이용한 바이러스 검사는 모두 음성이었다. 단순헤르페스바이러스, 수두대상포진바이러스, 거대세포바이러스, 엡스타인-바바이러스, 6형 사람헤르페스바이러스에 대한 항체와 중합효소연쇄반응이 음성이었고, 일본뇌염바이러스의 항체도 음성이었다. 뇌척수액의 결핵균검사도 모두 음성이었다. 배양검사, 중합효소연쇄반응이 음성이었고, 아데노신탈아미노효소활성도도 정상이었다. 미생물과 진균의 배양과 그람염색에서도 동정이 되거나 염색이 되는 것이 없었다.
자가면역뇌염 항체검사의 결과도 보고되었다. 신경세포표면항원과 시냅스단백에 대한 자가면역항체(autoantibodies against neuronal cell-surface antigens or synaptic protein, NSA)로는 항NMDA항체, 항AMPA1항체, 항AMPA2항체, 항LGI1항체, 항CASPR2항체 그리고 항GABAB항체를 검사하였고, 신생물딸림항체로는 항Hu항체, 항Ri항체, 항Yo항체, 항Amphiphysin항체, 항CV2항체, 항PNMA2항체, 항Recoverin항체, 항SOX1항체 그리고 항Titin항체를 검사하였는데 모두 음성이었다.
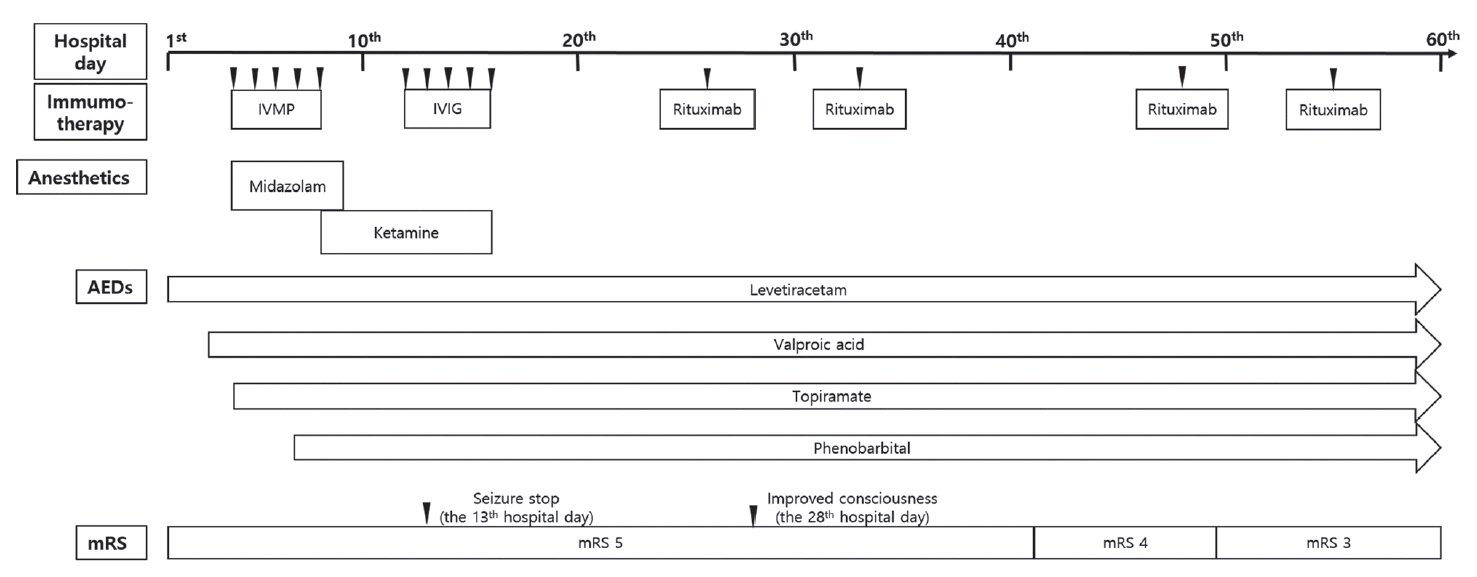
검사한 자가항체들이 음성이었지만 환자의 의식이 호전되지 않아 현재로는 검사를 할 수 없는 다른 자가항체에 의한 자가면역뇌염의 가능성을 고려하였다. 입원 26일째 리툭시맙 375 mg/m2을 400 mg/hr 속도로 정맥으로 주사하였다. 리툭시맙을 투여하고 이틀이 지나서 환자는 스스로 호흡을 하기 시작하였다. 이 때에 환자의 손에 통증자극을 주면 환자는 회피 반응을 하였다. 이틀이 더 지나서는 환자는 자발적으로 눈을 깜빡이기 시작하였다. 첫 번째 투여를 포함하여 리툭시맙 375 mg/m2을 총 4회 정맥으로 주사하였다. 정맥주사의 간격은 7일로 하였다. 그러나 세 번째 주사 시기에 발열과 기침이 환자에게 발생하고 백혈구증가증이 동반되었다. 이때 흉부 X선 검사에서는 확인할 수 없었지만 폐렴의 가능성이 있어 세 번째 리툭시맙은 정해진 시기에서 8일을 늦추어 주사하였다. 환자의 의식은 점차 호전되어 입원 61일째 수정랭킨척도(modified Rankin Scale, mRS) 3점으로 회복되어 걸어서 집으로 퇴원하였다(Fig. 2).
Wilder-Smith 등[5]은 2005년에 발표한 논문을 통하여 임상적으로 독특하며 동일한 양상이 있는 7명의 여자 환자를 모아서 NORSE를 정의하였다. 이들은 나이가 20-52세였고, 건강히 지내다가 갑자기 뇌전증지속상태를 겪은 환자들이었다. 뇌전증지속증의 지속 시간이 평균 32일로 길었으며, 원인을 찾을 수가 없었고 예후가 좋지 않았다. 7명 중 4명에서는 뇌척수액에 다구증이 있었고, 5명에서 발열이 선행하였다[5].
2017년에는 다기관의 전문가들이 패널을 통하여 NORSE의 표준적 정의를 마련하였다[6]. 이 패널에서 합의된 NORSE의 정의는 임상 발현이지 특정 진단이 아니다. 현재 활동성 뇌전증을 앓고 있지 않으며 뇌전증지속상태와 연관이 있을 만한 신경학적 질환이 없는 환자에서 발생하고, 새롭게 발생한 뇌전증지속상태가 난치성인 경우가 NORSE이다. 급성-활동성으로 발생한 구조적, 독성, 혹은 대사성 원인이 명확하지 않을 때 NORSE라고 하지만, 바이러스나 자가면역에 의하여 발생하는 경우를 포함한다. 원인을 결국 찾지 못하는 경우가 잠복 NORSE 혹은 원인불명(unknown etiology)의 NORSE이다.
NORSE 환자 중 자가면역기전이 원인인 경우가 적지 않다는 것이 알려지면서, NORSE의 발작을 조절하기 위하여 면역치료를 하게 되었다. 이 면역치료는 고용량스테로이드, 면역글로불린, 혈장교환술을 포함하고 있다. 면역치료가 NORSE의 발작을 조절하는 기전인지는 아직 명확하지 않다. 그러나 그 기전을 지지해주는 두 가지 발전이 있었다[4]. 첫째는 NORSE와 관련이 있는 항체의 발견이다. 전압작동포타슘통로에 대한 항체가 밝혀졌고 뒤를 이어 N-메틸-D-아스파르트산수용체(N-methyl-D-aspartate수용체)에 대한 항체가 밝혀졌다. 두 번째는 염증이 뇌전증발생에 중요한 역할을 한다는 것이 알려진 것이다. 동물실험과 사람의 조직에서 특정한 염증신호경로의 활성화가 뇌전증발생기전에 관여하였다.
리툭시맙은 B림프구특이항원인 CD20에 대한 단일클론항체로 작용하여 염증을 억제한다. 류마티스관절염, 전신홍반루푸스, 특발혈소판감소자반증들과 같은 자가면역질환의 치료에 주로 사용되고 있다[7]. NORSE의 원인이 될 수 있는 자가면역뇌염과 신생물딸림뇌염에 대한 리툭시맙의 효과가 다기관에서 모집한 환자를 대상으로 평가된 연구는 있다[8]. 이 연구에 포함되었고 일차면역치료가 효과가 없었던 환자들에서 리툭시맙을 사용한 경우와 그렇지 않은 경우가 있었다. 리툭시맙을 사용한 경우에 환자의 60.0%가 타인의 도움 없이 일상생활이 가능한 정도 이상으로 회복되었으나 리툭시맙을 사용하지 않은 경우는 환자의 22.2%만 이 정도의 회복을 보였다. NORSE의 상당수가 자가면역뇌염에 의하여 발생하므로 리툭시맙은 NORSE에 효과가 있다고 할 수 있으며 반드시 고려해야 할 치료이다. 특히 일차면역치료에 반응하지 않는 NORSE에서는 도움이 될 것이다.
다기관전향코호트연구로 뇌전증지속상태 환자를 등록하고 그중에서 잠복NORSE 증례를 추출하여 그 특성을 조사한 보고가 있다[9]. 잠복NORSE에 해당하는 증례는 19예였는데 이들에게 입원 중 시행한 면역치료의 효과를 평가하였다. 환자가 퇴원하고 3-6개월이 지난 후 평가한 mRS에서 생활하는데 타인의 도움이 필요하지만 보조 없이 걸을 수 있는 정도 이상으로 회복한 경우가 면역치료를 한 증례에서는 78.5%였고, 면역치료를 하지 않은 증례에서는 60%였다. 이 차이가 통계적인 의미는 없었던 것은 아쉬웠다. 리툭시맙을 포함한 면역치료를 한 경우만 포함시켰을 때에는 위와 같이 호전을 보인 경우는 90%였다. 따라서 리툭시맙이 잠복NORSE 환자에서 발작을 조절해줄 뿐 아니라 장기적 예후도 호전 시킨다고 할 수 있다. 잠복NORSE 환자에서 발작이 조절되어도 의식의 호전이 없으면 리툭시맙을 사용할 필요가 있다.
저자들은 이 증례에서 잠복NORSE 환자에서 자가면역뇌염을 초래할 수 있고 검사가 가능한 모든 항체들을 검사하였다. 이 검사들에서 양성 결과를 얻지 못하였지만 아직 알려져 있지 않는 항체들이 있어 자가면역뇌염을 완전하게 배제할 수 없었다. 자가면역뇌염 136명을 대상으로 한 연구에서 11명이 잠복NORSE에 해당하였다. 전체 환자 중 39명에서 NSA가 검출되었다. 이 중 2명에서는 아직 알려지지 않은 항원에 대한 항체가 원인이었다. 또 다른 1명에서는 본 증례에서 미처 검사를 하지 못한 항GABAA항체가 원인이었다. 이들 3명이 본 증례와 같은 검사 환경에 있었더라면 잠복NORSE로 분류될 수밖에 없다[10]. 잠복NORSE의 경우는 아니지만 mGluR5뇌염 10명의 증례도 보고되었다. 이 환자 중 6명에서 발작이 발현되었고 4명은 악성종양과 관련이 없었다[11].
병의 초기부터 항뇌전증약과 함께 일차면역치료인 고용량 스테로이드와 면역글로불린이 본 증례의 환자에게 사용되었다. 자가면역뇌염의 관련성을 고려하였기 때문이다. 이렇게 치료하고 환자의 발작은 조절되어서 일차면역치료가 발작을 조절하는데 기여하였을 가능성이 있다. 반대로, 발작이 조절되고 열흘이 지나도 환자의 의식이 호전되지 않은 점은 일차면역치료의 효과를 의심하게 하였다. 환자의 상태를 잠복 NORSE라고 정의할 수는 있지만 항체를 찾아낼 수 없으며, 일차면역치료에 반응하지 않는 자가면역뇌염일 가능성이 아직 남아 있다고 판단하여 이차면역치료로 리툭시맙을 사용하였다. 리툭시맙으로 치료를 하면서 환자는 의식을 빠르게 회복하였다. 본 증례는 검사를 통하여 아직까지는 찾아낼 수 없는 자가항체에 의한 자가면역뇌염의 가능성이 있다. 특히 본 증례와 같은 잠복NORSE 환자에서 발작이 조절되었더라도 의식이 호전되지 않는 경우에 이 가능성이 있으므로 일차면역치료에 실패한 경우라도 리툭시맙 치료를 고려해야 한다.
REFERENCES
1. Gaspard N, Foreman BP, Alvarez V, Cabrera Kang C, Probasco JC, Jongeling AC, et al. New-onset refractory status epilepticus: etiology, clinical features, and outcome. Neurology. 2015; 85:1604–13.
2. Gall CR, Jumma O, Mohanraj R. Five cases of new onset refractory status epilepticus (NORSE) syndrome: outcomes with early immunotherapy. Seizure. 2013; 22:217–20.

3. Li J, Saldivar C, Maganti RK. Plasma exchange in cryptogenic new onset refractory status epilepticus. Seizure. 2013; 22:70–3.

4. Shorvon S, Ferlisi M. The treatment of super-refractory status epilepticus: a critical review of available therapies and a clinical treatment protocol. Brain. 2011; 134(Pt 10):2802–18.

5. Wilder-Smith EP, Lim EC, Teoh HL, Sharma VK, Tan JJ, Chan BP, et al. The NORSE (new-onset refractory status epilepticus) syndrome: defining a disease entity. Ann Acad Med Singapore. 2005; 34:417–20.
6. Gaspard N, Hirsch LJ, Sculier C, Loddenkemper T, van Baalen A, Lancrenon J, et al. New-onset refractory status epilepticus (NORSE) and febrile infection-related epilepsy syndrome (FIRES): state of the art and perspectives. Epilepsia. 2018; 59:745–52.

7. Taylor RP, Lindorfer MA. Drug insight: the mechanism of action of rituximab in autoimmune disease--the immune complex decoy hypothesis. Nat Clin Pract Rheumatol. 2007; 3:86–95.

8. Lee WJ, Lee ST, Byun JI, Sunwoo JS, Kim TJ, Lim JA, et al. Rituximab treatment for autoimmune limbic encephalitis in an institutional cohort. Neurology. 2016; 86:1683–91.

9. Shin JW, Koo YS, Kim YS, Kim DW, Kim KK, Lee SY, et al. Clinical characterization of unknown/cryptogenic status epilepticus suspected as encephalitis: a multicenter cohort study. J Neuroimmunol. 2018; 315:1–8.

10. Iizuka T, Kanazawa N, Kaneko J, Tominaga N, Nonoda Y, Hara A, et al. Cryptogenic NORSE: its distinctive clinical features and response to immunotherapy. Neurol Neuroimmunol Neuroinflamm. 2017; 4:e396.
11. Spatola M, Sabater L, Martinez-Hernandez E, Rosenfeld M, Graus F, Dalmau J. Novel findings in autoimmune encephalitis with antibodies against the metabotropic glutamate receptor 5 (mGluR5) (P1.333). Neurology. 2017; 88(16 Supplement):P1–333.
Figure 1.
Electroencephalography taken on the 6th hospital day. Electrographic seizures started from the temporal area of the left cerebral hemisphere (filled arrow). Burst suppression patterns preceded the discharges. The ictal discharges propagated to adjacent areas, and sometimes to diffuse areas, including both cerebral hemispheres. Clinical accompaniment was either present or absent (A). The intervals without ictal discharges, when the patient was in status epilepticus, showed burst-suppression patterns (B). AV, average.
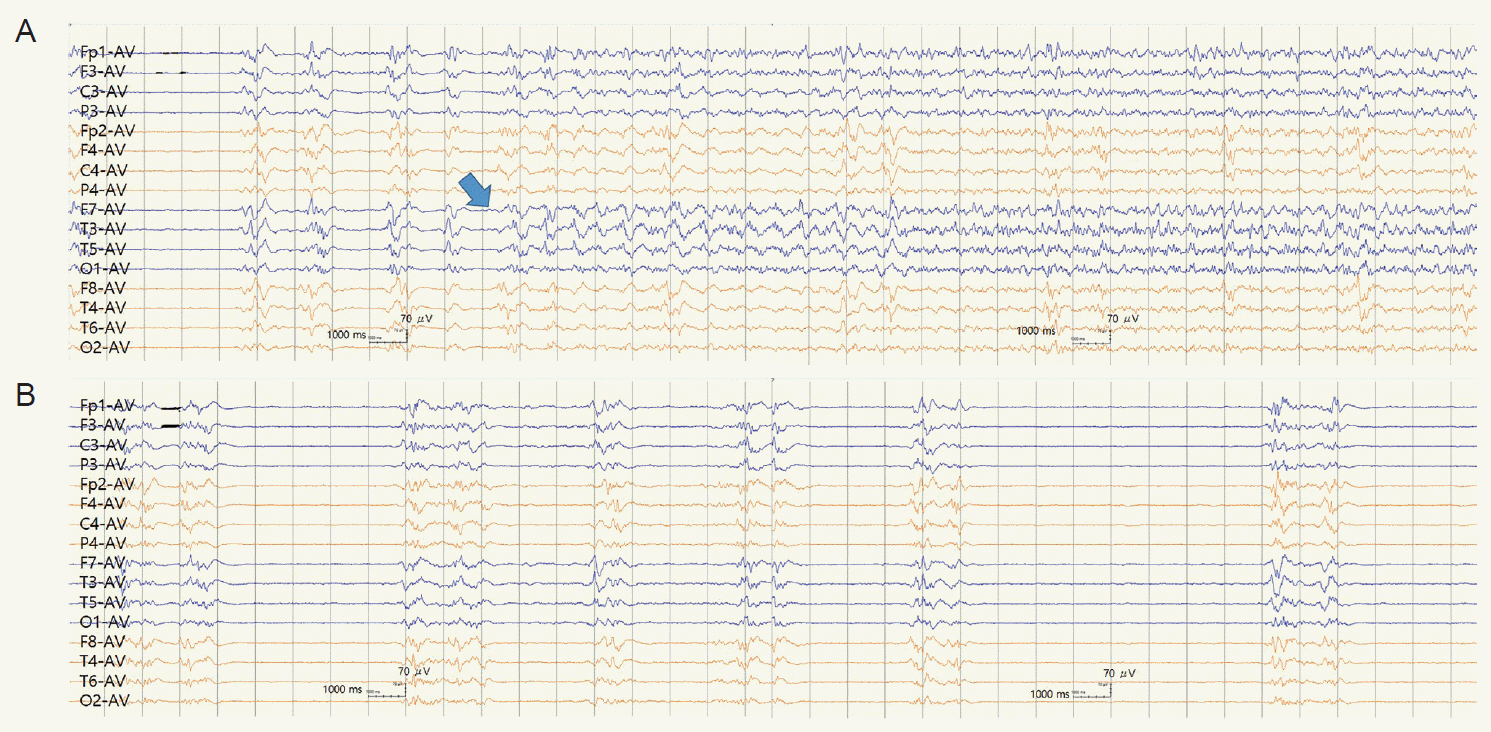
Figure 2.
Timeline of hospital course. We treated a cryptogenic NORSE patient with combination therapy, including antiepileptic drugs and primary immunotherapy. On the 13th hospital day, the seizures were controlled, but the patient remained in coma for 10 more days. We started using rituximab on the 24th hospital day. After the administration of rituximab, the patient rapidly regained consciousness. IVMP, intravenous methylprednisolone; IVIG, intravenous immunoglobulin; AEDs, antiepileptic drugs; mRS, modified Rankin Scale; NORSE, new-onset refractory status epilepticus.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download