증례
58세 여자가 30분 전 발생한 왼쪽 팔다리마비로 내원하였다. 환자는 1년 5개월 전 황달증상으로 내원 후 담낭암으로 진단받았고 이는 간과 폐로 전이된 상태였으며 수술은 받지 않았다. 당뇨, 고혈압, 고지혈증 및 심장병의 병력은 없었고 음주력과 흡연력도 없었으며 가족력 상에도 특이 소견은 없었다. 진찰에서 의식은 명료하였으나 왼쪽 얼굴신경마비, 구음장애가 있었고 근력은 왼쪽 팔다리가 Medical Research Council (MRC) grade 0등급이었다. 혈압 165/94 mmHg, 맥박 80회/분, 호흡 20회/분, 체온 36.0℃였고 청진상 심장잡음은 들리지 않았고 심전도도 정상이었다. 혈액검사상 포도당은 136 mg/dL (정상 범위 70-110 mg/dL)였고, 백혈구 8,000/μL (정상 범위 4,000-10,000/μL), 혈색소 9.8 g/dL (정상 범위 12-16 g/dL) 및 혈소판 215×103/μL (정상범위 150-450×103/μL)의 결과를 보였다. 아스파르테이트아미노전달효소(aspartate transaminase, AST), 알라닌아미노전달효소(alanine transferase, ALT), 알칼리성인산분해효소(alkaline phosphatase, ALP) 및 총빌리루빈이 각각 89 IU/L (정상 범위 8-38 IU/L), 48 IU/L (정상 범위 4-44 IU/L), 3,306 U/L (정상범위 104-338 U/L), 1.6 mg/dL (정상 범위 0.2-1.2 mg/dL)로 측정되었다. 프로트롬빈시간-국제표준화비율, D-dimer 및 C-반응성단백은 각각 1.32 (정상 범위 0.88-1.20), 36.08 mg/L (정상 범위 ≤0.5mg/L) 및 12.63 mg/dL (정상 범위 0.00-0.30 mg/dL)로 증가되어 있었다. 뇌 컴퓨터단층촬영에서 출혈은 없었고, 고음영 중간대뇌동맥 징후 및 바닥핵을 포함한 오른쪽 중간대뇌동맥영역에 저음영으로 보이는 조기허혈 변화도 없었다.
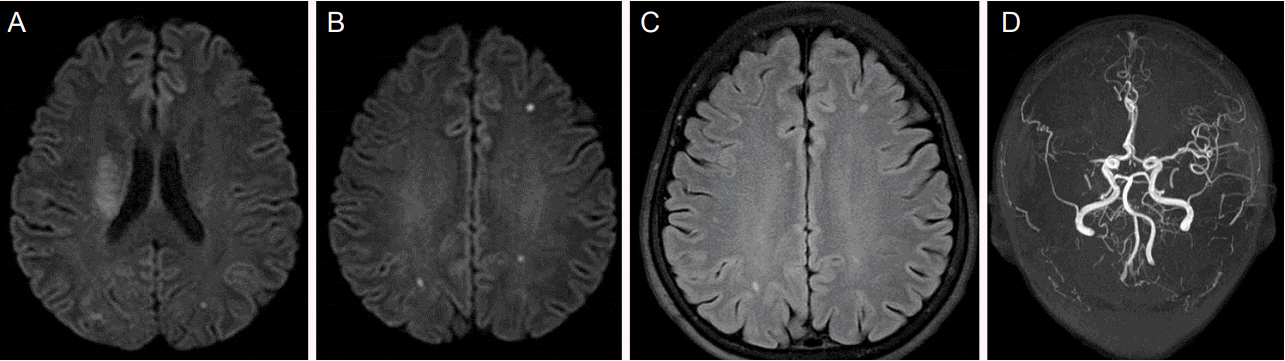
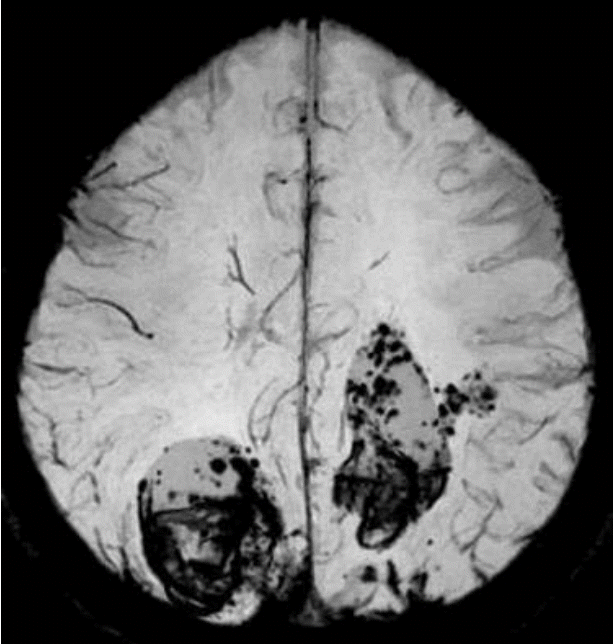
0.6 mg/kg (총 30 mg)의 정맥내 조직플라스미노겐활성제(tissue plasminogen activator, tPA)가 증상 발생 후 2시간 만에 투여되었고, 이후 환자의 왼쪽 팔다리마비가 호전되었다(MRC grade IV+). 약물 투여 후 촬영한 뇌 자기공명영상(magnetic resonance imaging, MRI) 확산강조영상에서 오른쪽 줄무늬체-속섬유막 영역(striatocapsular region)에 고신호병변이 있었고, 대뇌 실질에도 다발성 미세 고신호병변들이 있었다(Fig. 1A, B). 액체감쇠역전회복영상(fluid attenuated inversion recovery imaging)에서도 대뇌 실질에 다발성 미세 고신호병변들이 있었고(Fig. 1C), 오른쪽 중간대뇌동맥 영역에서 고신호혈관 징후가 있었다. 자기공명뇌혈관검사(magnetic resonance angiography)에서는 오른쪽 중간대뇌동맥이 폐색되어 있었다(Fig. 1D). tPA 투여 3시간 후에 환자가 갑자기 혼수상태가 되고 사지 근력도 감소하여(MRC grade II) 촬영한 뇌 MRI에서 양쪽 두정-후두부에 거대한 뇌내출혈이 있었다(Fig. 2).
환자에 대해 수술적 치료 없이 대증적 치료만을 시행하였다. 입원 중 환자에서 발열증상이 생겼고, 황달이 심해졌으며, 간기능도 악화되어 AST, ALT, ALP 및 총 빌리루빈은 각각 194 IU/L, 56 IU/L, 4,629 U/L, 9.3 mg/dL까지 상승되었다. 혈액배양검사에서 균은 동정되지 않았으나, 담관염으로 판단하여 항생제 치료를 시작하였다. 하지만, 치료에 반응은 없었고, 환자는 입원 47일 후 패혈증으로 사망하였다.
고찰
암과 관련하여 생기는 뇌경색은 응고항진병증(hypercoagulopathy)에 기인하는 것으로 알려져 있다[4]. 이는 혈액에서 D-dimer가 증가되는 것이 특징이며, 주로 다발성의 병변으로 나타난다[4]. 본 환자는 내원 당시 증상과 연관된 오른쪽 줄무늬체-속섬유막 영역 경색뿐 아니라, 미세 경색이 다발성으로 있었고, D-dimer도 증가되어, 암에 의한 응고항진병증으로 인해 뇌경색이 생겼으리라 판단된다.
아직까지 암 환자에서 정맥내혈전용해술과 뇌내출혈 발생과의 관련성은 규명된 바가 없다. 최근 암 환자에서 정맥내혈전용해술의 안전성을 평가하였던 연구들에서는 암 환자에서 정맥내혈전용해제 사용이 뇌내출혈의 발생을 증가시키지 않음이 보고되었지만 이 연구들에서는 암 환자에서 뇌경색의 주된 기전인 응고항진병증에 대한 언급이 없거나 뇌경색 환자의 단지 5%에서만 응고항진병증이 있어서[5,6], 이 연구들이 본 증례와 같이 암에 의한 응고항진병증과 관련된 뇌경색 환자에서 정맥내혈전용해제 사용의 안전성을 규명하였다고 볼 수는 없겠다. 일반적으로, 정맥내혈전용해제 투여 후 뇌내출혈이 발생할 수 있는 위험인자로는 고령, 뇌경색의 중증도, 고혈당, 이전 항혈소판제의 사용, 심방세동, 심부전, 신부전 및 조기 허혈성 변화 등이 있다[7,8].
최근 연구에서 정맥내혈전용해제 사용 후 뇌경색 이외 부위에 발생한 뇌내출혈은 이전의 뇌경색이나 대뇌아밀로이드 혈관병증 등 이전의 혈관 병리와 관련이 깊은 것으로 보고되었다[9]. 본 환자는 말기 담낭암 환자였고 정맥내 tPA 투여 후 뇌경색 이외 부위에 뇌내출혈이 생겼으며, 기존에 알려진 정맥내혈전용해제와 관련된 뇌내출혈의 위험성은 낮았다.
Ikeda 등[10]은 최근에 저자들과 비슷한 예를 경험하여 보고하였는데, 이들은 암 환자에서 MRI에서 보이지 않을 만큼 작은 미세 혈전색전증, 미세 전이 또는 미세 종양색전이 출혈과 관련이 있을 수 있음을 주장하였다. 암 환자에서 감염심내막염이 호발하며[11], 감염심내막염에 의한 뇌경색도 암 관련 뇌경색처럼 주로 다발성으로 생기고[4], 감염심내막염 환자에서 정맥내혈전용해술이 뇌내출혈의 위험성을 증가시킨다는 것은 많은 연구를 통해 보고된 바 있다[12]. 본 환자는 담도패혈증으로 사망하였다고 판단된다. 비록 청진에서 심장잡음은 들리지 않았고 혈액배양검사에서 균이 동정되지 않았지만 감염심내막염으로 인해 다발성 뇌경색이 생겼고, 이로 인해 정맥내혈전용해술 관련 출혈이 생겼을 가능성도 완전히 배제할 수는 없겠다.
암 환자에서 응고항진병증에 의해 뇌경색이 생길 수 있으며, 이 경우 정맥내혈전용해제 사용이 금기는 아니지만, 아직까지 이에 대한 안전성의 근거는 부족하다. 저자들이 경험한 예처럼 암 환자에서 급성 뇌경색 발생시 정맥내혈전용해제의 사용은 뇌경색 발생 부위뿐만 아니라 그 이외 부위에도 뇌내출혈이 발생할 가능성이 높아 주의가 필요하겠으며, 앞으로 이에 대한 많은 연구가 필요할 것으로 생각된다.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download