서 론
호흡은 자발적으로 조절되는 수의호흡(voluntary respiration)과 무의식적으로 유지되는 자동호흡(automatic respiration)으로 이루어지는데 이들은 서로 다른 신경경로를 통한다[1-3]. 수의호흡의 신경조절은 운동피질(motor cortex)과 전운동피질(premotor cortex)에서 유래한 신경세포가 담당하는데 피질척 수로와 피질연수로를 따라 척수로 내려가며, 각성상태에서 의도적으로 숨을 쉬고, 말이나 노래를 하고, 숨을 참는 등의 호흡반응을 관장한다[1,2]. 자동호흡은 교뇌와 연수의 등가쪽피개(dorsolateral tegmentum)에 있는 고립로핵(solitary nucleus)과 의핵(ambigus nucleus), 망상체 등이 관여하며, 의지와 관계없이 자동적으로 조절된다[1,2].
뇌간의 자동호흡중추 이상으로 깨어있을 때에는 정상적인 호흡을 하지만 잠이 들면 호흡수가 감소하는 수면관련 저환기 장애가 나타날 수 있다. 유전이상에 의해 선천적으로 발생할 수 있고[4], 여러 원인에 의해 후천적으로 나타나기도 한다[5]. 후천적 중추신경계 이상으로 인한 수면관련 저환기 장애에 대한 지금까지의 보고들은 뇌경색증, 감염, 종양, 다발경화증, 종양, 사립체 질환, 상부 경수 외상 등이 뇌간 자동호흡중추에 영향을 주어 발생했으며 대부분 뇌영상검사에서 연수 병변이 발견되었다[1,3,5,6]. 드물게 연수 병변 없이 발생한 예가 있었는데 신생물딸림증후군 및 항인지질항체증후군에 병발한 경우였다[7,8].
저자들은 연수 병변 없이 광범위축삭손상에 의해 수면관련 저환기 장애가 나타난 매우 드문 예를 경험하였기에 이를 보고하는 바이다.
Go to : 
증 례
29세 남자가 농흉 치료를 위해 본원 호흡기내과로 전원되었다. 환자는 본원 내원 2개월 전 자가운전 도중 전봇대를 들이받는 교통사고를 일으켰고, 머리와 가슴을 운전대와 앞 유리에 심하게 부딪혀 혼수상태로 인근 종합병원으로 후송되었다. 당시 활력징후는 혈압 80/50 mmHg, 심박수 130회/분, 호흡수 29회/분, 체온 36.7℃였다. 뇌컴퓨터단층촬영에서 전반적인 뇌부종, 대뇌다리 사이 수조의 거미막하출혈, 외측 뇌실내출혈, 좌측 전두엽 점상출혈이 있었으나 뇌간에는 병변이 없었다(Fig. 1). 경추 컴퓨터단층촬영은 정상이었다. 흉부와 복부 컴퓨터 단층촬영에서 좌측 2번째 및 3번째 늑골과 쇄골 골절, 기흉, 비장 손상, 복강내 출혈, 횡격막 파열이 있었다. 비장과 횡격막 손상, 기흉에 대한 응급 수술 및 흉관삽입술을 시행하였고, 두개내출혈은 보존적으로 치료하였다. 약 2개월 후, 기관절개술을 하고 치료를 하던 중 농흉이 발생하여 본원 호흡기내과로 전원되었다. 과거력에서 사고 전 내과적 질환 없이 건강했으며 코골이 등 호흡관련수면질환을 의심할만한 병력은 없었다. 전원 당시 활력징후는 혈압 130/90 mmHg, 심박수 117회/분, 호흡수 26회/분, 체온 37.8℃였다. 신체진찰에서 신장 172 cm였고, 체중 55 kg으로 신체질량지수는 18.6 kg/m2 였다. 자발호흡은 잘 유지되어 있었고, 좌측 폐야 호흡음 감소 외에 특이 소견은 없었다. 일반혈액검사에서 백혈구 10,000개/µL, 혈색소 9.4 g/dL, 혈소판 394,000개/µL였다. 전해질검사, 신장기능검사, 간기능 검사는 정상이었다. 적혈구침강속도는 106 mm/hr (정상 0-16), C-반응단백질은 13.296 mg/dL (정상 0-0.75)였다. 동맥혈가스 분석에서 pH 7.43 (정상 7.35~7.45), PaO2 104 mmHg (정상 75-100), PaCO2 44 mmHg (정상 35-45), 중탄산염 31.2 mmol/L (정상 20-29), 산소포화도 98% (정상 95-98)였다. 심전도와 심초음파는 정상이었다. 흉부 컴퓨터단층촬영에서 이전의 손상 부위들이 치유되어 있었고 기흉도 호전되었으나 좌측 폐 하엽 주위에 균질성 저밀도 병변 및 무기폐가 있었다. 항생제 및 점액용 해제를 정맥 주사하면서 보존적 치료를 했고 호흡이상 없이 치료에 대한 반응은 좋았다. 호흡을 억제할 수 있는 진정제나 아편유사제, 근이완제 등의 약물은 사용하지 않았다. 전원 후 13일째 새벽에 맥박산소측정(pulse oximetry)에서 산소 농도가 떨어지면서 갑자기 심장정지가 발생했다. 당시 기관절개관의 폐쇄는 없었고, 동맥혈가스분석에서 pH 7.131, PaO2 38.7 mmHg, PaCO2 102.1 mmHg, 중탄산염 33.3 mmol/L, 산소포화도 54.3%였다. 즉시 응급심폐소생술을 시행하여 수 분내 심박동이 회복되었고, 중환자실로 이동하여 기계적조절환기(controlled mechanical ventilation, CMV) 방식으로 인공호흡기 치료를 시작하였다. 산소포화도가 잘 유지되어 하루 후 동시성 간헐강제환기(synchronized intermittent mandatory ventilation, SIMV)로 바꾸었고, 3일째 인공호흡기를 제거하고 자발호흡을 유지할 수 있게 되어 일반병실로 왔다. 이후 간헐적으로 호흡수가 분당 10회 이하로 떨어졌는데 잠에 든 것처럼 보일 때였고, 자극을 주면 다시 호흡수가 증가하는 증상이 발생하여 신경과로 의뢰되었다. 호흡수가 떨어졌을 때 시행한 동맥혈 가스분석에서 산소농도의 저하, 이산화탄소의 저류, 중탄산염의 상승 및 산소포화도의 감소를 보였다(Table 1). 신경학적진찰에서 자발적으로 눈을 뜰 수 있었으나 명령에 따르는 행동은 없었고, 의사소통이 되지 않았다. 눈머리반사, 각막반사, 대광반사는 정상이었으나, 양측 구역반사의 저하가 있었다. 사지는 경직되어 있었다. 통증 자극에 우측 팔은 가슴까지 올리고 우측 다리는 무릎을 굽힐 정도의 회피굴곡 반응을 보였고, 좌측 팔과 다리는 움찔거리기만 하는 이상굴곡반응을 보였다. 사지의 모든 심부건 반사는 항진되어 있었고 양측에서 바빈스키 징후가 관찰되었다. 지속식물상태(persistent vegetative state)였고, 뇌손상으로 인한 수면관련 저환기 장애가 의심되었다. 당시 촬영한 뇌자기공명영상에서 육안적 출혈은 사라졌고, 뇌실 확장 및 뇌실 주위 백질변성, 뇌량 병변을 보였으나 연수 병변은 없었다(Fig. 2). 기울기에코영상(gradient echo image)에서 양측 전두부 백질과 중뇌에 다발성 미세출혈이 관찰되었다(Fig. 3). 이후 호흡양상의 호전 없이 수면 시 호흡수 감소가 간헐적으로 나타나 가정용 휴대 기계호흡기를 이용하여 치료하였고, 5개월 후 요양병원으로 전원하였다.
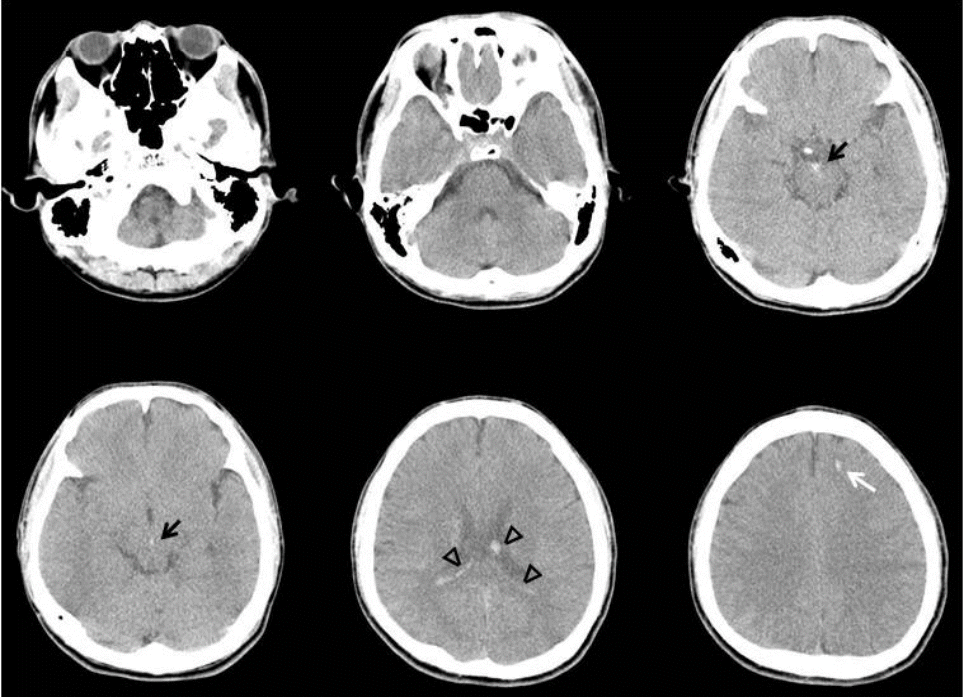 | Figure 1.Initial non-enhanced brain CT shows generalized cerebral edema, subarachnoid hemorrhage in the interpeduncular cistern (black arrow), intraventricular hemorrhages in the lateral ventricle (arrowhead), and petechial hemorrhage in the left frontal lobe (white arrow). There is no lesion in the brainstem. |
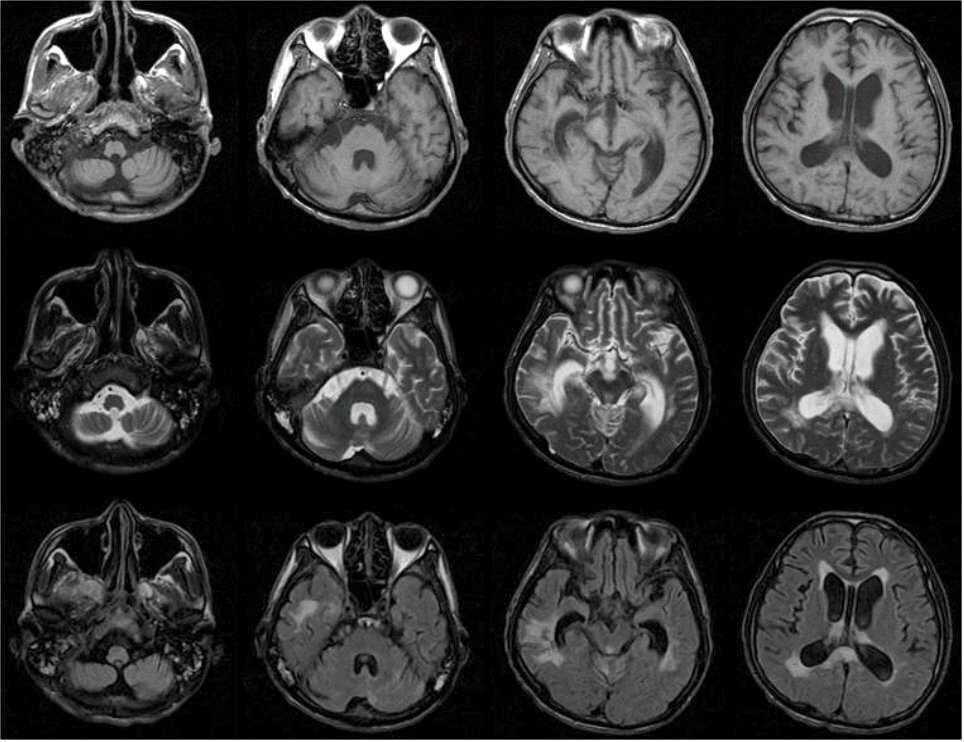 | Figure 2.Follow up brain MRI (A; T1-weighted, B; T2-weighted, and C; FLAIR images) revealed dilatation of the ventricle, periventricular white matter change, and splenium of corpus callosum lesion. There are no gross hemorrhages and brainstem lesions. |
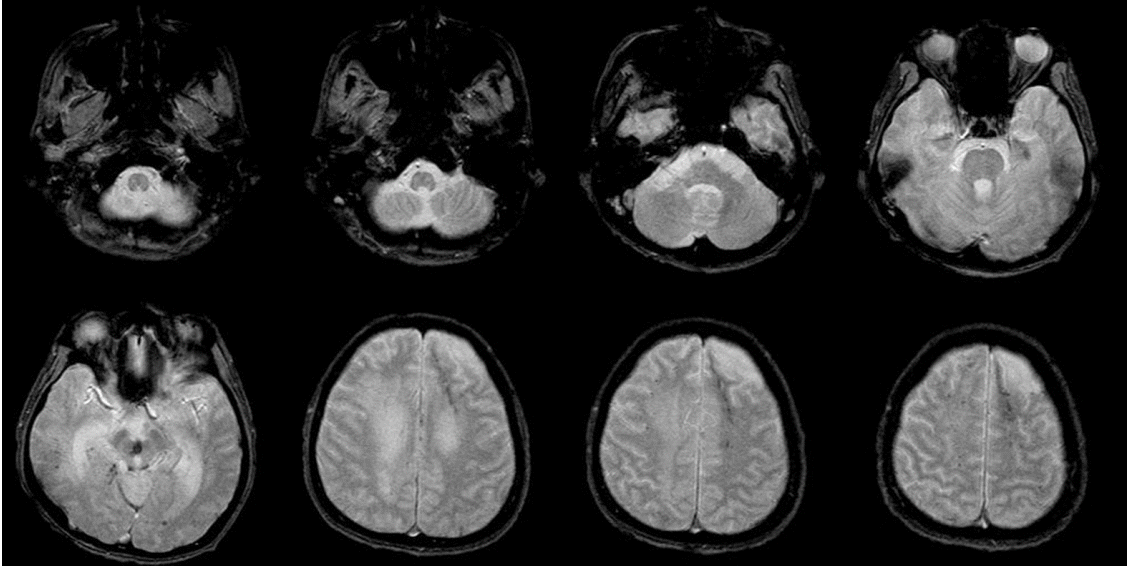 | Figure 3.T2-weighted gradient echo images show multiple microbleeds in the midbrain and both cerebral white matter, and encephalomalacia in the left frontal lobe. No microbleeds are found in the medulla and pons. |
Table 1.
Arterial blood gas analysis of the patient
Go to : 
고 찰
본 증례는 연수 병변 없이 광범위축삭손상에 의해 수면관련 저환기 장애가 발생한 매우 드문 예이다.
국제수면질환분류 제3판(International classification of sleep disorder, ICSD-3)에서 성인의 수면관련 저환기 장애는 수면 시 발생한 저환기로 인해 적어도 10분 이상 동맥혈 이산화탄소 분압이 55 mmHg를 초과하거나, 각성상태보다 동맥혈 이산화탄소 분압이 10 mmHg 이상 증가하여 50 mmHg를 초과하는 현상이 적어도 10분 이상 지속될 때 진단할 수 있다[9]. 본 증례는 환자가 지속식물상태이고 수면다원검사를 시행하지 않아 수면과 각성상태를 명확하게 구분할 수는 없었던 한계는 있다. 그러나 저환기 사건이 나타나기 전 호흡에 특별한 문제가 없었고, 동맥혈가스분석 결과가 정상이었으며, 저환기가 발생했을 때 동맥혈 산소분압이 떨어지면서 이산화탄소 분압이 55 mmHg 이상 증가한 점, 자는 것처럼 보일 때 호흡수가 감소하고 자극을 가하면 다시 호흡수가 증가하는 현상이 반복적으로 나타난 점으로 볼 때 수면관련 저환기 장애를 의심할 수 있을 것으로 여겨진다.
수면관련 저환기 장애는 유전이상에 의해 선천성으로 발생할 수 있고, 여러 원인에 의해 후천적으로 병발하기도 한다[10,11]. 후천성 원인으로는 비만, 호흡에 영향을 줄 수 있는 약제, 폐와 기도, 흉벽을 침범하는 내과적 질환, 신경근육이나 중추신경계 이상 등이 있다[11]. 본 증례는 후천적 원인에 의한 수면관련 저환기 장애가 의심되는데, 신체질량지수가 18.6 kg/m2 였고 호흡을 억제할 수 있는 진정제나 아편유사제, 근이완제 등의 약물은 사용하지 않았기 때문에 비만과 약제는 원인이 아닐 것으로 판단된다. 기흉, 농흉, 늑골 골절, 횡격막 손상, 좌하엽 무기폐 등 폐와 흉벽 이상 및 두개내출혈, 광범위축삭손상 등 뇌손상이 있었기 때문에 이들이 수면관련 저환기 장애를 유발했을 것으로 여겨져 ICSD-3의 sleep related hypoventilation due to a medical disorder에 부합할 것으로 판단된다.
뇌간의 자동호흡중추는 각성 때보다는 수면 중에 중요한데 혈액과 뇌척수액의 산소와 이산화탄소 농도, 산-염기 변화에 의한 생체되먹임 기전에 의해 자동적으로 조절된다[2,3]. 이들은 서로 연결된 세 쌍의 호흡관련 핵군으로 구성되어 있는데 한 쌍은 교뇌피개에, 두 쌍은 연수피개에 존재한다고 알려져 있다[2,3]. 교뇌호흡핵군(pontine respiratory group)은 폐와 기계수용기의 반사를 통합하고 편도와 시상하부로 신경자극을 전달하는 호흡조정중추(pneumotaxic center)로 입쪽, 등가쪽에 있는 팔곁핵(parabrachial nucleus)과 Kölliker-Fuse 핵으로 이루어진다. 등쪽 호흡핵군(dorsal respiratory group)은 연수의 고립로핵의 배가 쪽에 있으며 말초 화학수용기와 기계수용기로부터 구심성 신호를 받아 호흡과 심혈관계 반사를 통합하는 기능을 한다. 배쪽 호흡핵군(ventral respiratory group)은 얼굴신경핵 바로 아래의 상부 배쪽 연수에서 1번 경수에 이르는 기둥형 구조로 4개의 서로 구분된 신경핵 복합체로 이루어져 있는데, 입쪽에서 꼬리쪽 순으로 Botzinger 복합체, pre-Botzinger 복합체, 입쪽 배쪽 호흡핵군, 꼬리쪽 배쪽 호흡핵군이 있다. Botzinger 복합체는 후의핵(retroambigus nucleus)의 흡기관련 신경세포를 억제하여 호기에 관여하며, pre-Botzinger 복합체는 호흡리듬을 조절한다. 입쪽 배쪽 호흡핵군은 흡기에, 꼬리쪽 배쪽 호흡핵군은 호기에 관여하는 연수척수 신경세포의 자극을 전달한다[3]. 이러한 복잡한 신경연결에 의해 정상 호흡이 유지되는데 손상이 일어나면 여러 호흡이상이 초래될 수 있다. 본 증례에서 환자는 전원 13일째에 갑자기 심장정지가 발생했다. 폐나 흉벽과 연관된 병변들은 이미 치유되었거나 치료가 잘 되고 있었고, 갑작스런 심장정지가 나타나기 이전의 동맥혈가스분석과 호흡 양상에서 문제가 없었으며, 심초음파와 심전도가 정상이었던 점으로 보아 심폐질환에 의한 심장정지는 아니었을 것으로 여겨진다. 기관절개 상태여서 질식이 일어났을 가능성도 낮으며 기관절개관의 폐쇄도 없었다. 뇌외상으로 뇌간 자동호흡중추의 신경단절이 일어나 수면 시 저환기가 유발되었고, 이로 인한 이산화탄소 저류와 산소포화도 감소가 심장정지를 유발했을 것으로 판단된다.
광범위축삭손상은 빠른 가속-감속 외상에 의해 갑작스런 엇밀림힘(shearing force)이 뇌조직에 가해져 축삭과 소혈관이 손상되어 발생하는데, 심한 뇌외상의 50% 이상 및 교통사고에서 85% 이상 동반된다[12]. 이로 인한 축삭돌기의 손상 및 부종으로 인해 신경전도 장애, 즉 이차적인 신경단절이 일어나며 Waller 변성(Wallerian degeneration)으로 진행한다. 전두엽과 뇌실주위 측두엽의 백질-회백질 경계부와 뇌량팽대, 뇌간 등 뇌 시상면 주변 구조물을 흔히 침범한다[12]. 뇌컴퓨터단층촬영은 대개 정상인 경우가 많지만, 광범위한 뇌부종이나 점상출혈이 나타나기도 한다[12]. 고식적 뇌자기공명영상은 출혈로 인한 혈액파괴 산물인 탈산소혈색소, 메트헤모글로빈, 혈철소 함량에 따라 다양하게 나타날 수 있는데 T2강조영상과 액체감쇠역전회복영상에서 고신호강도를 나타내는 경우가 많다[13,14]. 외상성 미세출혈은 광범위축삭손상의 영상의학적 표지이며 기울기에코와 자화율강조영상(susceptibility-weighted MR image)에서 발견할 수 있다[13-15]. 자발미세출혈이 기저핵이나 시상 등 뇌심부에서 주로 관찰되고 무증상인 경우가 많은 반면 외상성 미세출혈은 백질, 뇌량, 대뇌부챗살, 입쪽 중뇌, 소뇌 등에 호발하며 부위에 따라 여러 증상을 유발할 수 있다[15]. 자화율강조영상은 기울기에코영상보다 미세출혈의 발견에 민감도가 더 높으며[15], 7.0 테슬라의 고해상도영상은 저해상도영상에서 보이지 않는 미세출혈도 찾아낼 수 있다[14]. 본 증례는 초기 뇌컴퓨터단층촬영에서 천막상부에 소량의 거미막하출혈, 뇌실내출혈, 점상출혈과 뇌부종을 보였다. 2개월 후 고식적 뇌자기공명영상에서는 뇌실 확장, 백질변성, 뇌량병변이 있었고, 기울기에코영상에서 양측 대뇌반구의 백질부와 중뇌에 다발성 외상성 미세출혈이 관찰되어 외상에 의한 광범위축삭손상의 뇌영상에 부합하였다.
본 증례에서 환자는 연수 병변이 없었음에도 수면관련 저환기가 발생했는데, 이전의 보고에서 항인지질항체증후군과 신생물딸림증후군의 예에서 연수 병변이 없었다[7,8]. 항인지질항체 증후군의 예에서 저자들은 병변의 크기가 너무 작아서 고식적 뇌자기공명영상에서 병변이 발견되지 않았을 것이라 추론했다[8]. 본 증례도 3.0 테슬라 뇌자기공명영상에서 연수 병변이 없었는데 병변의 크기가 너무 작았을 가능성이 있다. 기울기에코영상에서 연수에 미세출혈이 발견되지 않았으나 자화율강조영상이나 7.0 테슬라의 고해상도영상이 있었으면 연수에 미세출혈 등의 병변이 발견되었을 가능성도 있을 것이다. 또한 외상에 의한 엇밀림힘이 뇌간에 작용하여 뇌영상의 이상 없이 자동호흡과 관련한 신경축삭의 기능적 전도장애와 신경단절을 유발했을 수도 있을 것이다.
외상성 뇌손상에서 여러 호흡이상이 나타날 수 있는데 연수 병변이 없더라도 수면관련 저환기 장애가 나타날 수 있으므로 이에 대한 주의가 필요하다.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download