Abstract
Oral anti-thrombotic agents including anti-coagulants or anti-platelet agents are widely used to prevent cerebral infarction in patients with certain risk factors for ischemic stroke. Oral anti-coagulants, particularly warfarin, have long been used after Stroke Prevention in Atrial Fibrillation (SPAF) trials and European Atrial Fibrillation Trial proved its preventive effect. But along with the increased use of oral anti-thrombotic agents, the incidence of oral anti-thrombotic agent-associated intracranial hemorrhage has also increased. In many clinical trials, the recently approved oral anti-coagulants had a lower risk of hemorrhagic complication compared to warfarin, and real world evidence showed that non-vitamin K antagonist oral anti-coagulants have a relatively lower risk of hemorrhagic complication, especially intracerebral hemorrhage. However, the clinical outcome of non-vitamin K antagonist oral anti-coagulant-related intracerebral hemorrhage seems to be unfavorable. Moreover, management and prognosis of anti-platelet agent-associated intracerebral hemorrhage have been limited. The aim of this article is to review the currently suggested clinical evidences for 1. incidence and prognosis, 2. risk factors, 3. treatment, 4. resumption of anti-thrombotics in oral anti-thrombotic agent-associated intracerebral hemorrhage.
혈관질환의 치료 및 예방을 위해 현재 사용되는 경구용 항혈전제(anti-thrombotics)는 크게 항응고제와 항혈소판제로 나눌 수 있다. 이 중에서 와파린은 전 세계적으로 가장 널리 사용되는 경구용 항응고제이다. 와파린은 비타민 K 의존 응고인자 II, VII, IX, 그리고 X의 N-말단부위의 글루탐산의 번역(translation) 후 카르복시화(carboxylation)를 억제하여 항응고효과를 낸다[1]. 혈전색전증 예방, 특히 심방세동이나 심근경색 후의 혈전색전증 예방에 대한 와파린의 효과는 이미 여러 연구에서 입증된 바 있다[2]. 그러나, 와파린은 치료효과를 보일 수 있는 약물의 혈중 유지 범위가 좁고 음식과 병용약제에 많은 영향을 받기 때문에 약물 농도조절이 어려우며 출혈부작용, 특히 두개내출혈의 발생 위험을 유의하게 높이는 명백한 단점이 있다[3]. 최근에 개발된 비타민 K 비의존성 경구용 항응고제의 경우 여러 임상연구에서 와파린 대비 전반적인 출혈부작용의 위험성이 낮음이 입증되었으며 실제 다수의 인구집단을 대상으로 한 연구에서도 출혈부작용, 특히 두개내출혈의 발생위험이 상대적으로 낮음이 입증되었다[4]. 그러나 비타민 K 비의존성 경구용 항응고제와 연관된 두개내출혈의 임상양상 및 예후가 어떠한지에 대해서는 아직까지 그 근거가 부족한 실정이다[4]. 경구용 항혈소판제도 자발성 두개내출혈의 중요한 위험인자 중 하나이다[5-12]. 그러나 경구용 항혈소판제가 경구용 항혈소판제와 연관된 두개내출혈의 출혈량과 사망률을 증가시키는 지에 대해서는 여러 연구결과들이 일관적이지 않다[5-12]. 본 종설에서는 경구용 항응고제와 항혈소판제 투여와 연관된 두개내출혈의 1. 빈도 및 예후, 2. 위험인자, 3. 치료, 4. 항혈전제의 재시작에 대한 현재까지 제시된 임상적인 증거들에 대해 확인하고자 한다.
여러 보고를 종합해보면 와파린으로 대표되는 경구용 항응고제와 연관된 두개내출혈의 빈도는 전체 두개내출혈의 약 5-12% 정도를 차지하며[13] 미국의 경우 1년 발생률은 약 3,000명 정도로 알려져 있다[14-16]. 여러 무작위 임상 시험결과를 종합하면 와파린과 연관된 두개내출혈은 항응고요법을 시행하는 원인에 따라 출혈발생률이 약간씩 차이가 있다(기계판막[1-8.3%], 심방세동[0-6.6%], 관상동맥질환[0-19.3%], 정맥혈전증[0-16.7%], 뇌경색[2-13%]) [17]. 또한, 여러 임상시험에서 와파린과 연관된 두개내출혈의 1년 발생률은 약 0.3%였고, 10만명 당 2-9명 꼴로 발생하였으며 항응고요법을 시행하지 않는 인구 집단에 비해 7-10배의 높은 발생위험도를 보였다[18,19]. 이러한 와파린과 연관된 두개내출혈의 발생빈도는 최근 들어 증가하고 있는데, 이는 뇌경색의 2차예방을 위해 와파린의 사용빈도가 많아지게 되고 특히 항혈소판제와의 병용 치료를 하는 경우가 많아진 것 때문으로 판단되고 있다[16,20]. 비타민 K 비의존성 경구용 항응고제의 경우 와파린과 비교한 여러 임상시험의 결과를 종합할 때 평균 2년 동안의 추적관찰기간 동안 최대 3% 미만의 환자에서 두개내출혈이 발생하였으며 와파린보다 유의하게 두개내출혈 발생위험성이 낮았다[4]. 또한 임상시험이 아닌 최근의 실제 임상 상황에서 결과도 크게 다르지 않았다[21,22].
와파린과 연관된 두개내출혈은 일반적으로 항응고제투여중이 아닌 상태에서 발생한 두개내출혈과 비교하였을 때 예후가 나쁘다. 와파린 투여 중 발생한 두개내출혈의 사망확률은 44-68%에 달하며 대부분 두개내출혈 발생 수일 내에 사망한다[23,24]. 이렇게 사망률이 높은 이유는 와파린과 연관된 두개내출혈이 출혈량이 상대적으로 많고 두개내출혈 직후 출혈의 확장이 단시간에 발생하며 출혈이 확장되는 양 자체도 많기 때문이다[25,26]. 비타민 K 비의존성 경구용 항응고제의 경우 실제 임상 상황에서 두개내출혈의 발생 빈도자체는 와파린 대비 상대적으로 적은 것으로 입증되긴 하였지만[27], 최근의 실제 임상 상황을 대표하는 대규모 코호트 연구결과에 의하면 전체 61명의 비타민 K 비의존성 경구용 항응고제투여 중 발생한 두개내출혈의 환자에서 28%의 환자가 3개월째 사망하였으며, 출혈의 확장을 뇌 CT나 magnetic resonance imaging (MRI)를 시행하여 확인한 하위분석에서 38%의 환자에서 출혈의 확장이 관찰된 바 있고 프로트롬빈 복합 농축물을 투여하여도 3개월째의 수정랜킨척도가 프로트롬빈 복합 농축물을 투여하지 않는 군과 비교해서 차이가 없었다[28]. 따라서 비타민 K 비의존성 경구용 항응고제이 비록 두개내출혈의 빈도는 와파린에 비해 적지만 실제 두개내출혈이 발생하면 그 예후가 나쁠 수 있음을 주지해야 한다[28].
경구용 항혈소판제와 연관된 두개내출혈은 일차예방 목적으로 투여시 1,000인년당 0.2건 정도 발생한다[29]. 아스피린의 경우 두개내출혈의 위험이 용량에 비례하여 증가하는 것으로 보이며, 다른 항혈소판제들도 아스피린과 비슷한 결과를 보였다[7,30-38]. 한편, 이전 연구에 의하면, 혈소판의 활성도를 아스피린의 경우 VerifyNow Aspirin, 클로피도그렐의 경우 P2Y12 검사법으로 측정하였을 때, 혈소판의 활성도 감소는 두개내출혈 발생 후 12시간 뒤에 측정한 출혈량 증가와 관련되어 있었으며 뇌실내 출혈량과 14일째 사망률, 3개월째 나쁜 예후와도 관련이 있었다[39-41]. 두개내출혈 환자를 대상으로 한 아스피린과 클로피도그렐을 비교한 후향적 연구에서 클로피도그렐 사용 군이 아스피린 투여 군보다 두개내출혈의 크기가 컸으며 집으로의 퇴원 가능성이 더 낮았다. 또한 사망률도 증가하는 경향을 보였으나 이는 통계적으로 유의하지는 않았다[42]. 따라서, 경구용 항혈소판제와 연관된 두개내출혈도 드물지 않으며 예후가 좋지 않을 수 있음을 염두에 두어야 한다.
현재까지 여러 요인들이 경구용 항혈전제와 연관된 두개내출혈의 위험인자로 제시되고 있다(Table 1). 와파린의 경우 무엇보다 international normalized ratio (INR)의 상승이 중요한 출혈의 위험인자이다. 일반적인 치료범위인 INR 2.0-3.0보다 높은 경우 두개내출혈을 포함한 출혈가능성이 높다. 뇌경색의 2차 예방을 위해 아스피린과 와파린 투여를 비교한 임상시험에서 INR을 1.4-2.8로 조절하였을 때는, 두개내출혈을 포함한 주요출혈부작용이 아스피린과 차이가 없었으나[43] INR을 3.0-4.5로 조절한 연구에서는 두개내출혈의 발생이 와파린군이 아스피린에 비해 유의하게 높아 연구가 조기 중단된 바 있다[44]. 또한, 여러 연구들의 결과를 종합하여 다수의 환자를 대상으로 분석하였을 때도 INR이 4.0가 넘는 경우 유의하게 와파린과 연관된 두개내출혈을 포함한 주요 출혈의 위험성이 높았다[45]. 이외에도 항응고제와 항혈소판제의 병용투여, 고혈압, 흡연, 과도한 음주, 간기능이상, 암, 이전 뇌출혈의 병력, 그리고 뇌아밀로이드혈관병의 유전자 검사소견(아포지방단백 E ε2, ε4 alleles) 등이 경구용 항혈전제와 연관된 두개내출혈의 위험인자로 제시되었다[3,14]. 최근에는 뇌 T2 gradient recalled echo image나 susceptibility weighted imaging에서 관찰되는 미세출혈(cerebral microbleeds)이 항혈전제, 특히 항응고제 투여 시 향후 두개내출혈 발생의 주요 위험인자 및 영상바이오마커의 하나로 대두되고 있다[46]. 특히 미세출혈이 뇌의 엽(lobar) 부위에 다수 분포하는 경우에는 뇌아밀로이드혈관병의 가능성이 매우 높으며 뇌아밀로이드혈관병은 그 자체가 출혈가능성이 높은 질환이기 때문에 항혈전제 투여로 인한 출혈부작용과 향후 뇌경색 예방 효과의 득실을 고려하여 투여를 시행하여야 한다[47]. 비타민 K 비의존성 경구용 항응고제의 경우 비록 무작위 임상시험의 하위분석이기는 하지만 심방세동환자에서 apixaban과 아스피린의 효과를 비교한 연구에서 연구시작시점 및 1년 뒤 T2 gradient recalled echo MRI 영상을 시행하였을 때, 양 군에서 새로 생긴 미세출혈의 빈도에 차이가 없었다. 따라서 비타민 K 비의존성 경구용 항응고제의 경우 미세출혈의 발생 또는 악화가능성이 아스피린과 유사할 것으로 판단되지만 이에 대해서는 추가 연구가 필요하다[48].
두개내출혈의 악화 및 확장을 방지하기 위해 절대안정, 머리의 위치를 30도 이상 올리기, 수축기혈압을 140 mmHg보다 낮게 조절하는 등의 기본적인 처치를 시행함과 동시에 역전제를 포함한 적절한 약제투여가 필수적이다. 이러한 위급한 상황에서 무작위 대조군 연구를 시행하는 것은 사실상 불가능하기 때문에 무작위 대조군 연구결과는 거의 없다. 와파린과 연관된 두개내출혈 환자에서 INR을 어느 정도까지 낮추어야 할지에 대해 목표치가 명확하게 밝혀져 있지 않은 상황이며 실제 여러 연구들에서는 <1.3 에서 <1.5 사이의 다양한 목표를 사용한 바 있다[19]. 근본적으로 와파린을 비롯한 비타민 K 길항제를 복용 중인 환자에서 두개내출혈이 발생했다면 우선 비타민 K 길항제를 중단하고 이후 INR을 빠르게 교정해야 한다(class I; level of evidence C) [49]. 이를 위해 비타민 K 신선냉동혈장(fresh frozen plasma, FFP), 프로트롬빈 복합 농축물의 투여가 추천된다(class IIb; level of evidence B) (Table 2) [49-51]. 그러나 외국의 경우 출혈로 인한 응급상황에서 프로트롬빈 복합 농축물 투여가 가능하지만 우리나라에서는 제도적인 한계로 인해 프로트롬빈 복합 농축물을 항시 병원에 비치할 수 없기 때문에 두개내출혈 환자에게 신속하게 사용하기에는 현실적으로 어려운 상황이다. 따라서, 비타민 K의 빠른 작용을 위해 비타민 K의 정맥주사와 가능하다면 FFP를 병용 투여하는 것이 우리나라의 현실에서는 최선이라 할 수 있다.
와파린과 연관된 두개내출혈에 투여할 수 있는 길항제들을 살펴보면 비타민 K 주사는 투여 직후 효과를 나타내지는 못하지만 가급적 빠른 약효를 기대하기 위해 정맥내 투여를 원칙으로 한다. 용량은 일반적으로 5-10 mg을 투여한다. 작용 시작 시간은 2시간이며, 간기능이 정상인 경우 약 24시간 째 최대 작용점에 다다른다[52]. FFP를 투여하기 위해서는 해동과 혈장교차시험(thawing and cross matching)의 과정이 필요하며, 수혈에 따른 알러지, 감염 등의 위험이 있고 완전히 INR을 되돌리기 위해서는 많은 양을 투여해야 하며 이로 인한 혈액 수액 과다공급의 부작용을 고려해야 한다[53]. 프로트롬빈 복합 농축물은 응고인자 IX 결핍(B형 혈우병)의 치료를 위해 개발된 혈장 유도 응고인자 농축물이다. 3-factor 프로트롬빈 복합 농축물은 factors II, IX, X을 포함하고 있으며 4-factor 프로트롬빈 복합 농축물은에는 factor VII이 추가로 포함되어 있다. 프로트롬빈 복합 농축물은 혈장교차시험이 필요하지 않고 적은 양(20-40 mL)을 신속하게 투여할 수 있는 장점이 있으며 와파린을 복용 중이었던 환자에서 INR을 수분 이내로 빠르게 정상화시킨다[54-56]. 그러나 몇몇 연구에서 INR의 교정은 빠르지만 임상적 예후가 호전되지는 않았기 때문에 이에 대해서는 좀더 증거가 필요하며[26,57,58], 교정 후 심부정맥혈전증이나 뇌경색이 발생했다는 보고도 있어 주의가 필요하다[54].
와파린과 연관된 두개내출혈 환자에서 FFP 단독투여와 FFP에 프로트롬빈 복합 농축물을 병용투여를 비교한 무작위배정 연구에서 FFP 단독 사용군은 상대적으로 많은 양의 FFP를 사용하여 수액 과다공급에 의한 부작용이 더 높았다[59]. FFP와 프로트롬빈 복합 농축물을 비교하였을 때, 24명의 두개내출혈 환자를 포함한 2,002명의 급성출혈환자를 대상으로 한 무작위배정 비교 연구에서 4-factor 프로트롬빈 복합 농축물이 FFP에 비하여 열등하지 않음을 입증된바 있다[60]. 이 연구에서, 치료 종료 30분 이내에 INR이 1.3 미만에 도달하는 비율은 프로트롬빈 복합 농축물군에서 62.2%, FFP에서 9.6%였다. 또한 혈전색전증 발생 비율은 유의한 차이가 없었으며 (프로트롬빈 복합 농축물 군에서 7.8%, FFP 군에서 6.4%), 수액 과다공급에 의한 부작용은 FFP 군에서 더욱 많았다(12.8% versus 4.9%) [60]. 3-factor와 4-factor 프로트롬빈 복합 농축물를 직접 비교한 임상 연구는 현재까지 시행되지 않았다. rFVIIa은 선천성 factor VII 결핍으로 인한 혈우병 환자에서 승인되어 사용하고 있으며, 자발성 혹은 와파린과 연관된 두개내출혈을 치료하기 위한 약제로서의 사용 가능성이 제시되고 있다. 그러나 rFVIIa는 VKA 연관 두개내출혈에서 INR를 빠른 속도로 정상화할 수 있으나[61-65] 비타민 K 의존성 응고인자를 모두 다 보충하지는 못하므로 프로트롬빈 복합 농축물 만큼의 효과를 내지 못한다[66]. 그리하여, 현재까지 와파린과 연관된 두개내출혈에 단독으로 rFVIIa를 사용하는 것은 추천되지 않는다(class III; level of evidence C) [49,67].
비타민 K 비의존성 경구용 항응고제과 연관된 두개내출혈에서 비타민 K 또는 프로트롬빈 복합 농축물 등의 약제와 비타민 K 비의존성 경구용 항응고제 자체의 역전제에 대한 무작위배정 연구는 연구결과가 많지 않다. 현재 사용되는 비타민 K 비의존성 경구용 항응고제(dabigatran, rivaroxaban, apixaban, edoxaban)들은 와파린에 비해 상대적으로 반감기가 짧아(5-15시간) 우선적으로 약제를 중단하는 것이 최우선이며 빠른 교정을 위해 프로트롬빈 복합 농축물 또는 rFVII를 사용하는 것을 고려할 수 있다. FFP는 유용성이 밝혀져 있지 않고, 비타민 K는 효과가 없다[68]. Direct thrombin inhibitor (dabigatran)에는 factor eight inhibitor bypassing activity (FEIBA) 혹은 rFVIIa가, factor Xa inhibitors인 rivaroxaban과 apixaban에는 다른 프로트롬빈 복합 농축물이 더 효과적일 것으로 제시되었으나, 이는 예비 결과로 대규모 임상시험결과가 필요하다[69-72]. 수시간 이내에 dabigatran, apixaban, rivaroxaban을 복용하였을 때에는 활성화차콜을 사용하여 가장 최근 복용한 약물의 흡수를 억제할 수 있다[73]. Dabigatran에 대하여는 투석을 고려해볼 수 있으나, rivaroxaban과 apixaban은 단백결합률이 높아 효과적이지 않을 수 있다(Fig. 1) [62]. 각각의 약물에 대한 특이적 해독제가 현재 임상개발 단계에 있으며[74] 최근에는 dabigatran역전제가 임상시험을 통해 효과와 안전성이 입증된 뒤 국내에서도 사용이 가능해진 상태이다[75].
항혈소판제와 연관된 두개내출혈의 치료 및 혈종의 크기 증가를 막기 위해 혈소판 수혈을 고려해 볼 수 있다[76,77]. 아스피린과 클로피도그렐을 사용하는 환자에서 10-12.5 단위의 혈소판 수혈을 하였을 때 혈소판 기능이 정상으로 회복되었다는 보고가 있다[78]. 45명의 자발성 두개내출혈 환자에서 혈소판 억제 정도를 측정 후 입원 12시간 내 혈소판 수혈을 시행하였을 때 혈소판 억제 정도가 큰 환자 중에서 12시간 내에 혈소판 수혈을 받은 환자는 12시간 이후 혈소판 수혈을 받은 환자군에 비하여 혈종 크기가 덜 증가하였으며 또한 좋은 예후를 보였다[79]. 반면 항혈소판제와 연관된 두개내출혈 환자에서 혈소판 수혈로 역전을 시도한 35명과 그렇지 않은 31명의 임상 경과와 예후를 비교한 다른 연구에서는 두 군간에 혈종의 크기 증가나 예후에 차이가 없었다[80]. 더구나 최근에 발표된 항혈소판제와 연관된 두개내출혈 환자에서 혈소판 수혈을 통해 항혈소판제의 효과를 역전시키는 치료에 대한 무작위배정 연구(platelet transfusion in cerebral hemorrhage [PATCH] trial)에서는 혈소판을 수혈한 군이 수혈하지 않은 군보다 사망 또는 3개월째의 의존도(dependence)가 유의하게 높았다. 따라서 항혈소판제와 연관된 두개내출혈 환자에서 혈소판 수혈을 통한 항혈소판제의 역전은 더 이상 추천하기 힘들다[81].
항응고요법을 시행하고 있던 환자들은 항응고요법을 중단하면 필연적으로 혈전색전증의 위험성이 높아진다. 따라서 대부분의 경우 항응고요법을 재시작해야 할 필요가 있다. 한편, 두개내출혈 병력이 있는 환자들은 추후 두개내출혈을 포함한 출혈이 발생할 가능성이 두개내출혈의 병력이 없는 환자보다 높다[82]. 특히 두개내출혈의 재발 위험은 두개내출혈 이후 1년 이내에 가장 높으며 특히 두개내출혈이 뇌의 엽(lobar)에 위치한 두개내출혈일 경우 더욱 높다[83,84]. 또한, 조절되지 않는 고혈압, 고령화 등도 두개내출혈의 재발의 중요한 위험인자이다[83,85]. 고혈압은 심부와 엽에 위치한 두개내출혈 모두의 재발 위험을 높이며[85] 고령에서의 두개내출혈의 위험 증가는 뇌아밀로이드혈관병의 유병률 증가 또는 다른 동반질환들과 이로 인한 항혈전제 사용 증가에 의한 것으로 판단된다[86]. 특히 뇌아밀로이드혈관병은 그 자체가 두개내출혈의 재발의 위험인자이며, 특히 엽에 위치한 두개내출혈이 잘 발생한다[85]. 또한 아포지방단백 E ε2, ε4 대립유전자가 있는 경우나[87] 미세출혈의 수가 많을수록(특히 뇌의 엽에 위치했을 경우) 두개내출혈 재발의 위험이 크다[86,88]. 심방세동을 동반한 뇌경색 환자를 대상으로 장기간(중앙값 2.5년) 추적관찰한 연구에서 연구에 포함된 환자의 사망여부 및 사망원인과 미세출혈의 연관성을 분석하였을 때 미세출혈이 다수(5개 이상)이거나 뇌의 엽에 분포하는 경우는 향후 두개내출혈로 인한 사망과 유의하게 연관되어 있었다[89]. 따라서 미세출혈이 뇌의 엽부위에 다수(5개 이상) 분포하는 환자에서는 항응고요법의 재시작여부는 신중히 판단하여 시행해야 한다.
재출혈의 위험성이 높거나 기타 여러 이유로 인해 항응고제를 재시작하기가 어려운 환자에서는 항혈소판제(아스피린, 아스피린 및 클로피도그렐 병용)를 사용하거나[90] 좌심방폐색술(percutaneous left atrial appendage closure) [91] 등을 고려해볼 수도 있다. 항혈소판제제는 두개내출혈 상태에서 혈종의 크기를 증가시킬 위험성을 크게 높이지 않았으며[11,92] 127명의 엽에 위치한 두개내출혈 환자와 80명의 심부 두개내출혈 환자를 대상으로 한 연구에서 두개내출혈의 재발에 항혈소판제 투여가 관련이 없었다[93]. 따라서 엽에 위치한 두개내출혈이나 뇌아밀로이드혈관병으로 인한 두개내출혈 환자에서 항응고요법이 어렵다면 항혈소판제가 대안이 될 수 있다. 비타민 K 비의존성 경구용 항응고제의 경우 일관성 있게 심방세동 환자에서 와파린보다 두개내출혈의 위험이 낮은 것으로 보고되었으나[94-96] 두개내출혈 이후 와파린 대용으로 사용이 가능할 지와 두개내출혈의 재발의 위험을 감소시키는지는 명확하지 않아 추가 연구가 필요하다. 최근의 진료지침에 따르면 와파린과 연관된 두개내출혈 이후 항응고요법의 재시작에 대해서 두개내출혈 환자에서 두개내출혈의 재발의 위험인자로 (1) 엽에 위치한 두개내출혈; (2) 고령; (3) 미세출혈의 유무 및 개수; (4) 항응고치료 여부; (5) 아포지방단백 E ε2 or ε4 alleles 유무 (class IIa; level of evidence B) 등을 고려할 것을 언급하였다. 그리고 와파린과 연관된 두개내출혈중 엽에 위치한 두개내출혈의 경우는 재발의 위험성이 높기 때문에, 비판막성 심방세동의 치료로 와파린등의 항응고제의 장기간 투여를 피할 것을 언급하였다(class IIa; level of evidence B). 또한, 비엽성 (nonlobar) 두개내출혈의 경우는 혈전색전증의 재발위험성이 높은 환자라면 항혈소판제, 항응고제 모두 투여를 고려할 수 있음을 명시한 바 있다(class IIb; level of evidence B) [49].
와파린 또는 비타민 K 비의존성 경구용 항응고제와 연관된 두개내출혈 이후 항응고요법 재개 시기는 연구에 따라 의견이 분분하며 이에 대한 무작위배정 연구 결과도 없어 근거가 매우 부족하다. 본 종설에서는 항응고요법을 2주 이내 재시작한 (대부분 72시간내 재시작) 연구와 2주 이후 재시작한 연구로 나누어 정리하였다(Table 3). 결론적으로 이전의 연구결과들을 종합해보면 특별한 이유가 없다면 적어도 2주 뒤에 항응고요법을 재시작하는 것이 혈전색전증과 재출혈의 예방에 좀더 나은 것으로 판단된다. 비교적 최근의 234명의 와파린과 연관된 두개내출혈 환자를 34주 간 추적 관찰한 연구에서는 항응고요법을 약 10주 이후에 시작하는 것이 허혈성과 출혈성 뇌졸중의 위험을 최소화하는 것으로 나타났으며 이 연구의 저자들은 혈전색전위험성을 고려할 때 와파린과 연관된 두개내출혈 이후 이후 적어도 4주 이후에 항응고요법을 재시작하는 것을 제시하였다[97]. 최근의 진료지침에서도 와파린과 연관된 두개내출혈 이후 재시작 시기는 근거가 부족하며 인공심장판막이 있어 상대적으로 조기에 항응고요법의 재시작이 필요한 환자가 아니라면 최소한 4주간은 경구 항응고요법을 피하는 것을 고려하도 록하고 있다(class IIb; level of evidence B) [49]. 또한 만약 필요하다면 두개내출혈 이후 수일 내에 아스피린 단독 투여를 고려할 수는 있으나 역시 그 시작시기에 대한 근거는 부족함을 언급하였다(class IIa; level of evidence B) [49].
두개내출혈을 비롯한 치명적인 재출혈 위험성에도 불구하고 항혈소판제를 중단하는 것에는 위험이 따른다. 일반적으로 뇌혈관 및 심장혈관 스텐트 삽입술을 시행받은 환자에서 항혈소판제를 어떠한 이유든 중단하였을 경우 스텐트내 혈전발생 및 심근경색, 뇌경색의 위험성이 높아진다[98-100]. 두개내에 스텐트 삽입술을 시행받은 환자도 마찬가지로 항혈소판제를 중단하면 뇌경색과 일과성 뇌 허혈증이 발생할 위험성이 높다[101]. 따라서, 항혈소판제를 절대적으로 투여할 수 없는 경우가 아니라면 항혈소판제 투여가 필요한 환자에서는 재투여를 고려해야 한다. 그러나 항혈소판제와 연관된 두개내출혈 환자에서 항혈소판제를 언제 재시작해야 하는지에 대해서는 근거가 부족하다. 우선 항응고제의 재투여시의 지침을 참조할 때 두개내출혈 4주 뒤 재 투여를 시도해볼 수 있으며, 허혈성 뇌경색을 포함한 혈전색전증의 발생 위험성이 높은 환자에게는 두개내출혈 이후 수일 내에 투여도 가능할 수는 있다. 이에 대한 해답을 얻기 위해서는 향후 신뢰도 높은 임상연구가 필수적이다.
와파린 또는 비타민 K 비의존성 경구용 항응고제와 연관된 두개내출혈은 예후가 좋지 않을 가능성이 높기 때문에 신속한 진단 및 치료가 필수적이며 와파린과 연관된 두개내출혈의 경우는 우리나라의 현실에서는 비타민 K와 FFP투여가 권장된다. 와파린과 연관된 두개내출혈 이후 항응고요법을 다시 고려해야 한다면 위험인자 및 두개내출혈의 위치 등을 고려하여 재시작 여부를 결정하고 적절한 약제를 선택하여야 한다. 또한 재시작 시점은 적어도 4주 이후가 적절하다고 판단된다. 항혈소판제와 연관된 두개내출혈에서 혈소판 수혈은 추천하기 어려우며 두개내출혈 이후 항혈소판제 재시작 여부와 시점에 대해서는 아직 근거가 부족하기 때문에 좀더 연구가 필요하다.
ACKNOWLEDGMENTS
This research was supported by grants of Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (2015R1D1A1A01057934).
REFERENCES
1. Whitlon DS, Sadowski JA, Suttie JW. Mechanism of coumarin action: significance of vitamin K epoxide reductase inhibition. Biochemistry. 1978; 17:1371–7.

2. Albers GW, Amarenco P, Easton JD, Sacco RL, Teal P; American College of Chest Physicians. Antithrombotic and thrombolytic therapy for ischemic stroke: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008; 133(6 Suppl):630S–69S.
3. Schulman S, Beyth RJ, Kearon C, Levine MN; American College of Chest Physicians. Hemorrhagic complications of anticoagulant and thrombolytic treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008; 133:257S–98S.
4. Kuznetsov S, Barcelona R, Josephson RA, Mohan SK. The Role of Nonvitamin K Antagonist Oral Anticoagulants (NOACs) in stroke prevention in patients with atrial fibrillation. Curr Neurol Neurosci Rep. 2016; 16:47.

5. Campbell PG, Sen A, Yadla S, Jabbour P, Jallo J. Emergency reversal of antiplatelet agents in patients presenting with an intracranial hemorrhage: a clinical review. World Neurosurg. 2010; 74:279–85.

6. Cantalapiedra A, Gutierrez O, Tortosa JI, Yañez M, Dueñas M, Fernandez Fontecha E, et al. Oral anticoagulant treatment: risk factors involved in 500 intracranial hemorrhages. J Thromb Thrombolysis. 2006; 22:113–20.

7. Caso V, Paciaroni M, Venti M, Alberti A, Palmerini F, Milia P, et al. Effect of on-admission antiplatelet treatment on patients with cerebral hemorrhage. Cerebrovasc Dis. 2007; 24:215–8.

8. Foerch C, Sitzer M, Steinmetz H, Neumann-Haefelin T. Pretreatment with antiplatelet agents is not independently associated with unfavorable outcome in intracerebral hemorrhage. Stroke. 2006; 37:2165–7.

9. Lacut K, van der Maaten J, Le Gal G, Cornily G, Mottier D, Oger E. Antiplatelet drugs and risk of venous thromboembolism: results from the EDITH case-control study. Haematologica. 2008; 93:1117–8.

10. Roquer J, Rodriguez Campello A, Gomis M, Ois A, Puente V, Munteis E. Previous antiplatelet therapy is an independent predictor of 30-day mortality after spontaneous supratentorial intracerebral hemorrhage. J Neurol. 2005; 252:412–6.

11. Sansing LH, Messe SR, Cucchiara BL, Cohen SN, Lyden PD, Kasner SE; CHANT Investigators. Prior antiplatelet use does not affect hemorrhage growth or outcome after ICH. Neurology. 2009; 72:1397–402.

12. Toyoda K, Okada Y, Minematsu K, Kamouchi M, Fujimoto S, Ibayashi S, et al. Antiplatelet therapy contributes to acute deterioration of intracerebral hemorrhage. Neurology. 2005; 65:1000–4.

13. Schurgers LJ, Aebert H, Vermeer C, Bultmann B, Janzen J. Oral anticoagulant treatment: friend or foe in cardiovascular disease? Blood. 2004; 104:3231–2.

14. Hart RG, Tonarelli SB, Pearce LA. Avoiding central nervous system bleeding during antithrombotic therapy: recent data and ideas. Stroke. 2005; 36:1588–93.
15. Hart RG, Boop BS, Anderson DC. Oral anticoagulants and intracranial hemorrhage. Facts and hypotheses. Stroke. 1995; 26:1471–7.
16. Flaherty ML, Kissela B, Woo D, Kleindorfer D, Alwell K, Sekar P, et al. The increasing incidence of anticoagulant-associated intracerebral hemorrhage. Neurology. 2007; 68:116–21.

17. Levine MN, Raskob G, Beyth RJ, Kearon C, Schulman S. Hemorrhagic complications of anticoagulant treatment: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004; 126(3 Suppl):287S–310S.
18. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials. Arch Intern Med. 1994; 154:1449–57.
19. Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy: current practices and unresolved questions. Stroke. 2006; 37:256–62.
20. Smith NL, Psaty BM, Furberg CD, White R, Lima JA, Newman AB, et al. Temporal trends in the use of anticoagulants among older adults with atrial fibrillation. Arch Intern Med. 1999; 159:1574–8.

21. Beyer-Westendorf J, Camm AJ, Coleman CI, Tamayo S. Rivaroxaban real-world evidence: Validating safety and effectiveness in clinical practice. Thromb Haemost. 2016; 116(Suppl 2):S13–S23.

22. Romanelli RJ, Nolting L, Dolginsky M, Kym E, Orrico KB. Dabigatran versus warfarin for atrial fibrillation in real-world clinical practice: a systematic review and meta-analysis. Circ Cardiovasc Qual Outcomes. 2016; 9:126–34.
23. Flaherty ML, Haverbusch M, Sekar P, Kissela BM, Kleindorfer D, Moomaw CJ, et al. Location and outcome of anticoagulant-associated intracerebral hemorrhage. Neurocrit Care. 2006; 5:197–201.

24. Sjalander A, Engstrom G, Berntorp E, Svensson P. Risk of haemorrhagic stroke in patients with oral anticoagulation compared with the general population. J Intern Med. 2003; 254:434–8.

25. Cucchiara B, Messe S, Sansing L, Kasner S, Lyden P; CHANT Investigators. Hematoma growth in oral anticoagulant related intracerebral hemorrhage. Stroke. 2008; 39:2993–6.

26. Sjoblom L, Hardemark HG, Lindgren A, Norrving B, Fahlen M, Samuelsson M, et al. Management and prognostic features of intracerebral hemorrhage during anticoagulant therapy: a Swedish multicenter study. Stroke. 2001; 32:2567–74.

27. Chatterjee S, Sardar P, Biondi-Zoccai G, Kumbhani DJ. New oral anticoagulants and the risk of intracranial hemorrhage: traditional and Bayesian meta-analysis and mixed treatment comparison of randomized trials of new oral anticoagulants in atrial fibrillation. JAMA Neurol. 2013; 70:1486–90.
28. Purrucker JC, Haas K, Rizos T, Khan S, Wolf M, Hennerici MG, et al. Early clinical and radiological course, management, and outcome of intracerebral hemorrhage related to new oral anticoagulants. JAMA Neurol. 2016; 73:169–77.

29. Gorelick PB, Weisman SM. Risk of hemorrhagic stroke with aspirin use: an update. Stroke. 2005; 36:1801–7.
30. Akbari SH, Reynolds MR, Kadkhodayan Y, Cross DT 3rd, Moran CJ. Hemorrhagic complications after prasugrel (Effient) therapy for vascular neurointerventional procedures. J Neurointerv Surg. 2013; 5:337–43.

31. Broderick JP, Diringer MN, Hill MD, Brun NC, Mayer SA, Steiner T, et al. Determinants of intracerebral hemorrhage growth: an exploratory analysis. Stroke. 2007; 38:1072–5.
32. Lacut K, Le Gal G, Seizeur R, Prat G, Mottier D, Oger E. Antiplatelet drug use preceding the onset of intracerebral hemorrhage is associated with increased mortality. Fundam Clin Pharmacol. 2007; 21:327–33.

33. Roquer J. Previous antiplatelet treatment and mortality in patients with intracerebral hemorrhage. Stroke. 2007; 38:863.

34. Saloheimo P, Ahonen M, Juvela S, Pyhtinen J, Savolainen ER, Hillbom M. Regular aspirin-use preceding the onset of primary intracerebral hemorrhage is an independent predictor for death. Stroke. 2006; 37:129–33.

35. Sorimachi T, Fujii Y, Morita K, Tanaka R. Predictors of hematoma enlargement in patients with intracerebral hemorrhage treated with rapid administration of antifibrinolytic agents and strict blood pressure control. J Neurosurg. 2007; 106:250–4.

36. Stetler WR, Chaudhary N, Thompson BG, Gemmete JJ, Maher CO, Pandey AS. Prasugrel is effective and safe for neurointerventional procedures. J Neurointerv Surg. 2013; 5:332–6.

37. Thrift AG, McNeil JJ, Forbes A, Donnan GA. Risk of primary intracerebral haemorrhage associated with aspirin and nonsteroidal anti-inflammatory drugs: case-control study. BMJ. 1999; 318:759–64.

38. Tuhrim S. Aspirin-use before ICH: a potentially treatable iatrogenic coagulopathy? Stroke. 2006; 37:4–5.
39. Naidech AM, Bendok BR, Garg RK, Bernstein RA, Alberts MJ, Bleck TP, et al. Reduced platelet activity is associated with more intraventricular hemorrhage. Neurosurgery. 2009; 65:684–8. discussion 688.

40. Naidech AM, Bernstein RA, Levasseur K, Bassin SL, Bendok BR, Batjer HH, et al. Platelet activity and outcome after intracerebral hemorrhage. Ann Neurol. 2009; 65:352–6.

41. Naidech AM, Jovanovic B, Liebling S, Garg RK, Bassin SL, Bendok BR, et al. Reduced platelet activity is associated with early clot growth and worse 3-month outcome after intracerebral hemorrhage. Stroke. 2009; 40:2398–401.

42. Campbell PG, Yadla S, Sen AN, Jallo J, Jabbour P. Emergency reversal of clopidogrel in the setting of spontaneous intracerebral hemorrhage. World Neurosurg. 2011; 76:100–4. discussion 159-60.

43. Mohr JP, Thompson JL, Lazar RM, Levin B, Sacco RL, Furie KL, et al. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. N Engl J Med. 2001; 345:1444–51.

44. The Stroke Prevention In Reversible Ischemia Trial (SPIRIT) study group. A randomized trial of anticoagulants versus aspirin after cerebral ischemia of presumed arterial origin. Ann Neurol. 1997; 42:857–65.
45. Hylek EM, Evans-Molina C, Shea C, Henault LE, Regan S. Major hemorrhage and tolerability of warfarin in the first year of therapy among elderly patients with atrial fibrillation. Circulation. 2007; 115:2689–96.

46. Song TJ, Kim J, Lee HS, Nam CM, Nam HS, Heo JH, et al. The frequency of cerebral microbleeds increases with CHADS(2) scores in stroke patients with non-valvular atrial fibrillation. Eur J Neurol. 2013; 20:502–8.
47. Biffi A, Greenberg SM. Cerebral amyloid angiopathy: a systematic review. J Clin Neurol. 2011; 7:1–9.

48. O’Donnell MJ, Eikelboom JW, Yusuf S, Diener HC, Hart RG, Smith EE, et al. Effect of apixaban on brain infarction and microbleeds: AVERROES-MRI assessment study. Am Heart J. 2016; 178:145–50.
49. Hemphill JC 3rd, Greenberg SM, Anderson CS, Becker K, Bendok BR, Cushman M, et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2015; 46:2032–60.

50. Holbrook A, Schulman S, Witt DM, Vandvik PO, Fish J, Kovacs MJ, et al. Evidence-based management of anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012; 141:e152S–84S.
52. Dentali F, Ageno W, Crowther M. Treatment of coumarin-associated coagulopathy: a systematic review and proposed treatment algorithms. J Thromb Haemost. 2006; 4:1853–63.

53. Goldstein JN, Thomas SH, Frontiero V, Joseph A, Engel C, Snider R, et al. Timing of fresh frozen plasma administration and rapid correction of coagulopathy in warfarin-related intracerebral hemorrhage. Stroke. 2006; 37:151–5.

54. Leissinger CA, Blatt PM, Hoots WK, Ewenstein B. Role of prothrombin complex concentrates in reversing warfarin anticoagulation: a review of the literature. Am J Hematol. 2008; 83:137–43.

55. Pabinger I, Brenner B, Kalina U, Knaub S, Nagy A, Ostermann H, et al. Prothrombin complex concentrate (Beriplex P/N) for emergency anticoagulation reversal: a prospective multinational clinical trial. J Thromb Haemost. 2008; 6:622–31.
56. Riess HB, Meier-Hellmann A, Motsch J, Elias M, Kursten FW, Dempfle CE. Prothrombin complex concentrate (Octaplex) in patients requiring immediate reversal of oral anticoagulation. Thromb Res. 2007; 121:9–16.

57. Fredriksson K, Norrving B, Stromblad LG. Emergency reversal of anticoagulation after intracerebral hemorrhage. Stroke. 1992; 23:972–7.

58. Cartmill M, Dolan G, Byrne JL, Byrne PO. Prothrombin complex concentrate for oral anticoagulant reversal in neurosurgical emergencies. Br J Neurosurg. 2000; 14:458–61.
59. Boulis NM, Bobek MP, Schmaier A, Hoff JT. Use of factor IX complex in warfarin-related intracranial hemorrhage. Neurosurgery. 1999; 45:1113–8. discussion 1118-9.

60. Sarode R, Milling TJ Jr, Refaai MA, Mangione A, Schneider A, Durn BL, et al. Efficacy and safety of a 4-factor prothrombin complex concentrate in patients on vitamin K antagonists presenting with major bleeding: a randomized, plasmacontrolled, phase IIIb study. Circulation. 2013; 128:1234–43.
61. Lin J, Hanigan WC, Tarantino M, Wang J. The use of recombinant activated factor VII to reverse warfarin-induced anticoagulation in patients with hemorrhages in the central nervous system: preliminary findings. J Neurosurg. 2003; 98:737–40.

62. Veshchev I, Elran H, Salame K. Recombinant coagulation factor VIIa for rapid preoperative correction of warfarin-related coagulopathy in patients with acute subdural hematoma. Med Sci Monit. 2002; 8:CS98–100.
63. Sorensen B, Johansen P, Nielsen GL, Sorensen JC, Ingerslev J. Reversal of the International Normalized Ratio with recombinant activated factor VII in central nervous system bleeding during warfarin thromboprophylaxis: clinical and biochemical aspects. Blood Coagul Fibrinolysis. 2003; 14:469–77.
64. Freeman WD, Brott TG, Barrett KM, Castillo PR, Deen HG Jr, Czervionke LF, et al. Recombinant factor VIIa for rapid reversal of warfarin anticoagulation in acute intracranial hemorrhage. Mayo Clin Proc. 2004; 79:1495–500.

65. Ilyas C, Beyer GM, Dutton RP, Scalea TM, Hess JR. Recombinant factor VIIa for warfarin-associated intracranial bleeding. J Clin Anesth. 2008; 20:276–9.

66. Tanaka KA, Szlam F, Dickneite G, Levy JH. Effects of prothrombin complex concentrate and recombinant activated factor VII on vitamin K antagonist induced anticoagulation. Thromb Res. 2008; 122:117–23.

67. Rosovsky RP, Crowther MA. What is the evidence for the off-label use of recombinant factor VIIa (rFVIIa) in the acute reversal of warfarin? ASH evidence-based review 2008. Hematology Am Soc Hematol Educ Program. 2008; 36:8.
68. Heidbuchel H, Verhamme P, Alings M, Antz M, Diener HC, Hacke W, et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace. 2015; 17:1467–507.

69. Dager WE, Gosselin RC, Roberts AJ. Reversing dabigatran in life-threatening bleeding occurring during cardiac ablation with factor eight inhibitor bypassing activity. Crit Care Med. 2013; 41:e42–6.

70. Eerenberg ES, Kamphuisen PW, Sijpkens MK, Meijers JC, Buller HR, Levi M. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation. 2011; 124:1573–9.
71. Lazo-Langner A, Lang ES, Douketis J. Clinical review: Clinical management of new oral anticoagulants: a structured review with emphasis on the reversal of bleeding complications. Crit Care. 2013; 17:230.

72. Oh JJ, Akers WS, Lewis D, Ramaiah C, Flynn JD. Recombinant factor VIIa for refractory bleeding after cardiac surgery secondary to anticoagulation with the direct thrombin inhibitor lepirudin. Pharmacotherapy. 2006; 26:569–77.

73. Kaatz S, Kouides PA, Garcia DA, Spyropolous AC, Crowther M, Douketis JD, et al. Guidance on the emergent reversal of oral thrombin and factor Xa inhibitors. Am J Hematol. 2012; 87 Suppl 1:S141–5.

74. Majeed A, Schulman S. Bleeding and antidotes in new oral anticoagulants. Best Pract Res Clin Haematol. 2013; 26:191–202.

75. Pollack CV Jr, Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA, et al. Idarucizumab for dabigatran reversal. N Engl J Med. 2015; 373:511–20.

76. Beshay JE, Morgan H, Madden C, Yu W, Sarode R. Emergency reversal of anticoagulation and antiplatelet therapies in neurosurgical patients. J Neurosurg. 2010; 112:307–18.

77. McMillian WD, Rogers FB. Management of prehospital antiplatelet and anticoagulant therapy in traumatic head injury: a review. J Trauma. 2009; 66:942–50.

78. Vilahur G, Choi BG, Zafar MU, Viles-Gonzalez JF, Vorchheimer DA, Fuster V, et al. Normalization of platelet reactivity in clopidogrel-treated subjects. J Thromb Haemost. 2007; 5:82–90.

79. Naidech AM, Liebling SM, Rosenberg NF, Lindholm PF, Bernstein RA, Batjer HH, et al. Early platelet transfusion improves platelet activity and may improve outcomes after intracerebral hemorrhage. Neurocrit Care. 2012; 16:82–7.

80. Ducruet AF, Hickman ZL, Zacharia BE, Grobelny BT, DeRosa PA, Landes E, et al. Impact of platelet transfusion on hematoma expansion in patients receiving antiplatelet agents before intracerebral hemorrhage. Neurol Res. 2010; 32:706–10.

81. Baharoglu MI, Cordonnier C, Al-Shahi Salman R, de Gans K, Koopman MM, Brand A, PATCH Investigators, et al. Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy (PATCH): a randomised, open-label, phase 3 trial. Lancet. 2016; 387:2605–13.

82. Arima H, Tzourio C, Butcher K, Anderson C, Bousser MG, Lees KR, et al. Prior events predict cerebrovascular and coronary outcomes in the PROGRESS trial. Stroke. 2006; 37:1497–502.

83. Hanger HC, Wilkinson TJ, Fayez-Iskander N, Sainsbury R. The risk of recurrent stroke after intracerebral haemorrhage. J Neurol Neurosurg Psychiatry. 2007; 78:836–40.

84. Weimar C, Benemann J, Terborg C, Walter U, Weber R, Diener HC, et al. Recurrent stroke after lobar and deep intracerebral hemorrhage: a hospital-based cohort study. Cerebrovasc Dis. 2011; 32:283–8.

85. Izumihara A, Suzuki M, Ishihara T. Recurrence and extension of lobar hemorrhage related to cerebral amyloid angiopathy: multivariate analysis of clinical risk factors. Surg Neurol. 2005; 64:160–4. discussion 164.

86. Biffi A, Halpin A, Towfighi A, Gilson A, Busl K, Rost N, et al. Aspirin and recurrent intracerebral hemorrhage in cerebral amyloid angiopathy. Neurology. 2010; 75:693–8.

87. Tzourio C, Arima H, Harrap S, Anderson C, Godin O, Woodward M, et al. APOE genotype, ethnicity, and the risk of cerebral hemorrhage. Neurology. 2008; 70:1322–8.

88. Greenberg SM, Eng JA, Ning M, Smith EE, Rosand J. Hemorrhage burden predicts recurrent intracerebral hemorrhage after lobar hemorrhage. Stroke. 2004; 35:1415–20.

89. Song TJ, Kim J, Song D, Nam HS, Kim YD, Lee HS, et al. Association of cerebral microbleeds with mortality in stroke patients having atrial fibrillation. Neurology. 2014; 83:1308–15.

90. ACTIVE Investigators, Connolly SJ, Pogue J, Hart RG, Hohnloser SH, Pfeffer M, et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med. 2009; 360:2066–78.

91. Reddy VY, Doshi SK, Sievert H, Buchbinder M, Neuzil P, Huber K, et al. Percutaneous left atrial appendage closure for stroke prophylaxis in patients with atrial fibrillation: 2.3-Year Follow-up of the PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) Trial. Circulation. 2013; 127:720–9.
92. Demchuk AM, Dowlatshahi D, Rodriguez-Luna D, Molina CA, Blas YS, Dzialowski I, et al. Prediction of haematoma growth and outcome in patients with intracerebral haemorrhage using the CT-angiography spot sign (PREDICT): a prospective observational study. Lancet Neurol. 2012; 11:307–14.

93. Viswanathan A, Rakich SM, Engel C, Snider R, Rosand J, Greenberg SM, et al. Antiplatelet use after intracerebral hemorrhage. Neurology. 2006; 66:206–9.

94. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009; 361:1139–51.

95. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011; 365:883–91.

96. Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011; 365:981–92.
97. Majeed A, Kim YK, Roberts RS, Holmstrom M, Schulman S. Optimal timing of resumption of warfarin after intracranial hemorrhage. Stroke. 2010; 41:2860–6.

98. Ferrari E, Benhamou M, Cerboni P, Marcel B. Coronary syndromes following aspirin withdrawal: a special risk for late stent thrombosis. J Am Coll Cardiol. 2005; 45:456–9.
99. Iakovou I, Schmidt T, Bonizzoni E, Ge L, Sangiorgi GM, Stankovic G, et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA. 2005; 293:2126–30.

100. Sharma AK, Ajani AE, Hamwi SM, Maniar P, Lakhani SV, Waksman R, et al. Major noncardiac surgery following coronary stenting: when is it safe to operate? Catheter Cardiovasc Interv. 2004; 63:141–5.

101. Rossen JD, Chalouhi N, Wassef SN, Thomas J, Abel TJ, Jabbour PM, et al. Incidence of cerebral ischemic events after discontinuation of clopidogrel in patients with intracranial aneurysms treated with stent-assisted techniques. J Neurosurg. 2012; 117:929–33.

102. Cervera A, Amaro S, Chamorro A. Oral anticoagulant-associated intracerebral hemorrhage. J Neurol. 2012; 259:212–24.

103. Lee SB, Manno EM, Layton KF, Wijdicks EF. Progression of warfarin-associated intracerebral hemorrhage after INR normalization with FFP. Neurology. 2006; 67:1272–4.

104. Phan TG, Koh M, Wijdicks EF. Safety of discontinuation of anticoagulation in patients with intracranial hemorrhage at high thromboembolic risk. Arch Neurol. 2000; 57:1710–3.

105. Bertram M, Bonsanto M, Hacke W, Schwab S. Managing the therapeutic dilemma: patients with spontaneous intracerebral hemorrhage and urgent need for anticoagulation. J Neurol. 2000; 247:209–14.

106. Butler AC, Tait RC. Management of oral anticoagulant-induced intracranial haemorrhage. Blood Rev. 1998; 12:35–44.

107. Leker RR, Abramsky O. Early anticoagulation in patients with prosthetic heart valves and intracerebral hematoma. Neurology. 1998; 50:1489–91.

108. Nakagawa T, Kubota T, Handa Y, Kawano H, Sato K. Intracranial hemorrhage due to long-term anticoagulant therapy in patients with prosthetic heart valves--four case reports. Neurol Med Chir (Tokyo). 1995; 35:156–9.
Figure 1.
Management of bleeding in patients taking non-vitamin K antagonist oral anticoagulants. Possible therapeutic measures in case of minor or severe bleeding in patients on non-vitamin K antagonist oral anticoagulant therapy [68]. NOACs, Nonvitamin K Antagonist Oral Anticoagulants.
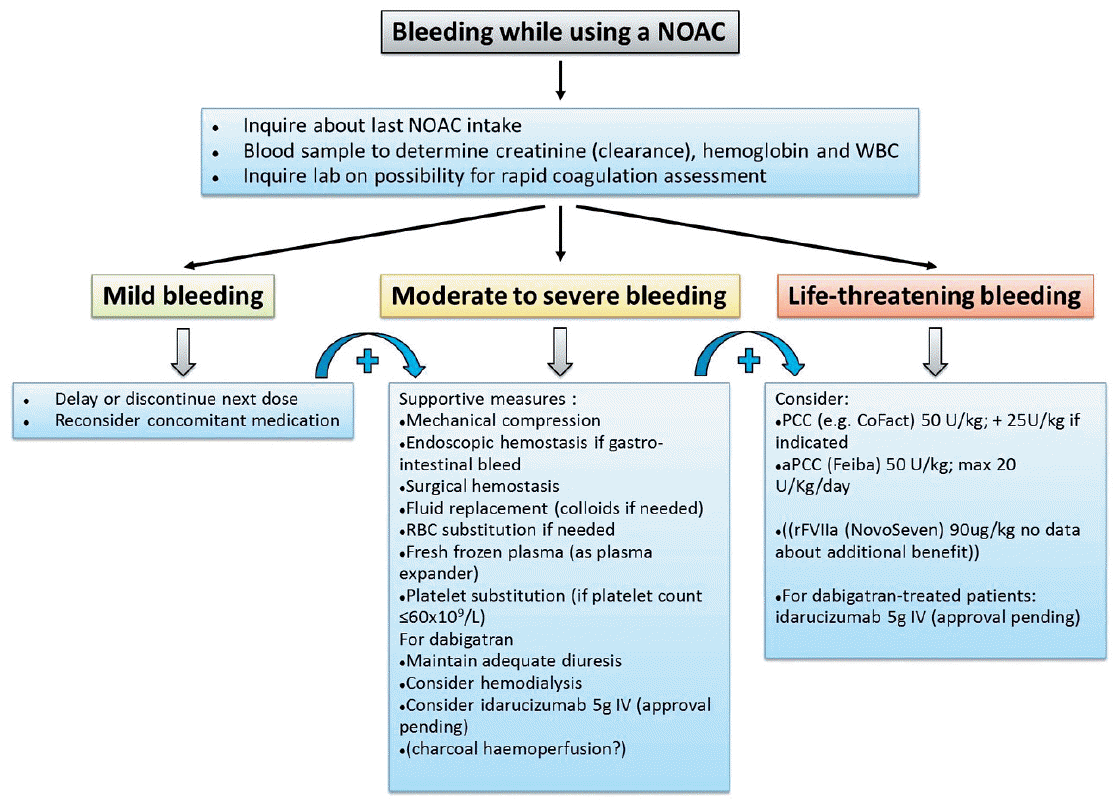
Table 1.
Table 2.
Table 3.
Main results of early versus late anti-coagulation with full-dose heparin or warfarin in patients with OAC-ICH
| Author | Number of study population | Anti-coagulation | Rebleeding | Embolism |
|---|---|---|---|---|
| Phan et al [104] | 34 | Late | 0 | 3 |
| Bertram et al. [105] | 15 | Early | 3 | 3 |
| Butler and Tait [106] | 13 | Early | 1 | 3 |
| Leker and Abramsky [107] | 4 | Early | 0 | 0 |
| Nagakawa et al. [108] | 4 | Early | 0 | 0 |
| Kawamata et al. [109] | 12 | Early | 0 | 0 |
| Lieberman et al. [110] | 1 | Early | 1 | 0 |
| Summary of findings | 83 | 5 (6.0%) | 9 (10.8%) | |
| Early anti-coagulation | 49 | 5 (10.2%) | 6 (12.2%) | |
| Late anti-coagulation | 34 | 0 | 3 (8.8%) |




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download