서 론
신증후군은 하루 3.0 g/day 이상의 단백뇨가 나타나며, 이로 인해 이차적으로 저알부민혈증, 부종 및 고지질혈증 등이 동반되는 질환이다[1]. 신증후군 환자에서 3-45%에서 혈전증 발생이 보고되고 있는데, 이는 주로 정맥 내에 잘 생기고, 동맥 내에는 매우 드물게 생기는 것으로 알려져 있다[2]. 저자들은 신증후군 환자에서 동맥내 혈전증으로 인해 발생한 급성 뇌경색의 희귀한 예를 경험 하였기에 보고하는 바이다.
Go to : 
증 례
35세 남자가 30분 전 갑자기 생긴 오른쪽 팔다리 위약, 구음장애 및 언어장애 증상으로 본원에 내원하였다. 환자는 11년 전 단백뇨 및 전신부종으로 타 병원에 방문하여 신생검을 통해 신증후군의 일종인 미세변화병(minimal change disease)으로 진단받아, 치료 후 증상이 호전된 적이 있었다. 본원 내원 2일 전 단백뇨 증상이 재발해서 프레드니솔론 60 mg/day을 투약받기 시작했다. 당뇨, 고혈압 및 심장병의 병력은 없었고, 고지질혈증의 병력은 있었으나, 항고지질혈증 약물은 복용하지 않고 있었다. 환자는 첫 신증후군 진단 후, 6개월 정도 지나 타 병원에서 신정맥혈전증으로 진단받고 수개월 간 항응고제를 복용한 병력이 있었다. 음주력과 흡연력은 없었고, 가족력상에도 특이소견은 없었다.
내원 당시 혈압 119/90 mmHg, 맥박 110회/분, 체온 36.3℃였고, 부종은 없었다. 옆구리 통증 및 갈비척추각의 압통이나 다리의 압통도 없었다. 신경계 진찰에서 의식은 명료하였으나, 구음장애, 전실어증, 왼쪽 주시 경향 및 오른쪽 얼굴마비가 있었다. 근력은 오른쪽 팔다리가 Medical Research Council (MRC) 0등급이었고, 미국 국립 보건원 뇌졸중 척도(National Institutes of Health Stroke Scale, NIHSS)는 20점이었다. 뇌 컴퓨터단층촬영(computed tomography, CT)에서 출혈은 없었고, 증상 발생 60분 후 재조합조직플라스미노겐활성제(recombinant tissue plasminogen activator, rTPA)를 정맥 내로 투여하였다. rTPA 투여 후 촬영한 컴퓨터단층혈관조영에서 왼쪽 내경동맥 근위부가 완전 폐색 되어있었다. 증상의 호전도 없어 동맥내혈전용해술을 진행하였는데, 내경동맥 혈전은 금방 제거되었으나, 시술 중 혈전이 이동하여 외경동맥은 폐색되었다(Fig. 1). 증상 발생 후 2시간 35분 만에 왼쪽 내경동맥이 재개통 되었으며, 재개통 후 시행한 뇌혈관조영술에서 좌측 후대뇌동맥은 태아형(fetal type)이었고, 뇌 내 혈관들의 폐색이나 협착은 보이지 않았다. 시술 후 NIHSS는 6점으로 호전되었고, 24시간 이후 촬영한 뇌 자기공명영상(magnetic resonance imaging, MRI)에서 왼쪽 중대뇌동맥영역 및 후대뇌동맥영역에 다발성 고신호 병변 및 출혈변환(hemorrhagic transformation)이 있었다(Fig. 2A,B). 전체혈구계산에서 백혈구가 20,500개/μL (정상범위 4,000-10,000개/μL)로 증가된 것 이외에는 이상은 없었다. 혈액응고검사에서도 프로트롬빈시간-국제표준화비율(prothrombin time-international normalized ratio) 및 활성화부분트롬보플라스틴시간(activated partial thromboplastin time)은 정상이었고, 항트롬빈III, 단백질 C 항원, 총 단백질 S, 단백질 C 및 S활성도 등 응고 관련 인자 검사도 정상이었다. 면역혈청검사에서 류마티스인자(rheumatoid factor)와 항핵항체 또한 모두 정상이었으며, 루푸스항응고인자와 항카디오리핀항체(IgG, IgM) 역시 음성이었다. 일반화학 검사상 단백 4.6 g/dL (정상범위 6.7-8.3 g/dL) 및 알부민 2.5 g/dL (정상범위 3.8-5.3 g/dL)으로 감소되어 있었고, 총 콜레스테롤 386 mg/dL (정상범위 130-250 mg/dL)로 증가되어 있었으나, 나트륨, 칼륨, 혈액요소질소 및 크레아티닌은 정상이었다. 요검사에서는 알부민이 증가되어 있었고(4+), 단백질도 2,954 mg/dL (정상범위 0-20 mg/dL)으로 증가되어 있었다. 흉부경유심장초음파 검사에서는 심장기능은 정상이었고, 좌심실 및 좌심방에 혈전은 없었다. 공기방울을 이용한 두개경유도플러에서 오른왼쪽션트는 없었고, 24시간심전도검사도 정상이었다.
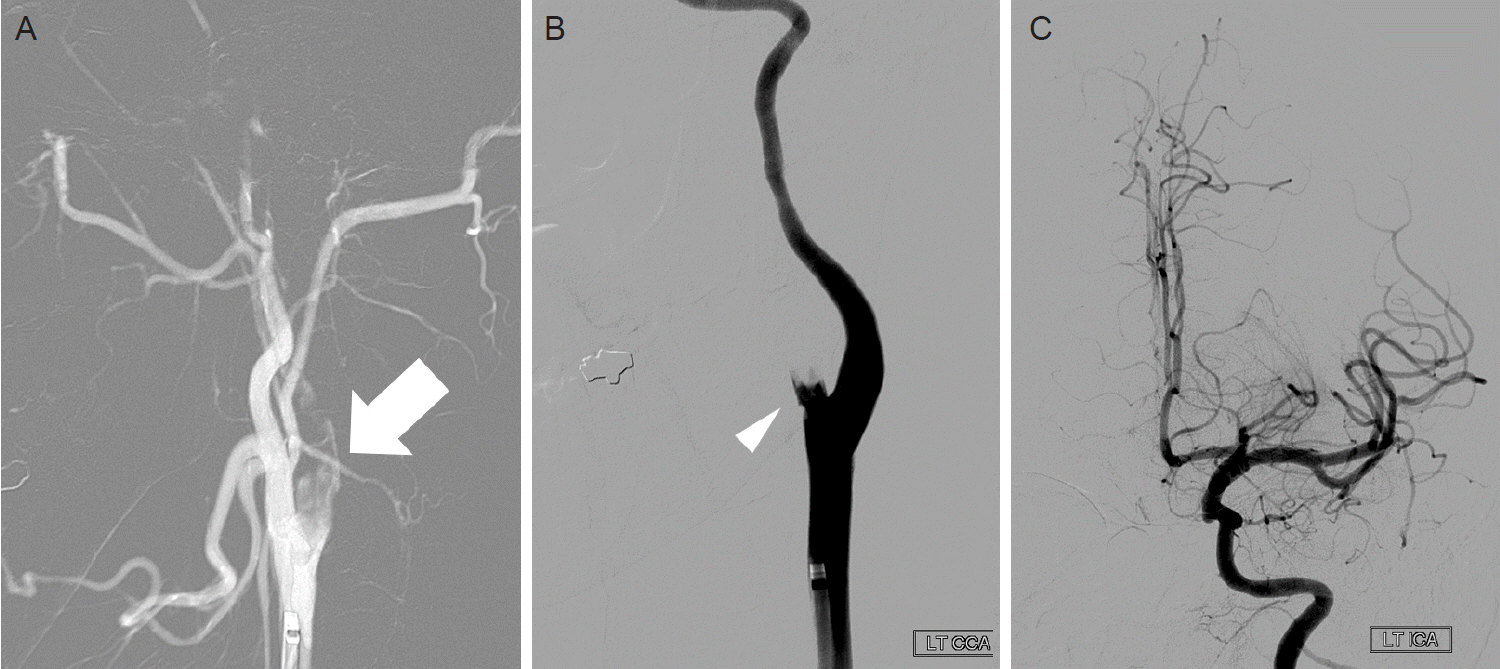 | Figure 1.(A) Initial cerebral angiography of the left ICA shows total occlusion due to thrombus at the proximal portion of the left ICA (white arrow). (B, C) After intra-arterial thrombolysis, the left ICA is visualized. An occlusion occurs in the left ECA (white triangle), which was caused by migration of clot fragments from the ICA to the ECA during the procedure. ICA, internal carotid artery; ECA, external carotid artery. |
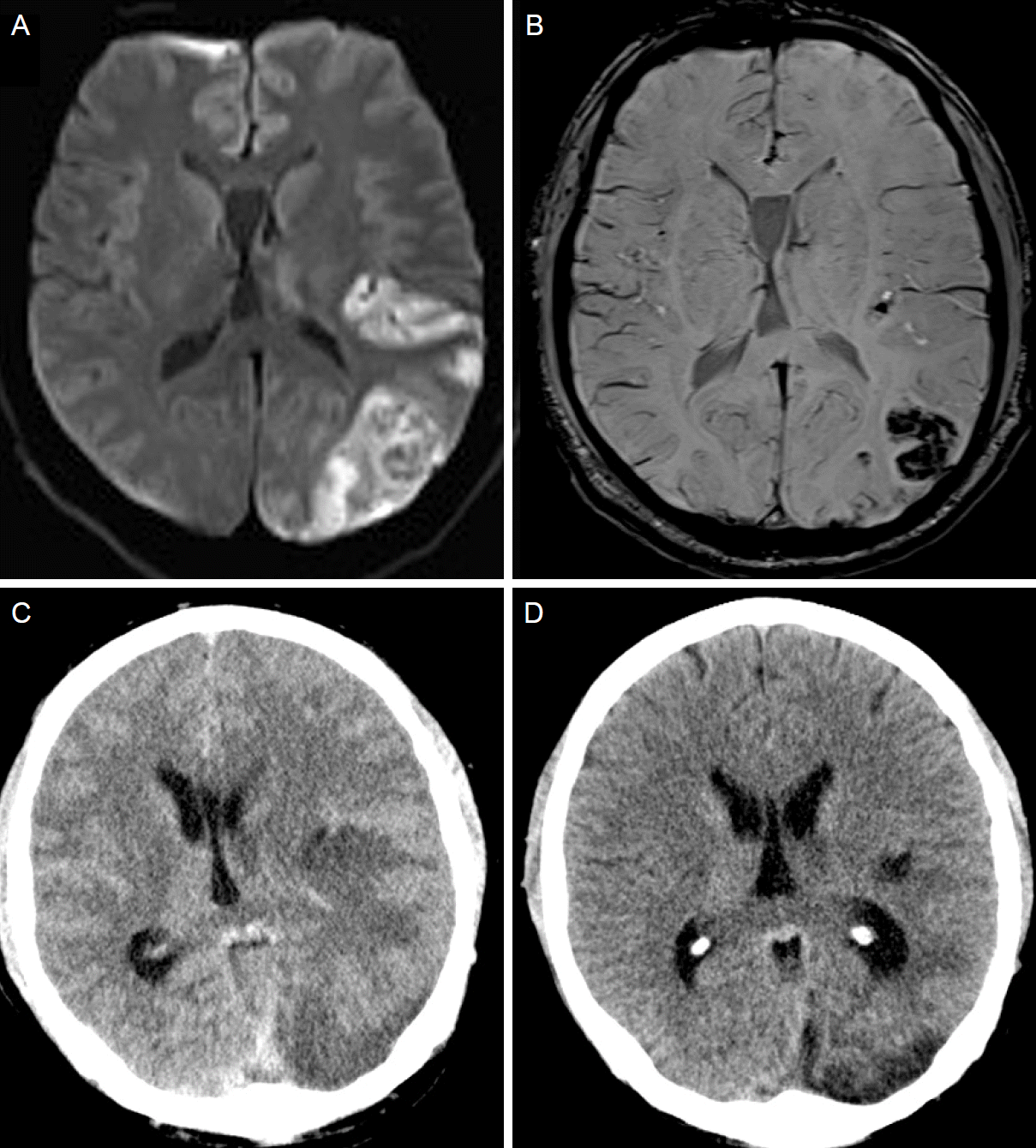 | Figure 2.(A, B) Brain MRIs acquired 24 hours after symptom onset show acute infarction with hemorrhagic transformation in the left MCA and left PCA territories. (C) Brain CT acquired 3 days after symptom onset shows cerebral edema with midline shifting. (D) Brain CT acquired 4 weeks after symptom onset shows improvement of edema and midline shifting. MRI, magnetic resonance imaging; MCA, middle cerebral artery; PCA, posterior cerebral artery; CT, computerized tomography. |
내원 3일째부터 환자는 왼쪽 머리 부위에 심한 두통과 구토 증상을 호소하였다. 당시 진찰에서 NIHSS는 변화가 없었으나, 전신부종이 있었다. 뇌 CT에서는 병변 부위의 심한 부종이 있었고(Fig. 2C), 뇌압감소를 위해 퓨로세마이드를 투여하기 시작하였다. 내원 11일째부터 두통, 구토 및 전신부종 증상이 호전되기 시작하였다. 내원 4주 후 추적 뇌 CT에서 뇌부종도 호전을 보였고(Fig. 2D), 출혈도 흡수되어 항응고제를 투여 하였다. 증상 발생 후 3개월 째 NHISS 1점으로 증상은 많이 호전되었고, 검사실 검사에서도 혈청 알부민 4.4 g/dL, 요단백질 7 mg/dL으로, 전보다 호전되었다.
Go to : 
고 찰
신증후군과 연관되어 생기는 가장 흔한 혈전 합병증은 신정맥혈전증이며[3], 뇌동맥 내의 혈전증으로 인한 뇌경색 발생은 매우 드문 예이다. 신증후군과 관련된 혈전증의 발생 기전은 아직까지 알려진 바가 없으나 몇 가지 가설이 제시되고 있다. 신증후군 환자에서는 사구체 모세혈관의 기능부전으로 저 분자량의 응고 관련인자인 제 IX, XI인자, 항트롬빈III, 플라스미노젠 및 단백질S 들의 소변을 통한 배설이 증가되어, 이 인자들이 혈액 내에서는 감소되므로, 상대적으로 혈액 내 고 분자량의 응고 관련 인자(제 V, VII, VIII, X인자, 피브리노젠, 알파-2-안티플라스민, 알파-2-마크로글로블린 등)들이 증가된다. 이러한 변화로 응고 촉진 관련 인자들과 항응고 관련 인자들 간에 불균형을 일으키고, 과응고 경향이 유발되어 혈전증이 발생될 수 있다[4]. 신증후군에서 나타나는 저알부민혈증, 고지질혈증 및 용적감소가 혈소판 응집을 유발하여 혈전증이 발생 될 수도 있다[5]. 또한, 신증후군에 사용되는 스테로이드가 혈전증을 유발시킨다는 가설도 제기되고 있다. 스테로이드는 혈액 내 응고 촉진 관련 인자들의 농도를 증가 시키고, 항 응고 관련 인자들의 농도를 감소시켜 혈전증이 유발될 수 있고, 고용량의 스테로이드 시작 후 발생한 급성 혈전증의 예도 보고 되고 있다[6,7].
본 환자의 경우, 식도경유심장초음파를 이용한 좌심방귀의 혈전 여부 및 열린타원구멍 등을 확인하지 못하였다. 허혈성 뇌졸중에서 원인이 밝혀지지 않은 경우는 약 10% 정도이고, 이들 중 일부는 심장성 색전증이 원인일 가능성이 있다[8]. 따라서, 본 환자에서 신증후군이 뇌경색의 직접적인 원인이라고 단정지을 수는 없다. 하지만, 24시간심전도 및 흉부경유심장초음파에서 심장성 색전증의 증거는 없었다. 두개경유도플러-공기방울검사에서도 오른왼쪽션트는 없었으며, 혈액응고검사 및 응고 관련인자는 정상이었고, 면역혈청검사에서도 이상은 없었다. 또한, 동맥혈전용해술로 혈전이 쉽게 제거되었으며, 혈전제거후 뇌내혈관들의 협착이나 폐색은 없었다는 점을 고려하면, 뇌경색은 신증후군에 의한 뇌동맥내 혈전 형성과 연관되어 발생했을 것이라 추측할 수 있다. 이 환자에서 모든 응고 관련 인자들의 검사가 시행되지 못했지만, 항트롬빈III, 단백질C와 S가 정상이었던 것을 고려해 볼 때, 저알부민혈증과 고지질혈증 등에 의한 혈소판 응집 및 고 용량의 스테로이드 사용이 환자의 뇌경색과 관련되어 있을 것이라 생각한다.
신증후군 환자에서 뇌경색 등의 혈전 합병증 예방을 위해서 항응고제가 도움이 되는데[9], 혈청알부민 수치가 2.0 g/dL 이상으로 회복될 때까지 이를 유지하는 것을 추천하고 있다[2]. 본 환자의 경우 뇌경색 발생시 혈청 알부민은 2.5 g/dL이었다. 신증후군은 악화와 호전이 반복되는 질환으로, 치료제로 스테로이드가 많이 사용된다. 신증후군의 악화시에는 혈전증 발생에 취약할 뿐 아니라, 이 시기에 사용되는 스테로이드 또한 혈전증을 유발할 수 있으므로, 뇌경색을 포함한 혈전합병증 발생 유무를 세심하게 관찰하여야 하고, 혈청 알부민 수치가 2.0 g/dL 이상이더라도, 혈전증을 예방하기 위해 항응고제 사용을 고려해 볼 필요가 있다.
중대뇌동맥이나 내경동맥 등 큰 뇌혈관이 급성으로 폐색되어 뇌경색이 생긴 경우, 빠른 재개통이 요구된다. 최근 들어서는 중대뇌동맥이나 내경동맥의 급성 폐색으로 발생된 뇌경색에서, 혈류 재개통을 위해 정맥내혈전용해술 뿐 아니라, 동맥내혈전용해술도 표준적인 치료법으로 인정되고 있다[10]. 본 환자의 경우도 동맥내혈전용해술로 폐색된 내경동맥이 재개통 되었다. 아직까지 신증후군 환자에서 급성기 뇌경색에 대한 정립된 치료 지침은 없으나, 저자들의 경험으로 급성으로 폐색된 뇌혈관의 재개통을 위해, 동맥내혈전용해술이 도움이 될 것이라 생각한다.
신증후군 환자에게서 발생한 뇌경색은 매우 드물며, 발병기전도 명확하지 않다. 신증후군 악화시에 뇌경색 등의 혈전 합병증 예방을 위해 항응고요법을 적극적으로 고려해야 한다. 아울러, 뇌경색의 급성기에는 혈관 재개통을 위한 치료로 동맥내혈전용해술도 염두에 두어야 할 것이다.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download