서 론
대상 및 방법
대상
좌심방 용적지수(left atrial volume index)의 평가
자료 처리
결 과
전체 환자의 특성
Table 1.
| Characteristic | Total (N=98) |
|---|---|
| Age (yr.) | 72.2±9.1 |
| Male, No. (%) | 64 (65.3) |
| Initial NIHSS score | 8.4±7.5 |
| Location of stroke in left hemisphere, No. (%) | 48 (49.0) |
| Posterior circulation infarction*, No. (%) | 16 (16.3) |
| Hypertension, No. (%) | 63 (64.3) |
| Diabetes mellitus, No. (%) | 25 (25.5) |
| Smoking, No. (%) | 37 (37.8) |
| Previous stroke, No. (%) | 12 (12.2) |
| Ischemic heart disease, No. (%) | 19 (19.4) |
| Peripheral vascular disease, No. (%) | 2 (2.0) |
| Body mass index | 23.8±3.5 |
| History of taking antiplatelet agents, No. (%) | 50 (51.0) |
| Statin use, No. (%) | 20 (20.4) |
| Diagnosed as AF previously, No. (%) | 45 (45.9%) |
| Pre-stroke CHA2DS2-VASc scores | |
| 0 | 8 (8.2%) |
| 1 | 17 (17.3%) |
| 2 | 12 (12.2%) |
| 3 | 26 (26.5%) |
| 4 | 18 (18.4%) |
| 5 | 9 (9.2%) |
| 6 | 4 (4.1%) |
| 7 | 2 (2%) |
| 8 | 2 (2%) |
| PT INR | 1.1±0.1 |
| D-dimer (µg/mL) – mean (SD) | 2.6±5.0 |
| Left atrium volume index (mL/m2) | 57.1±25.4 |
| Median (Interquartile range) | 52.3 (39.3-67.1) |
| Left ventricular ejection fraction (%) | 58.0±10.6 |
Values are presented as mean ± SD unless otherwise indicated.
Analyses were performed with the independent sample t-test, Fisher’s exact test, or χ2 test.
AF, atrial fibrillation; NIHSS, National Institudes of Health Stroke Scale; PT INR, prothrombin time international normalized ratio; T, total participants; M, male; F, female.
CHA2DS2-VASc 점수와 좌심방용적지수 및 D-이합체의 연관성
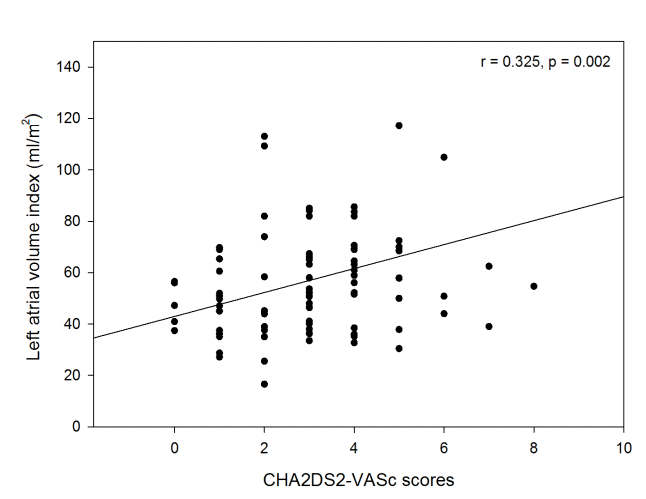 | Figure 1.Scatterplot and the result of correlation coefficient analysis between CHA2DS2-VASc scores and left atrial volume index. |
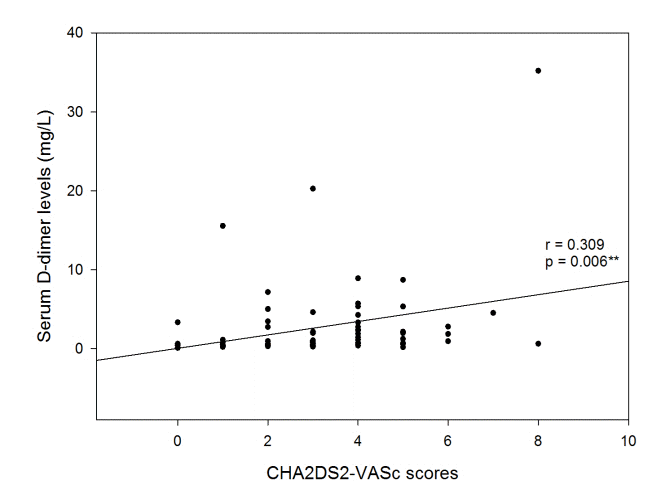 | Figure 2.Scatterplot and the result of correlation coefficient analysis between CHA2DS2-VASc scores and serum D-dimer levels. |
Table 2.
| Variables | β ± SE | t value | P-value |
|---|---|---|---|
| Congestive heart failure | 28.615±14.034 | 2.039 | 0.045* |
| Hypertension | 12.482±4.964 | 2.515 | 0.014* |
| Age | -0.442±0.287 | -1.539 | 0.127 |
| Diabetes mellitus | 3.780±5.435 | 0.695 | 0.489 |
| Prior Stroke or TIA or thromboembolism | 12.443±7.514 | 1.656 | 0.102 |
| Ischemic heart disease | -4.091±6.140 | -0.666 | 0.507 |
| Peripheral vascular disease | 66.705±17.310 | 3.853 | 0.000† |
| Female sex | 7.319±5.004 | -1.463 | 0.147 |




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download