Abstract
Transesophageal echocardiography is a useful device to evaluate the posterior structure of heart with an advantage of enabling clearer images, as compared to transthoracic echocardiography. With intraoperative transesophageal echocardiography, we can reconfirm pre-diagnosed lesions, determine the success of the operation, and in particular, diagnose new lesions that are undetected in pre-operative evaluation. In the present case, undiagnosed patent ductus arteriosus was found on intraoperative transesophageal echocardiography during cardiopulmonary bypass. Subsequently, the patent ductus arteriosus was ligated successfully. With transesophageal echocardiography, we can diagnose the structural and functional abnormality of heart unidentified in the pre-operative evaluation. Also, transesophageal echocardiography can play the role of a rescuer to solve the problems that occur during cardiopulmonary bypass.
Go to : 
동맥관 개존증은 흔한 선천 심장 기형으로 소아 시기에 진단되며, 진단에는 경흉부 심장초음파(transthoracic echocardiography)가 주로 이용된다. 그러나 성인 환자에서는 경흉부 심장초음파를 이용한 진단의 경우 피하지방, 폐조직, 갈비뼈 등의 방해를 받아 좋은 영상을 얻을 수 없어 진단이 어려울 수 있다. 경식도 심장초음파(transesophageal echocardiography)는 심장 수술 중에 국소적, 전반적 심실 기능 장애, 심실 크기, 판막 구조, 심장 내 공기의 발견에 유용하며, 도플러 기능을 이용하여 심장의 혈류를 파악할 수 있다. 또한 경식도 심장초음파는 경흉부 심장초음파 영상에서 제한이 있는 심장의 후방 구조물에 대한 평가에 유용하며, 보다 선명한 영상을 얻을 수 있는 장점이 있다. 저자들은 수술 전 경흉부 심장초음파로 진단되지 않은 동맥관 개존증을 심폐우회술 도중 경식도 심장초음파를 이용하여 진단한 경우를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Go to : 
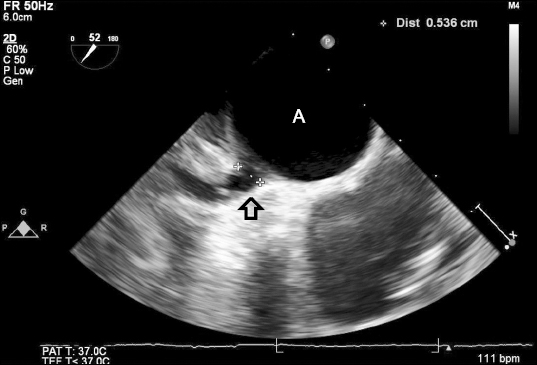
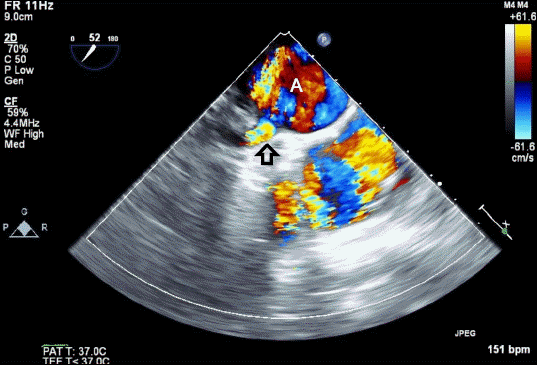
신장 182 cm, 몸무게 70.1 kg의 41세 남자 환자가 전흉부 통증을 동반한 이첨 대동맥 판막 역류 소견으로 수술적 치료가 계획되었다. 환자는 과거력 상 특별한 병력이 없었으며, 수술 전 시행한 경흉부 심장초음파에서 좌측 관상동맥 첨판과 우측 관상동맥 첨판 사이에 봉합선이 있는 이첨 대동맥 판막과 중증 대동맥판 역류 소견을 보였으며, 42.2 mm의 상행 대동맥류가 동반되어 있었다. 수술 전 심박출계수는 59%였고 국소적 심벽 운동 장애는 없었다. 컴퓨터 단층촬영에서 판막 비후가 동반된 이첨 대동맥 판막, 접합 부전이 동반된 전방 판막 기형 그리고 상행 대동맥류 소견을 보였다. 그 외의 검사에서 특이 소견은 없었다. 이에 대동맥 인공 판막 치환술을 시행하기로 하고 수술장에 입실하였다. 마취 전 투약은 시행하지 않았으며, 심전도, 혈압, 산소포화도, bispectral index (BIS), 뇌조직 산소 포화도 감시를 시작하였다. 수술실 도착 후 환자의 활력 징후에 이상이 없음을 확인한 후 좌측 요골 동맥에 부위 마취 후 20 게이지 카테터를 거치하고 침습적 동맥혈압 감시를 시작하였다. 마취유도는 midazolam 13 mg, vecuronium 10 mg과 sufentanil 50 μg을 정주한 후에 100% 산소로 용수 환기한 후 내경 8.0 mm의 기관내 튜브를 삽관하였다. 흡입산소분율 0.5로 기계 환기를 시작하였으며, 호기말 이산화탄소 분압이 35–40 mmHg가 되도록 조절하였다. 마취 유지를 위해 목표농도조절주입펌프를 이용하여 propofol과 remifentanil을 지속 주입하였고, 시간당 vecuronium 3 mg을 지속 정주하여 근이완을 유지하였다. Propofol은 수술 중 BIS 수치가 40 이하를 유지하도록 효과처 농도 기준 1–2 μg/ml로 조절하였고, remifentanil은 8–15 ng/ml 범위에서 환자의 혈역학적 상황에 따라 조절하였다. 그 후 초음파 유도하에 우측 내경정맥에 중심정맥관(AVA catheter®; Edwards Lifesciences, Irvine, USA)를 거치하였고, 이를 통해 폐동맥 카테터(CCombo®; Edwards Lifesciences, Irvine, USA)를 삽입하였다. 중심체온 측정을 위해 비인두에 체온계를 삽입하였으며, Edward Vigilance II® (Edwards Lifesciences, Irvine, CA, USA)을 통해 지속적 심장박출지수와 혼합정맥 산소포화도 감시를 시작하였다. 경식도 심장 초음파를 삽입한 후 이첨 대동맥 판막 소견과, 중증 대동맥판막 역류를 다시 확인하였고, 그 외에 특이소견은 발견하지 못하였다. 심폐우회술 전 혈압은 102/50 mmHg, 심박수는 82 beats/min, 산소포화도는 100%로 안정적이었으며, 수술은 특이사항 없이 진행되었다. 헤파린 210 mg 정주 후 집도의가 상행 대동맥, 상대정맥, 하대정맥에 심폐우회술을 위한 캐뉼라를 삽입하고 심폐 우회술을 시작하였다. 우측 상부 폐정맥을 통해서 좌심실 벤트를 삽입하였고 대동맥 교차차단 후 좌측 관상동맥을 통해서 전방적 심정지 용액 주입을 하였다. 심폐우회술이 지속되면서, 좌심실 벤트를 통해 배액되는 혈액양이 비정상적으로 많음이 발견되었고, 외과의로부터 이의 원인이 될만한 구조적 이상이 없는지 확인해 달라는 요청을 받았다. 이에 경식도 심장초음파를 이용하여 심장과 흉부대동맥을 면밀히 재확인하였다. 우선 경식도 심장초음파로 mid-esophagus 4 chamber view를 확인한 후 초음파 프로브를 반시계방향(counter-clock wise)로 90도 회전시켜 하행흉부대동맥을 short-axis view로 확인하였다. 동시에 color flow doppler 모드를 작동시켜 하행흉부대동맥과 그 주변의 혈류를 확인하였다. 프로브를 천천히 후진시켰을 때 상부 하행흉부대동맥과 근위부 좌측 폐동맥 사이에 존재하는 혈류를 발견하였고, 동맥관개존(patent ductus arteriosus)으로 진단하였다 (Figs. 1 and 2). 이에 외과의는 상기 동맥관개존에 대해 수술적 결찰을 시행하였고, 이후 큰 문제 없이 대동맥판막 치환술을 마쳤다. 심폐우회술 이탈 후 시행한 경식도 심장초음파에서 동맥관 개존 부위의 혈류는 보이지 않았고, 치환된 대동맥 판막이 정상적으로 작동하는 소견을 보였다. 수술을 마친 후 환자는 기관 삽관을 유지한 채로 활력징후 감시 하에 중환자실로 이송되었다. 총 마취 시간은 7시간 55분, 총 수술시간은 6시간 55분이었으며, 투여된 수액은 정질액 2,400 ml, 농축 적혈구 1단위, 신선동결혈장 3단위, 혈소판농축액 6단위이었고, 추정 실혈량은 1,500 ml 이었으며, 소변량은 2,415 ml 이었다. 환자는 수술 후 1일째에 성공적으로 기관내관 발관 되었으며 폐동맥 카테터가 제거되었다. 그 후 5일간 간헐적 3도 방실 차단 및 빈맥 소견으로 중환자실에서 관찰하였다. 수술 후 6일째 시행한 경흉부 심장초음파에서 인공 대동맥판막의 기능은 양호 하였으며, 영상에 제한이 있어 동맥관 개존증 결찰 부위의 관찰은 어려웠다. 환자는 수술 6일 후 일반병동으로 이송되었고, 수술 후 11일 째 별다른 합병증 없이 퇴원하였으며, 흉부외과 외래 추적관찰 하기로 하였다.
Go to : 
동맥관 개존증은 흔한 선천성 심기형으로 주로 신생아 시기에 진단된다. 이른 시기의 동맥관 개존증의 진단은 동맥관 개존증의 치료 및 예후에 중요하며, 소아에서 수술적 결찰술 후 정상 심장 기능을 회복할 수 있다. 또한 증상이 없는 동맥관 개존증도 치료를 하는 것을 추천하고 있으며, 이는 청소년기나 성인에서의 동맥관 개존증에도 해당이 된다[1]. 소아 환자에서는 경흉부 심장초음파를 이용하여 동맥관 개존증을 영상으로 확인하고 color flow doppler 모드를 통해 동맥관의 혈류를 확인하여 진단할 수 있다[2]. 하지만 성인 환자에서는 경흉부 심장초음파를 이용한 진단의 경우 피하지방과 폐조직 및 갈비뼈의 방해를 받아 초음파 시야가 좋지 않기 때문에 진단이 어려울 수 있으며 소아에서만큼 유용한 진단 방법이 아니다[3,4].
성인 환자의 청진 시 흉골 좌상방에서 지속적인 심잡음이 들리면 동맥관 개존증을 의심해볼 수 있다. 크기가 큰 동맥관 개존증이 있는 환자에서는 흉부 X-ray에서 심비대 소견을 관찰할 수 있으며, 심전도 검사에서 좌심실의 이완기말 고혈압에 의한 심내막하 허혈을 반영하는 ST-T파 변형이 보일 수 있다. 그리고 혈압측정에서 낮은 이완기 혈압을 관찰할 수 있다[1]. 하지만 위 소견들은 비 특이적이며 크기가 작은 동맥관 개존증의 경우 증상이 없는 경우가 많고, 단순흉부검사와 심전도 검사에서 정상 소견을 보일 수 있다[5]. 그러므로 신체 검진과 단순흉부검사 및 심전도 검사는 동맥관 개존증을 진단하는데 민감도와 특이도가 높지 않다. 본 증례에서는 수술 전 시행한 신체검진 상에서 특이소견은 없었으며, 수술 전 측정한 혈압은 정상이었고, 단순흉부검사에서도 특이소견이 없었다. 수술 전 시행한 심전도 검사에서 좌심실 비대와 QRS widening을 보였으나, 비특이적인 소견으로 동맥관 개존증을 의심하기 어려웠다. 또한 수술 전 시행한 흉부 컴퓨터 단층촬영에서도 이첨 대동맥 판막과 상행 대동맥류 외에 다른 소견은 관찰되지 않았다. 컴퓨터 단층촬영 단면 간격이 3 mm 였으나 동맥관 개존증을 의심할 구조물은 관찰되지 않았다.
경식도 심장초음파는 심장 수술 중에 국소적, 전반적 심실 기능 장애, 심실 크기, 판막 구조, 심장내 공기의 발견에 유용하며, color flow doppler 모드를 이용하여 심장의 혈류를 파악할 수 있다. 또한 경식도 심장 초음파는 경흉부 심초음파 영상에서 제한이 있는 심장의 후방 구조물에 대한 평가에 유용하며, 보다 선명한 영상을 얻을 수 있는 장점이 있다. 이전 연구에 따르면 동맥관 개존증을 진단받은 40명의 성인 환자에서 경식도 심장초음파는 97%의 진단 민감도를 보인 반면, 경흉부 심장초음파는 42%의 민감도를 보였다[6]. 2003년도 American College of Cardiol±Cardiology/American Heart Association (ACC/AHA) 가이드 라인에서 이전 가이드 라인에서 없었던 수술 중 경식도 심장초음파가 수술 후 임상 결과를 향상시키는 유용성을 인정받아 새롭게 소개되었다[7]. 또한 2010년 미국 마취과 학회의 가이드라인에서는 성인 환자의 심장 수술 시 부적응증이 없다면 반드시 경식도 초음파를 사용할 것을 권고하였다[8]. 경식도 초음파를 시행하는 목적은 1) 수술 전 진단을 확인하고, 2) 새로운 병변을 발견하며, 3) 이에 따라 적절한 수술과 마취 계획을 수립하고, 4) 수술적 처치 결과를 평가하는 것이다[8]. 본 증례에서는 대동맥판막 치환술 계획하에 심폐우회술이 계획된 환자에서 대동맥판막 병변을 확인하고, 판막치환술 후 인공 대동맥판막의 기능평가를 위해 경식도 심장초음파를 거치하였으나, 이를 통하여 수술 전 발견되지 않았던 새로운 병변인 동맥관 개존증을 발견하게 되어 이를 결찰하는 수술이 추가되었다.
경식도 심장초음파가 경흉부 심장초음파에 비해 심장의 후방 구조물 평가에 유용하지만, 신체내부에서 기관지와 폐조직과 같이 음향 저항(Acoustic impedance)이 낮은 조직에 인접해 있는 구조물의 경우 관찰하기 어렵다는 것은 초음파기기의 피할 수 없는 단점이다. 동맥관개존의 경우 좌측 기관지와 인접해 있는 경우가 많기 때문에 구조를 관찰하기 위해서는 숙련된 마취과 의사의 초음파 프로브 조작이 필요하다[5]. 과거로부터 좌측 기관지가 초음파 영상에 방해되는 것을 줄이기 위해 좌측 기관지 내부에 식염수로 채워진 풍선을 넣어 음향 저항을 높이는 방법이 알려져 있으며, 최근 보고에서는 좌측 폐동맥과 동맥관개존을 모두 관찰할 수 있도록 프로브를 전굴(anteflextion), 우회전(rightward rotation) 시키는 방법도 소개되었다[9]. 본 증례에서 저자들은 short-axis view로 하행흉부대동맥을 확인한 후 프로브를 천천히 빼내면서 color flow doppler 모드를 이용하여 하행흉부대동맥과 그 주변의 혈류를 면밀히 확인한 결과, 상부 하행흉부대동맥과 근위부 좌측 폐동맥 사이의 이상 혈류를 관찰할 수 있었고, 이를 동맥관개존으로 진단하였다. 심폐우회술이 시행되고 있는 상황에서는 심장 및 주위 구조물을 구분하기 어려우므로, 심폐우회술 중에도 해부학적 구조를 유지하는 하행흉부대동맥을 먼저 확인하고, 이를 기준으로 하여 다른 구조물을 확인할 수 있었다.
심폐우회술 중 저체온 심정지 용액을 사용한 심정지는 수술 중 심근의 손상을 막기 위한 것이다. 또한 좌심실에 벤트를 삽입하는 것은 심폐 우회술 중 좌심실의 과도한 팽창을 막고, 그로 인한 좌심실의 산소 소모량 증가를 막아 심근을 보호하는 역할을 위함이다[10]. 본 증례에서 좌심실 벤트를 통해 배액되는 혈액양이 비정상적으로 많음을 확인하였으며, 경식도 심장초음파를 통해 동맥관 개존증을 진단하여 조치를 취하기 전까지 좌심실 벤트를 통해 혈액을 배액하는 것 외에는 좌심실 팽창을 막을 방법이 없었다. 동맥관 개존에 의해 상부 하행흉부대동맥과 근위부 좌측 폐동맥 사이에 연결이 있었고, 폐로 인공심폐기를 거친 혈액이 순환하게 되어 좌심실 벤트로 배액되는 혈액양이 비정상적으로 많음이 감지된 것이다. 좌심실이 과도하게 팽창될 정도로 동맥관의 혈류가 많았거나, 경식도 심장초음파를 통해 그 원인을 찾지 못하였으면 심근 손상으로 인하여 예후에 부정적인 영향을 미쳤을 가능성이 있다.
결론적으로 본 증례를 통하여 경식도 심장 초음파는 수술 전 평가에서 발견하지 못한 심장의 구조적, 기능적 이상을 진단할 수 있는 도구로서의 유용함을 알 수 있었다. 또한 심폐우회술 도중 발생하는 이상 징후에 대해 좀 더 주의를 기울여 빠르게 대처할 수 있도록 최선의 노력을 기울여야 할 것이며, 이 때 경식도 심장 초음파는 심폐우회술 시에 발생할 수 있는 문제를 해결하는 구조자(rescue)의 역할을 할 수 있을 것이다.
Go to : 
REFERENCES
1. McGrath RL, McGuinness GA, Way GL, Wolfe RR, Nora JJ, Simmons MA. The silent ductus arteriosus. J Pediatr. 1978; 93:110–3. DOI: 10.1016/S0022-3476(78)80617-9.

2. Allen HD, Goldberg SJ, Valdes-Cruz LM, Sahn DJ. Use of echocardiography in newborns with patent ductus arteriosus: a review. Pediatr Cardiol. 1982; 3:65–70. DOI: 10.1007/BF02082335. PMID: 7155942.

3. Houston AB, Gnanapragasam JP, Lim MK, Doig WB, Coleman EN. Doppler ultrasound and the silent ductus arteriosus. Heart. 1991; 65:97–9. DOI: 10.1136/hrt.65.2.97.

4. Marelli AJ, Child JS, Perloff JK. Transesophageal echocardiography in congenital heart disease in the adult. Cardiol Clin. 1993; 11:505–20. PMID: 8402777.

5. Chugh R, Salem MM. Echocardiography for patent ductus arteriosus including closure in adults. Echocardiography. 2015; 32(Suppl 2):S125–39. DOI: 10.1111/echo.12457. PMID: 24888537.

6. Shyu KG, Lai LP, Lin SC, Chang H, Chen JJ. Diagnostic accuracy of transesophageal echocardiography for detecting patent ductus arteriosus in adolescents and adults. Chest. 1995; 108:1201–5. DOI: 10.1378/chest.108.5.1201. PMID: 7587417.

7. Cheitlin MD, Armstrong WF, Aurigemma GP, Beller GA, Bierman FZ, Davis JL, et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). J Am Coll Cardiol. 2003; 42:954–70. DOI: 10.1016/S0735-1097(03)01065-9.
8. American Society of Anesthesiologists and Society of Cardiovascular Anesthesiologists Task Force on Transesophageal Echocardiography. Practice guidelines for perioperative transesophageal echocardiography. An updated report by the American Society of Anesthesiologists and the Society of Cardiovascular Anesthesiologists Task Force on Transesophageal Echocardiography. Anesthesiology. 2010; 112:1084–96. PMID: 20418689.
9. Gogia R, Kumar B, Jayant A. A proposed method to visualize the ductus arteriosus on transesophageal echocardiography. Ann Card Anaesth. 2014; 17:296–8. DOI: 10.4103/0971-9784.142068. PMID: 25281628.

10. Kanter KR, Schaff HV, Gott VL, Gardner TJ. Reduced oxygen consumption with effective left ventricular venting during postischemic reperfusion. Circulation. 1982; 66:I50–4. PMID: 7083546.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download