This article has been
cited by other articles in ScienceCentral.
Abstract
Objectives
This study aimed to evaluate the antibacterial activity of phytoncide on oral biofilm.
Methods
Antibacterial activity of phytoncide was examined on the bacteria Streptococcus mutans, Aggregatibacter actinomycetemcomitans, Enterococcus faecalis, Porphyromonas gingivalis, and oral biofilm. After mixing the phytoncide, S. mutans, A. actinomycetemcomitans, E. faecalis, and P. gingivalis with a culture alone turbid and mixed, and they were then incubated at 37°C under anaerobic conditions and cultured. Following incubation, a microplate reader was used to measure the absorbance and observe the amount of bacteria. In addition, non-polarized saliva containing bacteria was grown for 72 h under anaerobic conditions for the determination of biofilm biomass and bacterial numbers. Various concentrations of phytoncide were added to the saliva biofilm. Statistical significance tests were conducted using the Mann-Whitney test and SPSS 24.0.
Results
S. mutans, A. actinomycetemcomitans, E. faecalis, P. gingivalis, and antibacterial effects were shown as phytoncide concentrations increased in oral biofilm. Observing the growth of bacteria using phase difference microscopes showed that the number of bacteria decreases as the phytoncide concentration increased. Also, the formation of biofilm in the saliva decreased compared to the control group.
Conclusions
Based on the experimental results of phytoncide on oral biofilms causing oral cavity formation in the saliva decreased compared to that in the control group. Phytoncide showed antibiosis against oral biofilms when it remained inside the mouth for above certain concentrations. Accordingly, using phytoncide as a clinical method for preventing oral disease is deemed to be effective.
Go to :

Keywords: Aggregatibacter actinomycetemcomitans, Enterococcus faecalis, Oral biofilm, Phytoncide, Porphyromonas gingivalis, Streptococcus mutans
서 론
구강 세균은 구강질환 발생에 중요한 역할을 하며, 구강질환과 세균에 관한 많은 연구가 이루어지고 있다
1). 구강 내 세균들은 치아우식증 및 치주질환의 중요한 원인이며, 구강질환을 예방하거나 진행을 억제하기 위해서는 세균의 활성을 억제하는 것이 필수적이다. 특히 구강질환은 부유성 세균(planktonic bacteria)보다는 바이오필름 형태로 존재하는 세균으로 인해 발생한다
2). 구강 내 바이오필름은 초기에는 그람양성 세균의 부착으로 형성되고, 차츰 구강환경의 변화로 그람양성 세균이 그람음성 세균과 응집하여 성숙한 바이오필름 형태로 변화하게 된다
3). 최근 분자생물학적 방법을 이용한 연구를 통해 바이오필름 내의 다양한 세균 간의 상호작용으로 구강질환이 발생한다고 보고되고 있다
4).
타액에 존재하는 세균은 구중청량제 등을 이용하여 구강 내 세균의 활성을 억제하여 구강질환을 예방할 수 있다. 그러나 구강 내 세균을 억제하기 위하여 사용되는 제재는 주로 화학성분이며, 이는 인체에 위해작용과 내성균 출현과 같은 부작용으로 사용이 어려운 경우가 대부분이다. 강력한 화학제재는 병원균에 대한 항균 효과뿐만 아니라 구강 내 정상 세균총에 대한 위해작용도 있어서 장기간의 사용이 어렵다. 따라서 화학성분을 이용한 구중청량제는 구강 환경의 항상성을 저해하지 않아야 하며, 이는 구강 내 상주균에 대한 고려도 있어야 한다. 이러한 이유로 합성 화학성분보다는 천연 추출물을 이용한 구중청량제 개발이 최근에 대두되고 있다
5,6).
피톤치드(phytoncide)는 식물성 방향성 물질로서 휘발성 성분인 테르펜류가 주성분이며, 이 휘발성 성분들은 식물 종류에 따라 수십 종에서 많은 것들은 200여 종에 달하며 이외에도 알칼로이드, 페닐프로판, 아세토제닌, 페놀계 등의 유기화합물로 구성되어 있다
7). 피톤치드의 양은 수종에 따라 차이가 있고, 잡목이나 활엽수보다는 소나무, 잣나무, 편백나무와 같은 침엽수에서 훨씬 많이 존재하며 수증기를 증류하거나 압축하여 얻는 추출액인 정유는 일상생활에서 주로 사용된다
8). 다수 연구를 통해 다양한 식물에서 추출된 피톤치드는 미생물에 대한 광범위한 항균 효과가 있는 것으로 보고되고 있다
9,10).
본 연구의 목적은 구강 내 세균성 질병에 대한 피톤치드의 효과를 알아보기 위해 기존에 구강질환 병원균에 대한 항균력 실험과 함께 타액 바이오필름 내 구강질환 병원균에 대한 피톤치드의 항균 효과를 조사해보고자 하였다.
Go to :

연구대상 및 방법
1. 세균 및 세균배양
실험에 사용된 세균은 Streptococcus mutans ACTC 25175, Aggregatibacter actinomycetemcomitans ACTC 43718, Enterococcus faecalis ACTC 29212, Porphyromonas gingivalis ACTC 3327로 American Collection for Type Culture에서 구입하였다. S. mutans, A. actinomycetemcomitans 및 E. faecalis는 37℃ 혐기성조건 (5% H2, 10% CO2 및 85% N2)에서 Brain heart infusion (BD Bioscience, Franklin Lakes, NJ, USA. BHI) 배지로 배양하였다. P. gingivalis는 37℃ 혐기성 조건에서 헤민 (hemin, 5 μg/ml)과 비타민 K (vitamin K, 0.2 μg/ml)이 포함된 BHI 배지를 이용하여 배양하였다.
2. 구강 세균에 대한 민감도 시험
실험에 사용된 피톤치드는 편백나무(Chamaecyparis obtusa)에서 추출한 정유로서 (주)편백치드에서 구입하였다. 피톤치드의 항균 활성은 Clinical Laboratory Standard Institute (CLSI)의 방법에 따라 평가되었다
11). 피톤치드는 dimethyl sulfoxide (DMSO) (Sigma-aldrich Co., USA)를 이용하여 희석하였다. BHI 배지 또는 헤민과 비타민 K (180 μl)를 포함하고 있는 BHI 배지는 96-well plate (SPL Lifescience, Gyeonggi, Korea)에 각 well에 분주하였다. 준비된 피톤치드 용액 (180 μl)은 96-well plate의 각 well에 분주하고 남은 11개의 well에도 2배 연속 희석법을 이용하여 희석하였다. 배양된 세균은 bacterial counting chamber (Marienfeld, Lauda-Konigshofen, Germany)로 세균수를 측정하였고, 새로운 BHI 배지에 1×10
7 cells/ml로 조정하였다. 세균 현탁액 (20 μl)은 피톤치드 포함된 96-well plate에 각 well에 접종하고, 37℃ 혐기성 조건에서 배양하였다. 배양 후 microplate reader (BioTek, Winooski, VT, USA)를 이용하여 600 nm 파장에서 흡광도를 측정하고 세균의 양을 관찰하였다.
3. 타액 바이오필름 형성
10명의 건강한 성인에서 타액을 모아 2% sucrose 포함된 BHI 배지에 1분 동안 vortex mixer (GENIE Ⅱ; Scientific Industries. USA)로 혼합하였다. 타액에 있는 부유물을 제거하기 위해 2000 × g에서 10분간 원심분리하였고, 상층액은 새로운 튜브로 옮겼다. 세균 상충액을 8-well glass chamber (BD Bioscience, San Jose, CA, USA)에 넣고 바이오필름 생성량을 분석하고, 12-well polystyrene plate (SPL Lifescience)에 넣고 세균의 수를 측정하였다. chamber와 plate를 37℃ 염기 상태에서 배지를 매일 교환하며 72시간 배양하였다.
4. 피톤치드의 타액 바이오필름 형성 억제효과
타액 바이오필름에 대한 피톤치드의 효과를 관찰하기 위해 타액 바이오필름에 다양한 농도의 피톤치드를 첨가하였다. 8-well glass chamber에서 바이오필름은 인산완충용액(phosphate buffered saline, PBS, pH 7.4)을 이용하여 3번 세척하였고 제조사의 프로토콜에 따라 bacterial live/dead staining kit (Invitrogen, USA)로 염색 이용하여 염색하였다. 바이오필름은 0-60 μm의 Z-stack scans을 사용하는 공초점 레이저 주사현미경(confocal laser scanning microscope, LSM 700; Carl-zeiss, Oberkochen, Germany)을 이용하여 분석하였다. 바이오필름의 이미지는 Carl-Zeiss의 ZEN program에 의해 분석되었다. 12-well plate에서 바이오필름은 인산완충용액를 이용하여 3번 세척하고 BHI 배지 1 ml를 첨가하였다. 바이오필름은 Scraper (Corning Co., USA)를 이용하여 기계적으로 분쇄되었고 1.5 ml 튜브로 옮겼다. 튜브는 vortex를 사용하여 1분 동안 혼합하였고, 세균현탁액은 새로운 BHI 배지로 10에서 106으로 연속 희석하였다. 각각 희석된 세균현탁액의 50 ml는 BHI Agar plate에 접종되었다. Agar plate는 37℃ 혐기성조건에서 72시간 동안 배양되었고, 세균 집락 수를 측정하였다.
또한, 12-well plate에서의 바이오필름은 인산완충용액으로 세척한 후 1% 크리스탈 바이올렛 염료로 염색하였다. 비결합 크리스탈 바이올렛을 제거하기 위해 염색된 바이오필름은 인산완충용액로 3회 세척하였고, 90% 에틸알콜 1 ml을 첨가하여 바이오필름을 탈색하였다. 방출된 크리스탈 바이올렛 (200 μl)을 96-well plate로 옮기고 microplate reader (Biotek)로 590 nm 파장에서 광학 밀도를 측정하였다.
5. 통계학적 유의성 검사
대조군과 실험군의 통계학적 유의성 검사는 SPSS 23.0 (IBM, Armonk, NY, USA)을 사용하고 Mann-whitney test를 이용하여 검증하였다. P 수치는 0.05 미만일 때 통계학적 유의성이 있다고 고려되었다.
Go to :

연구 성적
1. S. mutans에 대한 피톤치드의 항균력 평가
S. mutans에 대한 피톤치드의 항균 활성을 알아보기 위해, 항균활성도 검사를 시행한 결과 일정 농도(0.36%) 이상에서 항균력을 보였다(
P<0.05) (
Fig. 1).
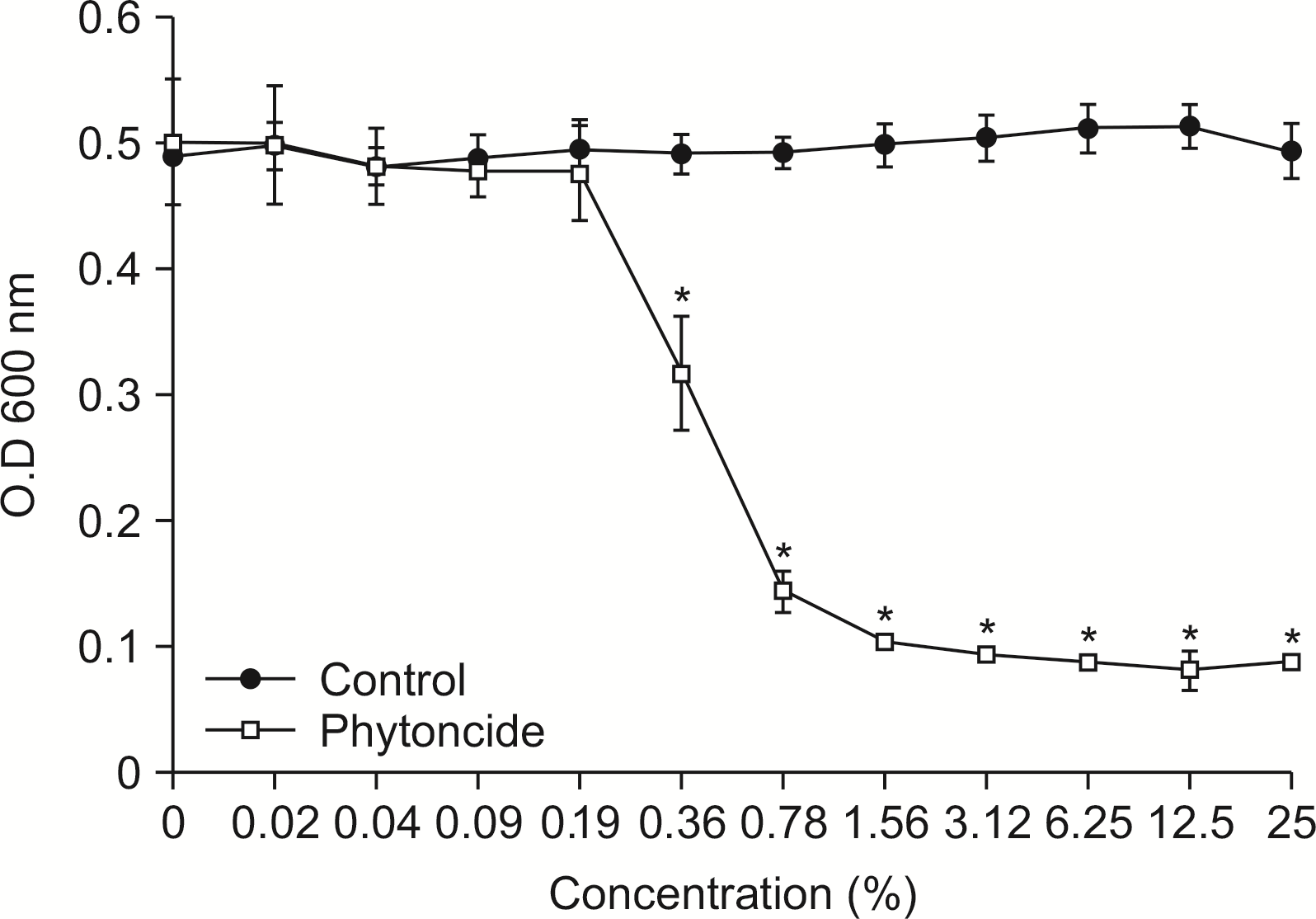 | Fig. 1Susceptibility assay of S. mutans for phytoncide. S. mutans was cultivated with or without phytoncide in the various concentration. The growth of S. mutans was measured by spectrophotometer at 600 nm of wavelength. *Statistically significant compared to control group (P<0.05). 
|
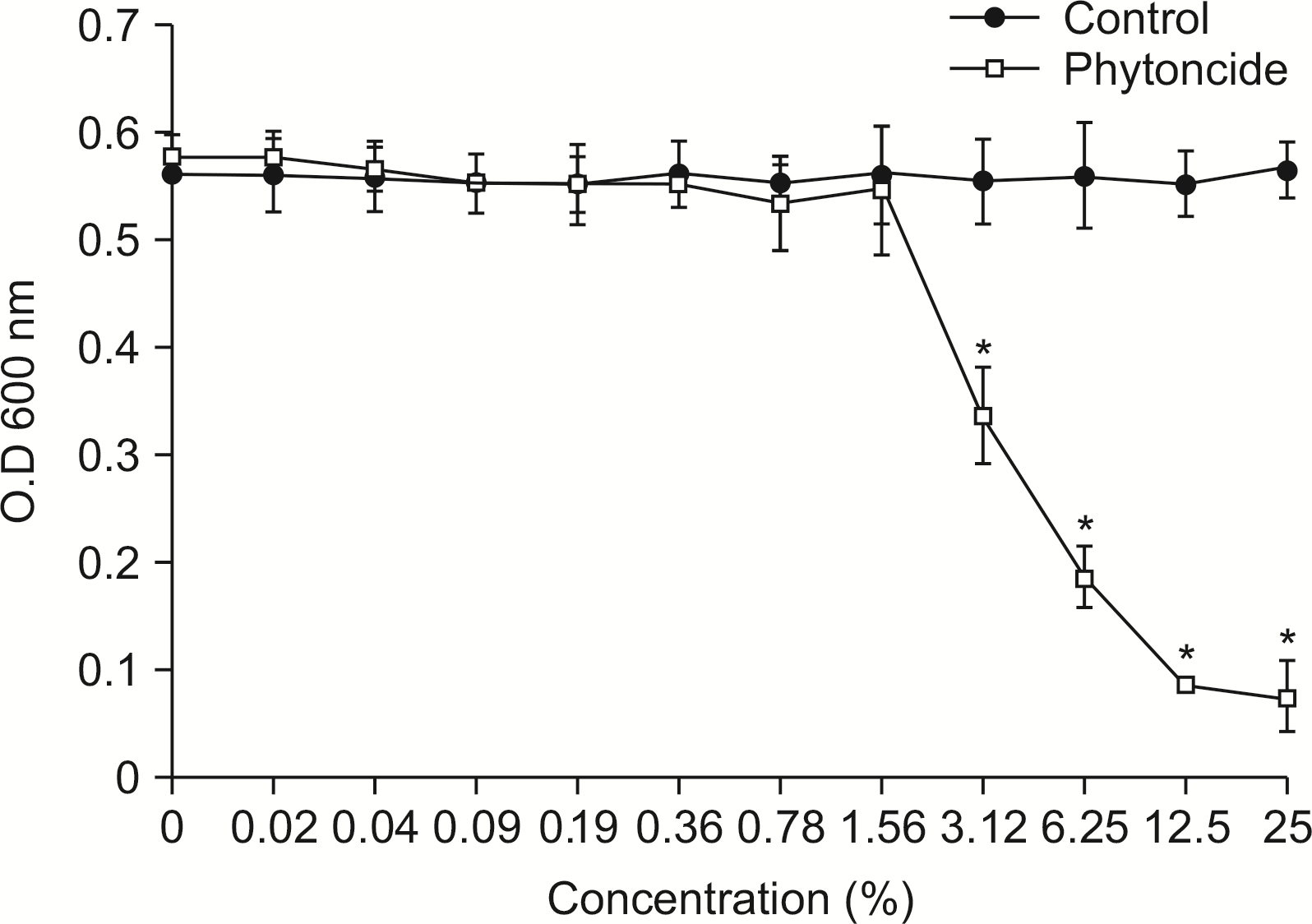
2. A. actinomycetemcomitans에 대한 피톤치드의 항균력 평가
A. actinomycetemcomitans는 대조군에 비해 피톤치드와 혼합 배양한 결과, 일정 농도(0.09%) 이상에서
A. actinomycetemcomitans에 대해 항균력을 보였다(
P<0.05) (
Fig. 2).
 | Fig. 2Susceptibility assay of A. actinomycetemcomitans for phytoncide. A. actinomycetemcomitans was cultivated with or without phytoncide in the various concentration. The growth of A. actinomycetemcomitans was measured by spectrophotometer at 600 nm of wavelength. *Statistically significant compared to control group (P< 0.05). 
|
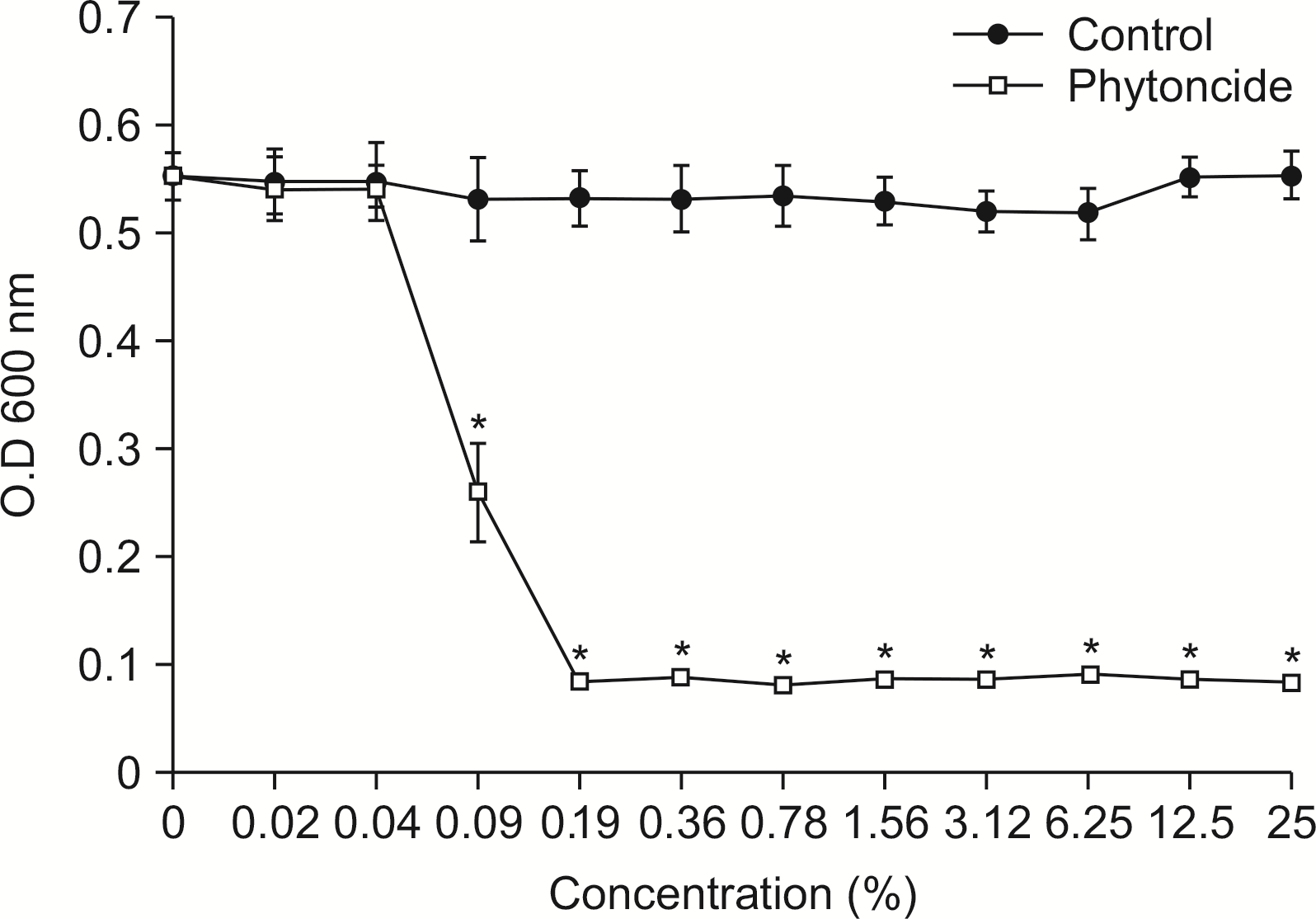
3. P. gingivalis에 대한 피톤치드의 항균력 평가
P. gingivalis에 항균력 평가는
Fig. 3과 같이 나타났다.
 | Fig. 3Susceptibility assay of P. gingivalis for phytoncide. P. gingivalis was cultivated with or without phytoncide in the various concentration. The growth of P. gingivalis was measured by spectrophotometer at 600 nm of wavelength. *Statistically significant compared to control group (P<0.05). 
|
P. gingivalis에 대한 항균력은 피톤치드의 농도(0.02%) 이상에서 나타냈다(P<0.05).
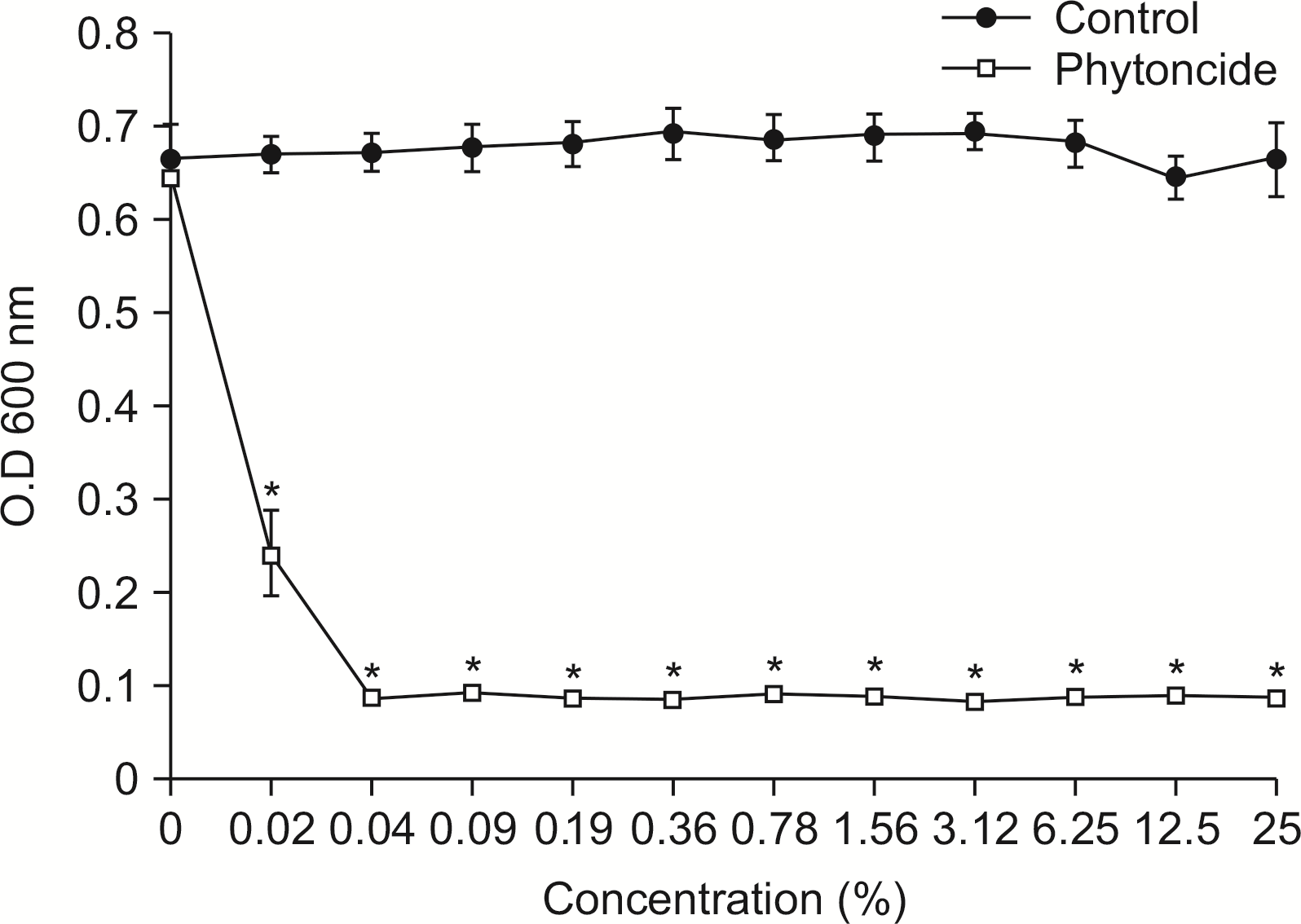
4. E. faecalis에 대한 피톤치드의 항균력 평가
E. feacalis에 피톤치드의 항균력 평가는
Fig. 4와 같이 나타났다.
 | Fig. 4Susceptibility assay of E. faecalis for phytoncide. E. faecalis was cultivated with or without phytoncide in the various concentration. The growth of E. faecalis was measured by spectrophotometer at 600 nm of wavelength. *Statistically significant compared to control group (P<0.05). 
|
E. feacalis에 대한 피톤치드의 항균력은 피톤치드의 농도(3.12%) 이상에서 나타났다(P<0.05).
5. 피톤치드의 타액 바이오필름 형성 억제효과
타액 바이오필름에 대한 피톤치드의 억제 효과를 알아보기 위해, 다양한 농도의 피톤치드 적용 후 시간에 따라 타액 바이오필름의 광학 밀도를 측정한 결과는
Fig. 5와 같이 나타났다. 피톤치드의 농도가 증가함에 따라 바이오필름의 형성 정도는 대조군에 비해 유의하게 감소하였다. 또한 1분 적용에 비해 10분 적용이 바이오필름의 형성을 통계적으로 유의하게 감소하였다(
P<0.05).
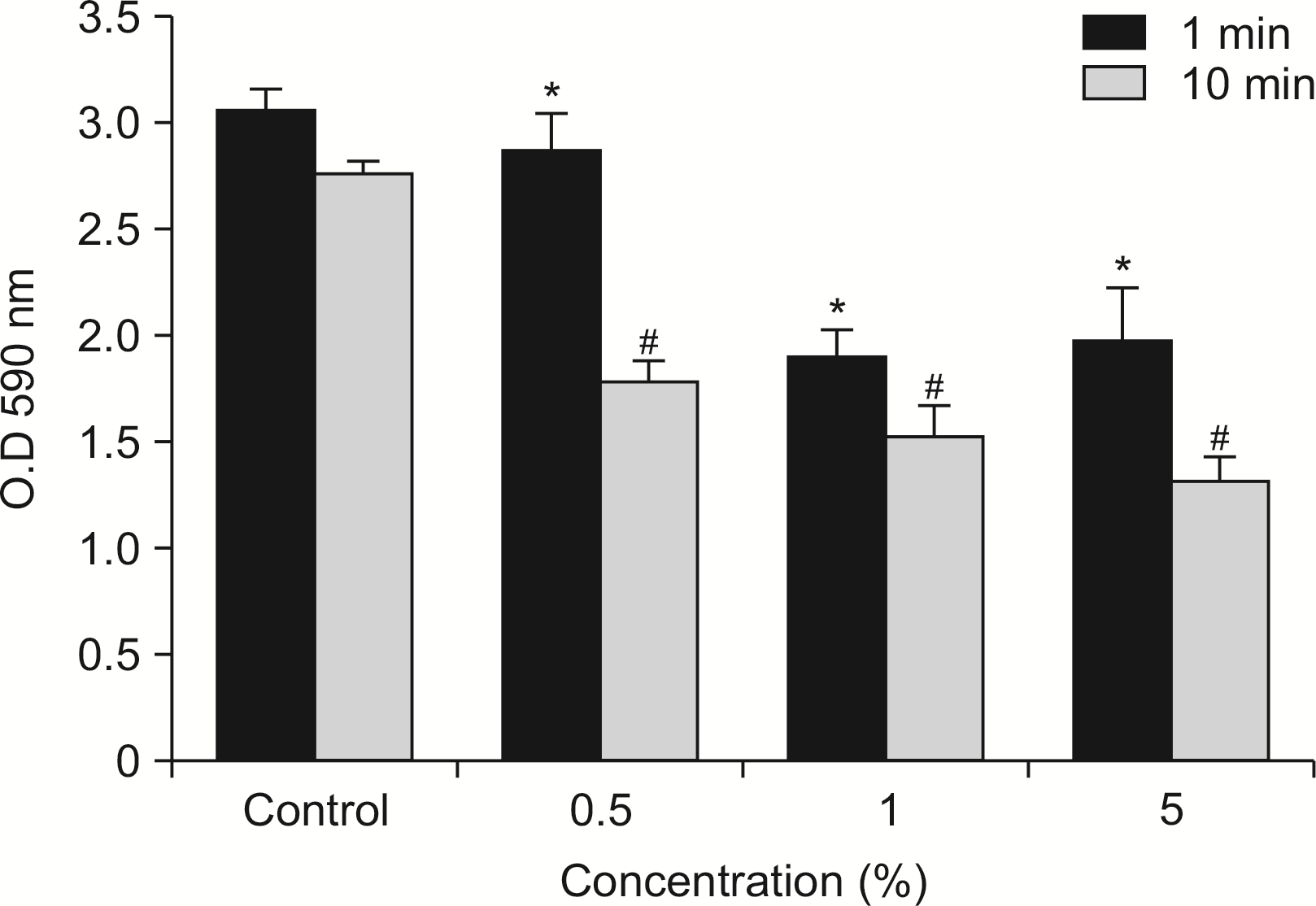 | Fig. 5Disturbing effect of phytoncide on salivary biofilm. Salivary biofilm was formed with various concentration phytoncide for 72 h at 37℃. The biofilm in the 12-well plate was stained 1% crystal violet after washing with PBS. The released crystal violet solution (200 μl) was transferred into 96-well plate and measured optical density at 590 nm wavelength by microplate reader. *Statistically significant compared to 1 min control group (P<0.05). #Statistically significant compared to 10 min control group (P<0.05). 
|
타액 바이오필름은 1% 크리스탈 바이올렛을 이용하여 염색 후의 결과는
Fig. 6과 나타났다. 피톤치드를 처리한 그룹은 대조군에 비해 바이오필름 형성이 줄었으며, 피톤치드의 농도가 증가할수록 바이오필름의 형성이 줄어들었다. 또한 피톤치드 10분 적용이 1분 적용에 비해 바이오필름의 형성이 줄었다.
 | Fig. 6Disturbing of phytoncide on salivary biofilm. Salivary biofilm in the 12-well plate was stained 1% crystal violet after washing with PBS. The stained biofilm was washed three times with PBS to remove non-binding crystal violet and added 1 ml of 90% ethyl alcohol to destain biofilm. The released crystal violet solution (200 μl) was transferred into 96-well plate. 
|
6. 피톤치드의 항바이오필름 활성도 평가
타액 바이오필름에 대한 피톤치드의 항바이오필름의 능력은
Fig. 7과 같이 나타났다. 피톤치드의 농도가 증가함에 따라 대조군과 대비하여 바이오필름의 형성을 통계적으로 유의하게 억제했다. 또한 적용 시간이 증가함에 따라 항바이오필름 활성도가 증가하였다.
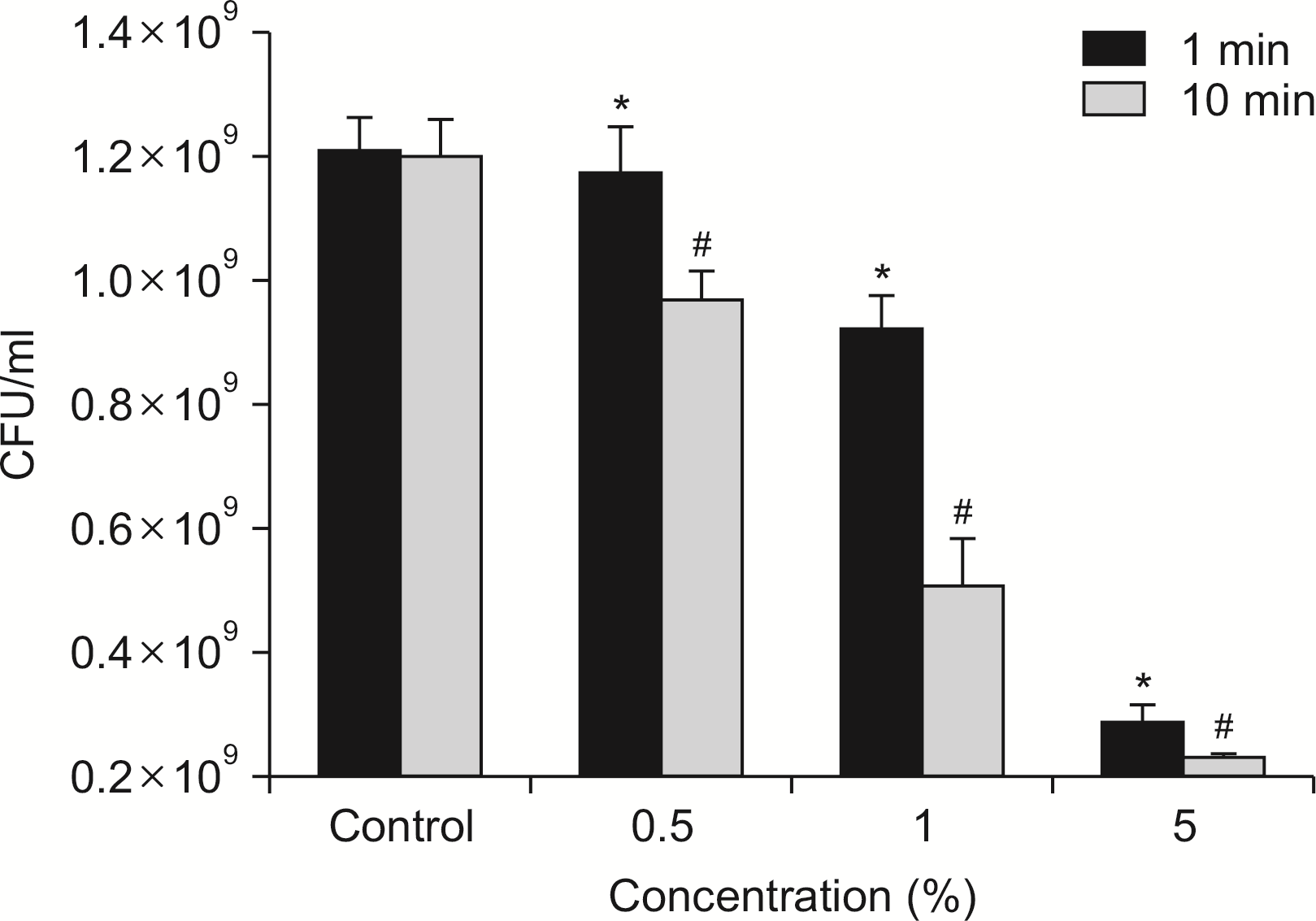 | Fig. 7Anti-biofilm activity of phytincide. The salivary biofilm was treated with phytoncide at the various concentration after removing media. In case of 12-well plate, the biofilm was washed three times with PBS and added 1 ml of BHI broth. The biofilm was mechanically disrupted with scraper and transferred into 1.5 ml tube. The tube was vortexed for 1 min, and the bacterial suspension was diluted 10 to 106 by new BHI broth. Fifty microliter of each diluted bacterial suspensions was inoculated on BHI agar plate. The agar plates were incubated at 37℃ for 72 h anaerobically, and the colonies were counted. *Statistically significant compared to 1 min control group (P<0.05). #Statistically significant compared to 10 min control group (P<0.05). 
|
Bacterial live/dead staining kit (Invitrogen, USA)로 염색 이용하여 바이오필름을 공초점 레이저 주사현미경를 이용하여 분석한 결과는
Fig. 8과 같이 나타났다. 바이오필름 내 존재하는 살아있는 세균은 초록색, 붉은색은 죽은 세균을 나타내며, 측면부는 바이오필름의 양을 나타낸다. 피톤치드의 농도가 증가됨에 따라 바이오필름의 양이 줄어들었으며, 살아있는 세균에 비해 죽은 세균의 양이 증가되는 양상을 보였다. 또한 적용 시간이 증가함에 따라 농도가 증가되는 양상과 비슷한 결과를 보였다.
 | Fig. 8Anti-biofilm activity of phytoncide by confocal laser microscope image. Salivary biofilm was treated with phytoncide for 1 min or 10 min after the formation of the biofilm. After washing with PBS, the biofilm was stained with live/dead staining kit and observed confocal laser scanning microscope. Green and red color indicated live and dead bacteria, respectively. 
|
Go to :

고 안
사람의 구강 내에는 수많은 미생물이 존재하며, 대부분은 병원성 세균 및 구강 상주균 등에 의한 구강질환 및 전신질환과 관련이 있다
12). 이러한 구강 내 미생물 중에 특정 세균이 증식하면 구강 내 질환이 발생하며, 대표적으로 치아우식증과 치주질환, 치수 및 치근단 감염 또는 악골 감염 등의 질환이다
13). 최근 바이오필름과 관련하여 치아우식증이나 치주질환 예방을 위한 천연물에 관한 관심이 고조되고 있으며, 항생제에 대한 내성이 증가함으로써 항생제를 대체할 수 있는 천연 항균물질인 피톤치드에 대해 많은 관심을 증가되고 있다
14).
피톤치드는 항균물질 또는 식물성 살균물질로 알려져 있으며, 미생물 등의 외부 공격으로부터 수목 자신을 보호하는 역할을 한다
15). 편백나무 줄기에서 많이 발견되는 송진은 편백 피톤치드 테르펜이 주성분이다. 편백 피톤치드에 감수성을 가진 세균으로는 그람양성 세균인
Staphylococcus epidermidis, 그람음성 세균인
Vibrio parahaemolyticus,
Pseudomonas aeruginosa,
Pseudomonas putida, 효모형 곰팡이인
Candida albicans, 사상형 곰팡이인
Aspergillus nidulas,
Alternaria mali,
Fusarium oxysporum 등이 알려져 있다
16). 박 등은 편백정유는 피부 사상균인
Microsprum canis와
Trichophyton mentagrophytes의 균사 생장을 저해하고 항진균 효과를 가지고 있다고 하였다
17). 김 등은
P. gingivalis에 대한 피톤치드의 항균 효과를 관찰한 결과,
P. gingivalis는 편백 피톤치드의 농도가 0.008%만 존재해도 성장이 억제되었고 0.01% 농도에서는
P. gingivalis를 완전히 사멸하였다고 보고하였다
18).
또한 Takarada 등은 BHI 한천 배지에 도말하여 생균수를 측정한 결과,
S. mutans와
Streptococcus sobrinus 모두 피톤치드에 사멸한 것으로 나타났으며, 피톤치드는 광범위한 미생물에 대해 항균 효과가 있는 것으로 보고하였다
19).
본 연구에서는 치주질환 유발 세균인 A. actinomycetemcomitans, P. gingivalis, 치아우식 유발 세균인 E. feacalis, S. mutans에 대한 항균실험과 타액 바이오필름에 대한 항바이오필름 활성정도를 평가하였다. 피톤치드는 구강 내 세균 4종에 대해 우수한 항균효과를 나타났다. 공초점 레이저 주사현미경을 이용하여 바이오필름 내의 세균의 생사와 바이오필름의 양을 관찰한 결과, 피톤치드의 농도가 증가할수록 살아있는 세균의 수가 감소하였다. 또한 타액 내 바이오필름의 형성은 대조군에 비해 감소하였다.
본 연구는 실험실 내에서 진행된 실험으로 한계점이 있으며, 추후 구강 질환에 대한 피톤치드의 효과에 대해 임상적 연구가 진행된다면 구강 내 질환의 예방 및 치료에 크게 이바지할 것으로 사료된다.
Go to :

결 론
타액 바이오필름에 대한 피톤치드의 항균 능력에 대한 실험적 연구를 통하여 다음과 같은 결론을 얻었다.
1. 피톤치드는 S. mutans에 대한 항균활성은 일정농도(0.36%) 이상에서 항균효과를 보였다(P<0.05).
2. 피톤치드는 A. actinomycetemcomitans에 대한 항균활성은 일정농도(0.09%) 이상에서 항균효과를 보였다(P<0.05).
3. 피톤치드는 P. gingivalis에 대한 항균활성은 일정농도(0.02%) 이상에서 항균효과를 보였다(P<0.05).
4. 피톤치드는 E. faecalis에 대한 항균활성은 일정농도(3.12%) 이상에서 항균효과를 보였다(P<0.05).
5. 피톤치드는 타액 바이오필름에 대해 농도와 적용시간이 증가할수록 항균효과를 보였다.
6. 피톤치드의 항 바이오필름의 능력은 농도와 적용시간이 증가할수록 증가되었다.
피톤치드는 구강 내 일정 농도 이상 적용시키면 구강 내 세균에 대해 항균성을 나타내었다. 또한 구강 내 바이오필름 형성을 줄이고 바이오필름 내 세균에 대해 항균성을 나타내었다. 피톤치드를 임상적으로 사용한다면 치아우식증과 치주질환의 구강질환을 감소시키는 데 도움을 줄 것으로 사료된다.
Go to :










 PDF
PDF Citation
Citation Print
Print






 XML Download
XML Download