초록
배경
전립선암은 전 세계적으로 암 사망의 주요 원인 가운데 하나이며, 전립선특이항원(prostate specific antigen, PSA)은 전립선암 선별검사, 진단 및 예후 예측에 유용하다. 저자들은 HISCL-5000 (Sysmex, Japan) 장비에서 PSA 검사의 분석능을 평가하고자 하였다.
방법
화학발광효소면역검사법에 기반한 HISCL-5000 장비의 분석능 및 PSA의 전립선암 및 전립선비대증 진단시 적용 가능성을 평가하였다. 분석능 평가를 위해 510검체가 수집되었으며, 정밀도, 직선성, 검출한계, 정확성, 장비 간 비교평가를 확인하였다. PSA의 전립선암 및 전립선비대증 진단능을 곡선하면적을 사용하여 분석하였다.
결과
저농도(3.81 ng/mL) 및 고농도(18.19 ng/mL)에서 PSA의 변이계수는 각각 5.46, 8.50%였다. 직선성은 0.002-189.900 ng/mL 구간에서 계산되었으며, 공시료 검출한계와 검출한계는 각각 0.007, 0.020 g/mL이었다. 기대값과 측정값의 바이어스는 -9.70%부터 11.16%까지의 범위였으며, 장비 간 비교평가에 의한 회귀 방정식은 y=-1.0605 + 0.9223x (R2=0.99)이었다. 전립선암 그룹을 양성 질환 그룹과 비교했을 때 전립선암과 전립선비대증의 곡선하면적은 각각 0.75, 0.52이었고 정상인과 비교했을 때는 전립선암과 전립선비대증의 곡선하면적은 0.97과 0.96이었다.
Abstract
Background
Prostate cancer (PCa) is the leading cause of cancer-related death worldwide. Prostate specific antigen (PSA) is a useful biomarker that can be screened for the diagnosis and prognosis of PCa. We evaluated the analytical performance of the PSA test using an HISCL-5000 immunoassay (Sysmex, Japan).
Methods
The analytical and clinical evaluation of PSA was performed using an HISCL-5000 chemiluminescent enzyme immunoassay. For analyzing the precision, linearity, trueness, limit of detection (LOD), limit of blank (LOB) and for comparing the method with UniCel DxI-800 ACCESS (Beckman Coulter, USA), 510 samples of PSA were collected. Clinical analyses were performed for benign prostate hyperplasia (BPH) and PCa. The area under the receiver operating characteristic curve (AUROC) was used for evaluating the diagnostic potential.
Results
The within-laboratory coefficient of variation (CV) for low- (3.81 ng/mL) and high- (18.19 ng/mL) level PSA was 5.46% and 8.50%, respectively. Linearity was verified from 0.002 to 189.900 ng/mL for PSA. LOB and LOD were 0.007 and 0.020 ng/mL, respectively. Bias between the expected true and measured values was -9.70-11.16%. The regression equation by method comparison was y=-1.0605+0.9223x (R2=0.99). AUROC values for diagnosis of PCa and BPH compared to non-malignant disease were 0.52 and 0.75, respectively. When compared to healthy subjects, AUROC values were 0.96 and 0.97, respectively.
전립선암(prostate cancer, PCa)은 전세계적으로 남성에서 두번째로 흔한 암이며 암환자 사망의 주요 원인 중 8번째이다[1]. 전립선암의 선별검사, 진단 및 예후 예측을 위해서 전립선특이항원(prostate specific antigen, PSA)을 종양 표지자로 사용하는데[2], PSA는 정액 액화를 위해 전립선에서 특이적으로 방출되는 세린 단백분해효소이며[3, 4] 전립선암뿐만 아니라 전립선 비대증(benign prostate hyperplasia, BPH)이나 전립선염(prostatitis)과 같은 양성 전립선 질환에서도 증가한다. 또한 비만군에서는 혈액 희석에 의해 PSA가 감소하고 일부 전립선암군에서는 혈청에서 검출되지 않는 것으로 보고되었다[5, 6].
PSA를 이용한 전립선암 선별검사는 유익성과 위해성에 대한 논란이 있지만[7], 유럽의 무작위 임상연구 및 기타 연구에서는 PSA 선별검사를 통해 전립선암 사망률이 크게 감소했다는 보고가 있으며[8-10], 일본에서도 PSA에 기반한 선별검사를 통해 PSA 수치가 높은 암 비율이 감소하고 전립선암의 예후 향상에 기여했다는 보고가 있다[11, 12]. 미국의 USPSTF (US Preventive Services Task Force)는 55세에서 69세의 남성에 대해서 C등급(최소한 중간 정도의 확신으로 전립선암 선별검사를 통한 이득이 적다고 보며, 전문적인 판단 및 개인의 선호도에 따라 권장함), 70세 이상에서는 D등급(전립선암 선별검사에 대해 중간에서 높은 정도의 확신으로 선별검사를 통한 이득이 없거나 오히려 손해가 클 것으로 보아 권장하지 않음)으로 보고하였다[13]. 한편, 전립선암 치료 후 모니터링에는 PSA가 유용하고 중요한 검사인 것으로 알려져 있으며[14] 특히, 수술 후 8주 이상이 경과한 시점에서 두 번 연속 측정한 PSA 수치가 0.2 ng/mL 이상인 경우 생화학적 재발을 의심할 수 있다[15]. 이와 같이 PSA 결과는 환자들의 임상적 상황에 대한 정보를 토대로 해석해야 하지만 PSA의 임상적 유용성 및 필요성은 크다는 것을 알 수 있다.
이에 본 연구에서는 새로이 개발된 HISCL-5000 장비(Sysmex, Kobe, Japan)의 PSA 전용 시약을 이용하여 PSA 검사의 분석능을 평가했다. 또한 PSA의 전립선암 및 전립선비대증 진단능을 수신기작동특성곡선하면적(area under the receiver operating characteristic curve, AUROC)을 사용하여 분석하였다.
본 연구는 가톨릭대학교 인천성모병원의 기관심의위원회의 승인을 받아서 진행되었으며(OC170ISE0020), 2017년 3월부터 2018년 2월까지 PSA 검사가 진행된 환자의 결과 및 각 환자의 혈청 510개를 수집하였다. 510개의 검체는 각각 건강검진을 시행한 사람 중 의무기록 상 확인된 정상인 검체 147개, 전립선암 환자 검체 79개, 전립선비대증 환자 검체 187개, 전립선염 환자 9명, 다른 악성 질환 12개, 그리고 다른 양성 질환(요로 감염 등) 검체 76개이며(Supplementary Table 1), 각 검체의 PSA 결과는 Beckman Coulter UniCel DxI 800 (Beckman Coulter, Miami, FL, USA) 장비로 측정된 것이다.
직선성은 저농도(0.002 ng/mL) 및 고농도(189.900 ng/mL) 환자 검체를 혼합하여 5단계 농도를 사용하여 측정했다: 저농도(L), 0.25*L+0.75*H (저농도와 고농도 1:3 혼합), 0.5*H+0.5*L (저농도와 고농도 1:1 혼합), 0.75*L+0.25H (저농도와 고농도 3:1 혼합), 고농도(H) [18]. 각 검체를 4회 측정하고 평균값과 기대값을 비교했으며 1차, 2차, 3차 다항식 회귀 분석을 수행했다. 허용 가능한 비직선성(non-linearity)은 PSA의 바이어스(bias) 기준인 18.70%로 하였으며[17], 제조사에서 제시한 PSA의 직선성의 범위는 0.003-200 ng/mL이다.
두 개의 공시료 검체(P1, P2) 및 4단계로 희석된 검체(P3-P6)가 사용되었다. 모든 검체는 6일 동안 10회 측정되었다[19]. P3-P6는 제조사에서 제공하는 희석액을 사용하였다. 제조사가 제시한 공시료 검출한계(limit of blank, LOB) 및 검출한계(limit of detection, LOD)는 각각 0.00037, 0.08000 ng/mL이며, LOB와 LOD는 95% 신뢰수준에서 다음과 같이 계산하였다:
LOB= μB + 1.645σB (μB, 공시료 검체의 평균, σB; 공시료 검체의 표준편차)
LOD=LOB + 1.645σs (σs; 최저 농도의 표준편차).
장비 간 비교를 위해 전립선암 환자 검체 79개, 전립선비대증 환자 검체 187개, 전립선염 환자 9명, 다른 악성 질환 환자 검체 12개, 그리고 다른 양성 질환(요로 감염 등) 환자 검체 76개를 사용했다. PSA 검체는 직선성 설정을 위해 사용되었다(0.003-200 ng/mL). HISCL-5000 장비 및 UniCel DxI 800 장비를 사용하여 비교하였으며, PSA는 0.01에서 541.56 ng/mL까지 측정되었고 UniCel DxI 800 장비의 변이계수 값은 2.16-3.85%였으며, 회귀분석을 통해 선형적합(linear fit)직선을 구하였다[21].
정상, 양성 질환, 악성 질환 그룹에서 각각 무작위로 57개의 검체를 선택하여[22] 각 그룹의 PSA 농도를 곡선하면적(AUROC) 분석으로 비교했다. 전립선암 및 전립선비대증에 대한 PSA의 진단 시 적용 가능성을 평가하였다.
분석능 계산에 R 소프트웨어, 버전 3.4.4(Free Software Foundation, Inc., Boston, MA, USA)가 사용되었으며, 메드칼크, 버전 18.2.1 (MedCalc Software, Mariakerke, Belgium)을 사용하여 장비 간 비교 및 곡선하면적을 계산했다. 곡선하면적 분석을 위해 표본 크기는 다음과 같은 가정을 기반으로 계산되었다: 제1종 오류, 0.05; 제2종 오류; 음성/양성 그룹의 검체 크기 비율이 1인 경우 57개의 대조군 및 질환 검체가 필요. 대조군 및 질환 검체는 무작위로 선택되었다[22]. 범주형 데이터에 대해 카이제곱검정(Chi-square test) 혹은 피셔정확검정(Fischer’s exact test)을 수행했다.
정밀 분석 결과 검사차례내, 검사차례간, 날짜간 및 검사실내변이계수 범위는 1.47-8.50%으로 확인되었다(Table 1). 분석된 모든 변이계수는 9.10% 이하로 이상적인 범위 내에 있었다. 직선성은 저농도와 고농도 정도관리 물질을 이용하여 확인하였다(Fig. 1). 기대값(x)과 측정값의 회귀 분석은 y=0.002+0.9999x (R2=0.99)였다. 바이어스 범위는 -9.70에서 11.16%까지였으며 생물학적 변이(18.70%) 내에 해당되었다. 공시료 검출한계 및 검출한계는 다음과 같이 각각 0.007 ng/mL, 0.020 ng/mL로 산출하였다. 정확성 평가에서 측정값은 기대값의 검증 간격 내에 있었고 바이어스 또한 허용 범위 안에 있었으며 가장 큰 바이어스(11.16%)는 최저 농도에서 확인되었다(Table 2). 장비 간 비교를 위해 질환군(363개)의 PSA 검체를 사용하였고, 상관계수는 0.99 (P<0.001), 회귀 방정식은 y= −1.0605 + 0.9223x (R2=0.99)이었는데 농도에 따른 계통오차는 없는 것으로 판단하였다(Fig. 2).
본 연구에서는 HISCL-5000 장비의 분석능을 평가하고 PSA의 전립선암 및 전립선비대증 진단능을 곡선하면적을 사용하여 분석했다. 총 변이계수는 1.47-8.50%로서, 비정밀도 기준인 9.10% 내에 있었으며[23] 이전 보고들과도 일치하였다[24, 25]. 직선성은 저농도(0.002 ng/mL)에서 고농도(189.900 ng/mL)까지 관찰하였고, 이는 제조사에서 제시한 직선성 구간 내에 포함되었다. 정확성 검증을 위한 기대값은 검증 간격 내에 있었다. 일치도 평가를 위해 383개의 비정상 PSA 검체가 사용되었으며, PSA의 상관계수는 이전의 연구와도 유사한 수준(0.99, P<0.001)으로 확인되었다[26]. 이와 같은 높은 수준의 검출 한계와 낮은 농도에서의 정밀도는 다른 보고의 결과와 비교해도 임상에서 필요로 하는 PSA 보고에 적합하다[27, 28].
전립선암 선별 검사에서 PSA의 임상적 유용성은 여전히 불분명하고 논란의 여지가 있으며[11], 본 연구의 결과에서도 확인된다. PSA는 기관 특이적인 것으로 알려져 있지만, 본 연구에서는 PSA가 전립선염, 요로 질환 등 양성 질환의 영향을 받는 것으로 확인되었다. 곡선하면적 분석에 의한 전립선암과 전립선비대증의 곡선하면적은 각각 0.75, 0.52였다. 정상인과 비교했을 때는 전립선암과 전립선비대증의 곡선하면적이 0.97과 0.96이었다. 실제 임상 환경에서는 전립선염, 요로 질환 등의 양성 질환자가 있을 수 있기 때문에 PSA의 전립선암 진단 유용성은 떨어질 수 있다.
본 연구의 한계점으로는 PSA의 임상적 검증이 완전히 평가되지 않았다는 것이다. 현재로서는 표준화된 치료를 받는 환자의 치료 효과 평가, 수술 혹은 항암 후의 전립선암 환자의 예후를 확인하는데 유용하다.
결론적으로, HISCL-5000 장비에 의한 PSA 측정은 신뢰할 수 있는 성능을 보였으며 결과값은 평가 기준 내에 있었다. PSA의 임상적인 적용은 신중하게 고려해야 하며 추가 연구가 필요할 것이다.
REFERENCES
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. 2018; Global cancer statistics 2018; GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68:394–424. DOI: 10.3322/caac.21492. PMID: 30207593.

2. Ilic D, Djulbegovic M, Jung JH, Hwang EC, Zhou Q, CLeves A, et al. 2018; Prostate cancer screening with prostate-specific antigen (PSA) test: a systematic review and meta-analysis. BMJ. 362:k3519. DOI: 10.1136/bmj.k3519. PMID: 30185521. PMCID: PMC6283370.

3. Lilja H, Ulmert D, Vickers AJ. 2008; Prostate-specific antigen and prostate cancer: prediction, detection and monitoring. Nat Rev Cancer. 8:268–78. DOI: 10.1038/nrc2351. PMID: 18337732.

4. Iremashvili V, Solosay MS, Rosenberg DL, Manoharan M. 2012; Clinical and demographic characteristics associated with prostate cancer progression in patients on active surveillance. J Urol. 187:1594–9. DOI: 10.1016/j.juro.2011.12.082. PMID: 22425088.

5. Bañez LL, Hamilton RJ, Partin AW, Vollmer RT, Sun L, Rodriguez C, et al. 2007; Obesity-related plasma hemodilution and PSA concentration among men with prostate cancer. JAMA. 298:2275–80. DOI: 10.1001/jama.298.19.2275. PMID: 18029831.

6. Leibovici D, Spiess PE, Agarwal PK, Tu SM, Pettaway CA, HItzhusen K, et al. 2007; Prostate cancer progression in the presence of undetectable or low serum prostate specific antigen level. Cancer. 109:198–204. DOI: 10.1002/cncr.22372. PMID: 17171704.
7. Pinsky PF, Prorok PC, Kramer BS. 2017; Prostate cancer screening-a perspective on the current state of the evidence. N Engl J Med. 376:1285–9. DOI: 10.1056/NEJMsb1616281. PMID: 28355509.
8. Schröder FH, Hugosson J, Roobol MJ, Tammela TL, Zappa M, Nelen V, et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet. 2014; 384:2027–35. DOI: 10.1016/S0140-6736(14)60525-0. PMID: 25108889. PMCID: PMC4427906.

9. Hugosson J, Carlsson S, Aus G, Bergdahl S, Khatami A, Lodding P, et al. 2010; Mortality results from the Goteborg randomized population based prostate cancer screening trail. Lancet Oncol. 11:725–32. DOI: 10.1016/S1470-2045(10)70146-7.
10. Oberaigner W, Siebert U, Horninger W, Klocker H, Bektic J, Schäfer G, et al. Prostate specific antigen testing in Tyrol, Austria: prostate cancer mortality reduction was supported by an update with mortality data up to 2008. Int J. Public Health. 2012; 57–62. DOI: 10.1007/s00038-011-0266-4. PMID: 21681451. PMCID: PMC3281998.
11. Kitagawa Y, Namiki M. 2015; Prostate specific antigen based population screening for prostate cancer: current status in Japan and future perspective in Asia. Asian J Androl. 17:475–80. DOI: 10.4103/1008-682X.143756. PMID: 25578935. PMCID: PMC4430954.
12. Kakehi Y, Sugimoto M, Taoka R. 2017; Evidence based clinical practice guideline for prostate cancer (summary: Japanese Urological Association, 2016 edition). Int J Urol. 24:648–66. DOI: 10.1111/iju.13380. PMID: 28667698.
13. US Preventive Services Task Force. Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, Davidson KW, et al. 2018; Screening for prostate cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 319:1901–13. DOI: 10.1001/jama.2018.3710. PMID: 29801017.
14. Schaefer U, Witt F, Schueller P, Micke O, Willich N. 2000; Prostate-specific antigen (PSA) in the monitoring of prostate cancer after radical prostatectomy and external beam radiation. Anticancer Res. 20:4989–92. PMID: 11326654.
15. Freedland SJ, Sutter ME, Dorey F, Aronson WJ. 2003; Defining the ideal cutpoint for determining PSA recurrence after radical prostatectomy. Prostate-specific antigen. Urology. 61:365–9. DOI: 10.1016/S0090-4295(02)02268-9. PMID: 12597949.
16. Clinical, Laboratory Standard Institute. Evaluation of precision of quantitative measurement procedures; approved guideline, Third edition. CLSI document EP05-A3. Wayes, PA: Clinical and Laboratory Standard Institute;2014.
17. Westgard QC. Desirable Biological Variation Database specifications. https://www.westgard.com/biodatabase1.htm. Last accessed on July 2021.
18. Clinical, Laboratory Standard Institute. Evaluation of the linearity of quantitative measurement procedures: A statistical approach; Approved guideline, CLSI document EP06-A. Wayne, PA: Clinical and Laboratory Standard Institute;2003.
19. Clinical, Laboratory Standard Institute. Evaluation of detection capability for clinical laboratory measurement procedures; Approved guideline, Second edition. CLSI document EP17-A2. Clinical and Laboratory Standard Institute;2012.
20. Clinical, Laboratory Standard Institute. 2014. User verification of precision and estimation of bias; Approved guideline-Third edition. CLSI document EP15-A3. Wayne, PA: Clinical and Laboratory Standards Institute;2014.
21. Clinical, Laboratory Standard Institute. 2013. Measurement procedure comparison and bias estimation using patient samples; Approved guideline, Third edition. CLSI document EP09-A3. Clinical and Laboratory Standard Institute;Wayne PA:
22. Obuchowski NA, Lieber ML, Wians FH Jr. 2004; ROC curves in clinical chemistry: uses, misuses, and possible solutions. Clin Chem. 50:1118–25. DOI: 10.1373/clinchem.2004.031823. PMID: 15142978.

23. Ricós C, Alvarez V, Cava F, García-Lario JV, Hernández A, Jiménez CV, et al. 1999; Current databases on biological variation: pros, cons and progress. Scand J Clin Lab Invest. 59:491–500. DOI: 10.1080/00365519950185229. PMID: 10667686.
24. Kort SA, Martens F, Vanpoucke H, van Duijnhoven HL, Blankenstein MA. 2006; Comparison of 6 automated assay for total and free prostate-specific antigen with special reference to their reactivity toward the WHO 96/670 reference preparation. Clin Chem. 52:1568–74. DOI: 10.1373/clinchem.2006.069039. PMID: 16762996.
25. Zur B, Holdenrieder S, Walgenbach-Brünagel G, Albers E, Stoffel-Wagner B. 2012; Method comparison for determination of the tumor markers AFP, CEA, PSA and free PSA between Immulite 2000 XPI and Dimension Vista 1500. Clin Lab. 58:97–105. PMID: 22372351.
26. Laffin R, Chan DW, Tanasijevic MJ, Fischer GA, Markus W, Miller J, et al. 2001; Hybritech Total and free prostate-specific antigen assays developed for the Beckman Coulter Access automated chemiluminescent immunoassay system: a multicenter evaluation of analytical performacne. Clin Chem. 47:129–32. DOI: 10.1093/clinchem/47.1.129. PMID: 11148190.
27. Park HI, Lee S, Kim Y, Shin DY, Lee C, Han S, et al. 2014; Analytical performance of a new one-step quantitative prostate-specific antigen assay, the FRENDTM PSA Plus. Clin Chem Lab Med. 52:715–23. DOI: 10.1515/cclm-2013-0545. PMID: 24323891.

28. Keukeleire SD, Wauters A, Luyts D, Chandler C, Piqueur M. 2014; Analytical performance of the VITROS immunodiagnostic products total PSA II and free PSA assays. Clin Biochem. 47:1323–5. DOI: 10.1016/j.clinbiochem.2014.06.006. PMID: 24940637.
Fig. 1
Linearity of the HISCL-5000 immunoassay for PSA. The red line and green lines indicate regression lines with linear and non-linear fit, respectively. Linearity was measured from 0.002 to 189.900 ng/mL.
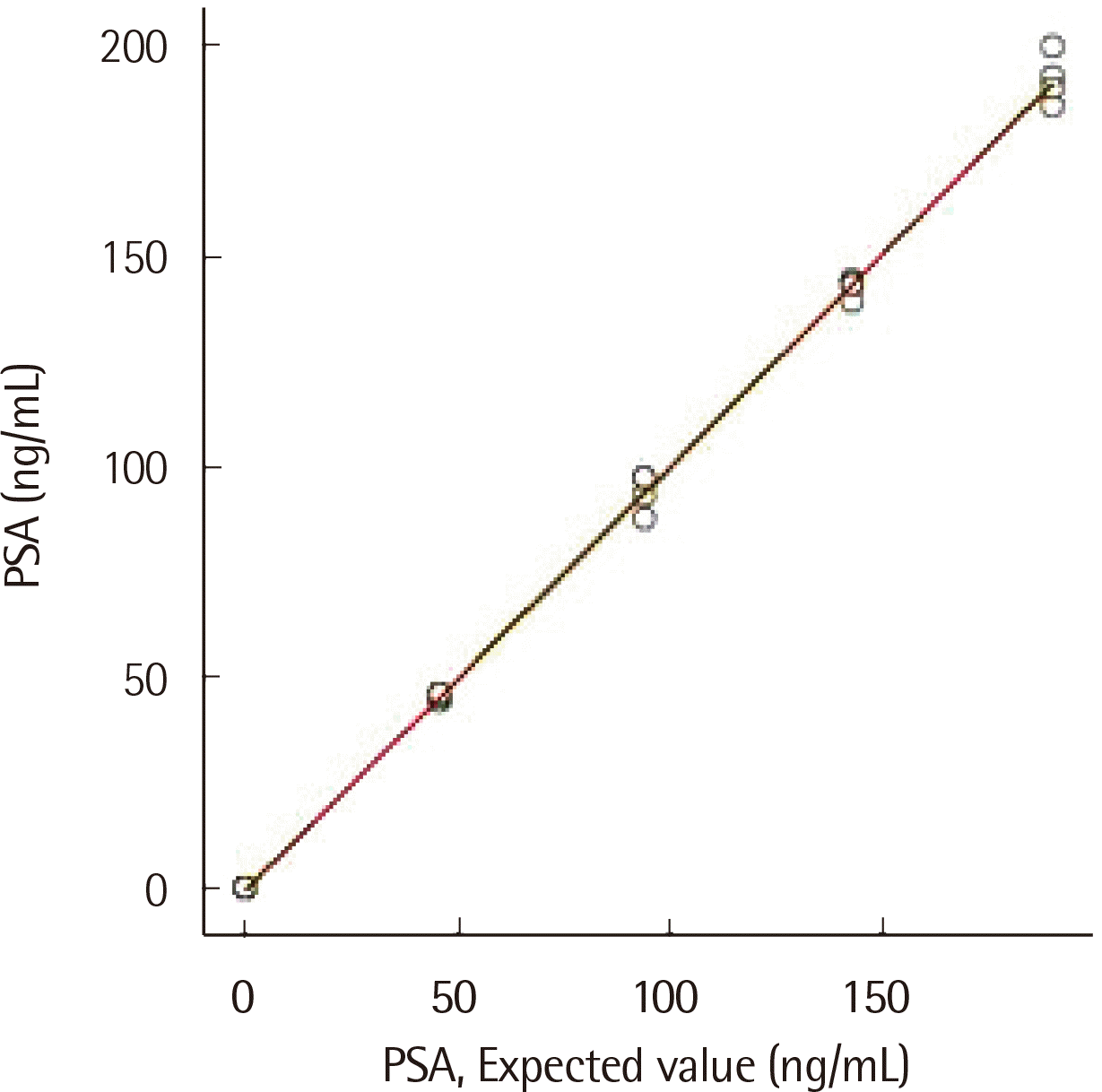
Fig. 2
Method comparison for HISCL-5000 immunoassay and UniCel DxI-800 immunoassay for PSA (N=363, R2=0.99). (A) Measured range was from 0.01 to 541.56 ng/mL. The slope (95% confidence interval) was 0.92 (0.91-0.93) for PSA. The intercept (95% confidence interval) was -1.06 (-1.71~-0.40). (B) Bland-Altman plot shows the mean difference and upper and lower limit of 1.96 SD.
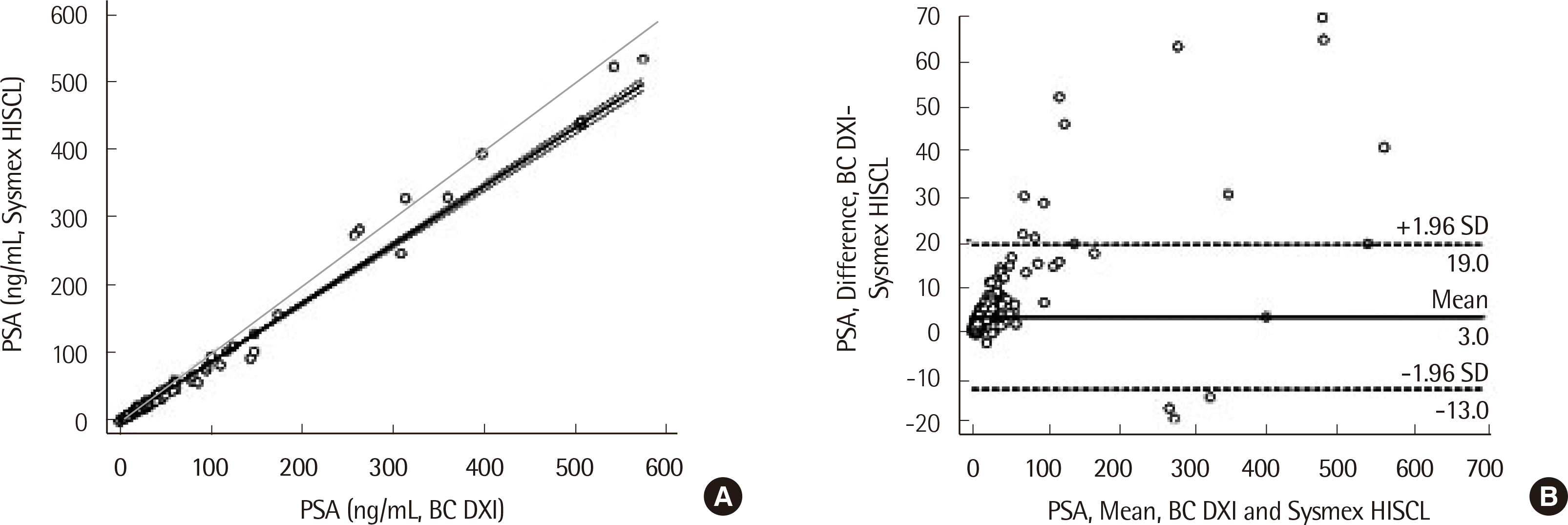
Fig. 3
Comparison of AUROCs in the BPH group with control group of non-malignant disease (A). PCa group with control group of non-malignant disease (B). BPH group with control group of healthy population (C). PCa group with control group of healthy population (D).
Abbreviations: BPH, benign prostate hyperplasia; PCa, prostate cancer.
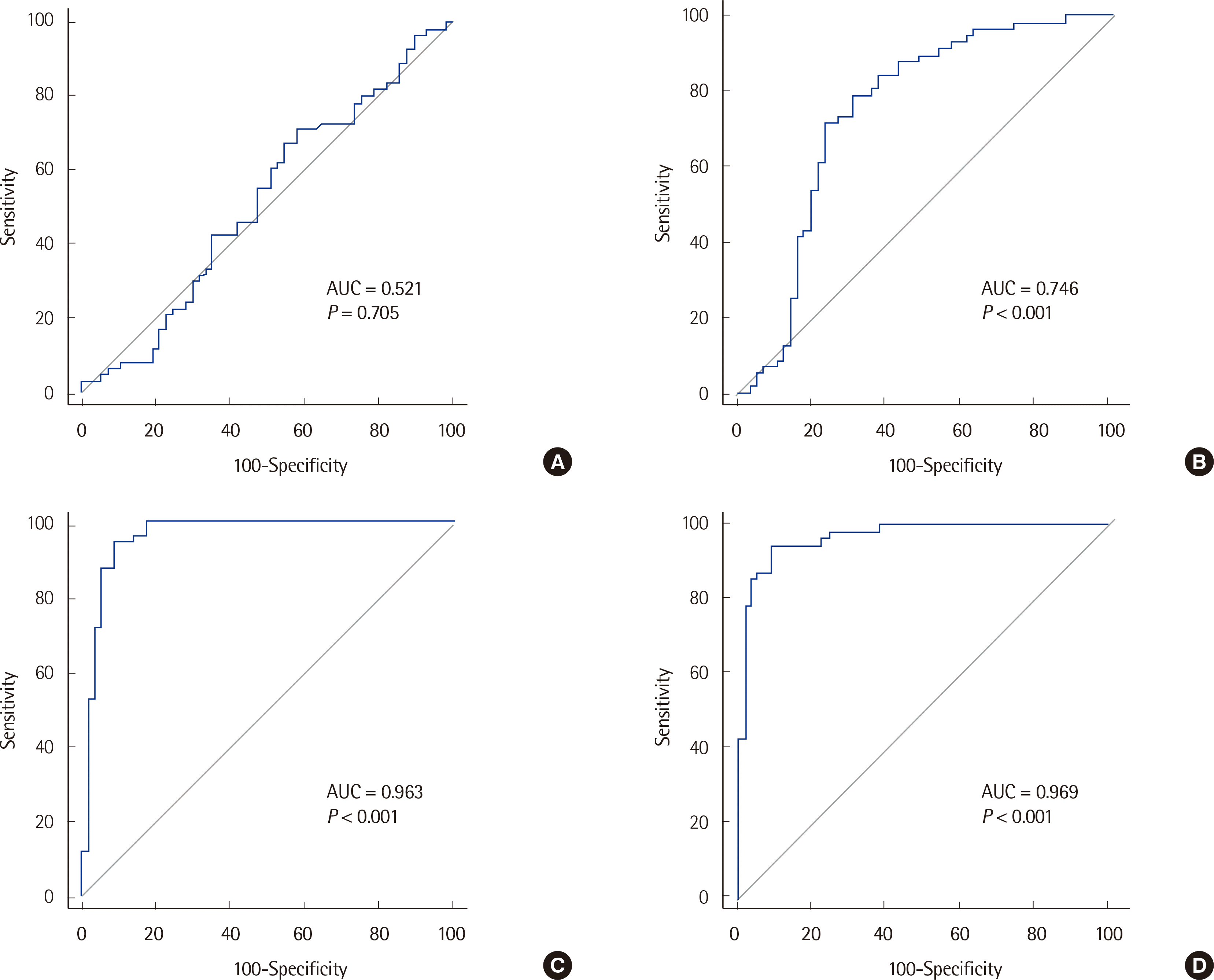
Table 1
Precision of analyzing PSA. Two PSA concentration levels were evaluated for duplicated samples and were measured two times a day for 20 working days (20×2×2 protocol)
Table 2
Trueness of analyzing PSA
| PSA level | Expected value (ng/mL) | Measured mean* (ng/mL) | SD (ng/mL) | CV (%) | Verification Interval | Bias | Bias (%)† | |
|---|---|---|---|---|---|---|---|---|
|
|
||||||||
| Low | High | |||||||
| 1 | 24.27 | 24.59 | 0.34 | 0.01 | 22.93 | 26.25 | 0.32 | 1.32 |
| 2 | 11.65 | 10.52 | 0.21 | 1.99 | 8.86 | 12.18 | -1.13 | -9.70 |
| 3 | 5.83 | 6.48 | 0.32 | 4.88 | 4.82 | 8.14 | 0.65 | 11.16 |
| 4 | 4.00 | 3.86 | 0.03 | 0.64 | 2.19 | 5.52 | -0.14 | -3.50 |
| 5 | 2.79 | 2.80 | 0.13 | 4.63 | 1.14 | 4.46 | 0.01 | 0.36 |
Table 3
The area under the receiver operating characteristic curve (AUROC) of PSA




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download