Abstract
Superficial esophageal squamous cell carcinoma (SESCC) is an esophageal squamous cell carcinoma confined to the mucosa or superficial submucosa. Recent Korean Guidelines recommend an endoscopic resection as the first-line treatment for SESCC without a distant or lymph node metastasis (LNM) after excluding those with an obvious submucosal invasion. Before endoscopic treatment of SESCC, Lugol chromoendoscopy or image-enhanced endoscopy is recommended to define the extent of the lesion, and endoscopic ultrasound is recommended to determine the T stage. The tumor size, macroscopic type of tumor, pathologic differentiation, depth of tumor, and lymphovascular invasion (LVI) are risk factors of LNM in SESCC. No additional treatment is necessary after an en bloc complete resection of SESCC invading no more than the lamina propria without LVI. Although the risk of LNM in a SESCC invading into muscularis mucosa without LVI is low, a close follow-up is recommended without additional treatment. On the other hand, additional treatment is recommended in the case of a tumor with submucosal invasion or an LVI positive or positive vertical resection margin. Adjuvant therapy includes esophagectomy or chemoradiotherapy (CRT), but it is unclear which treatment is better. The 5-year overall survival rates were reportedly 90-100% for esophagectomy and 75-85% for CRT. Nevertheless, patients with high-risk features including poorly differentiated histology, LVI positive, perineural invasion positive, T1b-SM2/T1b-SM3 cancer, and vertical resection margin positive need to be treated with an additional esophagectomy. Elderly patients, those with a physical condition and co-morbidities, and those with LNM or cancer-specific mortality require additional treatment after a non-curative endoscopic resection of SESCC.
표재성 식도암(superficial esophageal cancer)은 점막 혹은 점막하층에 국한된 식도암으로 정의된다. 한편, 조기 식도암(early esophageal cancer)이라는 용어도 혼용되어 사용되고 있으나, 일반적으로 조기 식도암은 암의 침윤이 점막층에 국한되고 림프절 전이가 없는 식도암을 의미하므로 표재성 식도암과는 차이가 있다. 식도암은 병리학적으로 크게 식도선암(esophageal adenocarcinoma)과 식도편평상피암(esophageal squamous cell carcinoma, ESCC)으로 나뉘며, 이 둘은 역학, 위험인자, 병기에 따른 치료 방법, 예후 등에서 큰 차이를 보인다.1 식도선암은 주로 서구에서 호발하는 반면 우리나라, 일본, 중국 등 동아시아에서는 식도편평상피암이 식도암의 대부분을 차지한다.2,3 우리나라 암등록통계자료에 따르면 89.9%의 식도암이 병리학적으로 식도편평상피암이었다.4 따라서 본고에서는 주로 표재성 식도편평상피암(superficial esophageal squamous cell carcinoma, SESCC)에 대해서 다루고자 한다.
표재성 식도암에서도 표준 치료는 수술이다. 하지만 식도절제술은 합병증 위험이 높고 수술 후 삶의 질 저하가 문제가 된다.5 최근 내시경 술기의 발달로 표재성 식도암에 대해서 내시경 절제술(endoscopic mucosal resection or endoscopic submucosal dissection)의 적용 범위가 넓어지고 있고, 내시경 절제술 후 장기 추적하는 환자도 증가하고 있다.6 내시경 절제술의 치료 성적은 수술적 치료와 비교하여 평가되어야 할 것이다. 따라서 최근 발표된 우리나라 조기 소화기암의 내시경 절제술 진료지침을 기반으로,7 SESCC에 대한 최근 연구들을 소개하고 특히 치료적 절제가 되지 않은 식도암의 치료적 접근 및 노인 표재성 식도암의 치료 시 고려사항에 대해서도 정리해 보고자 한다.
표재성 식도암으로 진단되면 우선적으로 내시경 절제술의 가능성을 고려해야 한다.7 따라서 표재성 식도암에 대한 치료 전 평가는 내시경 절제술의 적응증이 될 수 있을지, 아니면 수술적인 치료가 필요한지를 확인하는 것이 주 목적이 될 것이다.
SESCC에서는 우선 병변의 정확한 범위를 평가하기 위해 Lugol 색소내시경이나 영상강화내시경의 시행이 필요하다.7-10 이를 통해 병변의 정확한 경계를 확인할 수 있으며, 병변의 크기(longitudinal and circumferential)를 정확히 평가하여 내시경 시술의 난이도 및 내시경 절제술 후 합병증 위험도를 예측할 수 있다. Lugol 색소내시경은 동시성 병변(synchronous esophageal cancer)을 확인하는 데도 유용하다. 만일 병변이 내강의 75% 이상을 침범한 경우 과거에는 내시경 절제술 후 시술 부위의 협착(stricture) 위험이 높아서 내시경 절제술의 상대적인 금기증이었다.11 내강 둘레의 75% 이상을 절제한 경우 시술 후 협착 위험은 66-88%로 보고되고 있다.7 이 경우 풍선확장술(balloon dilatation)이나 부지술(bougienation) 등의 추가 치료가 필수적이다.12 하지만 시술 중 스테로이드 주입이나 시술 후 경구 스테로이드 복용을 통해 협착 위험을 유의하게 낮출 수 있다고 보고하고 있어,13,14 최근에는 이러한 경우에도 내시경 시술을 적극적으로 시행하는 추세이다.
또한, SESCC의 병기 설정을 위해서 초음파 내시경(EUS)의 시행이 권고된다.15,16 비록 EUS가 SESCC에서 점막층과 점막하층을 구분하는 정확도는 이전 연구에서 65-93% 정도로 기관마다 차이가 많이 있으며, 일부 전문가들은 EUS 결과와 상관없이 혹은 내시경 육안 소견만으로 내시경 절제술이 가능하다면 EUS 없이 진단 및 치료 목적의 내시경 절제술을 시행해보는 것을 권고하기도 한다.17,18 하지만 적어도 EUS에서 뚜렷하게 점막하층 침윤 소견이 관찰되는 경우에는 불필요한 내시경 절제술 없이 식도절제술을 우선적으로 고려하는 것이 합리적이며 최근 가이드라인에서도 이를 명시하고 있다.또한 흉부 전산화단층촬영(CT) 검사를 시행하여 원격 전이 및 림프절 전이 위험도를 평가해야 한다.15 필요하다면 18F-fluorodeoxyglucose PET (FDG-PET) 혹은 PET-CT 검사를 시행을 고려해야 한다. 일반적으로 SESCC에서 PET 검사는 T병기 예측에는 큰 도움이 되지 않으나, 림프절 전이 혹은 원격 전이를 예민하게 찾아낼 수 있어 시행하는 것이 권고된다.19 이전 메타분석에 따르면 식도암에서 PET 검사는 원격 전이를 예측하는 데 중간 수준의 민감도(67%) 및 높은 특이도(97%)를 보여주었다.20
일부에서는 확대내시경(magnification endoscopy) 검사가 내시경 절제술의 적응증이 되는 SESCC를 감별하는 데 높은정확도를 보였다고 보고하였다.21 이전 연구에서 Goda 등22은72명의 SESCC 환자의 101개의 병변에 대해서 확대내시경을적용하였을 때 점막하층 침윤을 예측하는 민감도는 72-83%,특이도는 89-92%로 특히 병변의 침윤 깊이를 과대평가(overestimation) 할 위험을 낮춘다고 보고하였다. 하지만 확대내시경 검사는 시술자의 숙련도에 따라 검사의 정확도에 차이를 보이며, 검사 시간이 오래 걸리는 제한점이 있다.19
전술한 여러 검사를 통해 SESCC에 대한 치료 방침을 정할수 있다. 내시경 치료의 궁극적인 적응증은 “림프절 전이의 위험이 없는” 조기 식도암이 될 것이다. 일반적으로 SESCC에서 내시경 검사를 통해 림프절 전이 위험을 예측하는 인자로는 병변의 크기, 병변의 모양 등이 있다. 최근 메타분석에 따르면 폴립양 병변(type 0-I) 혹은 궤양형 병변(type 0-III)인 경우, 평편형 병변(type 0-IIa or IIb or IIc)보다 림프절 전이 위험이 높다고 보고하였다(OR 3.74, 95% CI 2.74-5.09).23 또한 병변의 크기가 2 cm 미만인 식도암은 2 cm 이상인 식도암에 비해 림프절 전이 위험이 유의하게 낮았다(OR 0.40, 95% CI 0.29-0.55).23 하지만 크기나 모양만으로는 림프절 전이 위험을 정확하게 예측하기는 어렵다.
한편, EUS나 확대내시경 소견 상 점막하층 침윤 가능성이높다면 내시경 절제술보다는 수술적인 치료를 우선적으로 고려해야 한다.7,15 이전 연구 결과를 보면 병변이 고도이형성증(severe dysplasia)이거나 암세포가 상피층(epithelial layer, T1a-M1)에만 국한된 경우에는 림프절 전이가 없었다. 또한 고유층(lamina propria, T1a-M2) 혹은 점막근층(muscularis mucosa, T1a-M3) 침윤이 있는 경우 림프절 전이 위험은 0-8% 정도로 비교적 낮게 보고하고 있다. 하지만 점막하층침윤이 있는 경우, 특히 점막하층의 1/3 미만 혹은 200 μm미만의 침윤만 있는 경우에도 림프절 전이 위험은 최대 33%까지 증가하는 것이 알려져 있다(Table 1).6 즉, EUS나 확대내시경 검사 등을 통해 점막하 침윤의 증거가 있는지를 확인하는 것은 매우 중요하다. 다만 내시경 절제술 전 점막하층침윤 여부를 정확하게 평가하기는 어렵기 때문에, 통상적으로는 EUS에서 점막하층 침윤의 명확한 증거가 없는 경우 우선적으로 내시경 절제술을 시행하는 것이 추천된다. 최근 국내연구에 따르면 조기 식도암의 초치료로 수술을 시행하는 경우와 비교하여 내시경 절제술은 질병특이생존율(disease specific survival) 및 전체생존율(overall survival) 모두에서 동등한 결과를 보여주었다.24 따라서 내시경 절제술은 점막하 침윤의 증거가 없는 SESCC의 1차 치료로 권고되어야 한다.25
내시경 절제술 후 병리 소견을 통해서도 림프절 전이 위험을 예측할 수 있다. 일반적으로 병리 소견 중 림프절 전이 위험과 연관된 인자로는 침윤 깊이(depth of invasion), 수직절제연 양성, 병리학적 분화도 그리고 림프혈관침범(lymphovascular invasion, LVI)이다. 일반적으로 T1a-M3 이상의 침윤이 있는 경우 림프절 전이 위험이 급격하게 증가하며, 저분화암(poorly differentiated carcinoma)인 경우에도 림프절 전이 위험성이 높아진다.23 특히 LVI 양성인 경우 림프절 전이 위험은 6.68배 증가하며, 이전 연구에 따르면 M3의 침윤을 보이는 SESCC에서 LVI 양성인 경우에는 33.3%, LVI 음성인 경우에는 13.3%로 유의하게 림프절 전이 위험이 증가한다고 보고하였다.26
따라서 SESCC의 내시경 절제술 후 치료적 절제(curative resection) 여부의 평가는 최근 가이드라인 내용을 반영하여 침윤 깊이와 LVI 양성 유무에 따라 정리하면 Table 2와 같다.
최근 국내 가이드라인에 따르면 SESCC의 내시경 절제술 후 최종 병리 결과가 상피층 혹은 고유층(lamina propria)에 국한된 병변(T1a-M1 or T1a-M2)이고 LVI 음성이면서 일괄 절제(en bloc resection) 및 완전 절제(complete resection)가 된 경우에는 림프절 전이 위험이 매우 낮으므로 경과 관찰이 가능하다.7 또한 병리 결과에서 점막근층을 침범(T1a-M3)하였으나 LVI 음성이고 완전 절제가 된 경우에도 림프절 전이위험은 낮으므로 조심스럽게 경과 관찰을 권고할 수 있다.7
하지만 내시경 절제술 후 불완전 절제가 되었거나 혹은 완전 절제(complete resection)는 되었으나 치료적 절제는 되지 않은 경우(non-curative resection)에는 추가 치료가 필요하다. 특히 T1a-M3 병변이면서 LVI 양성이거나, 점막하층 침윤이 있는 경우(T1b), 수직 절제연 양성(positive vertical resection margin positive)인 경우에는 추가 치료(additional treatment)가 권고된다.7 추가 치료로 우선적으로 고려해야 하는 것은 식도절제술(Ivor-Lewis operation 혹은 McKeown operation)이다. 수술은 암특이사망률(cancer-specific mortality) 측면에서 가장 좋은 성적을 보여주고 있다. 기존에 보고된 5편의 연구 결과를 정리하면 총 110명의 치료적 절제가 되지 않았던 SESCC 환자(T1a 24명, T1b 86명)에서 추가 식도절제술을 시행하고 2-4년간 추적 관찰을 시행하였을 때, 모든 증례에서 국소 재발 및 원격 전이가 발생하지 않았다.27 하지만 수술 후 삶의 질 저하가 큰 문제가 되며,28,29 수술로 인한 합병증의 위험도 높고 수술 후 사망률도 3.63-3.72%까지 보고하고 있다.25,30 따라서 고령이거나 동반 질환이 있는 경우 수술적인 치료는 큰 부담이 된다.
한편, 내시경 절제술 후 추가 항암방사선 치료(chemoradiotherapy, CRT)를 고려할 수 있다. 이전 연구를 보면 치료적 절제가 되지 않은 SESCC에서 추가 치료를 하지 않았던 군에 비해 CRT를 시행한 군에서 유의하게 낮은 전이 및 재발률을 보여주었다.31 이전 연구 결과를 정리하였을 때, 총 7편의 연구에서 치료적 절제가 되지 않았던 SESCC 환자 175명(T1a 39명, T1b 136명)에 대하여 추가 CRT 후 2-6년간 추적 관찰을 시행하였을 때 국소 재발 및 원격 전이는 각각 2.2% 및 9.5%에서 발생하였다.27 비록 CRT로 인한 식도 협착(3.2%)이나 누공(3.2%), 호흡부전(2.8%), 심근 허혈(1.0%) 등 합병증 발생 위험이 있으나,32 수술과 비교하였을 때 장기를 보존할 수 있으며, 삶의 질 측면에서도 치료 후 빠른 회복을 기대할 수 있어 유리하다.33
내시경 절제술 후 치료적 절제가 되지 않았던 SESCC 환자에서 추가 수술과 CRT를 비교한 이전 연구들은 주로 소규모 연구였다. 일부 결과를 소개하면 Ikeda 등34은 식도절제술을 시행 받은 15명의 환자와 CRT를 시행 받은 11명의 환자를 추적 관찰하였을 때 3년 무질병 생존율(disease-free survival)은 각각 86%와 69%로 통계적인 차이는 없었다(p=0.21). 하지만 고위험군(poorly differentiated cancer, LVI positive or peri-neural invasion positive, T1b-SM2/T1b-SM3 cancer [>200 μm], deep resection margin positive)에서 재발률은 수술군과 CRT군에서 각각 0%와 50%로 큰 차이를 보여주었다.34 또한, Koterazawa 등35은 28명의 식도절제술 환자와 31명의 CRT 환자를 각각 45개월과 41개월 추적 관찰하였을 때 전체 사망률에서는 유의한 차이가 없었던 반면(p=0.46), 암특이생존율은 수술군에서 유의하게 높았으며(p=0.04), 고위험군에서는 재발률이 각각 0%와 40%로 유의한 차이를 보여주었다(p=0.031). Suzuki 등36의 연구에서도 식도절제술 환자 16명과 CRT 환자 16명을 2년간 추적 관찰하였을 때 전체 생존율 및 무질병 생존율은 양 군 간에 차이가 없었던 반면, 고위험군에서는 재발률에 유의한 차이를 보여주었다(0% vs. 20%). 이들 연구 결과를 보면 치료적 절제가 되지 않은 SESCC 중에서도 고위험군인 경우에는 식도절제술이 우선적으로 고려되어야 하며, 고위험요인이 없는 경우에는 CRT를 추가 치료로 고려할 수 있을 것이다.27
하지만 현재까지 SESCC에서 내시경 절제술 후 치료적 절제가 되지 않은 환자에서 식도절제술과 CRT를 전향적으로 비교한 무작위 배정 임상시험은 없다. 다만 2017년부터 현재까지 국내 다기관 연구(ASSURE trial; ClinicalTrials.gov number, NCT03306901)가 진행되고 있으며, 임상시험 결과가 나오면 치료적 절제가 되지 않은 SESCC의 치료 방침을정하는 데 큰 영향을 미칠 것으로 생각된다.
식도암은 노인에서 호발하는 질환이다. 조기 식도암은 수술이 표준 치료이지만 전술한 바와 같이 수술로 인한 합병증위험이 높으며, 수술 후 삶의 질 저하가 더 큰 문제가 된다.특히 노인에서는 가능한 한 덜 침습적인 치료가 권고될 수있다.
식도 이형성증 및 조기 식도암의 경우 치료하지 않더라도 비교적 양호한 경과를 보인다. 한 연구에서는 식도의 고도이형성증(severe dysplasia)을 보이는 17명의 환자를 중앙값(median) 기준 35개월간 추적 관찰하였을 때 47.1%에서만 식도암으로 진행하였다고 보고하였다.37 또한, SESCC 환자 3명을 치료 없이 장기 추적 관찰하였을 때 2명의 환자에서 각각 76개월, 87개월 후 진행 식도암으로 악화된 반면, 나머지 한 명의 환자는 장기간의 추적에도 식도암이 진행하지 않았다.37 따라서 비록 소규모 연구이지만 이러한 고령의 조기 식도암 환자의 양호한 자연 경과를 이해하는 것은 중요하다.
그럼에도 내시경 절제술은 고령의 SESCC 환자에서도 비교적 안전하고 완치를 기대할 수 있는 좋은 치료 방법이므로 초치료로 우선적으로 권고되어야 한다.38,39 하지만 내시경 절제술 후 치료적 절제가 되지 않은 고령 SESCC 환자 중 절반 이상은 추가 치료를 받지 않고 있으며, 특히 표준 치료라고 할 수 있는 식도절제술을 시행 받는 환자는 매우 드물다.40,41 가장 큰 이유는 노인에서 동반 질환이 많으며, 상대적으로 젊은 식도암 환자에 비해서 기대 여명이 길지 않으며, 전신 상태가 좋지 않아 수술이나 CRT를 견딜 수 없는 경우가 많기 때문이다.42
아직까지 고령의 SESCC 환자에 대해서 정해진 치료 가이드라인은 없다. 그럼에도 불구하고 노인 SESCC 환자에서는 식도암의 병기와 함께 신체 기능이나 동반 질환을 평가하는 것이 중요하다. 일반적으로 American Society of Anesthesiologists Physical Status, Charlson Comorbidity Index, Prognostic Nutritional Index, Geriatric Assessment 등을 이용하여 노인의 포괄적인 기능을 평가할 수 있으며, 이를 통해 노인 식도암 환자의 예후 및 치료 방침을 결정할 수 있다.32 가령 일본에서 시행된 다기관 후향적 연구에 따르면 SESCC 환자의 내시경 점막하 박리술 후 점막하층 침윤이 있거나 LVI 양성인 경우에도 원칙은 수술적 치료이지만, 고령(75세 이상)이거나 기저 질환이 있었던 경우, CRT 혹은 방사선 치료만 시행하더라도 생존율은 표준적인 식도절제술을 시행 받은 환자와 예후에서 차이를 보이지 않았다.42
앞으로 많은 연구가 필요하겠으나 현재까지의 근거로부터 치료적 절제가 되지 않은 SESCC 환자의 치료 방침에 대해 정리해 보면 Fig. 1과 같다. 75세 미만의 신체 기능이 양호한 환자에서는 CRT나 수술을 적극적으로 고려할 수 있다. 하지만 75세 이상의 고령에서는 신체 기능 및 동반 질환에 따라 추가 치료 방침을 결정할 수 있다. 즉, 동반 질환이 없고 신체 기능이 양호한 경우에는 적극적인 CRT 및 수술을 권유할 수 있으며, 동반 질환이 많거나(예를 들면, CCI score ≥2), 신체 기능이 좋지 않은 경우에는 추가 치료 없이 경과 관찰하거나 상대적으로 덜 침습적인 치료를 권유하는 것이 권고된다. 그리고 전술한 바와 같이 젊거나 고령이라고 하더라도 신체 기능이 양호하고 동반 질환이 없다면, 림프절 전이의 고위험군(poorly differentiated cancer, LVI positive or perineural invasion positive, T1b-SM2/T1b-SM3 cancer [>200 μm], deep resection margin positive)인 경우 수술적인 치료를 우선적으로 고려해야 할 것이다.
식도암은 예후가 나쁜 암종이지만 병기에 따라 예후에 큰 차이를 보인다. SESCC의 5년 생존율은 60-80%인 반면 진단 당시에 전이 소견이 있거나 절제가 불가능한 식도암의 1년 생존율은 20% 미만이다.43 따라서 식도암의 조기 발견은 매우 중요하다. SESCC는 주로 무증상이며 검진 내시경 중 우연히 발견되는 경우가 많다. 우리나라에서는 위암 조기 발견을 위해 40세 이상 성인에 대하여 2년 간격의 검진 내시경 프로그램을 진행하고 있다.44 이에 따라 무증상 성인의 내시경 검사율이 높아지고, 내시경 의사의 숙련도 또한 증가하게 되면서 SESCC 진단도 증가하는 추세이다.45 한편으로는 식도암은 노인에서 호발하는 질환으로 우리나라도 급격한 인구 고령화를 겪고 있어 노인에서 식도암 발생도 증가할 것으로 예측된다.이에 따라 SESCC에 대한 진단적 접근 및 최선의 치료 방법 결정은 중요하다. 우리나라 가이드라인에서도 점막하층 침윤이 없는 SESCC의 초치료는 내시경 절제술이며, 최종 병리 결과에 따라 추가 치료의 필요성을 결정하도록 권고하고 있다.7 치료적 절제가 이루어지지 않은 경우 수술(식도절제술 및 림프절 박리술)이 암 재발 측면에서는 가장 좋은 치료이지만 높은 이환율 및 삶의 질 저하가 문제가 된다. 추가 항암방사선 치료도 좋은 치료가 될 수 있으나 재발률 측면에서 수술보다 더 우월하지는 않다. 특히 고령이거나 기저 질환이 있는 경우에는 보존적 치료를 더 우선적으로 고려하여 치료 방침을 결정하는 것이 추천된다.
REFERENCES
1. Hongo M, Nagasaki Y, Shoji T. 2009; Epidemiology of esophageal cancer: orient to occident. Effects of chronology, geography and ethnicity. J Gastroenterol Hepatol. 24:729–735. DOI: 10.1111/j.1440-1746.2009.05824.x. PMID: 19646015.

2. Bollschweiler E, Wolfgarten E, Gutschow C, Hölscher AH. 2001; Demographic variations in the rising incidence of esophageal adenocarcinoma in white males. Cancer. 92:549–555. DOI: 10.1002/1097-0142(20010801)92:3<549::AID-CNCR1354>3.0.CO;2-L. PMID: 11505399.

3. Son JI, Park HJ, Song KS, et al. 2001; A single center's 30 years' experience of esophageal adenocarcinoma. Korean J Intern Med. 16:250–253. DOI: 10.3904/kjim.2001.16.4.250. PMID: 11855155. PMCID: PMC4578062.

4. Cho JH, Shin CM, Han KD, et al. 2020; Abdominal obesity increases risk for esophageal cancer: a nationwide population-based cohort study of South Korea. J Gastroenterol. 55:307–316. DOI: 10.1007/s00535-019-01648-9. PMID: 31792601.

5. Raymond DP, Seder CW, Wright CD, et al. 2016; Predictors of major morbidity or mortality after resection for esophageal cancer: a society of thoracic surgeons general thoracic surgery database risk adjustment model. Ann Thorac Surg. 102:207–214. DOI: 10.1016/j.athoracsur.2016.04.055. PMID: 27240449. PMCID: PMC5016796.

6. Spataro J, Zfass AM, Schubert M, Shah T. 2019; Early esophageal cancer: a gastroenterologist's disease. Dig Dis Sci. 64:3048–3058. DOI: 10.1007/s10620-019-05817-x. PMID: 31471859.

7. Park CH, Yang DH, Kim JW, et al. 2020; Clinical practice guideline for endoscopic resection of early gastrointestinal cancer. Korean J Gastroenterol. 75:264–291. DOI: 10.4166/kjg.2020.75.5.264. PMID: 32448858.

8. Endoscopic Classification Review Group. 2005; Update on the paris classification of superficial neoplastic lesions in the digestive tract. Endoscopy. 37:570–578. DOI: 10.1055/s-2005-861352. PMID: 15933932.
9. Oyama T, Inoue H, Arima M, et al. 2017; Prediction of the invasion depth of superficial squamous cell carcinoma based on microvessel morphology: magnifying endoscopic classification of the Japan Esophageal Society. Esophagus. 14:105–112. DOI: 10.1007/s10388-016-0527-7. PMID: 28386209. PMCID: PMC5362661.

10. Thosani N, Singh H, Kapadia A, et al. 2012; Diagnostic accuracy of EUS in differentiating mucosal versus submucosal invasion of superficial esophageal cancers: a systematic review and meta-analysis. Gastrointest Endosc. 75:242–253. DOI: 10.1016/j.gie.2011.09.016. PMID: 22115605.

11. Ono S, Fujishiro M, Niimi K, et al. 2009; Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for superficial squamous cell neoplasms. Endoscopy. 41:661–665. DOI: 10.1055/s-0029-1214867. PMID: 19565442.

12. Sato H, Inoue H, Kobayashi Y, et al. 2013; Control of severe strictures after circumferential endoscopic submucosal dissection for esophageal carcinoma: oral steroid therapy with balloon dilation or balloon dilation alone. Gastrointest Endosc. 78:250–257. DOI: 10.1016/j.gie.2013.01.008. PMID: 23453294.

13. Nagami Y, Shiba M, Tominaga K, et al. 2016; Locoregional steroid injection prevents stricture formation after endoscopic submucosal dissection for esophageal cancer: a propensity score matching analysis. Surg Endosc. 30:1441–1449. DOI: 10.1007/s00464-015-4348-x. PMID: 26123341.

14. Takahashi H, Arimura Y, Okahara S, et al. 2015; A randomized controlled trial of endoscopic steroid injection for prophylaxis of esophageal stenoses after extensive endoscopic submucosal dissection. BMC Gastroenterol. 15:1. DOI: 10.1186/s12876-014-0226-6. PMID: 25609176. PMCID: PMC4308850.

15. Japan Esophageal Society. 2017; Japanese classification of esophageal cancer, 11th edition: part I. Esophagus. 14:1–36. DOI: 10.1007/s10388-016-0551-7. PMID: 28111535. PMCID: PMC5222932.
16. Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. 2015; Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 47:829–854. DOI: 10.1055/s-0034-1392882. PMID: 26317585.

17. Pouw RE, Heldoorn N, Alvarez Herrero L, et al. 2011; Do we still need EUS in the workup of patients with early esophageal neoplasia? A retrospective analysis of 131 cases. Gastrointest Endosc. 73:662–668. DOI: 10.1016/j.gie.2010.10.046. PMID: 21272876.

18. Manner H, Wetzka J, May A, et al. 2017; Early-stage adenocarcinoma of the esophagus with mid to deep submucosal invasion (pT1b sm2-3): the frequency of lymph-node metastasis depends on macroscopic and histological risk patterns. Dis Esophagus. 30:1–11. DOI: 10.1111/dote.12462. PMID: 26952572.

19. Luo LN, He LJ, Gao XY, et al. 2016; Evaluation of preoperative staging for esophageal squamous cell carcinoma. World J Gastroenterol. 22:6683–6689. DOI: 10.3748/wjg.v22.i29.6683. PMID: 27547011. PMCID: PMC4970469.

20. van Westreenen HL, Westerterp M, Bossuyt PM, et al. 2004; Systematic review of the staging performance of 18F-fluorodeoxyglucose positron emission tomography in esophageal cancer. J Clin Oncol. 22:3805–3812. DOI: 10.1200/JCO.2004.01.083. PMID: 15365078.

21. Mizumoto T, Hiyama T, Oka S, et al. 2018; Diagnosis of superficial esophageal squamous cell carcinoma invasion depth before endoscopic submucosal dissection. Dis Esophagus. 31:10. DOI: 10.1093/dote/dox142. PMID: 29267962.

22. Goda K, Tajiri H, Ikegami M, et al. 2009; Magnifying endoscopy with narrow band imaging for predicting the invasion depth of superficial esophageal squamous cell carcinoma. Dis Esophagus. 22:453–460. DOI: 10.1111/j.1442-2050.2009.00942.x. PMID: 19222533.

23. Xu W, Liu XB, Li SB, Yang ZH, Tong Q. 2020; Prediction of lymph node metastasis in superficial esophageal squamous cell carcinoma in Asia: a systematic review and meta-analysis. Dis Esophagus. 33:doaa032. DOI: 10.1093/dote/doaa032. PMID: 32399558.

24. Min YW, Lee H, Song BG, et al. 2018; Comparison of endoscopic submucosal dissection and surgery for superficial esophageal squamous cell carcinoma: a propensity score-matched analysis. Gastrointest Endosc. 88:624–633. DOI: 10.1016/j.gie.2018.04.2360. PMID: 29750981.

25. Lee HD, Chung H, Kwak Y, et al. 2020; Endoscopic submucosal dissection versus surgery for superficial esophageal squamous cell carcinoma: a propensity score-matched survival analysis. Clin Transl Gastroenterol. 11:e00193. DOI: 10.14309/ctg.0000000000000193. PMID: 32675704. PMCID: PMC7386344.

26. Min BH, Yang JW, Min YW, et al. 2020; Nomogram for prediction of lymph node metastasis in patients with superficial esophageal squamous cell carcinoma. J Gastroenterol Hepatol. 35:1009–1015. DOI: 10.1111/jgh.14915. PMID: 31674067.

27. Tsou YK, Lee CH, Le PH, Chen BH. 2020; Adjuvant therapy for pT1a-m3/pT1b esophageal squamous cell carcinoma after endoscopic resection: esophagectomy or chemoradiotherapy? A critical review. Crit Rev Oncol Hematol. 147:102883. DOI: 10.1016/j.critrevonc.2020.102883. PMID: 32014674.

28. Blazeby JM, Farndon JR, Donovan J, Alderson D. 2000; A prospective longitudinal study examining the quality of life of patients with esophageal carcinoma. Cancer. 88:1781–1787. DOI: 10.1002/(SICI)1097-0142(20000415)88:8<1781::AID-CNCR4>3.0.CO;2-G. PMID: 10760752.

29. Lagergren P, Avery KN, Hughes R, et al. 2007; Health-related quality of life among patients cured by surgery for esophageal cancer. Cancer. 110:686–693. DOI: 10.1002/cncr.22833. PMID: 17582628.

30. Suzuki H, Gotoh M, Sugihara K, et al. 2011; Nationwide survey and establishment of a clinical database for gastrointestinal surgery in Japan: targeting integration of a cancer registration system and improving the outcome of cancer treatment. Cancer Sci. 102:226–230. DOI: 10.1111/j.1349-7006.2010.01749.x. PMID: 20961361.

31. Berger A, Rahmi G, Perrod G, et al. 2019; Long-term follow-up after endoscopic resection for superficial esophageal squamous cell carcinoma: a multicenter Western study. Endoscopy. 51:298–306. DOI: 10.1055/a-0732-5317. PMID: 30261535.

32. Hatta W, Gotoda T, Koike T, Masamune A. 2020; Management following endoscopic resection in elderly patients with early-stage upper gastrointestinal neoplasia. Dig Endosc. 32:861–873. DOI: 10.1111/den.13592. PMID: 31802529.

33. Rees J, Hurt CN, Gollins S, et al. 2015; Patient-reported outcomes during and after definitive chemoradiotherapy for oesophageal cancer. Br J Cancer. 113:603–610. DOI: 10.1038/bjc.2015.258. PMID: 26203761. PMCID: PMC4647690.

34. Ikeda A, Hoshi N, Yoshizaki T, et al. 2015; Endoscopic submucosal dissection (ESD) with additional therapy for superficial esophageal cancer with submucosal invasion. Intern Med. 54:2803–2813. DOI: 10.2169/internalmedicine.54.3591. PMID: 26567992.

35. Koterazawa Y, Nakamura T, Oshikiri T, et al. 2018; A comparison of the clinical outcomes of esophagectomy and chemoradiotherapy after noncurative endoscopic submucosal dissection for esophageal squamous cell carcinoma. Surg Today. 48:783–789. DOI: 10.1007/s00595-018-1650-y. PMID: 29532261. PMCID: PMC6060875.

36. Suzuki G, Yamazaki H, Aibe N, et al. 2018; Endoscopic submucosal dissection followed by chemoradiotherapy for superficial esophageal cancer: choice of new approach. Radiat Oncol. 13:246. DOI: 10.1186/s13014-018-1195-7. PMID: 30547811. PMCID: PMC6295044.

37. Wang JW, Guan CT, Wang LL, et al. 2017; Natural history analysis of 101 severe dysplasia and esophageal carcinoma cases by endoscopy. Gastroenterol Res Pract. 2017:9612854. DOI: 10.1155/2017/9612854. PMID: 28465681. PMCID: PMC5390561.

38. Peng C, Shen S, Xu G, et al. 2016; Efficacy and safety of endoscopic submucosal dissection for elderly patients with superficial squamous esophageal neoplasms. United European Gastroenterol J. 4:242–249. DOI: 10.1177/2050640615604780. PMID: 27087953. PMCID: PMC4804374.

39. Sekiguchi M, Oda I, Suzuki H, et al. 2017; Clinical outcomes and prognostic factors in gastric cancer patients aged ≥85 years undergoing endoscopic submucosal dissection. Gastrointest Endosc. 85:963–972. DOI: 10.1016/j.gie.2016.10.013. PMID: 27751873.
40. Kitagawa Y, Uno T, Oyama T, et al. 2019; Esophageal cancer practice guidelines 2017 edited by the Japan Esophageal Society: part 1. Esophagus. 16:1–24. DOI: 10.1007/s10388-018-0641-9. PMID: 30171413. PMCID: PMC6510883.

41. Kitagawa Y, Uno T, Oyama T, et al. 2019; Esophageal cancer practice guidelines 2017 edited by the Japan esophageal society: part 2. Esophagus. 16:25–43. DOI: 10.1007/s10388-018-0642-8. PMID: 30171414. PMCID: PMC6510875.

42. Nakajo K, Abe S, Oda I, et al. 2019; Impact of the Charlson comorbidity index on the treatment strategy and survival in elderly patients after non-curative endoscopic submucosal dissection for esophageal squamous cell carcinoma: a multicenter retrospective study. J Gastroenterol. 54:871–880. DOI: 10.1007/s00535-019-01583-9. PMID: 31055660.

43. Nieman DR, Peters JH. 2013; Treatment strategies for esophageal cancer. Gastroenterol Clin North Am. 42:187–197. DOI: 10.1016/j.gtc.2012.11.007. PMID: 23452638.

44. Lee S, Jun JK, Suh M, et al. Gastric cancer screening uptake trends in Korea: results for the National Cancer Screening Program from 2002 to 2011: a prospective cross-sectional study. Medicine (Baltimore). 2015; 94:e533. DOI: 10.1097/MD.0000000000000533. PMID: 25715251. PMCID: PMC4554157.
45. Kim JH, Han KD, Lee JK, et al. 2020; Association between the National Cancer Screening Programme (NSCP) for gastric cancer and oesophageal cancer mortality. Br J Cancer. 123:480–486. DOI: 10.1038/s41416-020-0883-x. PMID: 32398860. PMCID: PMC7403142.

Fig. 1
Determining the necessity for additional treatment after a non-curative endoscopic resection of superficial esophageal squamous cell carcinoma (SESCC).32 CRT, chemoradiotherapy; LVI, lymphovascular invasion; pT1a-M3, tumor invasion into the muscularis mucosa; pT1b-SM, tumor invasion into the submucosa. aFor patients with high-risk features (poorly differentiated histology, LVI positive, perineural invasion positive, T1b-SM2/T1b-SM3 cancer, and vertical resection margin positive), additional esophagectomy is recommended first.
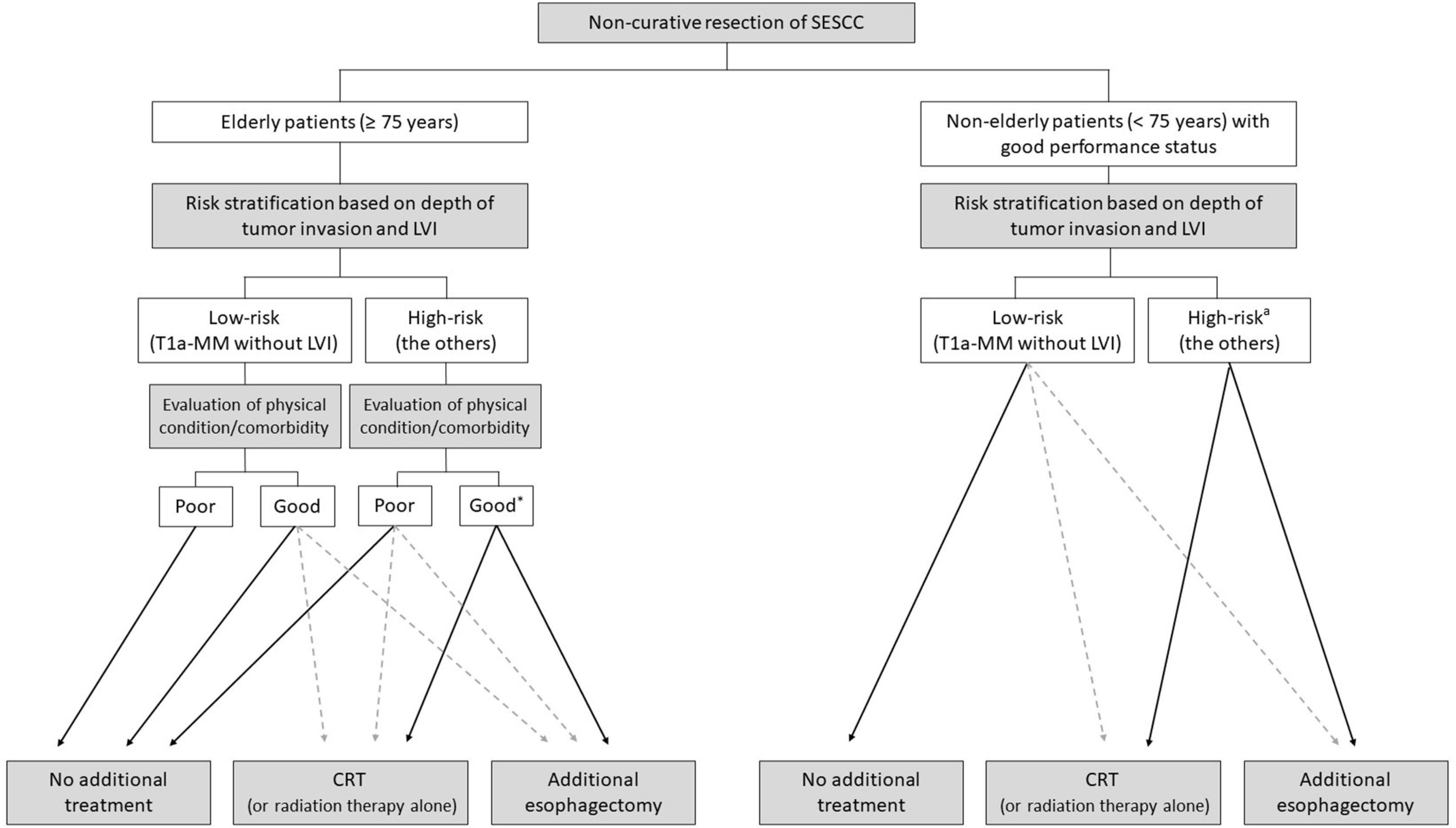
Table 1
Risk of LNM Based on the Depth of Invasion6
Table 2
Criteria for Curative Resection Based on the Depth of Invasion and Lymphovascular Invasion32
| pT1a-M1/M2 | pT1a-M3 | pT1b-SM1 | pT1b-SM2/SM3 | ||
|---|---|---|---|---|---|
|
|
|||||
| LVI negative | LVI positive | ||||
| Criteria for additional treatment | No additional treatment needed. | Grey Zonea | Additional treatment is recommended. | ||
| Lymph node metastasis rate (%) | 0-5.6 | 8.0-18.0 (0.0-4.3) | 11.0-53.1 | 30.0-53.9 | |
LVI, lymphovascular invasion; pT1a-M1/M2, tumor confined to epithelial layer (M1) or lamina propria (M2); T1b-SM1, cancer limited to superficial 1/3 or ≤200 μm of submucosa; T1b-SM2/SM3, cancer extending ≥1/3 or ≥200 μm of submucosa.
aA close follow-up can be recommended without additional treatment (reference: Park et al.7).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download