Abstract
Brain metastases are a leading cause of morbidity and mortality for patients with systemic cancer and are among the most common intracranial tumors in adults. Its incidence increases as cancer therapies improve, and patients live longer, providing new challenges to the multidisciplinary teams that manage these patients. The contemporary neurosurgical treatment of intracranial metastases has become gradually more complex as the available therapeutic options increase. For the past 50 years, whole brain radiotherapy and systemic corticosteroids have been considered as the standard of care for patients with brain metastases. However, in recent years, stereotactic radiosurgery is spotlighted as an alternative therapeutic modality for these patients because of its relatively short, convenient, and non-invasive treatment course. Stereotactic radiosurgery is a radiation therapy technique in which multiple focused radiation beams intersect over a target, which results in the delivery of highly conformal, high-dose of radiation to the target and minimal radiation to surrounding normal parenchyma. The purpose of this review is to provide an overview of stereotactic radiosurgery as a treatment modality for patients with brain metastases.
Go to : 
전이성 뇌종양은 두개강 내 발생하는 가장 흔한 악성종양으로 암 환자 중 9–15%에서 발생하는 것으로 알려져 있다[1]. 전이성 뇌종양 환자의 예후는 매우 좋지 않으며 스테로이드 단독 치료를 받았을 때 생존기간은 1–2개월 정도이고[2], 전뇌 방사선 치료를 받았을 때 대략적으로 6개월 정도의 생존기간을 보인다[3]. 현재 가장 널리 사용되는 전이성 뇌종양 치료로는 개두술 및 종양제거술, 전뇌 방사선 치료 및 뇌정위 방사선 수술 등이 있다.
역사적으로 1950년대 최초로 치료효과가 보고된 전뇌 방사선 치료[4,5]가 다발성 전이성 뇌종양의 표준 치료로 활용되고 있으며 개두술 및 종양제거술은 단일 병소이거나 즉각적인 두개 내 압력의 감압이 필요한 환자에게 선택적으로 시행되고 있다. 하지만 전뇌 방사선 치료가 신경학적 증상 개선에는 효과가 있으나 종양의 국소 치료효과는 비교적 떨어지며[6], 탈모, 무기력증, 그리고 삶의 질을 저하시키는 인지기능 저하라는 심각한 부작용을 초래할 수 있다는 단점이 있다[6,7]. 이러한 전뇌 방사선 치료의 한계로 인하여 뇌정위 방사선 수술이 많은 임상의에게 최근 각광을 받고 있다. 뇌정위 방사선 수술이란 고선량의 방사선을 환자의 두개강 내 특정 위치에 집중적으로 조사하여 해당 조직을 파괴 또는 변성을 유발시키는 비침습적인 수술 방법으로 기본적인 개념은 1951년 스웨덴의 신경외과의사 Lars Leksell에 의하여 고안되었으며 1968년 물리학자인 Borge Larson과 함께 179개의 코발트-60 (60Co) 방사선 동위원소가 반구 형태에 대칭적으로 위치하고 방출되는 감마선이 이들 중심에 집중될 수 있도록 설계된 최초의 뇌정위 방사선 수술 장비인 감마나이프(Gamma Knife; Elekta AB, Stokholm, Sweden)를 발명하여 임상에 적용되기 시작한 이래로[8] 전이성 뇌종양을 포함한 다양한 두개 내 병변에 널리 사용되고 있다. 2006년에는 외부 콜리메이터(collinator) 헬멧이 자동으로 교체가 되는 감마나이프 퍼펙션(Gamma Knife Perfexion)과 2015년에는 정위틀(stereotactic frame) 없이 마스크로 두부 고정이 가능하며 장비에 장착된 cone beam CT 영상을 활용하여 치료의 정확도를 높인 감마나이프 아이콘(Gamma Knife ICON)이 개발되어 치료에 적극적으로 활용되고 있다. 또한 1987년 뇌전이 환자 12명의 선형 가속기를 이용한 방사선 수술 장비를 이용하여 치료한 결과를 보고한[9] 이후 많은 연구들을 통하여 좋은 결과를 보고하였으며, 최근 cone beam CT 영상, robotic couch, 다발성 병변을 동시에 치료가 가능한 HyperArc 등과 같은 기술 및 치료시간을 단축시킬 수 있는 flattening filter free beam 등을 활용하여 선형가속기 기반의 방사선 수술 장비의 치료효과 및 안정성이 크게 향상되었다[10]. 본 종설에서는 전이성 뇌종양 치료를 위한 뇌정위 방사선의 역할과 이를 뒷받침해주는 여러 연구결과들 그리고 앞으로의 발전방향에 대하여 정리해 보고자 한다.
Go to : 
대략적으로 암환자의 20%에서 뇌전이가 발생한다고 알려져 있으나[1,11,12], 정확한 발병률은 이보다 높을 것으로 예상된다. 왜냐하면 실제 치료 중인 환자들은 통계조사 참여에 제한적이며 대부분의 고형암 치료 가이드라인은 신경학적 증상이 없는 환자들에게서 뇌자기공명영상 검사를 통한 선별검사를 권고하지 않고 있기 때문이다. 실제적으로 사후 부검을 통한 연구에서는 40% 이상의 높은 발생률을 보고하고 있다[13-15]. 또한 암환자의 생존율은 지속적으로 증가하는 추세이며 우리나라의 경우 뇌자기공명영상 검사의 보험급여 확대로 인하여 뇌자기공명영상 검사 시행 횟수의 증가로 전이성 뇌종양의 발생률은 점차 증가할 것으로 예상된다.
모든 종류의 암은 뇌로 전이가 가능하지만, 가장 뇌전이를 많이 하는 암으로는 폐암(20–56%), 유방암(5–20%), 흑생종(7–16%) 등이 있다[1,11,16,17]. 또한 신장암, 대장 및 직장암의 발생률 역시 높으며 유병률 역시 증가하는 추세이다[18]. 폐암은 성별에 상관없이 뇌로 가장 빈번하게 전이되는 암이면서 남성에게 가장 많이 발생하는 암이며 여성 환자에서는 유방암이 가장 뇌로 전이가 많이 된다고 알려져 있다.
원발암의 분자생물학적 아형 역시 뇌전이 발생에 영향을 미치는 것으로 알려져 있다. 대표적인 예로 human epidermal growth factor receptor 2 (HER2) amplification 또는 triple-negative hormone receptor (estrogen receptor-negative, progesterone receptor-negative and normal HER2 levels) 상태인 유방암 환자는 그렇지 않은 환자보다 뇌전이가 더 빈번하게 발생하는 것으로 보고되고 있으며 이러한 아형의 뇌전이는 새롭게 진단된 뇌전이 유방암 환자의 거의 25%을 차지하는 것으로 알려져 있다[19]. 또한 anaplastic lymphoma kinase-rearranged 비소세포폐암 환자는 특별히 뇌전이가 많이 발생하는 경향이 있는 것으로 알려져 있다[20].
현재 전이성 뇌종양 환자의 예후를 예측하는데 도움을 주는 예후 예측도구로는 1997년 Gaspar 등[21]이 고안한 Radiation Therapy Oncology Group (RTOG) recursive partitioning analysis가 있다. 1979년부터 1997년까지 시행된 세 개의 RTOG trials에 참여한 1,200명의 환자들의 정보를 바탕으로 고안된 이 예측도구는 Karnofsky Performance Scale (KPS)과 환자의 나이 그리고 원발암의 조절 여부를 가지고 class I, II, III로 나누어 예후를 예측하였다(Table 1). 이중 가장 중요한 지표는 환자의 기능적 활동 상태인데 KPS 점수가 70점 이하인 경우 예후가 가장 불량하였으며 반면에 65세 이하의 비교적 젊은 나이에 원발암의 조절이 잘되고 환자의 KPS 점수가 70점 이상인 경우에 예후가 가장 양호한 것으로 알려져 있다.
신경외과적 절제술에 이은 전뇌 방사선 치료는 일부 환자들에서 생존율을 획기적으로 증가시키고[22-24], 병리학적 진단에 도움을 주며 즉각적인 감압을 통하여 환자의 증상 조절에 도움을 준다. 1994년 Noordijk 등[22]은 단일 뇌전이 환자 66명을 대상으로 수술 후 전뇌 방사선 치료군과 단독 전뇌 방사선 치료 간의 생존율 및 삶의 질 개선 차이를 알아보고자 무작위 배정 연구를 진행하여 수술 후 방사선 치료를 시행한 군에서 생존율 향상(10개월 대 6개월, P=0.04)과 임종 전까지 기능적으로 독립 생활이 가능했던 기간으로 평가한 삶의 질 개선(7.5개월 대 3.개월, P=0.06)이 통계적으로 유의미한 차이가 있었다고 보고하였으며, 원발암의 두개강외 전이가 진행한 환자들에게는 수술적 치료의 이점이 없고 오히려 전뇌 방사선 치료가 더 효과적이라고 보고하였다. 또한 1990년에 Patchell 등[23]은 단일 병소의 전이성 뇌종양 환자들 48명을 대상으로 무작위로 수술 후 방사선 치료한 군과 조직 생검 후 방사선 치료한 군으로 나누어 진행한 연구에서 수술 후 방사선 치료를 한 군이 생존율(40주 대 15주, P<0.01), 국소 조절률(80% 대 48%, P<0.02), 그리고 기능적 독립 생활 기간(38주 대 8주, P<0.005) 등이 조직 생검 후 방사선 치료를 시행한 군보다 통계적으로 유의미하게 향상되었다고 보고하였다. 하지만 1996년 Mintz 등[24]에 의해 진행된 83명의 단일 뇌전이 환자를 대상으로 시행된 무작위 연구에서는 환자의 생존율 향상에 수술적 절제가 통계적으로 유의미한 이득이 없다고 보고하였고(6.3개월 대 5.6개월, P=0.24) 이는 연구 대상자 중 KPS 점수가 낮고 뇌 이외에 다른 장기로 전이된 환자의 비율이 높은 것을 이유로 설명하였다.
일반적으로 전이성 뇌종양 환자에게 있어서 수술적 절제는 종양의 최대 직경이 3 cm 이상이고 수술적 접근이 가능할 때, 종양 주변의 뇌 부종 및 종괴 효과가 관찰될 때, 원발암에 대한 적절한 조절로 인하여 환자의 전신 상태가 양호하고 전이성 뇌종양의 개수가 3개 이하일 때 시행할 수 있다. 또한 원발암이 방사선 치료에 저항성을 보이는 종양일 경우 수술적 치료를 고려해 볼 수 있다[25].
전이성 뇌종양은 임상적으로 원발암의 조절이 잘 되지 않은 경우 두개강 내 병변이 국소적으로 조절이 된 이후에도 재발 혹은 새로운 병변 발생이 가능하며 많은 경우 환자의 전신 상태가 양호하지 못하다는 특성이 있다. 과거에는 뇌전이가 발생한 이후 기대여명이 짧았지만 최근에 항암제 치료의 발달 등의 의료기술의 발전으로 암환자의 생존기간이 증가되었고 이에 따라 두개 내 전이성 병변의 국소적 재발에 대한 이슈가 부각되고 있다. 즉 기대여명이 길 것으로 예상되는 환자는 일회성의 치료보다는 재발 시 반복적인 치료가 가능한 방법을 선택하는 경향이 있으며 또한 암환자의 특성상 고령의 환자가 많으며 두개 내 이외의 다른 장기로 전이가 되거나 원발암에 대한 항암 방사선 치료를 통하여 전신 상태가 불량한 경우가 많아 비침습적인 치료가 선호된다. 뇌정위 방사선 수술은 이러한 반복 치료가 가능하며 비침습적인 뇌전이 치료 방법으로 각광을 받고 있다.
앞서 언급한 것처럼 뇌정위 방사선 수술은 고선량의 방사선을 환자의 두개강 내 특정 위치에 집중적으로 조사하여 목표 조직을 파괴 또는 변형을 일으키는 치료방법으로 전이성 뇌종양 환자에게 안전하고 비침습적인 치료방법이다[26]. 뇌정위 방사선 수술의 장점은 병변에 고선량의 방사선이 조사되고 병변 밖으로 갈수록 급격히 방사선량이 감소하여 주변의 정상 뇌조직이 받는 방사선량을 최소화하여 뇌조직의 손상을 막을 수 있다는 것이다. 대부분의 전이성 뇌종양은 주로 회질-백질 경계부위에 호발하는 것으로 알려져 있으며 구형의 모양이 많아 방사선 수술이 구현하고자 하는 sharp dose fall-off 현상을 적용하는데 용이하며 크기가 4 cm 이하인 경우가 많으며 교종과는 달리 주변 정상 뇌조직으로 침습적이지 않아 비교적 경계가 분명한 특징이 있다. 또한 종양 주변으로 뇌부종이 동반되어 상대적으로 작은 크기에서도 신경학적 증상이 나타나는 경우가 많아 조기에 발견되는 경우가 많으며 주로 brainstem이나 basal ganglia보다는 대뇌나 소뇌의 subcortical area에 발생하기 때문에 뇌정위 방사선 수술에 좋은 적응증이 된다[27-30]. 또한 두개 내 깊은 위치에 있거나 중요한 구조물 주변에 위치하여 수술적으로 접근이 불가능한 병변에 대하여 고식적인 절제술을 대체할 만한 치료방법으로 여겨지고 있다[31,32]. 다만 뇌정위 방사선 수술의 특성상 크기가 크거나 큰 낭종성 병변을 포함할 경우, 그리고 출혈이 동반된 경우는 적용하기가 어려운 단점이 있으며 그 빈도는 높지 않으나 일부 종양에서 방사선으로 인한 부종의 악화(3.8%) 및 종양 내 출혈(6.4%)의 위험이 있으며[33], 고선량의 방사선을 조사한 경우, 종양의 크기가 큰 경우, 그리고 이전에 방사선 치료를 받은 기왕력이 있는 환자에게서 방사선 괴사(24개월 11%)의 발생이 가능하다는 단점이 있다[34].
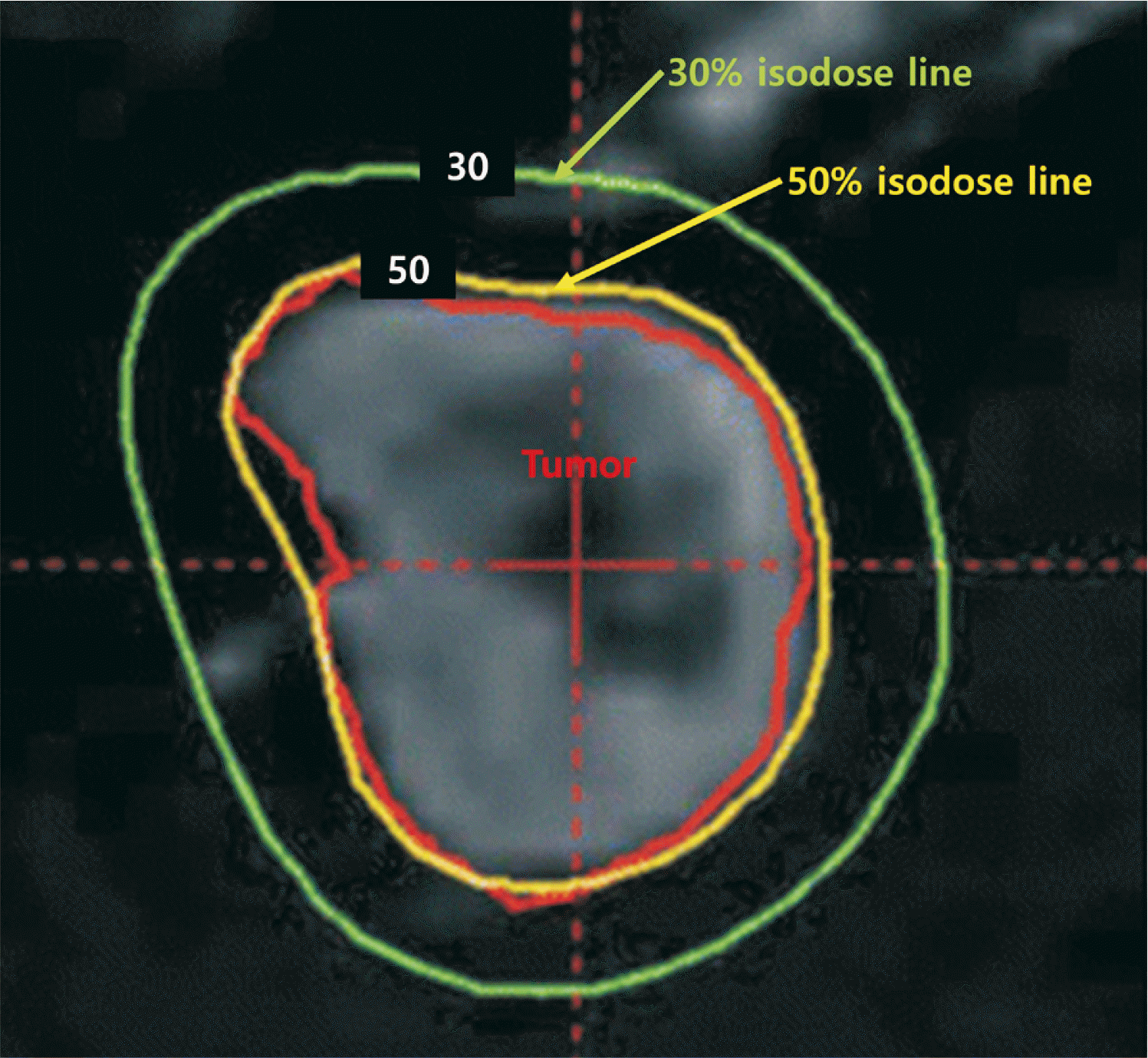
뇌정위 방사선 수술에 있어서 방사선 조사량은 prescribed isodose line 내 단위 질량당 흡수되는 에너지를 의미하는 그레이(Gy)로 표시된다. Prescribed isodose line은 그 안에 있는 모든 종양 세포들에게 조사되는 최소한의 방사선을 반영하며 대부분의 경우 이것은 종양의 외부 경계에 매우 근접한 형태가 된다. Prescribed isodose line은 주로 종양으로 조사되는 최대 방사선량의 퍼센트로 표현이 되는데, 예를 들면, 50% isodose line에 20 Gy가 조사되었다면 그 종양의 중심에 조사되는 최대 방사선량은 40 Gy가 되는 것이다(Fig. 1).
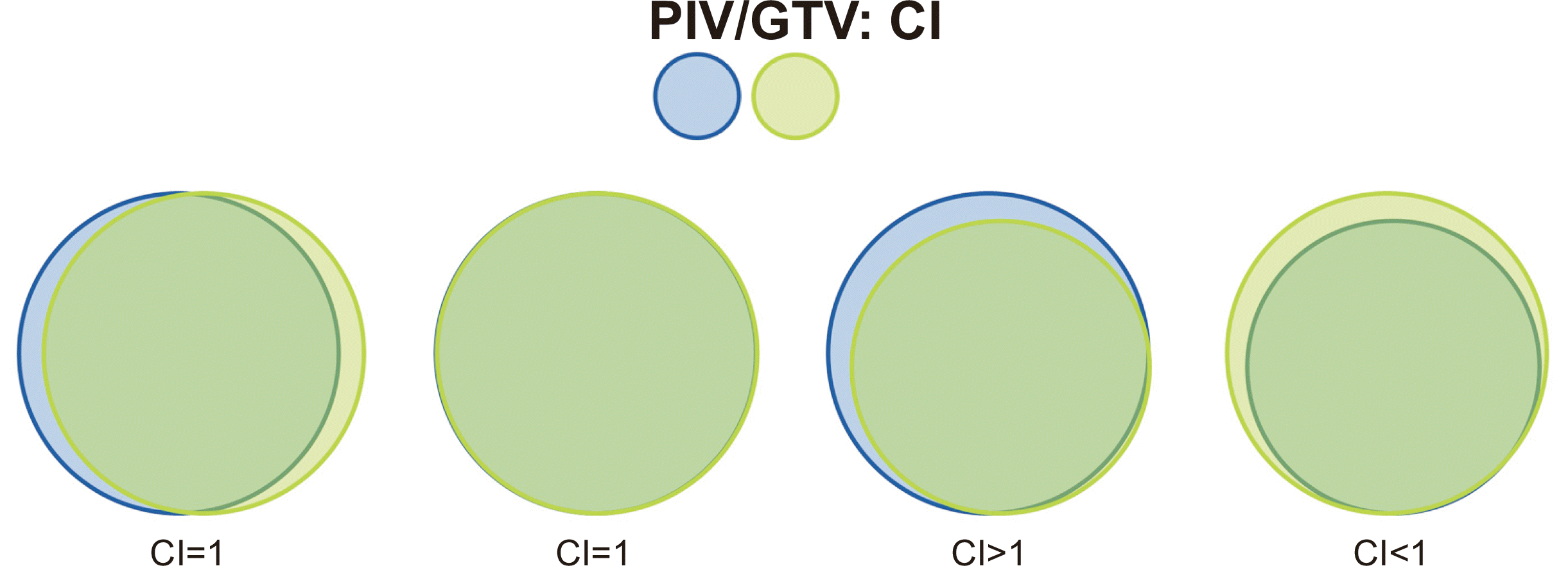
뇌정위 방사선 수술의 목표는 prescribed isodose volume (PIV) 내에 가능한 정상 뇌조직이 포함되지 않고 gross tumor volume (GTV)이 포함되도록 계획하는 것이다. PIV/GTV의 비는 뇌정위 방사선 수술 치료계획의 합치를 표현하는 방법으로 PIV와 GTV가 정확하게 일치하여 그 비율이 1이 되는 것이 이상적이나 현실적으로 불가능한 경우가 많기 때문에 최소한 GTV의 95% 이상을 PIV가 포함하도록 치료계획을 세우는 것이 바람직하다(Fig. 2). Gamma Knife 장비의 예를 들면 50% isodose line이 종양의 경계와 정확하게 일치하는 것이 바람직하겠지만 불가능한 경우가 많기 때문에 conformity index가 1일 경우는 극히 드물며 50% isodose line이 종양의 경계보다 더 넓은 범위를 포함한다면 종양 치료에는 효과적일 수 있으나 정상 뇌조직으로 조사되는 방사선 양이 증가하여 이에 대한 부작용 발생이 가능하며 이와 반대의 경우라면 종양 치료에 실패할 가능성이 있다.
뇌정위 방사선수술을 시행할 때 최대 내성 방사선 선량은 RTOG 9005 연구를 통하여 종양의 최대 직경이 <2.0 cm일 때 24 Gy, 2.1–3.0 cm일 때 18 Gy, 그리고 3.1–4.0 cm일 때 15 Gy으로 보고되었다[34]. 비록 이 연구의 결과가 뇌신경이나 뇌간 등 비교적 방사선에 민감한 구조물 근처에 발생한 전이암에 적용하기에 어려움이 있지만 뇌정위 방사선 수술 시 방사선량을 결정하는데 가이드라인과 기본적인 체계를 제공한 것에 의미가 있다. RTOG 9005 연구가 방사선 수술 시 방사선량 결정에 가이드라인을 제시했다면 이후에 RTOG 9508 연구에서는 뇌정위 방사선 수술이 뇌전이 환자에게 전뇌 방사선 치료 이후 부스트 치료로서의 역할을 보고하였다. 1–3개의 뇌전이가 있는 환자를 무작위로 전뇌 방사선 치료만 시행한 군과 추가로 뇌정위 방사선 수술을 시행한 군으로 나누어 연구가 진행되었으며 추가로 방사선 수술을 시행한 군에서 전체 생존율의 개선은 없었지만(6.5개월 대 5.7개월, P=0.135) KPS는 유의하게 높았으며(43% 대 27%, P=0.03) 수술이 불가한 단일 병소 환자들에게서 통계적으로 유의미한 생존율의 개선(6.5개월 대 4.9개월, P=0.0393)이 보고되었다[35].
수술적 절제술 및 뇌정위 방사선 수술은 둘 다 전이성 뇌종양 환자의 치료로 널리 사용되는 치료방법으로 이 둘은 상호 경쟁적인 관계가 아니라 상호 보완적인 관계로 각각의 환자 상태에 따라 더 적합한 방법을 선택하여 환자를 치료하게 된다. 수술적 절제술은 앞서 언급한 바와 같이 주로 단일 병소 환자 중 특히 즉각적인 종괴 효과의 해결이 필요한 환자들에게 주로 시행되며 4 cm 이상이거나 시신경 등과 같은 중요한 구조물과 근접한 병변에 대하여서도 치료가 가능하다. 이에 반하여 뇌정위 방사선 수술은 비침습적이라는 장점이 있으며 여러 병변에 대하여 동시에 치료가 가능하다는 장점이 있다. 일부 환자는 수술적 제거와 방사선 수술을 같이 시행하기도 한다. 예를 들어 다발성 뇌전이가 있을 때 크고 응급으로 종괴 효과를 해결해야하는 병변은 수술적 제거를 시행하고 남아있는 작은 병변에 대하여서는 방사선 수술을 시행하기도 하며 수술 후 남아있는 잔존 종양에 대하여 국소 재발을 방지하고자 방사선 수술을 시행하기도 한다. Patchell 등[36]은 단일 뇌전이 환자에게 수술적으로 전절제를 시행하고 추가 방사선 치료를 시행하지 않은 경우 46%의 재발률을 보고하였으며, Aoyama 등[37]은 뇌정위 방사선 수술 이후 12개월째 해당 병변 재발률을 27.5%로 보고하였다. 이렇듯 수술적 절제술 이후 발생하는 높은 재발률로 인하여 2020년 National Comprehensive Cancer Network clinical guideline에서는 수술 후 뇌정위 방사선 수술을 시행할 것을 권고하고 있다[38].
3개 이상의 병변이 있는 전이성 뇌종양 환자들에게 전뇌 방사선 치료가 표준 치료로서 자리 잡고 있었으나 인지기능의 저하 등의 전뇌 방사선 치료 후 발생 가능한 합병증으로 인하여 환자의 삶의 질에 악영향을 미친다는 내용의 연구결과들이 다수 보고되었다. 이런 결과들을 토대로 뇌정위 방사선 수술을 전뇌 방사선 치료와 병합하여 부스트 치료로 시행하는 개념에서 1차 치료로 뇌정위 방사선 수술을 시행하고 전뇌 방사선 치료는 구제치료로 남겨두는 형태로 패러다임이 변하고 있다[39].
Aoyama 등[37]에 의하여 시행된 무작위 배정 연구에서는 직경이 3 cm 이하인 한 개에서 네 개의 병변을 가진 전이성 뇌종양 환자 총 132을 대상으로 전뇌 방사선 치료 후 부스트 뇌정위 방사선 수술을 시행한 군과 단독 방사선 수술 시행 군으로 나누어 두 군 간의 생존율과 재발률, 1차 치료의 실패에 따른 구제치료 시행 여부, 신경학적 기능 보전 여부, 방사선과 관련된 합병증 및 사망원인 등을 비교하였다. 1년째 재발률(46.8% 대 76.4%, P<0.001)은 단독 방사선 수술군에서 통계적으로 유의미하게 높았으며 치료 실패에 따른 구제치료를 받은 환자도 전뇌 방사선 치료 후 부스트 뇌정위 방사선 수술을 시행한 군에서는 10명이었으나 단독 방사선 치료 군에서는 29명으로 통계적으로 유의미한 차이를 보였으나 생존율, 신경학적 기능 보전, 방사선과 관련된 합병증 및 사망 원인 등에서는 두 군 간에 차이가 없었다. 이에 Aoyama 등[37]은 전이성 뇌종양 치료를 위하여 전뇌 방사선 치료가 반드시 필요한 것은 아니며 장기간 신경학적 기능저하를 피하기 위하여 전뇌 방사선 치료를 연기하여도 비교적 안전하다고 결론지었다. 또한 Chang 등[40]은 전뇌 방사선 치료 또는 뇌정위 방사선 수술이 인지기능에 미치는 영향을 평가하기 위하여 1개에서 3개의 병변이 있는 뇌전이 환자들을 전뇌 방사선 치료 후 부스트 방사선 수술 시행군과 단독 방사선 수술군으로 무작위 배정 연구를 시행하였다. 연구의 일차 목표는 4개월째 신경 인지기능을 평가하는 것인데 58명의 환자가 연구에 참여하였을 때 4개월째 중간 연구결과가 전뇌 방사선 치료 후 부스트 방사선 수술 군에서 인지기능 검사 결과가 단독 방사선 수술 군에 비하여 현저한 저하를 보였기 때문에 조기 종료하였다. 다른 연구의 결과와 동일하게 American Society of Clinical Oncology의 2015년 annual meeting에서 North Central Cancer Treatment Group N0547 trial의 결과를 보고하였는데 213명 환자를 대상으로 무작위 배정 연구를 진행하여 3개월째 인지기능 검사를 시행한 결과 전뇌 방사선 치료 후 방사선 수술을 시행한 군에서 인지기능 중 immediate recall, memory, verbal fluency가 단독 방사선 수술군에 비하여 유의한 저하가 관찰됨을 보고하였다[19].
앞서 언급한 바와 같이 전뇌 방사선 치료가 인지기능에 미치는 악영향에 대한 우려로 인하여 많은 기관에서 4개 이상의 병변에 대한 치료로 방사선 수술을 시행하기 시작했다[41]. Yamamoto 등[42]은 1개에서 10개의 병변에 대한 치료로 뇌정위 방사선 수술을 시행한 1,194명에 대한 분석결과를 보고하였는데 2개에서 4개의 병변이 있는 환자군의 생존율이 10.8개월이었으며 5개에서 10개의 병변이 있는 환자군의 생존율 역시 10.8개월이었고 치료와 관련된 부작용은 두 군 간에 차이가 없었다. 이러한 결과는 10개 이하의 병변에서 전뇌 방사선 치료의 필요성에 대하여 의문을 제기하게 되었으며 또한 병변의 개수가 환자의 생존율에 크게 영향을 미치지 않는다고 보고하였다. 하지만 반대의 결과를 보고한 연구도 있는데, 대표적으로 Subbiah 등[43]은 뇌로 전이된 유방암 환자를 대상으로 진행한 연구에서 breast-grade prognostic assessment와 뇌전이 병변의 개수가 환자의 생존율에 영향을 미치는 요소라고 보고하였고 앞서 언급된 Yamamoto 등[42]에 의한 연구에서도 병변이 한 개인 환자의 생존율이 다른 군(2–4개와 5–10개)의 환자에 비하여 유의미하게 높은 결과를 보여 아직 병변 개수와 뇌정위 방사선 수술 시행 후 생존율과의 관계는 아직 명확한 결론은 없는 상태이다. 하지만 앞서 언급한 바와 같이 암환자의 삶의 질에 대한 관심이 증대되고 방사선 수술 장비의 기술적인 발전으로 치료시간 단축이 가능해짐에 따라 환자의 전신 상태를 고려하여 10개 이상의 병변에 뇌정위 방사선 수술을 시행하는 센터가 늘고 있는 추세이다[44,45].
전이성 뇌종양에 대한 수술적 치료 이후 50% 이하에서 국소 재발을 하는 것으로 알려져 있으며[46], Patchell 등[36]에 의한 무작위 배정 연구를 통하여 단일 병변의 환자에게 수술적 절제술 시행 이후 보조 전뇌 방사선 치료를 시행하는 것이 생존율 향상에 도움을 준다는 보고를 통하여 표준치료로 인식되었다. 또한 American Society for Radiation Oncology의 가이드 라인에서도 표준 치료로 수술 이후 전뇌 방사선 치료를 권장하였지만 인지기능 저하와 같은 전뇌 방사선 치료로 인하여 발생 가능한 문제점들 때문에[47], 최근 여러 후향적 연구 분석 및 무작위 배정 연구에서 전뇌 방사선 치료 대신 수술 후 뇌정위 방사선 수술을 시행한 결과들을 보고하고 있다[48]. Brennan 등[46]은 최초의 전향적 2상 연구를 통하여 1개 또는 2개의 병변을 가진 뇌전이암 환자를 대상으로 수술 이후 수술 부위에 방사선 수술을 시행한 결과를 보고하였는데 총 49명의 환자 중 39명의 환자들(40병소)을 대상으로 수술 후 방사선 수술을 시행하였고 이중 전체 병소 중 15%에서 재발하였으며 수술 후 병변의 크기를 측정하는 방법에 대하여서는 논란의 여지가 있으나 뇌실질의 표면 근처에 위치하여 경막 또는 연막을 침범한 3 cm 이상의 병변이거나 천막 하부에 위치한 병변은 국소 재발률이 높았다고 보고하였다. 또한 비교적 최근에 보고된 한 연구에서는 수술 후 병변 경계보다 2 mm 더 넓게 방사선을 조사하였을 경우 재발률이 유의미하게 낮다고(3% 대 16%, P=0.042) 보고하였다[49].
전이성 뇌종양 환자들에게 수술 전 뇌정위 방사선 수술의 효과에 대하여서는 아직 학문적 근거가 많이 부족한 실정이지만 비교적 치료 설계가 간단하다는 장점과 Brennan 등[46]에 보고처럼 수술 후 수술에 따른 합병증 때문에 방사선 수술을 시행하는 환자가 20% 정도 된다는 사실 때문에 수술 전 방사선 수술에 대한 관심이 증가하고 있다. 하지만 잠재적인 걸림돌은 대략적으로 11% 환자에서 전이성 뇌종양으로 생각하고 수술을 시행하였지만 병리학적으로 전이성 종양이 아닌 다른 종양으로 진단되는 경우[36]가 있으며 종양 주변 부종 등과 같이 방사선 수술의 합병증이 예상되는 환자들에게 수술적 절제술이 확실한 도움을 주는 경우가 있기 때문에 수술 전 뇌정위 방사선 수술을 시행하기 위하여서는 환자에 대한 면밀한 검토가 필요하다. Patel 등[50]은 전이성 뇌종양을 위해 수술 전 방사선 수술 시행한 환자 66명과 수술 후 방사선 수술을 시행한 환자 114명을 대상으로 시행한 후향적 연구에서 두 군 간에 생존율, 국소 재발률 및 두개 내 전이 등의 항목에서 차이가 없었지만 2년째 연수막 전이(16.6% 대 3.2%, P=0.010)와 방사선 괴사(16.4% 대 4.9%, P=0.010)의 발생률은 수술 후 방사선 수술을 시행한 환자들에게서 더 통계적으로 유의미하게 높았다고 보고하였으며 이러한 연구의 결과를 바탕으로 뇌전이 환자들에 대한 선행 뇌정위 방사선 수술에 대한 연구가 폭넓게 진행되고 있다.
Go to : 
암 치료에 있어서 진단 및 치료 분야에 눈부신 발전을 암 환자의 생존기간이 증가됨에 따라 전이성 종양 환자는 증가할 것이며 다양한 통로의 의료정보를 통하여 침습적인 치료보다는 비침습적인 뇌정위 방사선 수술에 대한 환자 및 보호자들의 선호도가 증가될 것으로 예상된다. 또한 뇌영상 기술의 발달과 보다 안전하고 효과적인 방사선 수술 장비의 개발 그리고 큰 종양에 대한 분할 방사선 수술 등의 방사선 수술의 테크닉의 진보로 뇌정위 방사선 수술의 적용 범위는 점점 더 확대될 것이다. 또한 전이성 뇌종양의 치료방법인 전뇌 방사선 치료, 수술적 절제술, 그리고 방사선 수술의 치료영역 및 그 역할은 명확하게 구분될 것이며 이로 인하여 전이성 뇌종양을 치료하는 여러 임상의들의 유기적인 협조를 바탕으로 한 진료가 요구될 것이다.
Go to : 
REFERENCES
1. Nayak L, Lee EQ, Wen PY. 2012; Epidemiology of brain metastases. Curr Oncol Rep. 14:48–54. DOI: 10.1007/s11912-011-0203-y. PMID: 22012633.

2. Weissman DE. 1988; Glucocorticoid treatment for brain metastases and epidural spinal cord compression: a review. J Clin Oncol. 6:543–551. DOI: 10.1200/JCO.1988.6.3.543. PMID: 3280744.

3. Brown PD, Pugh S, Laack NN, Wefel JS, Khuntia D, Meyers C, et al. 2013; Memantine for the prevention of cognitive dysfunction in patients receiving whole-brain radiotherapy: a randomized, double-blind, placebo-controlled trial. Neuro Oncol. 15:1429–1437. DOI: 10.1093/neuonc/not114. PMID: 23956241. PMCID: PMC3779047.

4. Chao JH, Phillips R, Nickson JJ. 1954; Roentgen-ray therapy of cerebral metastases. Cancer. 7:682–689. DOI: 10.1002/1097-0142(195407)7:4<682::AID-CNCR2820070409>3.0.CO;2-S.

5. Chu FC, Hilaris BB. 1961; Value of radiation theray in the management of intracranial metastases. Cancer. 14:577–581. DOI: 10.1002/1097-0142(199005/06)14:3<577::AID-CNCR2820140318>3.0.CO;2-F.
6. Mulvenna P, Nankivell M, Barton R, Faivre-Finn C, Wilson P, McColl E, et al. 2016; Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy (QUARTZ): results from a phase 3, non-inferiority, randomized trial. Lancet. 388:2004–2014. DOI: 10.1016/S0140-6736(16)30825-X.
7. Pinkham MB, Sanghera P, Wall GK, Dawson BD, Whitfield GA. 2015; Neurocognitive effects following cranial irradiation for brain metastases. Clin Oncol (R Coll Radiol). 27:630–639. DOI: 10.1016/j.clon.2015.06.005. PMID: 26119727.

8. Wu A, Lindner G, Maitz AH, Kalend AM, Lunsford LD, Flickinger JC, et al. 1990; Physics of gamma knife approach on convergent beams in stereotactic radiosurgery. Int J Radiat Oncol Biol Phys. 18:941–949. DOI: 10.1016/0360-3016(90)90421-F.

9. Sturm V, Kober B, Hover KH, Schlegel W, Boesecke R, Pastyr O, et al. 1987; Stereotactic percutaneous single dose irradiation of brain metastases with a linear accelerator. Int J Radiat Oncol Biol Phys. 13:279–282. DOI: 10.1016/0360-3016(87)90140-4.

10. Hartgerink D, Swinnen A, Roberge D, Nichol A, Zygmanski P, Yin FF, et al. 2019; LINAC based stereotactic radiosurgery for multiple brain metastases: guidance for clinical implementation. Acta Oncol. 58:1275–1282. DOI: 10.1080/0284186X.2019.1633016. PMID: 31257960.

11. Barnholtz-Sloan JS, Sloan AE, Davis FG, Vigneau FD, Lai P, Sawaya RE. 2004; Incidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System. J Clin Oncol. 22:2865–2872. DOI: 10.1200/JCO.2004.12.149. PMID: 15254054.

12. Tabouret E, Chinot O, Metellus P, Tallet A, Viens P, Goncalves A. 2012; Recent trends in epidemiology of brain metastases: an overview. Anticancer Res. 32:4655–4662.
13. Percy AK, Elveback LR, Okazaki H, Kurland LT. 1972; Neoplasms of the central nervous system. Epidemiologic considerations. Neurology. 22:40–48. DOI: 10.1212/WNL.22.1.40. PMID: 5061838.
14. Posner JB, Chernik NL. 1978; Intracranial metastases from systemic cancer. Adv Neurol. 19:579–592.
15. Tsukada Y, Fouad A, Pickren JW, Lane WW. 1983; Central nervous system metastasis from breast carcinoma: autopsy study. Cancer. 52:2349–2354. DOI: 10.1002/1097-0142(19831215)52:12<2349::AID-CNCR2820521231>3.0.CO;2-B.

16. Sperduto PW, Chao ST, Sneed PK, Luo X, Suh J, Roberge D, et al. 2010; Diagnosis-specific prognostic factors, indexes, and treatment outcomes for patients with newly diagnosed brain metastases: a multi-institutional analysis of 4,259 patients. Int J Radiat Oncol Biol Phys. 77:655–661. DOI: 10.1016/j.ijrobp.2009.08.025. PMID: 19942357.

17. Berghoff AS, Schur S, Fureder LM, Gatterbauer B, Dieckmann K, Widhalm G, et al. 2016; Descriptive statistical analysis of a real life cohort of 2419 patients with brain metastases of solid cancers. ESMO Open. 1:e000024. DOI: 10.1136/esmoopen-2015-000024. PMID: 27843591. PMCID: PMC5070252.

18. Nieder C, Spanne O, Mehta MP, Grosu AL, Geinitz H. 2011; Presentation, patterns of care, and survival in patients with brain metastases: what has changed in the last 20 years? Cancer. 117:2505–2512. DOI: 10.1002/cncr.25707. PMID: 24048799.
19. Brown PD, Asher AL, Ballman KV, Farace E, Cerhan JH, Anderson SK, et al. 2015; NCCTG N0574 (Alliance): A phase III randomized trial of whole brain radiation therapy (WBRT) in addition to radiosurgery (SRS) in patients with 1 to 3 brain metastases. J Clin Oncol. 33(18_suppl):LBA4. DOI: 10.1200/jco.2015.33.18_suppl.lba4.

20. Toyokawa G, Seto T, Takenoyama M, Ichinose Y. 2015; Insights into brain metastasis in patients with ALK+ lung cancer: is the brain truly a sanctuary? Cancer Metastasis Rev. 34:797–805. DOI: 10.1007/s10555-015-9592-y. PMID: 26342831. PMCID: PMC4661196.

21. Gaspar L, Scott C, Rotman M, Asbell S, Phillips T, Wasserman T, et al. 1997; Recursive partitioning analysis (RPA) of prognostic factors in three Radiation Therapy Oncology Group (RTOG) brain metastases trials. Int J Radiat Oncol Biol Phys. 37:745–751. DOI: 10.1016/S0360-3016(96)00619-0.

22. Noordijk EM, Vecht CJ, Haaxma-Reiche H, Padberg GW, Voormolen JH, Hoekstra FH, et al. 1994; The choice of treatment of single brain metastasis should be based on extracranial tumor activity and age. Int J Radiat Oncol Biol Phys. 29:711–717. DOI: 10.1016/0360-3016(94)90558-4.

23. Patchell RA, Tibbs PA, Walsh JW, Dempsey RJ, Maruyama Y, Kryscio RJ, et al. 1990; A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 322:494–500. DOI: 10.1056/NEJM199002223220802. PMID: 2405271.

24. Mintz AH, Kestle J, Rathbone MP, Gaspar L, Hugenholtz H, Fisher B, et al. 1996; A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer. 78:1470–1476. DOI: 10.1002/(SICI)1097-0142(19961001)78:7<1470::AID-CNCR14>3.0.CO;2-X.

25. Hatiboglu MA, Akdur K, Sawaya R. 2020; Neurosurgical management of patients with brain metastasis. Neurosurg Rev. 43:483–495. DOI: 10.1007/s10143-018-1013-6. PMID: 30058049.

26. Soffietti R, Ruda R, Trevisan E. 2008; Brain metastases: current management and new developments. Curr Opin Oncol. 20:676–684. DOI: 10.1097/CCO.0b013e32831186fe. PMID: 18841050.

27. Yu C, Chen JC, Apuzzo ML, O'Day S, Giannotta SL, Weber JS, et al. 2002; Metastatic melanoma to the brain: prognostic factors after gamma knife radiosurgery. Int J Radiat Oncol Biol Phys. 52:1277–1287. DOI: 10.1016/S0360-3016(01)02772-9.

28. Goyal LK, Suh JH, Reddy CA, Barnett GH. 2000; The role of whole brain radiotherapy and stereotactic radiosurgery on brain metastases from renal cell carcinoma. Int J Radiat Oncol Biol Phys. 47:1007–1012. DOI: 10.1016/S0360-3016(00)00536-8.

29. Leibel SA, Sheline GE. 1987; Radiation therapy for neoplasms of the brain. J Neurosurg. 66:1–22. DOI: 10.3171/jns.1987.66.1.0001. PMID: 3023563.

30. Flickinger JC, Kondziolka D, Lunsford LD, Coffey RJ, Goodman ML, Shaw EG, et al. 1994; A multi-institutional experience with stereotactic radiosurgery for solitary brain metastasis. Int J Radiat Oncol Biol Phys. 28:797–802. DOI: 10.1016/0360-3016(94)90098-1.

31. Li B, Yu J, Suntharalingam M, Kennedy AS, Amin PP, Chen Z, et al. 2000; Comparison of three treatment options for single brain metastasis from lung cancer. Int J Cancer. 90:37–45. DOI: 10.1002/(SICI)1097-0215(20000220)90:1<37::AID-IJC5>3.0.CO;2-7.

32. Hatiboglu MA, Chang EL, Suki D, Sawaya R, Wildrick DM, Weinberg JS. 2011; Outcomes and prognostic factors for patients with brainstem metastases undergoing stereotactic radiosurgery. Neurosurgery. 69:796–806. DOI: 10.1227/NEU.0b013e31821d31de. PMID: 21508879.

33. Chang EL, Selek U, Hassenbusch SJ 3rd, Maor MH, Allen PK, Mahajan A, et al. 2005; Outcome variation among "radioresistant" brain metastases treated with stereotactic radiosurgery. Neurosurgery. 56:936–945.
34. Shaw E, Scott C, Souhami L, Dinapoli R, Kline R, Loeffler J, et al. 2000; Single dose radiosurgical treatment of recurrent previously irradiated primary brain tumors and brain metastases: final report of RTOG protocol 90-05. Int J Radiat Oncol Biol Phys. 47:291–298. DOI: 10.1016/S0360-3016(99)00507-6.

35. Andrews DW, Scott CB, Sperduto PW, Flanders AE, Gaspar LE, Schell MC, et al. 2004; Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet. 363:1665–1672. DOI: 10.1016/S0140-6736(04)16250-8.

36. Patchell RA, Tibbs PA, Regine WF, Dempsey RJ, Mohiuddin M, Kryscio RJ, et al. 1998; Postoperative radiotherapy in the treatment of single metastases to the brain: a randomized trial. JAMA. 280:1485–1489. DOI: 10.1001/jama.280.17.1485. PMID: 9809728.

37. Aoyama H, Shirato H, Tago M, Nakagawa K, Toyoda T, Hatano K, et al. 2006; Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA. 295:2483–2491. DOI: 10.1001/jama.295.21.2483. PMID: 16757720.
38. Nabors LB, Portnow J, Ahluwalia M, Baehring J, Brem H, Brem S, et al. 2020; Central nervous system cancers, version 3.2020, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 18:1537–1570. DOI: 10.6004/jnccn.2020.0052. PMID: 33152694.

39. Linskey ME, Andrews DW, Asher AL, Burri SH, Kondziolka D, Robinson PD, et al. 2010; The role of stereotactic radiosurgery in the management of patients with newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 96:45–68. DOI: 10.1007/s11060-009-0073-4. PMID: 19960227. PMCID: PMC2808519.

40. Chang EL, Wefel JS, Hess KR, Allen PK, Lang FF, Kornguth DG, et al. 2009; Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial. Lancet Oncol. 10:1037–1044. DOI: 10.1016/S1470-2045(09)70263-3.

41. Knisely JP, Yamamoto M, Gross CP, Castrucci WA, Jokura H, Chiang VL. Radiosurgery alone for 5 or more brain metastases: expert opinion survey. J Neurosurg. 2010; 113 Suppl:84–89. DOI: 10.3171/2010.8.GKS10999. PMID: 21121790.

42. Yamamoto M, Serizawa T, Higuchi Y, Sato Y, Kawagishi J, Yamanaka K, et al. 2017; A multi-institutional prospective observational study of stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901 study update): irradiation-related complications and long-term maintenance of mini-mental state examination scores. Int J Radiat Oncol Biol Phys. 99:31–40. DOI: 10.1016/j.ijrobp.2017.04.037. PMID: 28816158.

43. Subbiah IM, Lei X, Weinberg JS, Sulman EP, Chavez-MacGregor M, Tripathy D, et al. 2015; Validation and development of a modified breast graded prognostic assessment as a tool for survival in patients with breast cancer and brain metastases. J Clin Oncol. 33:2239–2245. DOI: 10.1200/JCO.2014.58.8517. PMID: 25987700. PMCID: PMC5098846.

44. Minniti G, Capone L, Nardiello B, El Gawhary R, Raza G, Scaringi C, et al. 2020; Neurological outcome and memory performance in patients with 10 or more brain metastases treated with frameless linear accelerator (LINAC)-based stereotactic radiosurgery. J Neurooncol. 148:47–55. DOI: 10.1007/s11060-020-03442-7. PMID: 32100230.

45. Kim M, Cho KR, Choi JW, Kong DS, Seol HJ, Nam DH, et al. 2020; Two-staged gamma knife radiosurgery for treatment of numerous (>10) brain metastases. Clin Neurol Neurosurg. 195:105847. DOI: 10.1016/j.clineuro.2020.105847. PMID: 32371318.
46. Brennan C, Yang TJ, Hilden P, Zhang Z, Chan K, Yamada Y, et al. 2014; A phase 2 trial of stereotactic radiosurgery boost after surgical resection for brain metastases. Int J Radiat Oncol Biol Phys. 88:130–136. DOI: 10.1016/j.ijrobp.2013.09.051. PMID: 24331659. PMCID: PMC5736310.

47. Tsao MN, Rades D, Wirth A, Lo SS, Danielson BL, Gaspar LE, et al. 2012; Radiotherapeutic and surgical management for newly diagnosed brain metastasis(es): an American Society for Radiation Oncology evidence-based guideline. Pract Radiat Oncol. 2:210–225. DOI: 10.1016/j.prro.2011.12.004. PMID: 25925626. PMCID: PMC3808749.

48. Brown PD, Ballman KV, Cerhan JH, Anderson SK, Carrero XW, Whitton AC, et al. 2017; Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC•3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncol. 18:1049–1060. DOI: 10.1016/S1470-2045(17)30441-2.

49. Choi CY, Chang SD, Gibbs IC, Adler JR, Harsh GR 4th, Lieberson RE, et al. 2012; Stereotactic radiosurgery of the postoperative resection cavity for brain metastases: prospective evaluation of target margin on tumor control. Int J Radiat Oncol Biol Phys. 84:336–342. DOI: 10.1016/j.ijrobp.2011.12.009. PMID: 22652105.

50. Patel KR, Burri SH, Asher AL, Crocker IR, Fraser RW, Zhang C, et al. 2016; Comparing preoperative with postoperative stereotactic radiosurgery for resectable brain metastases: a multi-institutional analysis. Neurosurgery. 79:279–285. DOI: 10.1227/NEU.0000000000001096. PMID: 26528673.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download