초록
-Y는 남성의 조혈기관에서 발생하는 가장 흔한 체세포 유전체이상 중 하나임에도 불구하고 노화와 관련된 현상인지 아니면 질병에 연관된 이상인지에 대해 논란이 있어왔다. 문헌고찰과 최근의 분자유전학적인 연구, 그리고 본원의 12년에 걸친 증례분석을 통해 75% 이상의 중기세포에서 관찰되는 -Y 단일이상은 특히 MDS를 포함한 골수계 혈액종양과 관련됨을 알 수 있어서 원인불명의 빈혈이나 혈구감소에 동반될 때 지속적인 경과관찰이 필요하다고 생각된다. 본원에서는 비Hodgkin림프종 및 MM 환자에서도 75% 이상으로 -Y가 관찰된 예가 있어서 인구의 고령화와 함께 그 추이를 살펴볼 필요가 있겠다. 말초혈액에서 관찰되는 -Y는 혈액종양 이외에 전반적인 높은 사망률 및 낮은 기대수명, 자가면역질환, 심혈관질환, 당뇨 등과 연관되고, Y염색체 관련 유전자발현이 비생식계 조직에서도 확인되고 있으므로, X-Y 상동성 유전자 쌍 사이에 안정되고 균형 있는 발현을 유지하는 것이 남성에서 건강에 중요하다고 할 수 있다.
Go to : 
Abstract
Loss of chromosome Y (-Y) is one of the most common somatic genomic alterations in the male hematopoietic system. However, it has been widely debated whether -Y is an aging-related phenomenon or a disease-associated abnormality. Literature reviews, recent molecular genetic findings, and cytogenetic data obtained from the Dong-A University Hospital over the last 12 years supported that 75–100% of metaphases with isolated -Y were primarily associated with myeloid malignancies, including myelodysplastic syndrome. Thus, we need to monitor the frequency of -Y in patients with unexplained causes of anemia or cytopenia. We observed that in our hospital, more than 75% of -Y cases were diagnosed in patients with non-Hodgkin lymphoma or multiple myeloma, raising concerns on the disease development process when considering the increasing prevalence of these diseases in the aging population. -Y in peripheral blood has been associated with an increased risk of mortality, lower life expectancy, autoimmune disorders, cardiovascular diseases, diabetes, and hematologic malignancies. Y chromosome genes are known to be expressed in reproductive tissues. Therefore, it is crucial to maintain a regulated balance between the expression of X and Y homolog genes for men to remain healthy.
Go to : 
단일 클론성 이상 소견으로서의 Y 염색체 소실(-Y)은 남성의 조혈모세포에서 발견되는 가장 흔한 체세포 유전체 이상 중 하나이며, 말초혈액 림프구의 식물혈구응집소(phytohemagglutinin) 자극 배양이나 골수의 자연분열 중인 중기세포 모두에서 확인이 가능하다. 그러나 고령의 정상 남성에서도 나타나므로, 특징적인 형태학적 이상을 동반하지 않는 경우에는 클론성 조혈과정인지 아니면 노화현상 때문인지 구분하기 어려울 수도 있다. 골수의 핵형분석에서 -Y 빈도는 모든 남성의 약 6%, 그리고 비정상 골수에서는 15-20% 정도로 보고되고 있다. 연령과 비례하여 빈도가 증가하여 80세 이상의 건강한 남성에서는 골수의 전통적인 염색체 검사에서 20% 가까이 증가되어 있다[1-3].
-Y 이상은 조혈기관 세포에서 흔히 발견되기는 하지만 오랫동안질환과 무관한 노화현상의 하나로서 인식되어 왔다. 그러나 그간의 연구에서 급성백혈병의 치료 후 관해상태에서 -Y가 사라지고 정상핵형으로 회복되거나, 염색체 분석한 세포의 75% 이상에서 -Y를 보였던 남자 환자들은 혈액종양 질환과 연관됨을 나타내어 백혈병과 관련한 클론성 현상임을 시사하고 있다[1-5]. 골수형성이상증후군(myelodysplastic syndrome, MDS), 골수증식질환(myeloproliferative neoplasms, MPN), 급성골수백혈병(acute myeloid leukemia, AML)뿐만 아니라 림프세포증식질환 환자에서 단일 이상이거나 혹은 다른 염색체이상과 동반되어 나타나고, 또한 말초혈액 중의 -Y는 혈액종양 이외에 전반적인 높은 사망률 및 낮은 기대수명, 자가면역질환, 심혈관질환, 당뇨 등과 연관되고, 종양조직의 -Y는 두경부, 신장, 식도, 췌장 등 다양한 고형종양 질환에서 보고되고 있다[2-8].
그러나 이러한 소견이 어느 정도까지 원인을 제공하는 것인지 아니면 여러 변수 중의 하나인지는 명확하지 않으며, 원인이라고 하더라도 그 기전은 잘 알려져 있지 않다. 최근 대규모 전장 유전체 연관성 연구와 표적 차세대염기서열분석(next generation sequenc-ing, NGS) 등을 통해 -Y와 관련된 생식세포 단일염기다형성(single nucleotide polymorphisms, SNP), 메틸화 반응, 종양특이 체세포변이를 확인하고자 하는 연구들이 시도되고 있다[2, 3]. 본 종설에서는 일차적으로 혈액종양 질환에서 -Y의 임상적 의의를 파악하여 현재까지 알려진 관련 체세포 변이를 검토하고 나아가 혈액세포 유래의 돌연변이가 다른 장기 질환의 진행에 미치는 영향 등을 살펴보고자 한다.
Go to : 
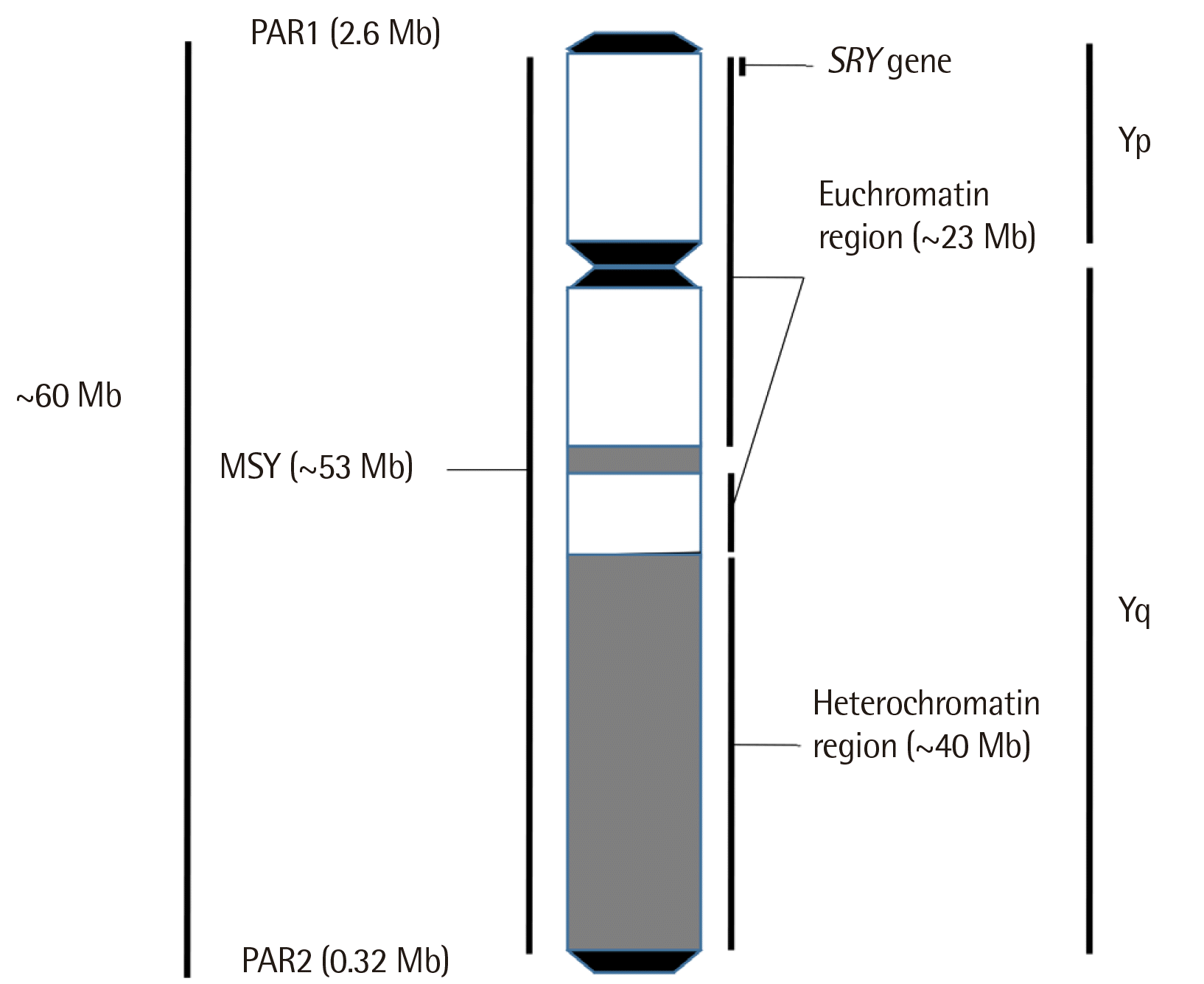
Y 염색체는 그 크기, 구조, 내용물, 안전성 및 유전 등이 다른 염색체와는 큰 차이가 있다. Y 염색체 크기는 약 60 megabase (Mb)이며, 두 개의 가성상염색체부위(pseudoautosomal regions, PAR)과 남성특이부위Y (male-specific region Y, MSY)를 포함한다(Fig. 1). PAR1 및 PAR2는 각각 2.6 Mb와 320 kb DNA로 구성되어 있고, Y 염색체의 양쪽 종말체 끝에 위치한다. MSY는 Y 염색체 길이의 95%를 차지하며, 약 53 Mb 크기로서 23 Mb의 퍼진염색질(euchro-matin)과 30-40 Mb의 뭉친염색질(heterochromatin)로 되어 있다. Y 염색체는 주로 뭉친염색질로 되어 유전자는 많지 않으며, 약 46-78개의 단백-부호화 유전자를 갖는다[5, 8-10].
PAR1 및 PAR2의 유전자는 X 염색체의 PAR에도 존재하여, 남성에서 감수분열 동안 PAR에서 X와 Y 염색체 사이에 교차가 발생하고, PAR 유전자는 X 비활성화를 이탈하여 여성과 남성의 조직 및 세포에서 거의 같은 수준으로 발현되게 된다. MSY 유전자 중에는 X 염색체의 유전자와 동일하지는 않으나 진화론적으로 잘 보존되어 유사한 상동성을 보이면서 다양한 조직에서 발현되는 다수의 유전자(예. DDX3Y, EIF1AY, KDM5D, RPS4Y, TBL1Y, USP9Y, UTY, ZFY 등)와 함께, 고환에 특이하게 분포하는 유전자들(예. HSFY, RBMY, SRY, TSPY 등)이 있다[5, 8, 9, 11]. 전자의 경우 유전자 발현과 단백 안정성을 잘 조절하여 X-Y 상동성 유전자 쌍 사이에 안정되고 균형 있는 발현을 유지하는 것이 남성에서 건강에 중요함을 알 수 있다.
Go to : 
-Y 빈도는 남성의 연령과 함께 증가하고, 그 크기 또한 연령에 따라 점차 증가한다. MDS, MPN, AML 및 림프세포증식질환 등에서정상인 경우보다 훨씬 높은 빈도로 발견되며, 질환이 없는 때에 75% 이상의 세포에서 관찰되는 경우는 상당히 드물다. 필라델피아염색체 양성인 만성골수백혈병(chronic myeloid leukemia, CML)이나t(8;21)을 동반한 AML에서는 이차성 현상으로 나타나서 추가적인임상적 중요성은 없는 것으로 생각되고 있다[1, 2, 12-15].
신규 MDS 환자의 약 반에서 현재의 클론성의 염색체 이상이 검출되며, MDS의진단과 예후 및 치료에 중요한 역할을 하고 있다. 단일 이상으로서 -Y는 MDS 남성 환자의 약 4-10%에서 관찰되고, WHO 분류에서는 del(5q) 혹은 del(7q)와는 달리 -Y 자체를 MDS 진단기준에 포함하고 있지는 않는데, 염색체가 정상인 경우에 비해 생존율이 높아서 International Prognosis Score System 개정안(IPSS-R)에서는 아주 좋은 예후군에 속한다[1, 2, 12-20].
Wiktor 등[12, 14]은 중기세포의 75% 이상에서 -Y가 관찰될 때, 의의 있게 75세 이상인 고령의 환자가 많았으며, 전체 97명 중 MDS 혹은 만성골수단구백혈병(chronic myelomonocytic leukemia, CMML) 환자가 41명으로서, 특히 질병과 연관된 클론성 이상을 나타낸다고 하였다. Wong 등[16]은 11년간 총 2,896명의 염색체 결과를 분석하여, 142명(5%)에서 -Y 이상을 확인하였는데, 중기세포의 100%가 -Y인 20명에서 통계적으로 의의 있게 주로 MDS의 악성 클론의 표지자가 된다고 하였다(대응비 3.8). Shahrabi 등[15]은 -Y는 35세 이하의 MDS 남성환자에서는 확인되지 않으며, 연령증가에 따른 유전체 불안정 현상일 수 있고 따라서 -Y 이외에 다른체세포 변이를 포함할 수 있다고 하였다.
Wiktor 등[14]은 75% 이상의 중기세포에서 -Y를 보였던 총 14명의 혈액종양 환자를 대상으로 경과 관찰을 하였는데, 두 명의 MDS 환자는 -Y 빈도의 증가를 보였고, 한 명 MDS에서는 오히려 감소하였다고 하였다. 또한 한 명의 MDS를 포함한 네 명의 -Y 골수계 종양환자에서 질병의 경과 중에 -Y 세포에서 추가적인 클론성 이상을 보이는 등 진행하는 양상을 보고하였다. 스페인 MDS 그룹[19]은 등록된 3,581명 MDS 및 CMML 환자 중 177명(4.9%)에서 -Y를 확인하였고, 이 중 75% 이상의 -Y를 동반한 98예를 분석하였다. 그 결과, 75% 미만인 경우에 비해 모세포증가MDS 아형(refractory anemia with excess blasts, RAEB)이 적고 CMML과 MDS/MPN 빈도가 더 높았고, 정상핵형의 MDS에 비해 -Y 군이 백혈병으로 이행할위험률이 낮았다고 하였다. 이러한 소견을 종합하면 연령증가와함께 종말체의 길이가 짧아진다거나 Y 염색체는 S-단계 후반에 복제가 되므로 -Y 현상에 의해 세포주기가 단축되어 골수계 아세포에 대한 증식이 억제되거나 혹은 보호되는 것을 하나의 기전으로서 제안하고 있다[1, 2, 19].
동아대학교병원에서 2009-2020년에 걸쳐 조사한 결과(Table 1)에서는 전체 골수배양의 6.3%에서 -Y가 단일 이상으로서 발견되었고, 이 중 75% 이상의 -Y는 0.7%인 총 15 검체에서 확인되었다. 두 명의 MDS 환자가 포함되었고 -Y는 모두 84%씩 나타났다. 그리고 형태학적으로 MDS는 아니지만 만성질환빈혈 2예, 면역혈소판감소자색반병 2예, 혈소판감소증 1예에서 80-100%의 -Y가 관찰되었다.
Summary of the 15 cases of hematologic diseases with isolated Y chromosome loss (≥75% of metaphases) in Dong-A University Hospital 2009–2020
최근 Ouseph 등[2]은 73명의 단일 -Y 이상이 골수에서 확인된 환자를 분석하여, 75% 이상 양성을 보이는 32명에서 특히 통계적으로 유의하게 MDS 유병률이 높았으며 다변량 분석을 통해 골수계 종양의 독립적인 예측인자라고 하였다(대응비 6.17). 더욱이 골수계종양에 특이한 체세포 변이를 가질 확률과 체세포 변이의 수가 높아서 75% 이상의 -Y 소견을 보이면, 골수계 종양과 관련된 체세포 변이가 증가하고 MDS의 형태학적 특징과 연관된다고 하였으나, 그 분자생물학적 기전은 아직 명확하지 않다고 하였다. 가장 흔하게 변이를 보인 유전자는 TET2, SF3B1, U2AF1, ZRSR 2 및 ASXL1라고 하였다. 그 중 12명에서는 경과를 모니터하였는데, 진단 초기에 골수계 형태이상이 없던 일곱 명 중 네 명은 MDS로 진행하면서 -Y 비율이 증가하거나 계속 100%를 나타내었고, 나머지 세 명에서는 -Y 빈도가 증가함에도 불구하고 골수계 질환으로 진행하지는않았다고 한다. 다섯 명은 진단시부터 MDS의 형태학적 이상을 동반하였고, 그 중 세 명은 100%의 -Y를 유지하고 두 명에서는 관찰중에 -Y 비율이 증가하였다. 이 기간 동안 체세포 변이는 MDS로진행함에 따라 변이의 수가 증가하고, 진단 당시부터 MDS 소견을보였던 군에서도 대부분 변이가 증가하였는데, 해당 유전자는 TET2, ZRSR 2, RUNX1, ASXL1, SETBP1, STAG2, IDH1, STAT3, CBL, CBLB및 PHF6였다고 한다.
단일 이상 -Y가 75% 이상의 중기세포에서 관찰되는 AML은 MDS보다 드물어서 전체적으로 3.0-3.7% 정도의 빈도로 보고하고 있으며, 단일 이상 -Y를 동반한 MDS에 비해 더 불량한 예후를 보고하고 있다[1, 2, 12, 16]. Wiktor 등[12]에 의하면 단일 -Y 이상을 보인 총 215명 중 AML은 일곱 명(3.3%)이었고, 그 중 세 명에서는 100% -Y를 보였다. 이들의 경과 관찰 결과, 한 명은 초기의 100%에서MDS로 되면서 60-70%로 감소하였고, 다른 한 명도 100%에서 70%로 감소하고, 세 번째 환자는 4개월째 계속 100%를 보였다고 하였다. 본원에서는 69세 성숙 AML 환자 한 명에서 진단 시에 -Y가 95% 확인되었고, 이후 5회 더 검사를 하였는데 관해와 함께 0%로 되었다가 재발하면서 다시 25%로 증가하는 소견을 나타내었다(Table 1).
Wiktor 등[12, 14]은 MPN에서 약 7.6% 빈도의 -Y를 보고하고, MDS와 AML에 비해 그 퍼센트는 작다고 하였다. 본원의 통계에서는 두 명의 본태혈소판증가증 환자가 포함되었는데(Table 1), 각각 연령은 76세와 78세, 그리고 -Y는 84% 및 95%였고 경과 관찰은 하지 않았다. 한 명의 62세 CML 환자에서는 진단 초기에는 2회에 걸쳐 필라델피아 염색체만 관찰되었는데, 이 후 3회 더 염색체 검사를 실시하였고, 필라델피아 염색체는 음성이고 BCR-ABL1 융합 전사의 주요분자반응을 보임에도 불구하고 81%와 34.6% 등 2회에 걸쳐 -Y가 관찰되었다. MPN은 질환의 특성상 주요 세 계열의 조혈세포를 모두 포함하고 골수의 세포충실도가 증가하므로 -Y가 비정상 클론임을 반영할 가능성이 높지만, 골수에 남아 있는 일부 정상세포에 나타날 수도 있고, 예후 관련성도 아직 확실하지는 않다[1, 13, 14, 16].
Zhang 등[13]은 G-분염법과 FISH 검사로 총 237명의 혈액종양환자 중 24명(10.1%)에서 클론성 -Y 이상을 검출하였는데, 다섯 명의 림프종과 세 명의 다발골수종(multiple myeloma, MM)을 포함하고 있고, 75%를 넘는 경우는 MM 한 명이었다. Wiktor 등[14]의 연구에서는 총 39예의 림프세포증식질환이 포함되어, 그 중 12명은 100% -Y를 보였는데, 증식률이 낮은 질환임을 고려할 때 높은 -Y 퍼센트는 악성 림프종 세포와 연관됨을 뜻한다고 하였다. Wiktor 등[12]에 의하면 75% 이상의 -Y를 보일 때 B세포림프종의 대응비는 다른 혈액종양 질환에 비해 낮아서 2.6이라고 하였다. Shah-rabi 등[15]에 의하면, T세포에 비해 B세포 질환에 -Y가 더 많이 보고되고 있고, 외투세포림프종에서는 -Y에 의한 PAR1 및 관련 유전자의 소실이 종양 억제 유전자의 역할을 나타낸다고 하였다.
본원의 12년간의 자료에서는 총 두 명의 비Hodgkin림프종 환자가 75% 이상의 -Y를 보이는 것으로 확인되었고(90%와 100%), 한명의 MM 환자는 78세였고 100%에서 -Y가 관찰되었다. 세 명 모두경과 관찰은 하지 않았다(Table 1).
Go to : 
말초혈액 중의 -Y는 역학적 분석을 통해 조혈과 관련된 질환 이외에 자가면역질환, 황반변성, 심혈관질환, 알츠하이머병(대응비 2.8, 위험도 6.8), 제2형당뇨, 비만, 혈액종양 이외에 각종 종양(위험도 2.47) 및 모든 원인에 기인한 사망률(위험도 1.91-5.24)과 연관되어 있음이 확인되고 있다[3-9, 11, 21]. 특히 최근에 Thompson 등[3]은 영국내 바이오뱅크 자원을 이용하여 20만명 이상의 남성 인구를 대상으로 PAR에 위치하는 대립유전자-특이 유전형 검사를시행하였는데, 그 결과 약 20%에서 -Y를 검출할 수 있었다. -Y 빈도는 연령과 함께 증가하여 40세에 2.5%이고 70세에는 43.6%였다. Danielsson 등[4]은 SNP-어레이 결과를 활용한 새로운 공식을 제안하여, -Y 빈도를 최고 5회까지 22년간 종적으로 분석하였는데 -Y 빈도는 개인간에 차이가 크며, 그 이유는 확실하지 않으나 -Y를 가진 클론의 증식력과 해당 전구세포의 수명과 관련이 있다고 하였다. 흡연, 음주, 대기오염과 같은 외부인자도 -Y 클론의 진행에 영향을 미친다고 하였다. Forsberg [7]와 Guo 등[8]은 혈액세포 중의 -Y이상이 다른 장기에 이상을 초래하는 기전을 면역감시체계의 이상으로서 설명하기도 하지만 증거가 충분하지는 않다.
Graham 등[6]은 362명의 남성과 719명의 여성이 포함된 뇌인지장애 코호트를 대상으로 전장유전체 염기서열법을 사용해서 말초혈액과 뇌조직 사이의 성염색체이상을 정량분석하였다. 그 결과 고령화에 따른 뇌신경변성이 X와 Y염색체 사이에 다르게 영향을 미치고, 이러한 연관성은 소뇌에서는 관찰되지 않아 뇌조직의 부위에 따라 다른 것을 알 수 있었다. Godfrey 등[9] 또한 수백 명으로부터 유래한 36개 다양한 조직을 대상으로 Y염색체 관련 유전자발현을 정량분석하였는데, 예상과 달리 Y염색체 유전자가 비생식계 조직에서도 발현이 증가되어 있음을 알 수 있었다. X-Y염색체 사이에 발현되는 유전자 혹은 단백의 증가 혹은 감소를 관찰하여 특정한 세포, 조직 그리고 발달단계에 따른 유전체의 변화를 파악하는 것이 특히 중요하다고 하였다.
Go to : 
REFERENCES
1. Van Dyke DL. 2001; -Y, Y loss in leukemia. Atlas Genet Cytogenet Oncol Haematol. 5:56–7.
2. Ouseph MM, Hasserjian RP, Dal Cin P, Lovitch SB, Steensma DP, Nardi V, et al. 2021; Genomic alterations in patients with somatic loss of the Y chromosome as the sole cytogenetic finding in bone marrow cells. Haematologica. 106:555–64. DOI: 10.3324/haematol.2019.240689. PMID: 32193254. PMCID: PMC7849577.
3. Thompson DJ, Genovese G, Halvardson J, Ulirsch JC, Wright DJ, Terao C, et al. 2019; Genetic predisposition to mosaic Y chromosome loss in blood. Nature. 575:652–7. DOI: 10.1038/s41586-019-1765-3. PMID: 31748747. PMCID: PMC6887549.
4. Danielsson M, Halvardson J, Davies H, Torabi Moghadam B, Mattisson J, Rychlicka-Buniowska E, et al. 2020; Longitudinal changes in the frequency of mosaic chromosome Y loss in peripheral blood cells of aging men varies profoundly between individuals. Eur J Hum Genet. 28:349–57. DOI: 10.1038/s41431-019-0533-z. PMID: 31654039. PMCID: PMC7028735.

5. Lau YC. 2020; Y chromosome in health and diseases. Cell Biosci. 10:97. DOI: 10.1186/s13578-020-00452-w. PMID: 32817785. PMCID: PMC7427063.

6. Graham EJ, Vermeulen M, Vardarajan B, Bennett D, De Jager P, Pearse RV 2nd, et al. 2019; Somatic mosaicism of sex chromosomes in the blood and brain. Brain Res. 1721:146345. DOI: 10.1016/j.brainres.2019.146345. PMID: 31348909. PMCID: PMC6717667.

7. Forsberg LA. 2017; Loss of chromosome Y (LOY) in blood cells is associated with increased risk for disease and mortality in aging men. Hum Genet. 136:657–63. DOI: 10.1007/s00439-017-1799-2. PMID: 28424864. PMCID: PMC5418310.

8. Guo X, Dai X, Zhou T, Wang H, Ni J, Xue J, et al. 2020; Mosaic loss of human Y chromosome: what, how and why. Hum Genet. 139:421–46. DOI: 10.1007/s00439-020-02114-w. PMID: 32020362.

9. Godfrey AK, Naqvi S, Chmátal L, Chick JM, Mitchell RN, Gygi SP, et al. 2020; Quantitative analysis of Y-chromosome gene expression across 36 human tissues. Genome Res. 30:860–73. DOI: 10.1101/gr.261248.120. PMID: 32461223. PMCID: PMC7370882.

10. HGNC (HUGO Gene Nomenclature Committee). https://www.genenames.org. Last accessed on June 2012.
11. Kido T, Lau YF. 2015; Roles of the Y chromosome genes in human cancers. Asian J Androl. 17:373–80. DOI: 10.4103/1008-682X.150842. PMID: 25814157. PMCID: PMC4430935.
12. Wiktor A, Rybicki BA, Piao ZS, Shurafa M, Barthel B, Maeda K, et al. 2000; Clinical significance of Y chromosome loss in hematologic disease. Genes Chromosomes Cancer. 27:11–6. DOI: 10.1002/(SICI)1098-2264(200001)27:1<11::AID-GCC2>3.0.CO;2-I. PMID: 10564581.

13. Zhang LJ, Shin ES, Yu ZX, Li SB. 2007; Molecular genetic evidence of Y chromosome loss in male patients with hematological disorders. Chin Med J. 120:2002–5. DOI: 10.1097/00029330-200711020-00012. PMID: 18067786.

14. Wiktor AE, Van Dyke DL, Hodnefield JM, Eckel-Passow J, Hanson CA. 2011; The significance of isolated Y chromosome loss in bone marrow metaphase cells from males over age 50 years. Leuk Res. 35:1297–300. DOI: 10.1016/j.leukres.2011.05.002. PMID: 21703685.

15. Shahrabi S, Khodadi E, Saba F, Shahjahani M, Saki N. 2018; Sex chromosome changes in leukemia: cytogenetics and molecular aspects. Hematology. 23:139–47. DOI: 10.1080/10245332.2017.1375063. PMID: 28889783.

16. Wong AK, Fang B, Zhang L, Guo X, Lee S, Schreck R. 2008; Loss of the Y chromosome: an age-related or clonal phenomenon in acute myelogenous leukemia/myelodysplastic syndrome? Arch Pathol Lab Med. 132:1329–32. DOI: 10.5858/2008-132-1329-LOTYCA. PMID: 18684036.

17. Greenberg PL, Tuechler H, Schanz J, Sanz G, Garcia-Manero G, Solé F, et al. 2012; Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 120:2454–65. DOI: 10.1182/blood-2012-03-420489. PMID: 22740453. PMCID: PMC4425443.

18. Ganster C, Kämpfe D, Jung K, Braulke F, Shirneshan K, Machherndl-Spandl S, et al. 2015; New data shed light on Y-loss-related pathogenesis in myelodysplastic syndromes. Genes Chromosomes Cancer. 54:717–24. DOI: 10.1002/gcc.22282. PMID: 26394808.

19. Nomdedeu M, Pereira A, Calvo X, Colomer J, Sole F, Arias A, et al. 2017; Clinical and biological significance of isolated Y chromosome loss in myelodysplastic syndromes and chronic myelomonocytic leukemia. A report from the Spanish MDS Group. Leuk Res. 63:85–9. DOI: 10.1016/j.leukres.2017.10.011. PMID: 29121539.

20. Hasserjian RP, Orazi A, et al. Swerdlow SH, Campo E, editors. 2017. Myelodysplastic syndromes: overview. WHO classification of tumours of haematopoietic and lymphoid tissues. 4th ed. International Agency for Research on Cancer;Lyon, France: p. 98–106.
21. Loftfield E, Zhou W, Yeager M, Chanock SJ, Freedman ND, Machiela M. 2019; Mosaic Y loss is moderately associated with solid tumor risk. Cancer Res. 79:461–6. DOI: 10.1158/0008-5472.CAN-18-2566. PMID: 30510122. PMCID: PMC6359954.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download