Abstract
Varices are a frequent complication of liver cirrhosis and a major cause of mortality in patients with liver cirrhosis. Patients with decompensated cirrhosis complications have a poor prognosis and require careful management. Portal hypertension is the most common complication of liver cirrhosis, which is the key determinant for varices development. Increased intrahepatic vascular resistance to portal flow leads to the development of portal hypertension. Collateral vessels develop at the communication site between the systemic and portal circulation with the progression of portal hypertension. Varices are the representative collaterals, develop gradually with the progression of portal hypertension and may eventually rupture. Variceal bleeding is a major consequence of portal hypertension and causes the death of cirrhotic patients. The present paper reviews the latest knowledge regarding the diagnosis and management of esophageal and gastric variceal bleeding.
간경변증의 흔한 합병증인 정맥류는 상부 내시경 검사를 시행한 간경변증 환자 중 약 52%에서 관찰되며,1 Child-Pugh A등급을 보이는 간기능이 양호한 대상성 간경변증 환자에 비해 Child-Pugh B등급 또는 C등급을 보이는 비대상성 간경변증 환자에서 더욱 흔히 관찰된다(35-43% vs. 48-72%).1,2 간경변증으로 인해 발생하는 문맥압항진증이 정맥류 발생의 주요 원인으로 알려져 있다. 간경변증 환자에서 간내 혈관저항이 증가하여 문맥압항진증이 발생하고 이러한 문맥압항진증은 과역동적 순환(hyperdynamic circulation)에 의해 더욱 악화된다.3-5 문맥압항진증이 점차 진행하면 전신순환계와 문맥순환계가 교차하는 영역에 우회혈관들(collateral vessels)이 발생하게 되는데, 식도 및 위정맥류가 대표적인 우회혈관이라 할 수 있다. 위•식도정맥류는 문맥압항진증이 진행함에따라 점차 진행하고 파열되면 심한 출혈이 발생하여 간경변증환자의 주된 사망 원인이 되고 있다. 따라서 위•식도정맥류에대한 적절한 관리가 반드시 필요하다.
정맥류가 동반되지 않은 간경변증 환자 중 1년에 5-9%, 2년에 14-17%의 환자에서 정맥류가 새로이 발견되며,6,7 문맥압항진증이 심할수록 정맥류 발생 위험이 증가하게 된다.6 크기가 작은 식도정맥류는 1년에 12%, 2년에 25%에서 크기가 증가하여 큰 정맥류로 진행하며, 간경변증의 원인이 알코올 관련 간질환인 경우, 비대상성 간경변증 및 비장비대 동반된 경우에 식도정맥류 진행의 위험이 증가하는 것으로 알려져 있다.7 위•식도정맥류가 동반된 간경변증 환자의 12% 정도가 1년이내 정맥류 출혈을 경험한다고 보고되었고, 정맥류 출혈의주요 위험인자로는 정맥류의 크기(작은 정맥류 출혈 빈도는 5%, 큰 정맥류 출혈 빈도는 15%), 정맥류 표면에 적색징후동반 여부 및 비대상성 간경변증이다.8 최근 위•식도정맥류 출혈에 대한 치료가 발전함에 따라 정맥류 출혈 환자의 예후가과거에 비해 크게 향상되었으나9,10 여전히 12-22%의 높은 사망률을 보인다.11-13 따라서 본고에서는 위•식도정맥류 출혈의진단과 치료에 대해 알아보고자 한다.
토혈 또는 흑색변 등 상부위장관 출혈을 시사하는 증상을주소로 내원한 환자에서 황달, 복수, 퍼덕떨림을 동반한 인지기능 장애, 다리부종, 거미상 혈관종이 동반되어 있거나 영상 검사에서 비장비대, 복부혈관의 우회순환(collateral circulation)의 소견이 있으면 문맥압 항진증에 의한 정맥류 출혈을 의심해야 하며, 내시경 검사에서 활동성 출혈이 동반된 정맥류가 관찰되거나 정맥류 표면에 혈괴(blood clot)나 섬유소 마개(fibrin plug)가 붙어 있는 경우에 식도정맥류 출혈로 진단할 수 있으며 위내 혈액은 관찰되나 식도정맥류 이외의 잠재적인 출혈 병소가 발견되지 않는 경우에도 진단할 수 있다(Fig. 1).14 이전 무작위 배정 임상 시험에서는 내시경 검사 시행 전 비위관 삽입을 통한 세척술이 환자군에서 위바닥(fundus) 관찰에 도움이 된다는 결과를 보고하였으나, 39명의 환자를 대상으로 시행한 소규모 임상 시험이고 실제 임상 상황에서는 충분한 위 세척이 어렵다는 점을 고려하면 비위관을 통한 위 세척의 유용성에 대하여는 논란의 여지가 있다.15
식도정맥류 출혈은 신속한 치료와 집중 모니터링이 필요한내과적 응급 질환으로서 출혈 병소를 정확히 진단하기 전이라 하더라도 초기 순환 및 호흡 유지가 중요하다. 안정적인 혈역학적 상태를 유지하기 위해서는 적절한 수액요법과 수혈이 이루어져야 한다. 스페인의 단일 기관에서 수행된 무작위 배정 임상 시험에서는 상부위장관 출혈 환자를 ‘제한적 수혈(초기 헤모글로빈 7 g/dL 미만 시에 7-9 g/dL를 유지하도록 수혈)’ 환자군과 ‘비교적 자유로운 수혈(초기 헤모글로빈 9 g/dL 미만 시에 9-11 g/dL를 유지하도록 수혈)’ 환자군으로 무작위 배정하였고 ‘제한적 수혈’ 환자군에서 ‘비교적 자유로운 수혈’ 환자군에 비해 사망률(5% vs. 9%, p=0.02)과 부작용 발생률(12% vs. 18%, p=0.01)이 유의하게 감소하였음을 보고하였다.16 ‘제한적 수혈’ 환자군에서 보인 사망률 감소 효과는 낮은 지혈 실패율과 부작용 발생률과 관련된 것으로 해석하였다. 식도정맥류 출혈 환자의 혈역학적 상태, 활동성 출혈 여부, 연령, 동반 심혈관계 질환 유무 등을 고려하여 적절한 수액요법과 농축 적혈구 수혈을 시행하되, 과도한 수액/수혈요법은 문맥압을 상승시켜 오히려 정맥류 출혈을 조장할 수 있으므로 주의가 필요하다.17 이전 임상 연구에서 정맥류 출혈 환자에서 신선동결혈장 수혈 또는 재조합 응고인자 VIIa 투여를 통한 출혈경향성의 교정 효과를 평가하였으나 효과가 뚜렷하지 않아 이러한 치료는 권고되지 않는다.18,19 정맥류 출혈 환자는혈소판 감소증이 동반된 경우가 많으나 혈소판 수혈의 효과에관한 임상 연구가 없어 근거가 부족하나 심한 혈소판 감소증을 보이는 환자에서는 고려해볼 수 있겠다.
간경변증 환자에서 위장관 출혈이 발생할 경우 세균 감염의 발생 위험이 높으므로 내원 당시부터 예방적 항생제 치료가 반드시 필요하다. 무작위 배정 임상 연구를 포함한 다수의메타분석에서 예방적 항생제 치료는 세균 감염, 재출혈, 사망위험을 감소시키는 것이 입증되었다.20,21 최근에 보고된 메타분석 결과에 따르면, 정맥류 출혈 환자에서 예방적 항생제 치료는 사망(RR 0.79; 95% CI 0.63-0.98), 세균 감염 관련 사망 (RR 0.43; 95% CI 0.19-0.97), 세균 감염 발생(RR 0.35; 95%CI 0.26-0.47), 재출혈(RR 0.53; 95% CI 0.38-0.74) 위험을 모두 낮추는 것으로 나타났다.21 위장관 출혈을 보이는 간경변증환자에서 ceftriaxone과 norfloxacin 치료의 세균 감염 예방효과를 비교한 무작위 배정 임상 연구에서 세균 감염 발생 (11% vs. 26%, p=0.03), 자발성 세균성 복막염 또는 균혈증 (2% vs. 12%, p=0.03) 위험이 ceftriaxone 투여 환자군에서유의하게 감소함이 보고되었다.22 그러나 스페인에서 수행된 이 연구는 비대상성 간경변증 환자만을 대상으로 하였고 norfloxacin 투여 환자군에서 검출된 균이 대부분 norfloxacin 내성 균주였던 점을 고려할 때 간경변증 환자 전체에 적용이가능한지에 대하여는 논란의 여지가 있다. 따라서 지역의 항생제별 내성 빈도를 고려하여 적절한 항생제를 선택하여 투여할 필요가 있다. 최근 대부분의 지역에서 퀴놀론계 항생제 내성률이 높은 점을 고려하면 정맥류 출혈 환자에서 세균 감염 예방을 위해 ceftriaxone 단기간 투여가 권장된다.
혈관수축제에는 vasopressin, terlipressin, somatostatin, octreotide과 같은 약물이 포함되는데, 정맥류 출혈 환자에서 문맥압을 감소시킴으로써 지혈 효과를 나타낸다. 다수의 무작위 배정 임상 연구를 포함한 메타분석 결과에 따르면 식도정맥류 출혈 환자에서 혈관수축제 투여 시에 7일째 사망률 감소(RR 0.74; 95% CI 0.57-0.95)와 지혈 성공률 향상(RR 1.21; 95% CI 1.13-1.30)이 입증되어,23 정맥류 출혈이 의심되는 환자에서는 내원 이후 내시경 검사 시행 전 가능한 빠른 시간 내에 예방적 항생제 치료와 함께 혈관수축제 투여를 시작해야 한다. Vasopressin은 전신 및 내장동맥의 혈관수축을 유발함으로써 문맥압을 감소시키는 효과는 있으나, 관상동맥 혈류를 감소시키고 말초혈관 저항을 증가시키는 등의 부작용이 많아 정맥류 출혈 환자에서 지혈 목적으로는 사용하지 않는다. Vasopressin의 합성 유사체인 terlipressin은 문맥압을 감소시켜 지혈에 효과적이며, 사망률 감소 효과(RR 0.66; 95% CI 0.49-0.88)가 증명된 유일한 약물이기는 하나,24 관상동맥 수축으로 인한 심장허혈 등의 부작용이 알려져 있으므로 투여 전 주의가 필요하다.25,26 그러나 최근에 보고된 메타분석23과 국내 다기관에서 수행된 무작위 배정 임상 연구11에서는 정맥류 출혈 지혈 효과와 생존율 등의 치료 결과에 있어 terlipressin, somatostatin, octreotide 간에 차이는 없었다. 이러한 연구 결과를 바탕으로 정맥류 출혈 환자에서는 terlipressin, somatostatin, octreotide 중 한 가지 약물을 선택하여 3-5일간 투여하도록 한다(Table 1).27,28
식도정맥류 출혈이 의심되는 환자에서 출혈 병소를 확인하고 지혈술을 시행하기 위해 가급적 빠른 시간 내 내시경 검사를 시행하고 식도정맥류 출혈이 확인되면 내시경적 지혈술을 시행한다. 내시경 정맥류 결찰술(endoscopic variceal ligation, EVL)이 1차 치료로 권장되며 내시경 주사 경화요법(endoscopic injection sclerotherapy, EIS)은 시술 실패, 합병증 발생 위험이 높아 더 이상 추천되지 않는다.29-33 식도정맥류 출혈 환자에서 EVL과 EIS를 비교 평가한 메타분석에서는 사망률은 차이가 없었으나(RR 0.95; 95% CI 0.77-1.17), EVL 시행군에서 재출혈이 감소하고(RR 0.68; 95% CI 0.57-0.81), 정맥류 소실률이 향상됨(RR 1.06; 95% CI 1.01-1.12)을 확인하였다.34
재출혈의 위험이 높은 일부 선별된 환자에서는 내시경적 지혈술 시행 후 조기에 경경정맥 간내문맥전신 단락술(transjugular intrahepatic portosystemic shunt, TIPS)을 시행하는 것을 고려할 수 있다. 간정맥압력차(hepatic venous pressure gradient)가 20 mmHg를 초과하는 문맥압항진증 환자를 대상으로 시행한 무작위 배정 임상 연구35와 Child-Pugh 점수 10-13점의 C등급 환자와 혈관수축제 투여에도 불구하고 내시경 검사에서 활동성 출혈이 확인된 Child-Pugh B등급 환자를 대상으로 시행한 무작위 배정 임상 연구36에서 TIPS 시행군에서 지혈 성공률 향상과 사망률 감소가 확인되었다. 그러나 해당 연구들에서는 Child-Pugh A등급 환자, 내시경 검사에서 활동성 출혈이 없는 B등급 환자, Child-Pugh 점수 14-15점의 C등급 환자, 75세 이상의 고령 환자, 높은 혈청 크레아티닌 농도(>3 mg/dL), Milan criteria를 벗어나는 간세포암종 환자 등 많은 제외 기준을 두고 수행된 임상 연구로서, 실제로 임상현장에서 접하는정맥류 출혈 환자 중 극히 일부 환자에 적용 가능한 결과임을고려해야 한다. 또한 최근의 전향 관찰 연구에서 조기에 TIPS를시행한 환자군에서 1년 내 재출혈 발생 위험은 유의하게 감소하였으나(3% vs. 49%, p<0.001), 1년 생존율은 차이가 없음을보고하여(66.8±9.4% vs. 74.2±7.8%, p=0.78),37 식도정맥류출혈 환자에서 내시경적 지혈술 시행 후 조기 TIPS 시행의적절한 대상 환자와 치료 효과에 관하여는 추가적인 연구가필요하다. 내시경적 지혈술을 통해 성공적으로 지혈된 환자에서 양성자펌프억제제(proton pump inhibitor, PPI) 투여의 유용성에 대하여는 근거가 부족하여 논란의 여지가 있으나, 이전무작위 배정 임상 시험 결과에서는 EVL 이후 단기간 PPI 투여한 환자군에서 EVL 시행 부위 궤양의 크기가 감소함을 보고하여 식도정맥류 출혈 환자에서 EVL 이후 단기간 PPI 투여를고려해볼 수 있겠다.38
출혈 발생 이후 5일 이내 사망하거나 다음 항목 중 하나 이상을 만족하여 치료를 변경해야 하는 경우 식도정맥류 출혈 치료 실패로 정의한다.41
- 약물 치료 또는 내시경적 지혈술 2시간 경과 후 100 mL이상의 토혈이 발생한 경우
- 저혈량성 쇼크가 발생한 경우
- 수혈 없이 24시간 이내 3 g/dL 이상의 혈색소 감소(또는헤마토크릿 9% 이상 감소)가 확인된 경우
TIPS는 식도정맥류 출혈 환자 중 지혈에 실패한 경우 구조요법으로서 우선적으로 고려해야 한다.42 약물 치료와 EIS에도 불구하고 지혈에 실패한 58명의 정맥류 출혈 환자에서 TIPS의 효과를 분석한 전향 관찰 연구에서 52명(90%)에서 지혈에 성공하였고, 1년 및 3년 생존율은 51.7% 및 40.2%로 보고하였다.42 단, 간경변증 환자에서는 문맥혈전증이 동반된 경우가 있어 이러한 경우 TIPS 시행이 어려우므로 혈역학적으로 안정된 환자에서는 영상 검사를 시행하여 문맥혈전증 여부를 확인할 필요가 있다. 풍선 탐폰(balloon tamponade) 삽입법은 TIPS 등의 구조요법 전 가교 치료(bridging therapy)로서 시행하는데, 약 80-90%의 환자에서 지혈 효과를 보이기는 하나 감압 이후 재출혈 위험이 높게는 50%에 이르는 것으로 보고되었다.43,44 또한 식도 파열, 식도 궤양, 흡인성 폐렴 등의 심각한 합병증을 유발할 위험이 있고 이에 따른 사망률이 20%에 이르는 것으로 보고되어 풍선 탐폰 거치 기간이24시간을 넘지 않도록 주의해야 한다.45
위정맥류는 위의 점막 하 정맥이 확장된 상태를 뜻하며 상부위장관 출혈의 원인 중 하나이다(Fig. 2). 위정맥류는 간경변증 환자의 약 20%에서 발생하며, 위정맥류 환자의 약 25%
가 2년 내에 출혈하는 것으로 보고되었다.46 식도정맥류에 비해 상대적으로 발생 빈도는 낮으나, 심각한 출혈을 유발하여위정맥류 출혈 환자에서의 재출혈률 및 사망률은 식도정맥류출혈 환자와 비교하여 더 높은 것으로 알려져 있다.46-48
위정맥류는 식도정맥류 동반 여부 및 위정맥류 위치에 따라 위식도정맥류(gastroesophageal varices, GOV)와 단독위정맥류(isolated gastric varices, IGV)로 분류된다. 위식도정맥류는 식도정맥류가 위의 소만을 따라 확장된 경우(GOV type 1, GOV1)와 위바닥으로 확장된 경우(GOV type 2, GOV2)로 나뉘며, 단독 위정맥류는 식도정맥류 없이 독립된정맥류가 위바닥에 위치한 경우(IGV type 1, IGV1)와 위 내다른 부위에 위치한 경우(IGV type 2, IGV2)로 나뉜다.46
위정맥류 출혈 환자만을 대상으로 한 임상 연구는 매우 부족하나 제한적 수혈과 예방적 항생제 치료는 위장관 출혈이 있는 간경변증 환자에서 재출혈률 감소와 생존율 향상이 입증되었다.16,49 혈관수축제(terlipressin, octreotide, somatostatin) 투여 효과도 위정맥류 환자만을 대상으로 효과를 평가한 임상 연구가 제한적이어서 정확한 평가가 어려우나 위정맥류 출혈 환자가 포함된 정맥류 출혈 환자 대상 연구들을 살펴보면 혈관수축제 투여는 지혈 성공률을 유의하게 향상시키는 것으로 보고되었다.23,50-52
내시경 정맥류 폐쇄술(endoscopic variceal obturation, EVO)은 n-butyl cyanoacrylate와 같은 조직접착제를 정맥류 내로 직접 주입함으로써 지혈하는 치료법이다.39 시술 과정에서 조직접착제에 의한 내시경 기구 손상, 폐색전증, 복강 내 누출, 천자침 관련 합병증 위험이 있어 주의가 필요하다. 폐색전증 발생 예방을 위해 주입하는 조직 접착제의 양은 한 번에 1 mL를 넘지 않도록 하는 것이 좋다. Cyanoacrylate는 혈액과 접촉하면 즉시 경화되므로 천자침을 늦게 뺄 경우에 천자침이 정맥류에 박힌 상태에서 굳는 상황이 발생할 수 있는데, 이러한 상황을 방지하기 위해 cyanoacrylate와 lipiodol과 같은 식물성 오일을 적절한 비율로 혼합하여 경화 속도를 늦추는 방법이 시도되고 있다.53,54 그러나 오히려 lipiodol이 색전증을 조장할 우려가 있어 최적의 방법에 대하여는 추가적인 연구가 필요하다.55 Lipiodol은 방사선 비투과성 물질이므로 EVO 시술 이후 흉부 및 복부 방사선 촬영을 하면 시술의 효과와 폐색전증이나 복강 내 누출 등의 합병증 발생 여부를 확인할 수 있다. 역행 경정맥 폐색술(retrograde transvenous obliteration, RTO)은 위신장단락(gastrorenal shunt)을 통해 위정맥류에 역행적으로 접근하여 정맥류에 동반되어 있는 우회혈관을 차단한 후 정맥류 내에 경화제 또는 색전물질을 주입하여 정맥류를 소실시키는 치료법이다.
GOV1은 식도정맥류가 위의 소만을 따라 확장된 것으로 좌위정맥(left gastric vein)으로부터 유입되는 혈류에 의해 형성된다. EIS나 EVL로 식도정맥류를 근절(eradication)하면 60-65%에서 위정맥류도 함께 소실되는 점으로 보아 GOV1에서 식도정맥류와 위정맥류는 매우 밀접한 관계가 있음을 알수 있다.46,56 위정맥류는 식도정맥류에 비해 크기가 크고 정맥류를 덮고 있는 점막층의 두께가 두꺼워 충분히 결찰하기 어려운 경우가 많고 내시경적 지혈술 시술 부위가 지속적으로위산과 음식물에 노출된다는 점에 대한 고려가 필요하다.51,57,58 GOV1 출혈 환자에서 EVL의 지혈 성공률은 80-90%,지혈술 후 재출혈률은 14-56%로 보고되었고, EVO의 지혈 성공률은 85-100%, 지혈술 후 재출혈률은 3-26%로 보고되었다.51,56,57,59,60 GOV1 출혈 환자에서 EVL과 EVO의 치료 효과를 비교한 후향 연구에서 지혈 성공률은 유의한 차이가 없었으나(82.6% vs. 100%, p=0.08), EVL 시행군에서 EVO 시행군에 비해 높은 재출혈률이 보고되었다(p=0.004).61
식도정맥류가 위바닥으로 확장된 경우를 GOV2, 단독으로 위바닥에 정맥류가 형성된 경우를 IGV1으로 분류하며,46 이들을 위바닥 정맥류로 통칭한다. 위바닥 정맥류는 식도정맥류와 달리 후방위정맥(posterior gastric vein)과 짧은위정맥(short gastric vein)으로부터 유입되는 혈류에 의해 형성되는 경우가 대부분이다.62,63 위바닥 정맥류 출혈은 대부분 크기가 큰 정맥류에서 발생하고 위신장(gastrorenal) 혹은 비신장단락(splenorenal shunt)이 동반된 경우가 많으며,64 정맥류내 혈류 속도가 빠르고 혈류량도 많아 지혈술이 어렵고 재출혈 위험이 높다.
내시경적 지혈술에는 EVO, EVL, EIS 등이 있으며 내시경 검사로 출혈 병소를 확인하고 즉각적인 지혈술 시행이 가능하다는 장점이 있다. 이 중 EVO는 위바닥 정맥류 출혈 환자에서 가장 널리 시행하는 치료이다.65 EVO는 위정맥류 출혈에서 EVL에 비해 지혈 성공률이 높고(OR 4.44; 95% CI 1.14-17.3), IGV1에서는 재출혈률도 낮았다(OR 0.06; 95% CI 0.01-0.58).66
위바닥 정맥류 출혈 환자에서 TIPS와 EVO의 효과를 비교한 연구에서는 두 치료 모두에서 90% 이상의 높은 지혈 성공률이 확인되었으나 TIPS 시행 환자군에서 스텐트 폐색 및 간성뇌증 발생 등의 부작용 위험이 높고 치료 비용이 높은 단점
이 있었다.67,68 TIPS는 내시경적 지혈술에도 불구하고 지혈에실패한 경우 구조요법으로서 시행할 수 있으며 지혈 성공률은 90-100%로 보고되었다.69-71 위신장단락이 동반된 위정맥류출혈 환자에서 풍선차단역행경정맥 폐색술(balloon-occluded retrograde transvenous obliteration, BRTO)은 지혈 성공률은 90% 이상으로 TIPS와 비교하여 차이가 없었으나,72-74 재출혈률이 감소하고(OR 0.27; 95% CI 0.09-0.81) 간성뇌증 발생 위험이 낮아(OR 0.05; 95% CI 0.02-0.13) 위정맥류 출혈환자에서 위신장단락이 동반되어 있는 경우 RTO (BRTO 혹은 vascular plug-assisted retrograde transvenous obliteration)를 우선적으로 고려할 수 있겠다.74
내시경적 지혈술에도 불구하고 지혈에 실패한 경우 구조요법으로 TIPS를 고려할 수 있다. 지혈에 실패한 위정맥류 출혈 환자에서 TIPS를 시행한 경우 지혈 성공률은 90-96%로 보고되었고 이는 식도정맥류 출혈 환자에서의 지혈 성공률과 큰 차이가 없다.70,71 비록 소규모 임상 연구이기는 하나 지혈 실패 위정맥류 출혈 환자에서 BRTO도 TIPS와 유사한 지혈 효과를 보여 위신장단락이 동반된 환자에서 구조요법으로서 BRTO 시행을 고려해 볼 수 있겠다.72,74 최근 보고된 국내 후향 연구 결과에 따르면 위정맥류 출혈 환자에서 BRTO 시행한 경우 TIPS와 비교하여 지혈 성공률(OR 4.72; p=0.06)과 재출혈률(p=0.06 by log-rank test)은 차이가 없었으나 생존율이 향상됨(adjusted hazards ratio 0.44; p=0.01)을 보고하였다.75 구조요법 시행 전 가교 치료로서 풍선 탐폰 삽입법을 시행할 수 있다.43
정맥류 출혈은 간경변증과 문맥압항진증 환자에서 여전히 심각한 합병증이다. 적절한 약물 치료 및 내시경적 치료에도 불구하고 사망률이 12-22%로 높다. 식도정맥류 출혈이 의심되는 경우 출혈 병소의 확인 및 지혈술을 위해 빠른 시간 내 내시경을 시행해야 하며, 식도정맥류 출혈이 확인되면 내시경적 지혈술을 시행해야 한다. 정맥류 출혈 환자에서는 혈중 헤모글로빈 7-9 g/dL를 유지하는 것을 목표로 제한적인 농축 적혈구 수혈이 권장된다. 위장관 출혈이 있는 간경변증 환자에서는 세균 감염의 발생 위험이 높으므로 내원 당시부터 단기간 예방적 항생제 치료가 필요하다. 정맥류 출혈이 의심되는 경우 가능한 빠른 시간 내에 terlipressin, somatostatin, octreotide 중 한 가지 약물을 투여해야 한다. 약물 및 내시경 치료에도 불구하고 지혈에 실패한 정맥류 출혈 환자에서 구조요법으로서 TIPS를 고려해야 하는데 위정맥류 출혈 환자에서는 RTO도 고려해 볼 수 있다. TIPS 등의 치료 전 가교 치료로서 풍선 탐폰 삽입법을 시행할 수 있다(Fig. 3).
REFERENCES
1. D'Amico G, Pasta L, Morabito A, et al. 2014; Competing risks and prognostic stages of cirrhosis: a 25-year inception cohort study of 494 patients. Aliment Pharmacol Ther. 39:1180–1193. DOI: 10.1111/apt.12721. PMID: 24654740.
2. Kovalak M, Lake J, Mattek N, Eisen G, Lieberman D, Zaman A. 2007; Endoscopic screening for varices in cirrhotic patients: data from a national endoscopic database. Gastrointest Endosc. 65:82–88. DOI: 10.1016/j.gie.2006.08.023. PMID: 17185084.

3. Iwakiri Y, Groszmann RJ. 2006; The hyperdynamic circulation of chronic liver diseases: from the patient to the molecule. Hepatology. 43(2 Suppl 1):S121–S131. DOI: 10.1002/hep.20993. PMID: 16447289.

4. García-Pagán JC, Gracia-Sancho J, Bosch J. 2012; Functional aspects on the pathophysiology of portal hypertension in cirrhosis. J Hepatol. 57:458–461. DOI: 10.1016/j.jhep.2012.03.007. PMID: 22504334.

5. Abraldes JG, Iwakiri Y, Loureiro-Silva M, Haq O, Sessa WC, Groszmann RJ. 2006; Mild increases in portal pressure upregulate vascular endothelial growth factor and endothelial nitric oxide synthase in the intestinal microcirculatory bed, leading to a hyperdynamic state. Am J Physiol Gastrointest Liver Physiol. 290:G980–G987. DOI: 10.1152/ajpgi.00336.2005. PMID: 16603731.

6. Groszmann RJ, Garcia-Tsao G, Bosch J, et al. 2005; Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med. 353:2254–2261. DOI: 10.1056/NEJMoa044456. PMID: 16306522.

7. Merli M, Nicolini G, Angeloni S, et al. 2003; Incidence and natural history of small esophageal varices in cirrhotic patients. J Hepatol. 38:266–272. DOI: 10.1016/S0168-8278(02)00420-8.

8. North Italian Endoscopic Club for the Study and Treatment of Esophageal Varices. 1988; Prediction of the first variceal hemorrhage in patients with cirrhosis of the liver and esophageal varices. A prospective multicenter study. N Engl J Med. 319:983–989. DOI: 10.1056/NEJM198810133191505. PMID: 3262200.
9. McCormick PA, O'Keefe C. 2001; Improving prognosis following a first variceal haemorrhage over four decades. Gut. 49:682–685. DOI: 10.1136/gut.49.5.682. PMID: 11600472. PMCID: PMC1728509.

10. Carbonell N, Pauwels A, Serfaty L, Fourdan O, Lévy VG, Poupon R. 2004; Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology. 40:652–659. DOI: 10.1002/hep.20339. PMID: 15349904.

11. Seo YS, Park SY, Kim MY, et al. 2014; Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage. Hepatology. 60:954–963. DOI: 10.1002/hep.27006. PMID: 24415445.

12. Villanueva C, Piqueras M, Aracil C, et al. 2006; A randomized controlled trial comparing ligation and sclerotherapy as emergency endoscopic treatment added to somatostatin in acute variceal bleeding. J Hepatol. 45:560–567. DOI: 10.1016/j.jhep.2006.05.016. PMID: 16904224.

13. Reverter E, Tandon P, Augustin S, et al. 2014; A MELD-based model to determine risk of mortality among patients with acute variceal bleeding. Gastroenterology. 146:412–419.e3. DOI: 10.1053/j.gastro.2013.10.018. PMID: 24148622.

14. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Practice Guidelines Committee of the American Association for the Study of Liver Diseases. Practice Parameters Committee of the American College of Gastroenterology. 2007; Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology. 46:922–938. DOI: 10.1002/hep.21907. PMID: 17879356.

15. Lee SD, Kearney DJ. 2004; A randomized controlled trial of gastric lavage prior to endoscopy for acute upper gastrointestinal bleeding. J Clin Gastroenterol. 38:861–865. DOI: 10.1097/00004836-200411000-00005. PMID: 15492601.

16. Villanueva C, Colomo A, Bosch A, et al. 2013; Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med. 368:11–21. DOI: 10.1056/NEJMoa1211801. PMID: 23281973.

17. Castañeda B, Morales J, Lionetti R, et al. 2001; Effects of blood volume restitution following a portal hypertensive-related bleeding in anesthetized cirrhotic rats. Hepatology. 33:821–825. DOI: 10.1053/jhep.2001.23437. PMID: 11283845.

18. Bosch J, Thabut D, Bendtsen F, et al. 2004; Recombinant factor VIIa for upper gastrointestinal bleeding in patients with cirrhosis: a randomized, double-blind trial. Gastroenterology. 127:1123–1130. DOI: 10.1053/j.gastro.2004.07.015. PMID: 15480990.

19. Bosch J, Thabut D, Albillos A, et al. 2008; Recombinant factor VIIa for variceal bleeding in patients with advanced cirrhosis: a randomized, controlled trial. Hepatology. 47:1604–1614. DOI: 10.1002/hep.22216. PMID: 18393319.

20. Bernard B, Grangé JD, Khac EN, Amiot X, Opolon P, Poynard T. 1999; Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology. 29:1655–1661. DOI: 10.1002/hep.510290608. PMID: 10347104.

21. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila F, et al. 2011; Meta-analysis: antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding - an updated Cochrane review. Aliment Pharmacol Ther. 34:509–518. DOI: 10.1111/j.1365-2036.2011.04746.x. PMID: 21707680.

22. Fernández J, Ruiz del Arbol L, Gómez C, et al. 2006; Norfloxacin vs ceftriaxone in the prophylaxis of infections in patients with advanced cirrhosis and hemorrhage. Gastroenterology. 131:1049–1285. DOI: 10.1053/j.gastro.2006.07.010. PMID: 17030175.

23. Wells M, Chande N, Adams P, et al. 2012; Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther. 35:1267–1278. DOI: 10.1111/j.1365-2036.2012.05088.x. PMID: 22486630.

24. Ioannou G, Doust J, Rockey DC. 2003; Terlipressin for acute esophageal variceal hemorrhage. Cochrane Database Syst Rev. (1):CD002147. DOI: 10.1002/14651858.CD002147. PMCID: PMC7017851.

25. Suk KT, Baik SK, Yoon JH, et al. 2012; Revision and update on clinical practice guideline for liver cirrhosis. Korean J Hepatol. 18:1–21. DOI: 10.3350/kjhep.2012.18.1.1. PMID: 22511898. PMCID: PMC3326994.

26. Solà E, Lens S, Guevara M, et al. 2010; Hyponatremia in patients treated with terlipressin for severe gastrointestinal bleeding due to portal hypertension. Hepatology. 52:1783–1790. DOI: 10.1002/hep.23893. PMID: 20931555.

27. de Franchis R. Baveno VI Faculty. 2015; Expanding consensus in portal hypertension: report of the Baveno VI consensus workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol. 63:743–752. DOI: 10.1016/j.jhep.2015.05.022. PMID: 26047908.
28. Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. 2017; Portal hypertensive bleeding in cirrhosis: risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology. 65:310–335. DOI: 10.1002/hep.28906. PMID: 27786365.

29. Hashizume M, Ohta M, Ueno K, Tanoue K, Kitano S, Sugimachi K. 1993; Endoscopic ligation of esophageal varices compared with injection sclerotherapy: a prospective randomized trial. Gastrointest Endosc. 39:123–126. DOI: 10.1016/S0016-5107(93)70050-4.

30. Lo GH, Lai KH, Cheng JS, et al. 1995; A prospective, randomized trial of sclerotherapy versus ligation in the management of bleeding esophageal varices. Hepatology. 22:466–471. DOI: 10.1002/hep.1840220215.

31. Laine L, Cook D. 1995; Endoscopic ligation compared with sclerotherapy for treatment of esophageal variceal bleeding. A meta-analysis. Ann Intern Med. 123:280–287. DOI: 10.7326/0003-4819-123-4-199508150-00007. PMID: 7611595.
32. Lo GH, Lai KH, Cheng JS, et al. 1997; Emergency banding ligation versus sclerotherapy for the control of active bleeding from esophageal varices. Hepatology. 25:1101–1104. DOI: 10.1002/hep.510250509. PMID: 9141424.

33. Stiegmann GV, Goff JS, Michaletz-Onody PA, et al. 1992; Endoscopic sclerotherapy as compared with endoscopic ligation for bleeding esophageal varices. N Engl J Med. 326:1527–1532. DOI: 10.1056/NEJM199206043262304. PMID: 1579136.

34. Dai C, Liu WX, Jiang M, Sun MJ. 2015; Endoscopic variceal ligation compared with endoscopic injection sclerotherapy for treatment of esophageal variceal hemorrhage: a meta-analysis. World J Gastroenterol. 21:2534–2541. DOI: 10.3748/wjg.v21.i8.2534. PMID: 25741164. PMCID: PMC4342933.

35. Monescillo A, Martínez-Lagares F, Ruiz-del-Arbol L, et al. 2004; Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding. Hepatology. 40:793–801. DOI: 10.1002/hep.20386. PMID: 15382120.

36. García-Pagán JC, Caca K, Bureau C, et al. 2010; Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med. 362:2370–2379. DOI: 10.1056/NEJMoa0910102. PMID: 20573925.

37. Rudler M, Cluzel P, Corvec TL, et al. 2014; Early-TIPSS placement prevents rebleeding in high-risk patients with variceal bleeding, without improving survival. Aliment Pharmacol Ther. 40:1074–1080. DOI: 10.1111/apt.12934. PMID: 25230051.

38. Shaheen NJ, Stuart E, Schmitz SM, et al. 2005; Pantoprazole reduces the size of postbanding ulcers after variceal band ligation: a randomized, controlled trial. Hepatology. 41:588–594. DOI: 10.1002/hep.20593. PMID: 15726658.

39. Korean Association for the Study of the Liver (KASL). 2020; KASL clinical practice guidelines for liver cirrhosis: varices, hepatic encephalopathy, and related complications. Clin Mol Hepatol. 26:83–127. DOI: 10.3350/cmh.2019.0010n. PMID: 31918536. PMCID: PMC7160350.
40. Labenz C, Beul L, Toenges G, et al. 2019; Validation of the simplified Animal Naming Test as primary screening tool for the diagnosis of covert hepatic encephalopathy. Eur J Intern Med. 60:96–100. DOI: 10.1016/j.ejim.2018.08.008. PMID: 30131209.

41. de Franchis R. Baveno V Faculty. 2010; Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 53:762–768. DOI: 10.1016/j.jhep.2010.06.004. PMID: 20638742.

42. Azoulay D, Castaing D, Majno P, et al. 2001; Salvage transjugular intrahepatic portosystemic shunt for uncontrolled variceal bleeding in patients with decompensated cirrhosis. J Hepatol. 35:590–597. DOI: 10.1016/S0168-8278(01)00185-4.

43. Panés J, Terés J, Bosch J, Rodés J. 1988; Efficacy of balloon tamponade in treatment of bleeding gastric and esophageal varices. Results in 151 consecutive episodes. Dig Dis Sci. 33:454–459. DOI: 10.1007/BF01536031. PMID: 3280273.
44. Terés J, Cecilia A, Bordas JM, Rimola A, Bru C, Rodés J. 1978; Esophageal tamponade for bleeding varices. Controlled trial between the Sengstaken-Blakemore tube and the Linton-Nachlas tube. Gastroenterology. 75:566–569. DOI: 10.1016/S0016-5085(19)31660-9.
45. Haq I, Tripathi D. 2017; Recent advances in the management of variceal bleeding. Gastroenterol Rep (Oxf). 5:113–126. DOI: 10.1093/gastro/gox007. PMID: 28533909. PMCID: PMC5421505.

46. Sarin SK, Lahoti D, Saxena SP, Murthy NS, Makwana UK. 1992; Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology. 16:1343–1349. DOI: 10.1002/hep.1840160607. PMID: 1446890.

47. de Franchis R, Primignani M. 2001; Natural history of portal hypertension in patients with cirrhosis. Clin Liver Dis. 5:645–663. DOI: 10.1016/S1089-3261(05)70186-0.

48. Sarin SK. 1997; Long-term follow-up of gastric variceal sclerotherapy: an eleven-year experience. Gastrointest Endosc. 46:8–14. DOI: 10.1016/S0016-5107(97)70202-5.

49. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI, Soares-Weiser K, Uribe M. 2010; Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane Database Syst Rev. 2010:CD002907. DOI: 10.1002/14651858.CD002907.pub2. PMID: 20824832. PMCID: PMC7138054.

50. Besson I, Ingrand P, Person B, et al. 1995; Sclerotherapy with or without octreotide for acute variceal bleeding. N Engl J Med. 333:555–560. DOI: 10.1056/NEJM199508313330904. PMID: 7623904.

51. Calès P, Masliah C, Bernard B, et al. 2001; Early administration of vapreotide for variceal bleeding in patients with cirrhosis. N Engl J Med. 344:23–28. DOI: 10.1056/NEJM200101043440104. PMID: 11136956.

52. Zuberi BF, Baloch Q. 2000; Comparison of endoscopic variceal sclerotherapy alone and in combination with octreotide in controlling acute variceal hemorrhage and early rebleeding in patients with low-risk cirrhosis. Am J Gastroenterol. 95:768–771. DOI: 10.1111/j.1572-0241.2000.01858.x. PMID: 10710072.

53. Seewald S, Ang TL, Imazu H, et al. 2008; A standardized injection technique and regimen ensures success and safety of N-butyl-2-cyanoacrylate injection for the treatment of gastric fundal varices (with videos). Gastrointest Endosc. 68:447–454. DOI: 10.1016/j.gie.2008.02.050. PMID: 18760173.

54. Bhasin DK, Sharma BC, Prasad H, Singh K. 2000; Endoscopic removal of sclerotherapy needle from gastric varix after N-butyl-2-cyanoacrylate injection. Gastrointest Endosc. 51:497–498. DOI: 10.1016/S0016-5107(00)70459-7.

55. Henry Z, Patel K, Patton H, Saad W. 2021; AGA clinical practice update on management of bleeding gastric varices: expert review. Clin Gastroenterol Hepatol. 19:1098–1107.e1. DOI: 10.1016/j.cgh.2021.01.027. PMID: 33493693.

56. Park SW, Seo YS, Lee HA, et al. 2016; Changes in cardiac varices and their clinical significance after eradication of esophageal varices by band ligation. Can J Gastroenterol Hepatol. 2016:2198163. DOI: 10.1155/2016/2198163. PMID: 28116285. PMCID: PMC5220445.

57. Tan PC, Hou MC, Lin HC, et al. 2006; A randomized trial of endoscopic treatment of acute gastric variceal hemorrhage: N-butyl-2-cyanoacrylate injection versus band ligation. Hepatology. 43:690–697. DOI: 10.1002/hep.21145. PMID: 16557539.

58. Seo YS. 2018; Prevention and management of gastroesophageal varices. Clin Mol Hepatol. 24:20–42. DOI: 10.3350/cmh.2017.0064. PMID: 29249128. PMCID: PMC5875194.

59. El Amin H, Abdel Baky L, Sayed Z, et al. 2010; A randomized trial of endoscopic variceal ligation versus cyanoacrylate injection for treatment of bleeding junctional varices. Trop Gastroenterol. 31:279–284.
60. Lo GH, Lin CW, Perng DS, et al. 2013; A retrospective comparative study of histoacryl injection and banding ligation in the treatment of acute type 1 gastric variceal hemorrhage. Scand J Gastroenterol. 48:1198–1204. DOI: 10.3109/00365521.2013.832792. PMID: 24047398.

61. Park SJ, Kim YK, Seo YS, et al. 2016; Cyanoacrylate injection versus band ligation for bleeding from cardiac varices along the lesser curvature of the stomach. Clin Mol Hepatol. 22:487–494. DOI: 10.3350/cmh.2016.0050. PMID: 28081588. PMCID: PMC5266343.

62. Watanabe K, Kimura K, Matsutani S, Ohto M, Okuda K. 1988; Portal hemodynamics in patients with gastric varices. A study in 230 patients with esophageal and/or gastric varices using portal vein catheterization. Gastroenterology. 95:434–440. DOI: 10.1016/0016-5085(88)90501-X.
63. Saad WE. 2013; Vascular anatomy and the morphologic and hemodynamic classifications of gastric varices and spontaneous portosystemic shunts relevant to the BRTO procedure. Tech Vasc Interv Radiol. 16:60–100. DOI: 10.1053/j.tvir.2013.02.002. PMID: 23830670.

64. Maruyama H, Okugawa H, Yoshizumi H, Kobayashi S, Yokosuka O. 2008; Hemodynamic features of gastrorenal shunt: a Doppler study in cirrhotic patients with gastric fundal varices. Acad Radiol. 15:1148–1154. DOI: 10.1016/j.acra.2008.03.008. PMID: 18692756.
65. Kim MY, Um SH, Baik SK, et al. 2013; Clinical features and outcomes of gastric variceal bleeding: retrospective Korean multicenter data. Clin Mol Hepatol. 19:36–44. DOI: 10.3350/cmh.2013.19.1.36. PMID: 23593608. PMCID: PMC3622854.

66. Qiao W, Ren Y, Bai Y, Liu S, Zhang Q, Zhi F. 2015; Cyanoacrylate injection versus band ligation in the endoscopic management of acute gastric variceal bleeding: meta-analysis of randomized, controlled studies based on the PRISMA statement. Medicine (Baltimore). 94:e1725. DOI: 10.1097/MD.0000000000001725. PMID: 26469912. PMCID: PMC4616775.
67. Mahadeva S, Bellamy MC, Kessel D, Davies MH, Millson CE. 2003; Cost-effectiveness of N-butyl-2-cyanoacrylate (histoacryl) glue injections versus transjugular intrahepatic portosystemic shunt in the management of acute gastric variceal bleeding. Am J Gastroenterol. 98:2688–2693. DOI: 10.1111/j.1572-0241.2003.08769.x. PMID: 14687818.

68. Procaccini NJ, Al-Osaimi AM, Northup P, Argo C, Caldwell SH. 2009; Endoscopic cyanoacrylate versus transjugular intrahepatic portosystemic shunt for gastric variceal bleeding: a single-center U.S. analysis. Gastrointest Endosc. 70:881–887. DOI: 10.1016/j.gie.2009.03.1169. PMID: 19559425.

69. Sanyal AJ, Freedman AM, Luketic VA, et al. 1996; Transjugular intrahepatic portosystemic shunts for patients with active variceal hemorrhage unresponsive to sclerotherapy. Gastroenterology. 111:138–146. DOI: 10.1053/gast.1996.v111.pm8698192. PMID: 8698192.

70. Chau TN, Patch D, Chan YW, Nagral A, Dick R, Burroughs AK. 1998; "Salvage" transjugular intrahepatic portosystemic shunts: gastric fundal compared with esophageal variceal bleeding. Gastroenterology. 114:981–987. DOI: 10.1016/S0016-5085(98)00640-4.

71. Barange K, Péron JM, Imani K, et al. 1999; Transjugular intrahepatic portosystemic shunt in the treatment of refractory bleeding from ruptured gastric varices. Hepatology. 30:1139–1143. DOI: 10.1002/hep.510300523. PMID: 10534333.

72. Choi YH, Yoon CJ, Park JH, Chung JW, Kwon JW, Choi GM. 2003; Balloon-occluded retrograde transvenous obliteration for gastric variceal bleeding: its feasibility compared with transjugular intrahepatic portosystemic shunt. Korean J Radiol. 4:109–116. DOI: 10.3348/kjr.2003.4.2.109. PMID: 12845306. PMCID: PMC2698068.

73. Sabri SS, Abi-Jaoudeh N, Swee W, et al. 2014; Short-term rebleeding rates for isolated gastric varices managed by transjugular intrahepatic portosystemic shunt versus balloon-occluded retrograde transvenous obliteration. J Vasc Interv Radiol. 25:355–361. DOI: 10.1016/j.jvir.2013.12.001. PMID: 24468043.

74. Terrault NA, Bzowej NH, Chang KM, et al. 2016; AASLD guidelines for treatment of chronic hepatitis B. Hepatology. 63:261–283. DOI: 10.1002/hep.28156. PMID: 26566064. PMCID: PMC5987259.

75. Gimm G, Chang Y, Kim HC, et al. 2018; Balloon-occluded retrograde transvenous obliteration versus transjugular intrahepatic portosystemic shunt for the management of gastric variceal bleeding. Gut Liver. 12:704–713. DOI: 10.5009/gnl17515. PMID: 29938456. PMCID: PMC6254622.

Fig. 1
Esophageal varices with (A) red color sign, (B) fibrin plug and (C) active bleeding. (D) Band-ligated esophageal varices.
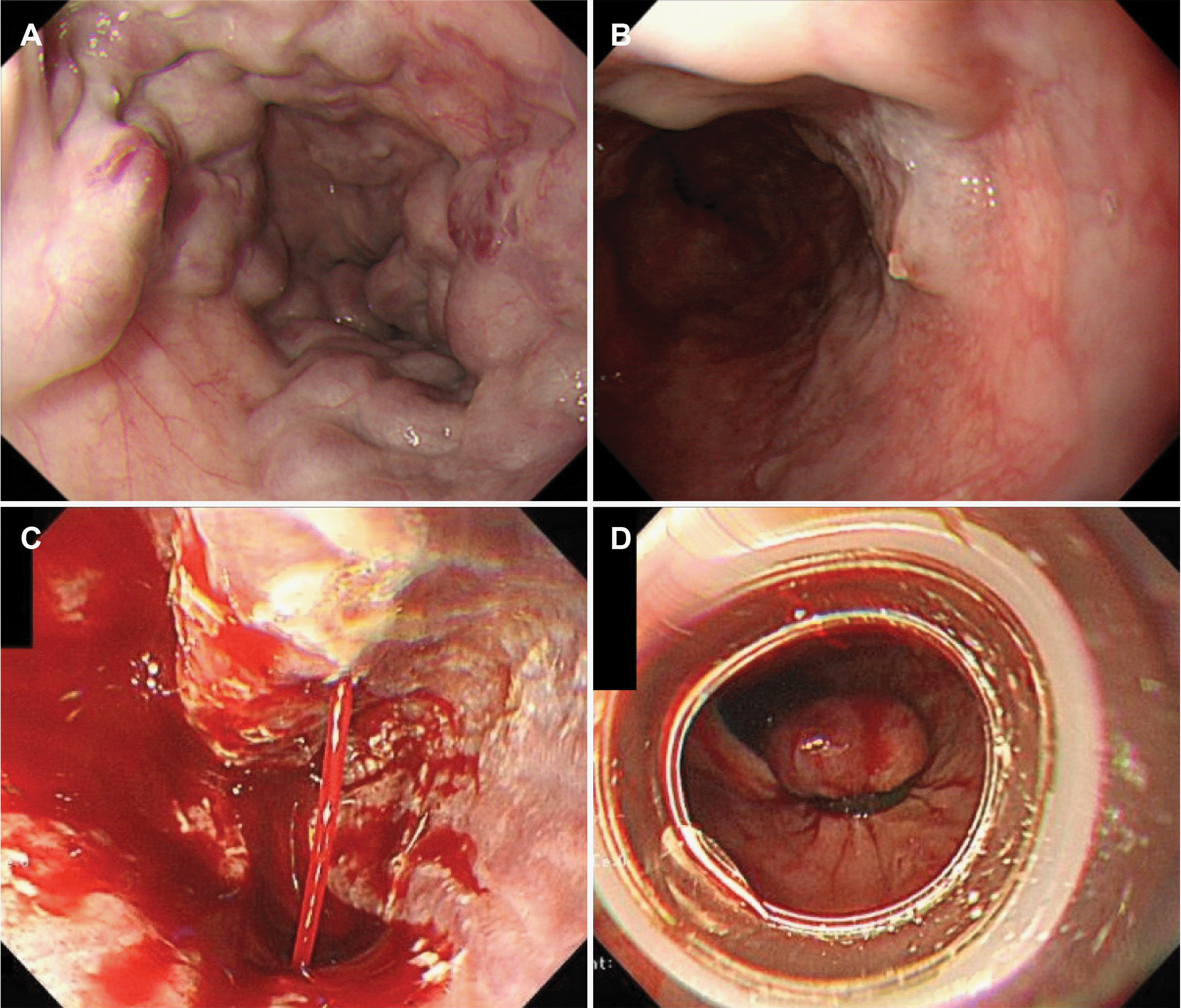
Fig. 2
Gastric varices. (A) Gastroesophageal varices type 1. (B) Endoscopic variceal obturation for bleeding gastric varices type 1. (C) Gastroesophageal varices type 2 with stigmata of recent bleeding before balloon-occluded retrograde transvenous obliteration (BRTO). (D) Regression of gastric varices after BRTO.
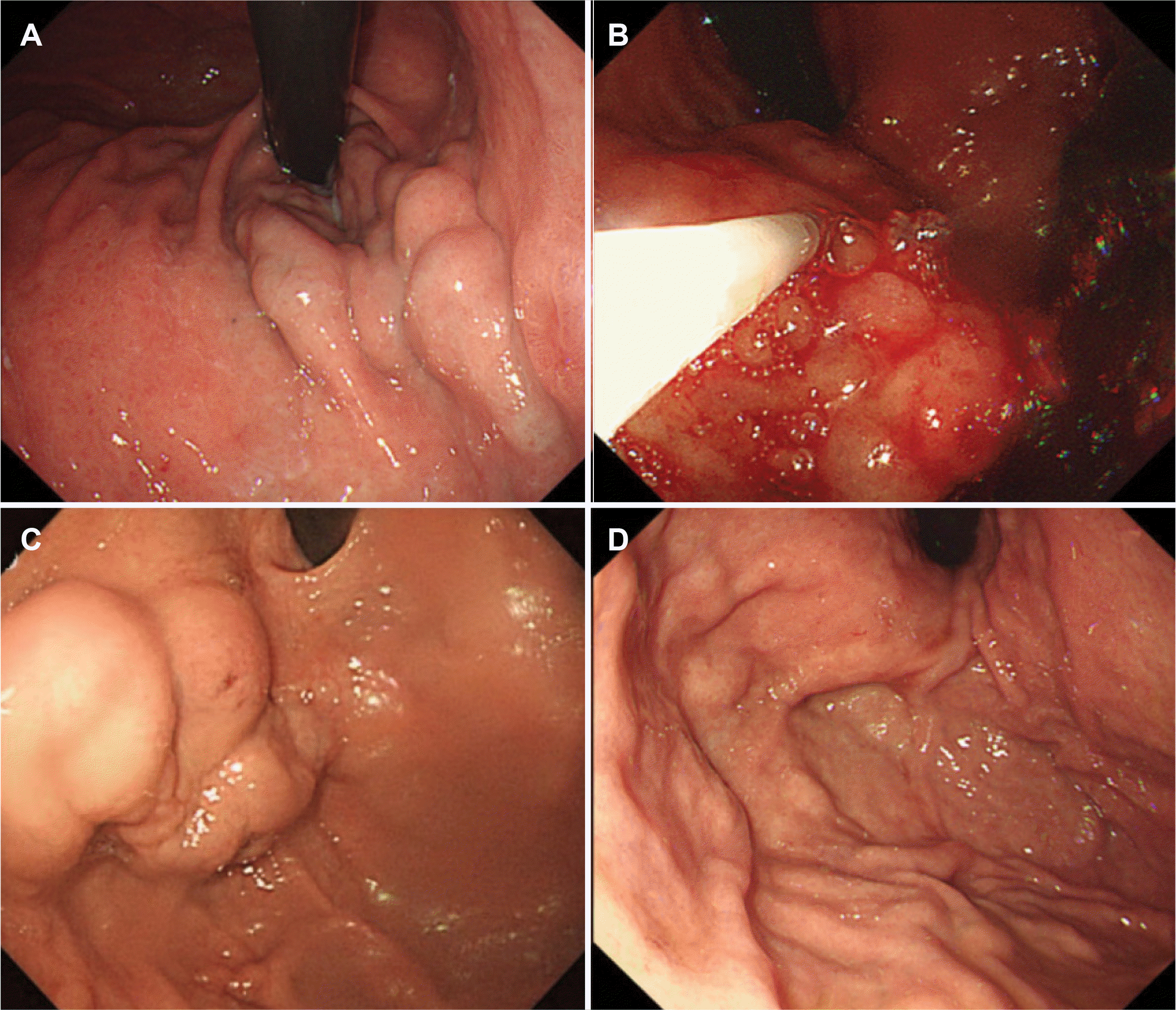
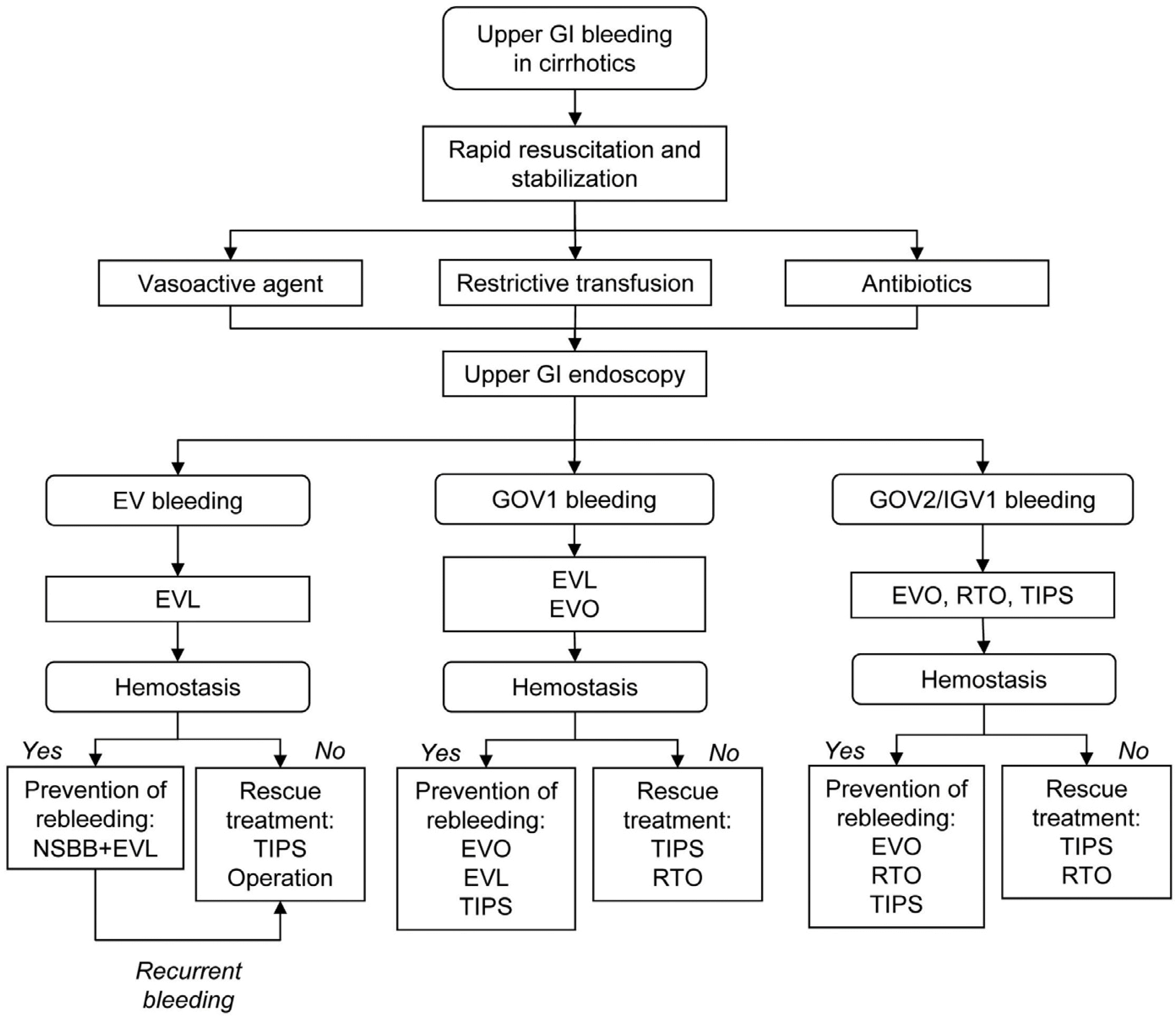
Fig. 3
Management of esophageal and gastric variceal bleeding. GOV, gastroesophageal varices; IGV, isolated gastric varices; RTO, retrograde transvenous obliteration; TIPS, transjugular intrahepatic portosystemic shunt. This algorithm was modified from 2019 KASL clinical practice guidelines for liver cirrhosis.39




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download