서 론
장병 연관성 T-세포 림프종(enteropathy-associated T-cell lymphoma) 은 장의 상피 내 림프구에서 기원하는 드문 질환이다.
1 원래 장병 연관성 T-세포 림프종은 제1형과 제2형으로 분류하였으나,
2 2017년 개정된 World Health Organization 분류에서 제1형은 장병 연관성 T-세포 림프종으로, 제2형은단일형 상피친화성 T-세포 림프종(monomorphic epithelio-tropic intestinal T-cell lymphoma, MEITL) 으로 명칭이 변경되었다.
1 장병 연관성 T-세포 림프종은 셀리악병과 연관이 있으며 아시아에서 드물고 미국과 유럽에서 비교적 흔한 반면MEITL은 셀리악병과 연관이 없고 아시아에서 가장 흔한 원발위장관 T-세포 림프종이다.
3 MEITL은 복통, 설사부터 폐색및 천공까지 매우 다양한 증상으로 나타나는데, 특징적인 증상이 없어 진단이 어렵고, 이로 인해 대부분의 환자들이 병이 진행된 상태에서 진단되는 경우가 많다.
4 또한 발생률이 낮고 증상이 다양하여 임상 연구 진행이나 치료법의 정형화도 어려울 뿐만 아니라, 치료 반응률이 낮고 전체 생존율은 7개월로 예후가 매우 좋지 않은 것으로 알려져 있다.
5 저자들은 장천공으로 수술 후 단기간에 사망하였던 MEITL 환자 2예를 경험하였기에 보고하는 바이다.
Go to :

고 찰
과거 제2형 장병 연관성 T-세포 림프종으로 분류되었던MEITL은 위장관 전역에 걸쳐 발생하며 매우 드물고 공격적인 형태의 말초 T-세포 림프종이다.
3 전체 소화기암 중 악성 림프종은 1-4% 정도로 드물게 발생하는데,
6 그중에서도 MEITL 은 전체 위장관 림프종에서 5% 미만으로 발생하는 매우 드문 림프종이다.
7
MEITL은 셀리악병과의 연관성이 없는 것으로 알려져 있으며, 셀리악병의 발병이 적은 아시아에서 주로 발생하는 것으로 알려져 있다.
6 Tse 등
8의 보고에 따르면 23-89 세 등 다양한 나이에서 발생하며 중위연령은 59세이고, 남녀 비는 2:1로 남자에서 더 흔하게 발병하는 것으로 알려져 있다. 소장, 특히 공장이 이 질환의 가장 흔한 원발 병소이며, 드물게 십이지장, 위, 대장에 침범하고 이 외에도 식도, 충수돌기 등에 침범하였던 보고들이 있다.
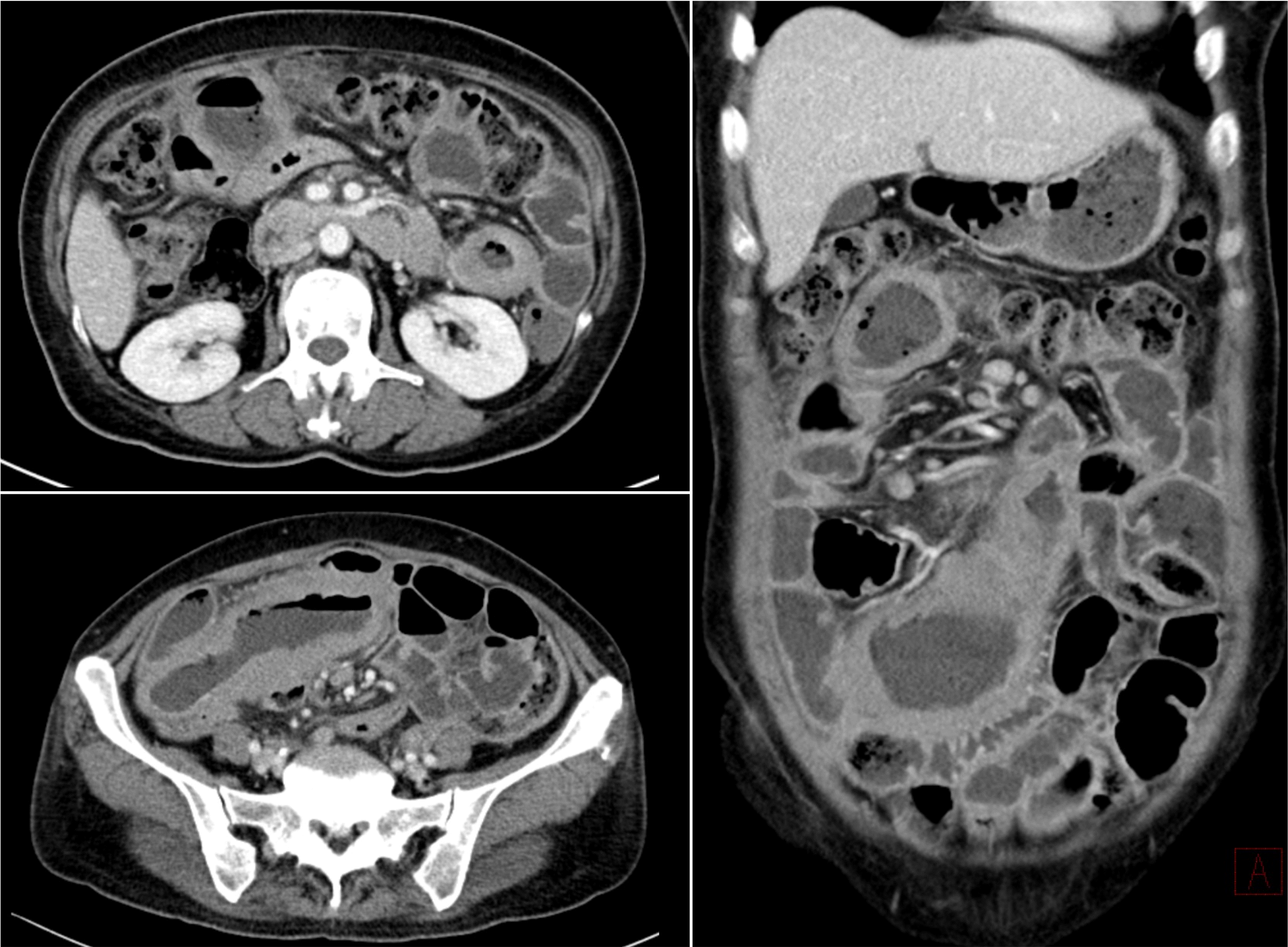
6,9 본고의 두 번째 증례처럼 장간막림프절에 주로 전이되며, 드물게 피부, 폐 혹은 뇌에 전이되기도 한다.
10,11
복통, 체중감소, 설사부터 출혈, 천공, 폐색 등 심각한 증상까지 매우 다양한 위장관 증상으로 나타나고 특징적인 임상증상은 없다.
8,11 심지어 소장의 침범이 있어도 장병 증상이 없거나,
12 무증상으로 우연히 발견되는 경우도 있다.
13 처음 내시경으로 진단되는 경우가 전체의 약 10% 밖에 되지 않으며, 대부분 수술을 통해 발견되는데,
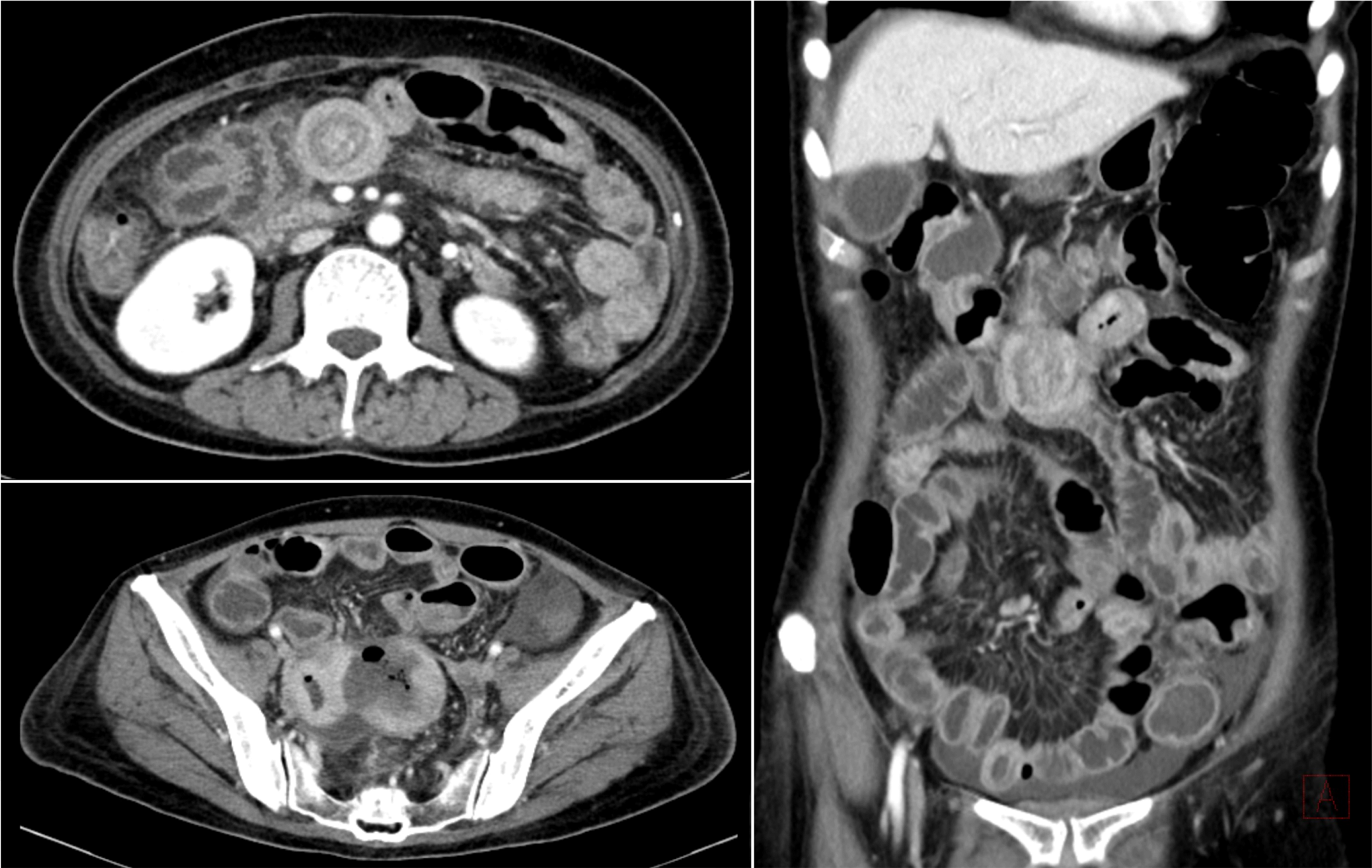
14 본고의 첫 번째 증례처럼 만성 설사 외 특이 증상이 없고, 각종 검사에서 특이 소견이 보이지않아 초기에 진단이 되지 않거나 두 번째 증례처럼 이미 병이진행된 상태에서 진단되는 경우가 흔하다.
6 실제로 병이 발생하는 위치와 비특이적인 임상증상으로 인해 대부분의 환자들
이 증상 발현 시점에 수술적 절제가 필요하며,
8,14 약 절반의환자들이 장천공이나 폐색으로 인해 응급 수술을 받게 된다.
8,14 장천공이 발생하는 경우 복막염, 패혈성 쇼크, 다발성장기 부전 등으로 인해 항암 치료가 지연되어,
15 예후가 보다 좋지 않을 것으로 예상되는데, 본고의 첫 번째 증례의 경우진단 당시 장 천공으로 응급 수술 후 다발성 장기 부전으로 사망하였으며, 두 번째 증례에서도 항암 치료 전 발생한 장전공으로 인해 치료가 지연되어 급격히 악화된 것으로 생각된다.
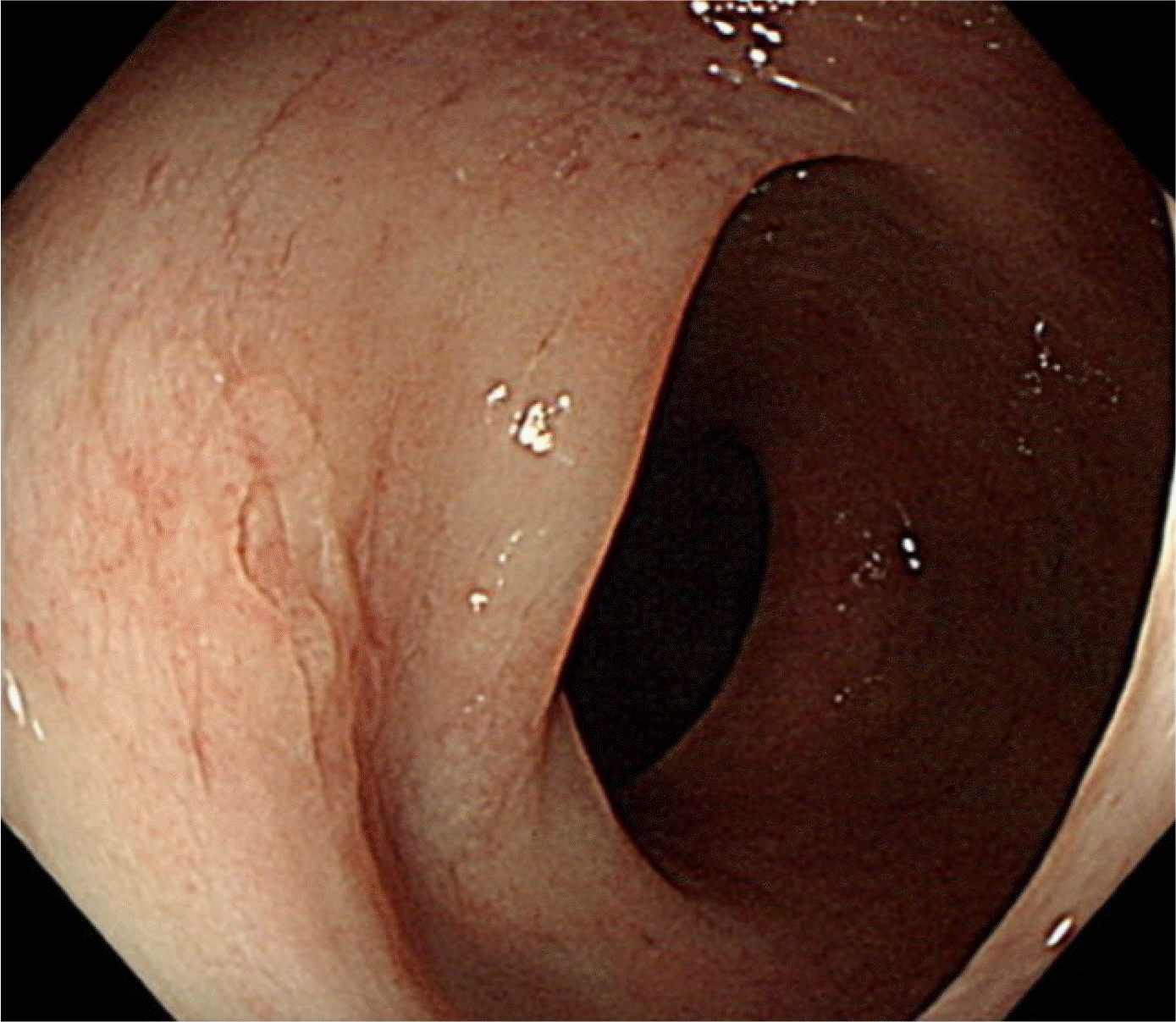
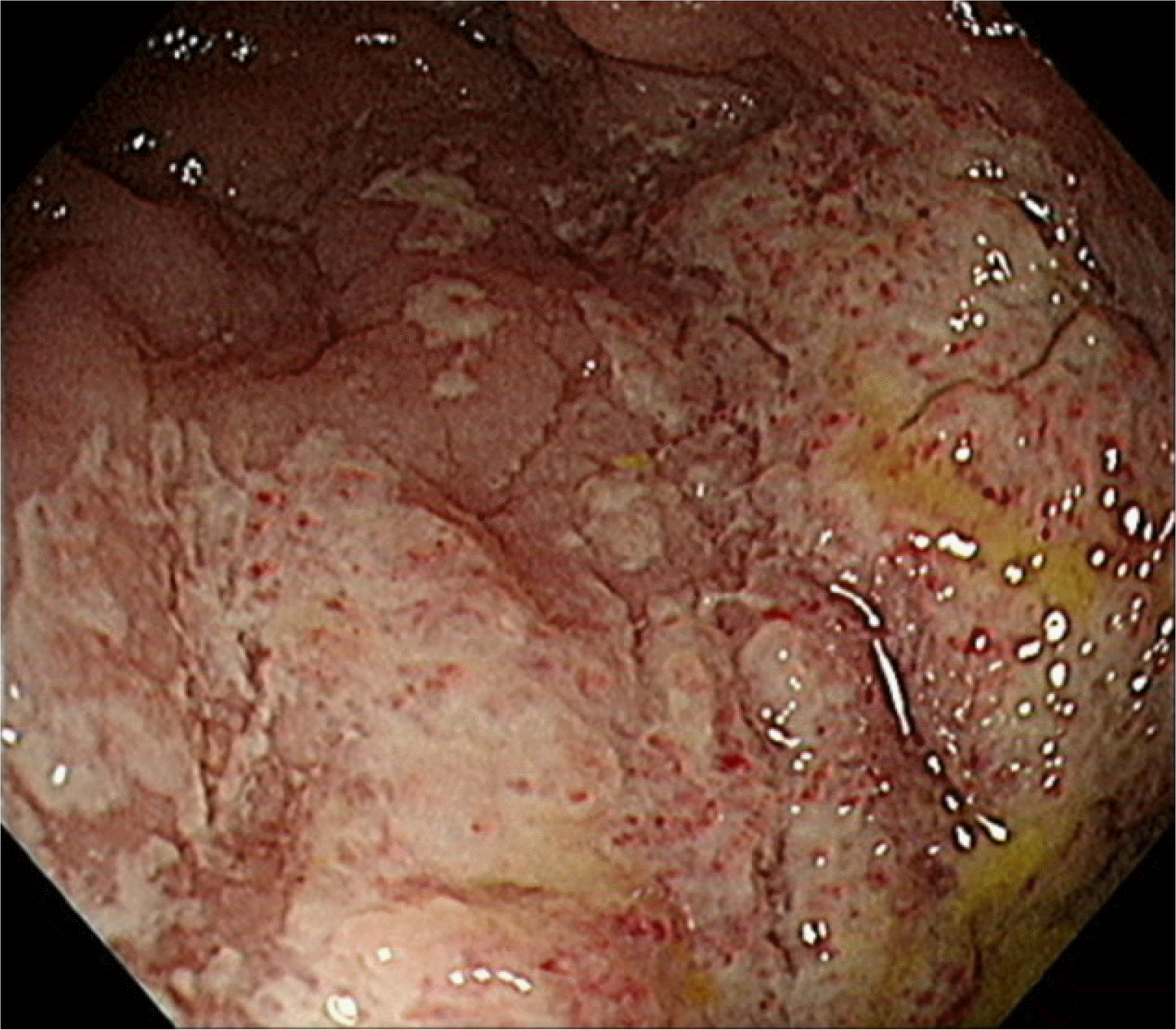
MEITL의 내시경 소견을 제시하는 논문이 많지는 않으나, Halphen 등
16은 소장 림프종의 내시경 소견을 크게 점막주름비후형(mucosal fold thickening), 결절형(nodular pattern), 침윤형(infiltrative pattern), 궤양형(ulcerative pattern), 모자이크형(mosaic pattern) 인 5가지로 분류하고 있으며, Tian 등
4은 이 질환의 내시경 소견으로 수많은 미세 과립 및 점막비후와 동반된 반원형의 얕은 궤양으로 보고하였는데, 이는 본고의 두 번째 증례 환자의 내시경 소견과 유사하였다. 병리적으로 MEITL은 동일한 모양을 갖는 중소형 크기의 창백한세포질을 갖고 다염색성 핵을 갖는 림프구들이 상피친화성을 보이고, 주로 염증이나 괴사의 소견은 동반되지 않으며,
4 면역조직화학염색에서는 대부분의 세포들이 CD2 (+), CD3 (+), CD7 (+), CD8 (+), CD56 (+), CD4 (-), CD5 (-), CD 30 (-)를 보인다.
17
Anthracycline을 기반으로 하는 CHOP 혹은 CHOP plus etoposide 를 시행하고 동종 조혈모세포 이식을 시행하는 것이 추천된다.
8,14 하지만 아직 표준화된 치료가 없고항암 치료 반응률이 약 36-58% 정도로 낮으며 항암 치료와 조혈모세포 이식 등 최선의 치료에도 80% 이상의 환자들은결국 재발하거나 사망하는 것으로 알려져 있다.
5,8,14,17 또한중위 생존기간은 진단 후 7개월로 짧고, 1년 생존률은 36% 로 예후가 매우 나쁘다.
8 De Baaij 등
18은 B증상과 international prognostic index 점수를 이용해 위험성에 따라 고위험군, 중간위험군 그리고 저위험군으로 나누어 enter-opathy-associated T-cell lymphoma prognostic index 를 장병 연관성 T-세포 림프종의 예후 예측인자를 제시하고 있는데, 이는 MEITL 환자들을 제외한 연구이기 때문에 바로 적용하는 데는 한계가 있을 것으로 생각된다. 또한 최근 저널들에 따르면 SETD2 변이와 SYK 발현이 이 질환에서 증가하는 것으로 알려져 추후 진단적인 부분에서 도움을 받을수 있을 것으로 생각되며,
19,20 향후 보다 효과적인 신규 치료법의 발견으로 이 희귀병의 예후 향상에 도움을 줄 수 있을 것이다.
많은 임상의와 조직병리학자들이 이 질환에 대한 인식이 없거나 부족하기 때문에 MEITL 은 때로 “잊혀진 진단”이 되기도 한다. 이 때문에 비슷한 증상이나 내시경적 소견을 갖는염증성 장질환 등으로 오인되는 경우도 있는데,
4 본고의 첫 번째 증례에서도 모든 검사에서 특이 소견이 보이지 않아 과민성 장증후군이나 현미경적 장염으로 오인되어 MEITL 으로 바로 진단하지 못하였다. 두 번째 증례에서는 처음 대장 내시경에서 말단회장까지 확인하였음에도 특이 소견을 보이지 않았으나 복부 전산화단층촬영에서 병변이 확인되어 회맹판 상부로 깊이 재검사하여 병변이 확인되었다. 항상 말단회장을 깊게 관찰할 필요는 없지만 이러한 복부 증상이 있을 때는 최대한 깊게 관찰을 하는 것이 필요하리라 생각된다. MEITL이 불량한 예후를 보이는 중요한 이유가 진단이 늦어지고 증상이 발현되는 시기에 환자의 전신 상태가 불량하고, 위장관 출혈과 천공 발생 시 항암 치료가 지연되기 때문이다.
6,15 MEITL 은 드문 병이나 원인 미상의 복통 및 설사 증상을 보일 때항상 의심(high index of suspicion) 을 갖고 접근하면 보다빠른 진단으로 출혈이나 천공 발생 전 치료를 시작하여 병의 예후의 향상을 기대할 수 있을 것으로 생각한다. 저자들은 장천공으로 수술 후 단기간에 사망하였던 MEITL 환자 2예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Go to :






 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download