초록
후천적 응고인자억제제는 주로 제VIII인자의 작용을 저해하는 자가항체가 생성되는 질환으로, 증상의 발생을 빨리 인지하여 신속하게 진단, 치료하는 것이 중요하다. 치료는 출혈의 억제, 자가항체의 제거 및 기저질환의 교정으로 나누어진다. 치료적 혈장교환술은 보조적인 치료방법으로 제한적인 경우에서 사용하는 것으로 알려져 있으나, 치료적 혈장교환술을 치료에 이용한 증례 보고가 드물어, 임상적 의의에 대한 합의도 없는 상황이다. 본 증례에서 저자들은 응고인자에 대한 후천적 억제제를 가지고 있는 것으로 판단되는 70세 여성 환자에게 치료적 혈장교환술을 13회 시행하였다. 환자는 항생제 치료 후 응고시간 증가를 보였으며 이는 혼합검사에서 교정되지 않았다. 제VIII인자 억제제 검사결과가 12 Bethesda unit/mL로 측정되었다. 감염성 심내막염 및 척수골수염이 의심되는 소견이 있어 통상적인 면역억제치료를 시행할 수 없었기 때문에, 치료적 혈장교환술을 단독으로 시행하였고 성공적으로 치료하였다. 본 증례는 응고인자에 대한 억제제를 혈장교환술 단독으로 치료한 첫 사례이다. 그러므로 본 증례를 통해 치료적 혈장교환술은 통상적인 면역억제치료를 시행할 수 없는 후천적 응고인자억제제를 가지고 있는 환자에서 적극적인 치료의 방법으로 고려할 수 있다고 보인다.
Abstract
Acquired coagulation factor inhibitors are autoantibodies that mainly inhibit the action of coagulation factors, and prompt diagnosis and treatment are important in this situation. Treatment often consists of suppression of hemorrhage, elimination of autoantibodies, and correction of the underlying cause. Therapeutic plasma exchange (TPE) is used as an adjuvant treatment in patients with acquired coagulation factor inhibitors; however, there is no consensus about its clinical significance. Herein, we reported a case of a 70-year-old female patient with acquired coagulation factor inhibitors treated with 13 sessions of TPE after antibiotic treatment. The presence of inhibitors was confirmed by the increased coagulation times without correction in the mixing tests and a factor VIII inhibitor level of 12 Bethesda U/mL. Since the patient could not undergo conventional immunosuppressive therapy because of suspected infective endocarditis and spinal osteomyelitis, only TPE was performed with a successful outcome. To our knowledge, this is the first case where acquired coagulation factor inhibitors were managed by TPE alone. Therefore, TPE might be an effective treatment option in patients with acquired coagulation factor inhibitors when conventional immunosuppressive therapy cannot be applied.
후천적 응고인자억제제(coagulation factor inhibitor)는 주로 제VIII인자의 작용을 저해하는 자가항체가 생성되는 질환으로 현재까지 알려진 원인들은 출산, 자가면역질환, 악성종양, 약물 부작용, 다양한 감염질환 등인데 특별한 기저 질환 없이 발생하는 경우도 상당수 보고되고 있다[1]. 연간 백만 명 중 한 명의 빈도로 발생하는 드문 질환이지만, 치명적인 출혈을 야기할 수 있어서 증상의 발생을 빨리 인지하여 신속하게 진단, 치료하는 것이 중요하다[2, 3].
치료는 출혈의 억제, 자가항체의 제거 및 기저질환의 교정으로 나눌 수 있는데 제VIII인자 우회치료제(bypassing agent), 제VIII인자 제제들을 사용하여 출혈을 억제하고 스테로이드 제제로 자가항체를 제거하는 방법이 널리 사용되고 있다[4]. 치료적 혈장교환술(therapeutic plasma exchange, TPE)은 보조적인 치료방법으로 제한적인 경우에서 사용하는 것으로 알려져 있으나, 전세계적으로 TPE를 치료에 이용한 증례 보고가 드물어, 임상적 의의에 대한 합의도 없는 상황이다[1]. 저자들은 후천적으로 응고인자 억제인자를 갖게 된 환자에서 TPE를 단독으로 시행하여 치료에 성공한 증례를 경험하였기에 문헌고찰과 함께 보고하고자 한다.
70세 여성 환자가 내원 8일 전부터 시작된 발열을 주소로 본원 응급실로 내원하였다. 환자는 내원 8일 전부터 발열과 허리 통증이 있어 타병원에 입원하였다가, 증상이 지속되고 내원 3일 전부터 호흡곤란이 생겨 전원되었다. 과거 병력으로 1년전 추간판탈출증 수술력, 3년전 안정성 협심증으로 관상동맥조영술을 받은 경력이 있으며, 13년 전 2형 당뇨병을 진단받아 metformin, lobeglitazone, r-thioctic acid tromethamine, insulin을 투약 중이었다.
응급실 내원 당시 생체 징후는 혈압 132/77 mmHg, 맥박 85회/분, 호흡수 26회/분, 체온 37.6°C였으며 의식은 명료하였다. 흑색변, 혈변, 혈뇨, 객혈은 없었고 신체검사에서 멍, 혈종, 혈관절 등의 출혈 소견은 관찰되지 않았다. 혈액 검사에서 백혈구 13,700/μL, 혈색소 8.9 g/dL, 혈소판 374,000/μL였으며 프로트롬빈시간(prothrom bin time, PT)은 1.21 국제정상화비율(international normalized ratio, INR) (참고치: 0.8-1.3), 활성화부분트롬보플라스틴시간(activated partial thromboplastic time, aPTT)(참고치: 25.0-35.0초)은 31.5초로 응고검사상에서는 특이 소견을 보이지 않았다.
혈액배양에서 Enterococcus faecalis가 동정되었고, 갑작스러운 전신 부종 및 폐부종이 진행되어 감염성 심내막염을 의심하여 입원 첫날부터 암피실린(ampicillin, 2 g/day)과 세프트리악손(ceftriaxone, 2 g/day) 투여를 시작하였다. 입원 후 시행한 심장초음파검사에서 감염성 심내막염을 의심할 소견은 보이지 않았으나 척추 자기공명영상에서 감염성 척추염, 혹은 척추골수염이 의심되는 소견을 보였다. 심장초음파에서 심내막염의 증거가 뚜렷하지는 않으나 척추골수염과 동반된 심내막염이 있다고 보고 항생제 치료를 지속하였다.
입원 16일째 PT 6.42 INR, aPTT 84.4초로 갑작스럽게 연장되어 신선동결혈장(fresh frozen plasma, FFP) 3단위를 수혈하였으나 입원 17일째 PT 8.44 INR, aPTT 109.6초로 더 연장되었다. 입원 19일째 실시한 검사에서는 혈소판 358,000/μL, 섬유소원 547 mg/dL (참고치: 200-400 mg/dL), D-dimer 1.89 μg/dL (참고치: <0.5 μg/dL), 섬유소분해산물 7.9 μg/dL (참고치: <5.0 μg/dL), 항트롬빈 III 75% (참고치: 80-120%)로 측정되었다(Table 1). 정상인의 혈장을 사용하여 PT/aPTT 혼합 검사를 시행한 결과, PT는 환자 혈장이 9.68 INR, 혼합 혈장이 7.60 INR로 교정되지 않았으며 aPTT도 환자 혈장 120초, 혼합 혈장이 109.7초로 교정되지 않아 응고인자억제제의 존재를 시사하였다. 응고인자들에 대한 활성도 검사 결과 모든 응고인자에서 감소하였고(Table 2), Bethesda assay [5]로 시행한 제VIII인자 억제제 역가는 12 Bethesda unit이었다. 루푸스항응고인자(lupus anticoagulant) 검사도 함께 시행하였으나 dRVVT (dilute Russell’s viper venom test), SCT (silica clotting time) 방법 모두에서 응고가 일어나지 않았고, 이는 응고인자에 대한 억제제에 의한 검사의 간섭으로 생각되었다. 임상적으로 항인지질항체증후군(antiphospholipid antibody syndrome)을 의심할 만한 혈전 등의 소견은 보이지 않았다. 이상의 결과로 환자에서 관찰된 PT, aPTT의 연장은 항생제 치료 후 후천적으로 발생한 응고인자에 대한 억제제에 의한 것으로 판단하였다
입원 21일째 항생제를 반코마이신(vancomycin 1.5 g/day)으로 바꾸고 후천성 제VIII인자 억제제에 준하여 스테로이드와 cyclophosphamide 치료를 고려하였으나 감염에 대한 의심 상황으로 투약하지 못하고, TPE를 시행하기로 하였다.
TPE는 Cobe Spectra (Terumo BCT Inc., Lakewood, CO, USA) 또는 Spectra Optia (Terumo BCT Inc., Lakewood, CO, USA) 장비를 사용하여 환자의 혈장 부피(total plasma volume) 만큼 FFP 및 알부민으로 교환하였다. 후천적 응고인자억제제에 대해 TPE를 시행할 때 치환용액으로 미국성분치료학회(American Society for Apheresis, ASFA) 가이드라인에서는 혈장을 사용할 것을 권장하고 있으나 환자의 경우 TPE 시행 첫날 전신의 두드러기와 발진을 보여 알부민과 FFP를 함께 사용하였다. TPE는 환자의 PT를 2.5 INR 미만으로 낮추는 것을 목표로 하여 입원 27일째부터 20일간 13회 시행하였다. 치료 경과에 따라 PT와 aPTT는 서서히 호전되었다(Fig. 1). 입원 47일째, TPE 13회차 후 PT 2.52 INR, aPTT 31.9초로 호전되었고 이후 TPE 추가 시행 없이 aPTT는 참고범위 내에서 유지되었다. 입원 55일째 응고인자억제제에 대한 치료는 종료되었고, 척추골수염에 대한 치료로 항생제 반코마이신 유지를 위해 전원하였다.
치료적 혈장교환술은 환자의 혈장 내에 존재하는 병적 성분을 혈액성분 채집기를 이용하여 분리, 제거하는 치료법으로, 제거된 혈장량만큼 알부민, FFP 등의 치환용액으로 보충한다. 치료적 혈장교환술은 혈전성혈소판감소성자반증, 급성 길랑-바레증후군, 근무력증, 국소분절사구체경화증, 전신홍반루푸스를 포함한 다양한 질환에 적용될 수 있다. ASFA에서는 여러 연구들을 통해 성분치료의 효과의 정도에 따라 질환별, 치료법별로 카테고리를 분류하고 있는데, 본 증례와 같이 응고인자에 대한 억제제에 대해서는 치료적 혈장교환술의 치료 효과를 카테고리 III (치료효과가 환자나 보고자에 따라 달라 아직 결론을 내리지 못한 적응증)으로 상황에 따라 시행여부를 결정하도록 권고하고 있다[1].
본 증례의 환자는 뚜렷한 선행 요인 없이 항생제 투여 후 PT, aPTT가 연장되었고 파종혈관내응고를 배제하기 위해 관련 검사를 시행하였다. 그러나 혈소판, 섬유소원의 증가 등이 파종혈관 내응고의 경향과 맞지 않았고 PT/aPTT 혼합검사에서 교정되지 않는 소견을 보였으며, 제VIII인자 억제제가 12 Bethesda unit으로 확인되어 항생제 치료 후 후천적으로 제VIII인자 억제제를 포함한 응고인자에 대한 억제제가 발생하였던 것으로 생각된다.
본 증례와 같이 약물 사용 후 응고인자에 대한 억제제가 발생한 증례에 대해서는 보고가 많지는 않으나, 후천적 제VIII인자 억제제와 관련된 약물은 암피실린(ampicillin)과 페니실린(penicillin)을 포함하는 베타락탐계 항생제, 설파제(sulfa drugs) 항생제, 인터페론알파(IFN-α) 등 다양하게 보고되었으며, 제VIII인자 억제제 검사에서 평균 67.7 BU/mL로 높게 측정되었다. 그러나 약물 중단 후 또는 면역억제요법(steroid, cyclophosphamide) 이후 완전 관해로 이어지는 경우가 83.3%로 예후가 좋은 편이었다[2].
후천적 제VIII인자 억제제의 제거를 위해 통상적으로 면역억제요법인 steroid, cyclophosphamide가 단독 혹은 병합요법으로 널리 사용되고 있으며, 치료적 혈장교환술은 보조적으로 일반적인 치료에 효과가 없는 환자에서 시행하는 경우 효과적이라는 연구들이 있었다[6-8]. 그 외 보고된 대부분의 증례들이 통상적인 치료에 회복되어 치료적 혈장교환술을 시행할 필요가 없었고, 혈장교환술의 효용성은 평가되기 어려웠다.
본 증례의 경우 감염성 심내막염 및 척수골수염이 의심되는 소견이 있어 통상적인 면역억제치료를 시행할 수 없었고, 치료적 혈장교환술만 시행하였기 때문에 치료적 혈장교환술이 치료효과가 있음을 확인하는 것이 가능했다.
치료적 혈장교환술을 단독으로 시행한 환자의 사례는 찾아볼 수 없었고, 치료적 혈장교환술을 포함한 병합요법으로 후천적 응고인자억제제의 치료를 시행한 세 환자의 사례와 비교하여 보았을 때(Table 3), 모두 제VIII인자 억제제가 높게 나타났고 한 증례의 경우 제VIII인자 우회치료제, 제VIII인자 제제, 스테로이드를 투약하였으나, aPTT가 지속적으로 증가되어 치료적 혈장교환술을 10회 시행하고 aPTT가 교정되었다[8]. 다른 증례의 경우 제VIII인자 우회치료제와 리툭시맙(rituximab) 치료 후 치료적 혈장교환술을 2회 시행하였고, 시행 전 제VIII인자 억제제가 8.2 BU/mL에서 치료적 혈장교환술 후 0.6 BU/mL 미만으로 감소하였다[6]. 치료적 혈장교환술은 다양한 횟수로 시행되었으며 aPTT의 호전을 보이며 치료의 효과를 보였다. 본 증례의 경우 다른 증례보다 제VIII인자 억제제는 12 BU/mL로 낮았으나 다른 치료를 병합하지 않고 치료적 혈장교환술을 단독으로 시행하였기에 혈장교환술의 횟수가 다른 증례보다 다소 많았던 것으로 생각된다. 본 증례에서 제VIII인자 억제제 혹은 제VIII인자 활성도는 추적하지 못하였으나 PT, aPTT의 호전으로 보아 치료에 기여했을 것으로 보인다.
후천적 응고인자억제제는 2019년에 ASFA에서 발표한 가이드라인에 따르면 category III로 아직 임상적 효과는 단발성 증례 중심이어서 결론을 내리지 못한 것으로 되어있으나 치료적 혈장교환술이 고농도의 항체를 가지고 있거나 통상 치료에 반응이 없는 경우에 보조적으로 사용할 수 있다고 하는 증례들이 보고되고 있다. 본 증례에서는 치료적 혈장교환술을 단독으로 사용하여 후천적 응고인자억제제를 성공적으로 치료하였으며, 따라서 통상적인 면역억제치료를 시행할 수 없는 환자의 경우 치료적 혈장교환술을 보조요법으로 취급하기보다는 적극적인 치료의 한 방편으로 고려할 수 있을 것으로 생각된다. 추후 이에 대해 더 많은 환자들을 대상으로 후속 연구들이 뒷받침된다면 ASFA 가이드라인의 조정 또한 고려할 필요가 있을 것이다.
REFERENCES
1. Padmanabhan A, Connelly-Smith L, Aqui N, Balogun RA, Klingel R, Meyer E, et al. 2019; Guidelines on the use of therapeutic apheresis in clinical practice - evidence-based approach from the writing committee of the American Society for Apheresis: the eighth special issue. J Clin Apher. 34:171–354. DOI: 10.1002/jca.21705. PMID: 31180581.

2. Franchini M, Capra F, Nicolini N, Veneri D, Manzato F, Baudo F, et al. 2007; Drug-induced anti-factor VIII antibodies: A systematic review. Med Sci Monit. 13:RA55–61. DOI: 10.1002/chin.200745229.
3. Borg JY, Guillet B, Le Cam-Duchez V, Goudemand J, Lévesque H. Group SS. 2013; Outcome of acquired haemophilia in France: the prospective SACHA (Surveillance des Auto antiCorps au cours de l'Hémophilie Acquise) registry. Haemophilia. 19:564–70. DOI: 10.1111/hae.12138. PMID: 23574453.

4. Franchini M, Vaglio S, Marano G, Mengoli C, Gentili S, Pupella S, et al. 2017; Acquired hemophilia A: a review of recent data and new therapeutic options. Hematology. 22:514–20. DOI: 10.1080/10245332.2017.1319115. PMID: 28441921.

5. Lim DH, Kim TO, Jeong Y, Kim WJ, Park SJ, Lee JH, et al. 2014; Antibiotic-induced acquired factor V Inhibitor. Korean J Med. 87:105–9. DOI: 10.3904/kjm.2014.87.1.105.

6. Wool GD, Chapel D, Treml A, Miller JL. 2017; Therapeutic plasma exchange as part of multimodal treatment of acquired hemophilia in a patient with concurrent acute intracerebral bleed and pulmonary embolism. Transfusion. 57:1827–32. DOI: 10.1111/trf.14132. PMID: 28436106.

7. Kumari S, Tripathi PP, Sharma RR, Hans R, Lamba DS, Khadwal A, et al. 2020; Efficacy of therapeutic plasma exchange in a patient with coagulation inhibitors (acquired haemophilia A) - A case report. Transfus Apher Sci. 59:102809. DOI: 10.1016/j.transci.2020.102809. PMID: 32527615.

8. Kim YK, Suh JS. 2012; Acquired hemophilia: successfully treated with plasma exchange in a patient with hightiter inhibitors. Korean J Blood Transfus. 23:68–71.
Fig. 1
Changes in prothrombin time (PT), activated partial thromboplastin time (aPTT) after therapeutic plasma exchange. Dashed and solid lines indicate PT (INR) and aPTT, respectively. Arrows indicate the days on which therapeutic plasma exchange was performed. The antibiotics used included ampicillin (AMP)+ceftriaxone (CRO) from hospitalization day (HD) 1 to HD 20 and vancomycin (VAN) from HD 21 until patient discharge.
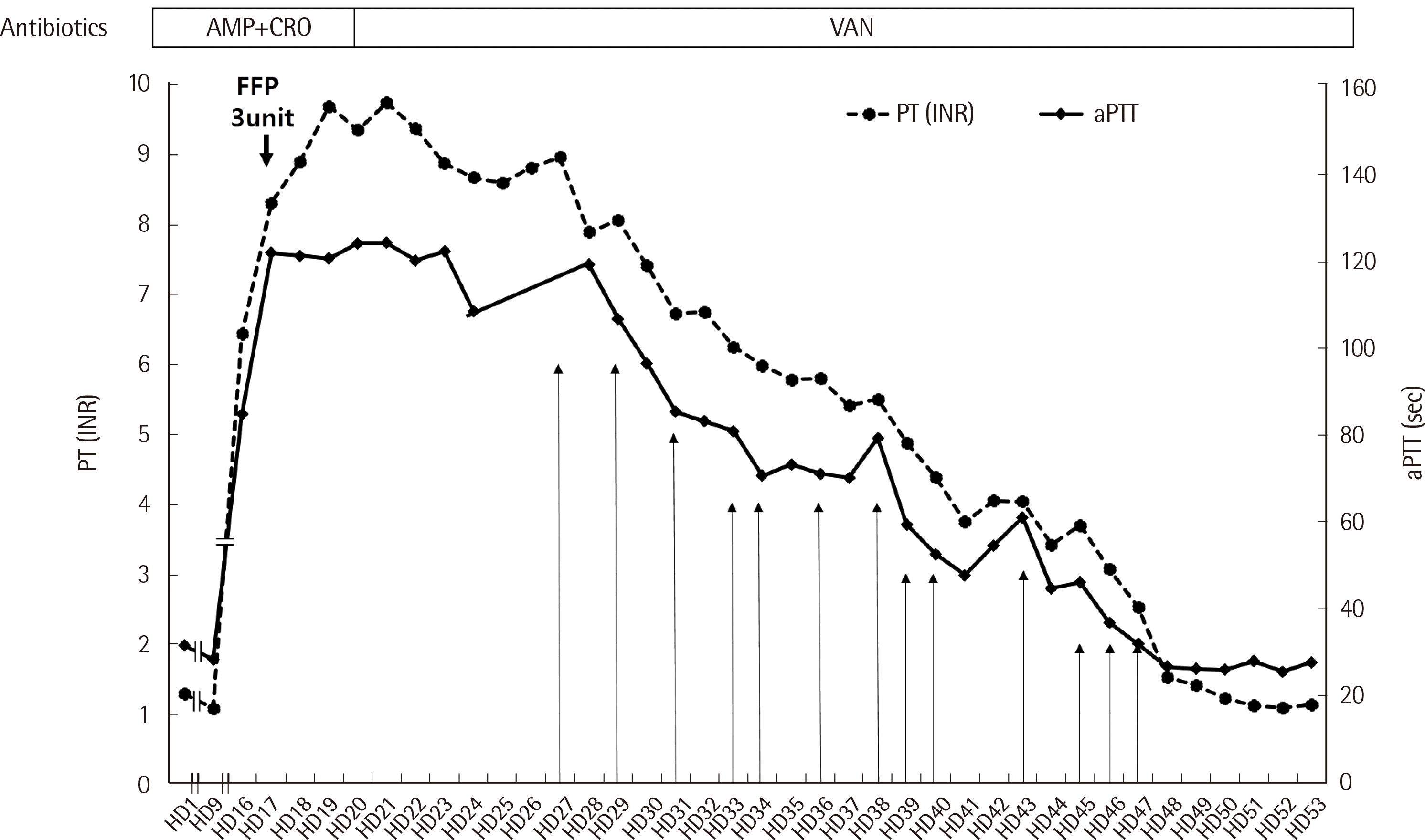
Table 1
Laboratory parameters related to the coagulation status on hospitalization day 19
Table 2
Coagulation factor activity measured on hospitalization day 19
Table 3
Comparison of the clinical laboratory parameters between the literature and this study
| Parameter | Kim et al., 2012 [8] | Geoffrey et al., 2017 [6] | Kumari et al., 2020 [7] | This study |
|---|---|---|---|---|
| Age/sex | 73/F | 73/M | 73/M | 70/F |
| Cause | Unknown | Unknown | Unknown | Drug |
| Bleeding episode | None | Thalamic bleeding | Hematuria | None |
| PT (sec) | 10.8 | 15.6 | 15.3 | 70.5 |
| aPPT (sec) | 95.9 | 76.9 | 103.9 | 120 |
| Factor VIII (%) | 1 | 4 | < 1 | < 1 |
| Factor VIII Ab (BU/mL) | 175.5 | 27 | 98 | 12 |
| Pharmacological treatment |
CFVIII FEIBA CS |
rFVIII rFVIIa rituximab |
rFVIII rFVIIa CS rituximab |
None |
| Number of TPE sessions | 10 | 2 | 5 | 13 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download