T세포큰과립림프구백혈병(T-cell large granular lymphocytic leukemia, T-LGLL)은 성숙T세포종양에 속하는 드문 질환으로, 소림프구백혈병의 2-3%를 차지한다. 발병기전은 아직 불명확하지만 자가면역질환과의 높은 관련성으로 미루어 지속적인 면역학적 자극으로 인한 세포독성 T 림프구(cytotoxic T lymphocyte, CTL) 반응이 주요 요인으로 생각된다[
1]. 장기이식 상황에서는 거부반응이나 이식편대숙주질환(graft-vs-host disease, GVHD)으로 인한 CTL의 활발한 면역반응 그리고 체액면역 저하 상태에서 감염원에 대한 CTL의 과도한 반응이 유발될 수 있으므로, 이식후림프증식질환(post-transplant lymphoproliferative disorder, PTLD)의 형태로 T-LGLL이 발병할 가능성이 상존한다. 그러나 전체 PTLD에서 T-LGLL의 빈도는 낮은 것으로 알려져 있다. 한 연구에 따르면 174명의 PTLD 환자군에서 T/NK 세포 PTLD는 9명(5.2%)이었고, 156예의 T/NK 세포 PTLD 증례를 대상으로 한 메타분석 결과 T-LGLL은 8예(5.1%)에서 확인되었다[
2]. 이러한 낮은 빈도로 인해 T-LGLL PTLD는 최근까지도 증례보고나 소규모 증례모음 형식으로 보고되고 있다. 이에 저자들은 2008년 1월 1일부터 2020년 6월 30일까지 서울아산병원 골수 아카이브로부터 PTLD로 발현한 T-LGLL 2예를 확인하고, 이들 증례의 임상병리학적 소견을 기술하였다. 또한 문헌검색을 통해 추출한 고형장기이식(solid organ transplantation, SOT) 및 제대혈이식을 포함한 동종조혈모세포이식(allogeneic hematopoietic stem cell transplantation, alloHSCT) 후 발생한 T-LGLL 증례의 임상적 특성을 분석하였다. 자가조혈모세포이식은 alloHSCT 및 SOT와 면역학적 배경이 상이하므로 본 증례분석에 포함시키지 않았다. 본 연구는 서울아산병원 임상연구심의위원회의 승인(2020-1114)을 받은 후 진행되었다.
첫 번째 증례는 39세 남자로 백혈구증가증의 원인을 밝히기 위해 골수검사를 시행하였다. 19년전 일차면역결핍증(primary immunodeficiency, PID) 진단을 받고 면역글로불린을 투여해 왔고, 6년 8개월전 B형간염바이러스 간경화로 생체 간이식과 비장적출 시행 후 면역억제제로 tacrolimus와 mycophenolate mofetil을 사용하였다. 이식 3개월만에 혈액에서 거대세포바이러스(cytomegalovirus, CMV) DNA 양성 소견을 보여 ganciclovir 치료를 받았고, 최근 CMV DNA 양 증가 및 설사 증상으로 CMV 대장염으로 진단받고 다시 ganciclovir 치료를 진행하고 있었다. 골수검사 당시 백혈구 수 30.9×10
9/L, 혈색소 9.5 g/dL, 혈소판 수 703×10
9/L, 망상적혈구 수 1.64%, 절대호중구수 4.3×10
9/L, 그리고 절대림프구수 25.0×10
9/L였다. 말초혈액 림프구의 대다수(24.4×10
9/L)는 큰과립림프구였고, 이는 골수 유핵세포 감별계산에서도 30.6%를 차지하였다. 큰과립림프구의 면역표현형은 CD3
+/cytoplasmic CD3
+/CD2
+/CD5
+/CD7
+/CD8
+/CD4
-/CD56
-/CD19
-/CD20
-이었고,
TCRG 유전자의 단클론성을 보였다(
Fig. 1). 이러한 소견을 종합하여 T-LGLL로 진단하였다. 염색체 핵형검사는 시행하지 않았으나, 골수검체를 이용한 차세대염기서열분석에서
IKZF1 c.439T>C (p.C147R) 변이가 52.0%의 빈도로 검출되었고,
STAT3 변이는 음성이었다. CMV DNA 음성 전환과 함께 증상 호전을 보였으며, T-LGLL에 대한 별도의 치료는 실시하지 않았다. 환자는 이후 5개월까지 특별한 증상없이 생존하고 있으나 림프구증가증을 동반한 백혈구증가증(마지막 추적검사의 백혈구 수 47.8×10
9/L)은 지속되고 있다. 본 증례에서 가장 흥미로운 점은 환자의 기저질환이 PID이고, 생식세포변이로 추정되는
IKZF1 p.C147R을 가지고 있다는 것이다. 최근 PID 중 면역세포의 조절장애로 인해 감염증보다 오히려 자가면역질환을 주된 임상표현형으로 가지는 환자군이 일차면역조절질환(primary immune regulatory disorders, PIRD)으로 따로 분류되었고, PIRD 관련 변이 유전자들 중 하나로
IKZF1이 제시되어 있다[
3]. 6종의
IKZF1 변이(p.C147R 포함) 양성 환자가 소속된 가계 연구에 따르면 임상적으로 B세포 결핍, CD8
+ T세포 증가 및 자가면역질환 소견을 보였으며, 변이 단백은 모두 표적 시퀀스와의 DNA 결합에 장애를 보였다[
4]. 이는 본 환자의 T-LGLL 발병에 지속적인 CMV 재활성화에 의한 면역자극 뿐 아니라
IKZF1 변이에 의한 면역조절 장애도 관여하였음을 시사한다.
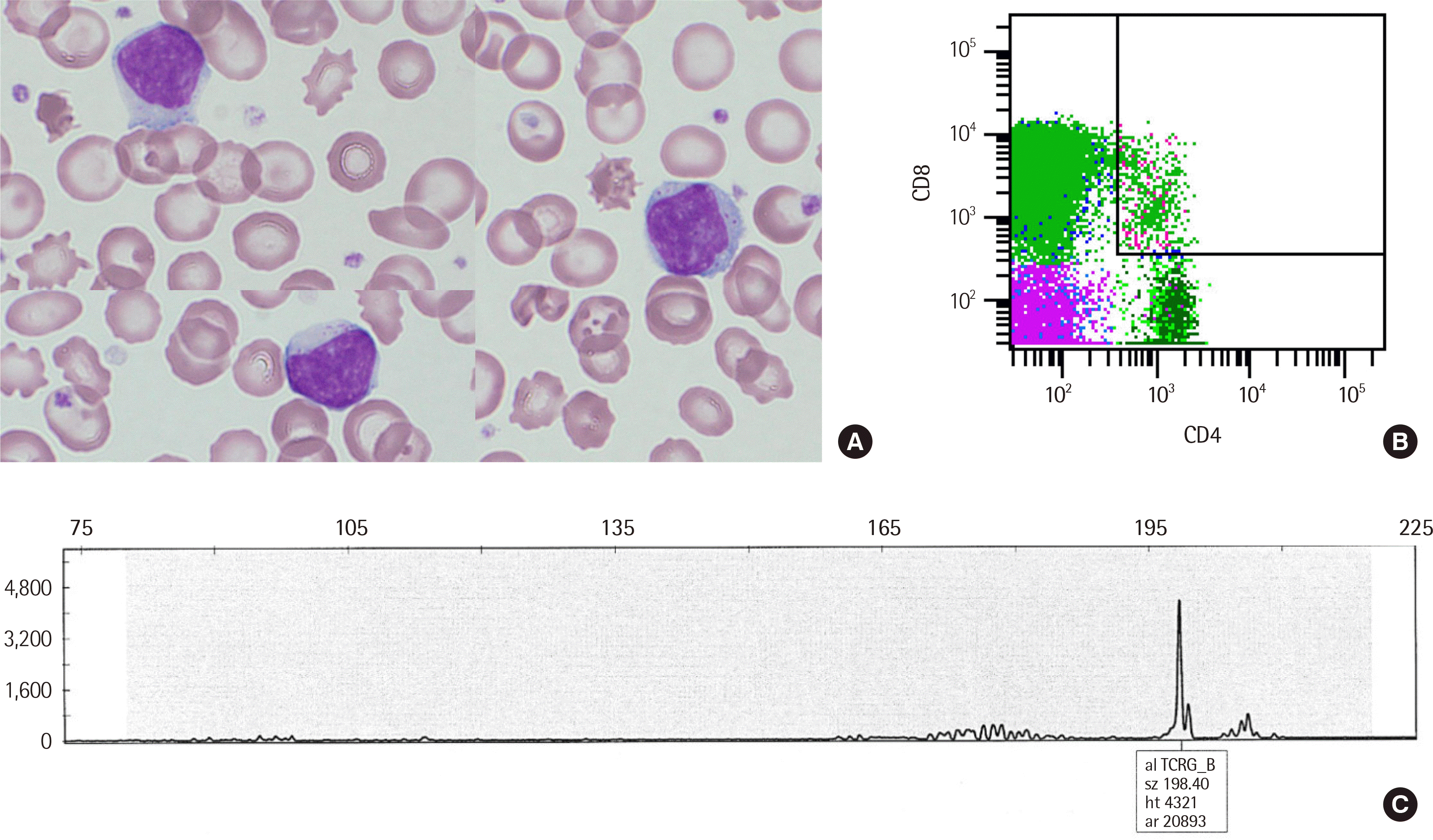 | Fig. 1Representative images of case 21 of Table 1. (A) A peripheral blood smear shows typical large granular lymphocytes with moderate cytoplasm and fine azurophilic granules. (B) Flow cytometric analysis shows a predominant population of CD4 -/CD8 + lymphocytes. (C) Capillary electrophoresis assay for clonal TCRG rearrangements shows a prominent positive peak within the valid size range, which is consistent with the presence of a clonal cell population.
Table 1
Clinicopathological features of T-LGLL in our own cases and in cases from literature after organ transplantation
|
Case No. |
Age*/sex |
Primary diagnosis |
Transplant |
Latency† (m) |
IS |
Reje-ction |
DC |
GVHD‡
|
LGL (×109/L) |
Cytopenia (N§/All/T¶) |
|
|
1 |
57/M |
HCV cirrhosis |
Liver |
312.0 |
CsA, S |
- |
NA |
NA |
7.9 |
+/-/+ |
|
2 |
60/F |
PSC |
Liver |
156.0 |
Tac |
- |
NA |
NA |
1.5 |
+/+/+ |
|
3 |
65/M |
HBV cirrhosis |
Liver |
324.0 |
- |
- |
NA |
NA |
2.4 |
-/-/- |
|
4 |
59/M |
ESRD/CMP |
Kidney/heart |
96.0 |
CsA, My |
+ |
NA |
NA |
6.0 |
-/-/- |
|
5 |
38/M |
CMP |
Heart |
48.0 |
S |
- |
NA |
NA |
2.4 |
+/-/- |
|
6 |
31/F |
ESRD |
Kidney |
43.2 |
ATG, Tac, My, S |
- |
NA |
NA |
0.1 |
-/-/- |
|
7 |
43/M |
Lupus nephritis |
Kidney |
156.0 |
Tac, S, Cp |
+ |
NA |
NA |
6.8 |
-/+/- |
|
8 |
57/F |
ESRD |
Kidney |
84.0 |
Tac, My, S |
- |
NA |
NA |
6.7 |
-/+/+ |
|
9 |
59/M |
ESRD |
Kidney |
48.0 |
Tac, S |
- |
NA |
NA |
1.9 |
-/-/+ |
|
10 |
31/M |
ESRD |
Kidney |
108.0 |
CsA, S |
- |
NA |
NA |
1.4 |
-/+**/- |
|
11 |
20/M |
ESRD |
Kidney |
36.0 |
Tac, My, S |
- |
NA |
NA |
0.9 |
-/+††/- |
|
12 |
44/M |
ESRD |
Kidney |
252.0 |
CsA, My, S |
- |
NA |
NA |
0.9 |
-/+/- |
|
13 |
53/F |
ESRD |
Kidney |
192.0 |
Siro, S |
- |
NA |
NA |
0.6 |
+/-/- |
|
14 |
67/F |
ESRD |
Kidney |
12.0 |
Tac, S |
- |
NA |
NA |
1.2 |
-/-/+ |
|
15 |
66/M |
COPD |
Lung |
24.0 |
ATG, Siro, S, Tac |
- |
NA |
NA |
0.6 |
+/-/+ |
|
16 |
69/F |
HCV cirrhosis/DN |
Liver/kidney |
72.0. |
Tac, S |
- |
NA |
NA |
5.5**
|
NA/+/- |
|
17 |
48/M |
FSGS |
Kidney |
168.0 |
Tac, Az, S |
- |
NA |
NA |
5.1**
|
NA/+/- |
|
18 |
55/M |
PIGN |
Kidney |
120.0 |
CsA, S |
- |
NA |
NA |
2.7**
|
NA/+/+ |
|
19 |
46/M |
FSGS |
Kidney |
144.0 |
CsA, S |
- |
NA |
NA |
4.5**
|
NA/+/- |
|
20 |
47/M |
VUR |
Kidney |
144.0 |
CsA, Az, S |
- |
NA |
NA |
11.5**
|
-/-/- |
|
21 |
39/M |
HBV cirrhosis, PID |
Liver |
81.7 |
Tac, My |
- |
NA |
NA |
24.4 |
-/+/- |
|
22 |
16/M |
Aplastic anemia |
Allogeneic |
3.6 |
CsA, S |
+ |
GF |
- |
NA |
+/-/+ |
|
23 |
57/F |
ALL |
Allogeneic |
48.0 |
CsA, My |
- |
C |
+ |
NA |
-/-/- |
|
24 |
36/F |
ALL |
Allogeneic |
44.4 |
CsA, My |
- |
C |
+ |
12.4 |
-/-/- |
|
25 |
39/F |
CML |
UCB |
6.0 |
- |
- |
C |
- |
2.2 |
-/-/- |
|
26 |
53/M |
MCL |
Allogeneic |
NA |
NA |
NA |
NA |
NA |
NA |
-/-/- |
|
27 |
11/F |
ALL |
UCB |
48.0 |
CsA, My |
- |
99% |
+ |
0.9 |
+/+/+ |
|
28 |
19/M |
PTCL |
SIB |
3.0 |
ATG |
- |
C |
- |
2.3**
|
+/-/+ |
|
29 |
61/F |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
4.0 |
-/NA/NA |
|
30 |
55/M |
T-PL |
SIB |
NA |
NA |
- |
NA |
+ |
4.0 |
-/NA/NA |
|
31 |
50/F |
AML |
MUD |
NA |
NA |
- |
NA |
- |
2.2 |
-/NA/NA |
|
32 |
41/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
2.2 |
-/NA/NA |
|
33 |
54/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
3.2 |
-/NA/NA |
|
34 |
66/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
2.3 |
-/NA/NA |
|
35 |
41/M |
ALL |
MUD |
NA |
NA |
- |
NA |
+ |
2.5 |
-/NA/NA |
|
36 |
47/M |
MDS/MPN |
SIB |
NA |
NA |
- |
NA |
- |
2.2 |
-/NA/NA |
|
37 |
38/M |
ALL |
MUD |
NA |
NA |
- |
NA |
+ |
2.2 |
-/NA/NA |
|
38 |
35/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
2.3 |
-/NA/NA |
|
39 |
65/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
3.1 |
-/NA/NA |
|
40 |
37/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
2.6 |
-/NA/NA |
|
41 |
62/M |
AML |
SIB |
NA |
NA |
- |
NA |
+ |
2.2 |
-/NA/NA |
|
42 |
43/F |
MDS/MPN |
MUD |
NA |
NA |
- |
NA |
+ |
2.5 |
-/NA/NA |
|
43 |
55/F |
FL |
Allogeneic |
NA |
NA |
- |
NA |
NA |
NA |
+/-/+ |
|
44 |
55/M |
CLL |
Allogeneic |
NA |
NA |
- |
NA |
NA |
NA |
-/-/- |
|
45 |
66/M |
AML |
SIB |
22.0 |
CsA, My |
- |
C |
+ |
2.1 |
-/NA/NA |
|
46 |
25/F |
Aplastic anemia |
MUD |
1.5 |
CsA, MTX |
- |
C |
- |
2.0 |
-/NA/NA |
|
47 |
42/M |
AML |
MisUD |
3.0 |
CsA, MTX |
- |
C |
+ |
2.7 |
-/NA/NA |
|
48 |
46/M |
ALL |
MUD |
1.5 |
CsA, MTX |
- |
C |
+ |
11.5 |
-/NA/NA |
|
49 |
31/F |
NK/TL |
SIB |
12.0 |
CsA, My |
- |
C |
+ |
2.1 |
-/NA/NA |
|
50 |
48/F |
DLBCL |
MUD |
4.0 |
NA |
- |
C |
+ |
4.7 |
-/+/+ |
|
51 |
21/F |
ALL |
SIB |
3.0 |
NA |
- |
C |
+ |
1.9 |
-/-/+ |
|
52 |
58/M |
MCL |
SIB |
6.0 |
NA |
- |
C |
- |
3.0 |
-/-/+ |
|
53 |
11/F |
ALL |
MUD |
24.0 |
NA |
+ |
GF |
+ |
2.5 |
-/-/- |
|
54 |
59/M |
AML |
UCB |
10.0 |
CsA, My |
- |
C |
- |
3.1 |
-/+/- |
|
55 |
47/M |
CLL |
SIB |
5.0 |
NA |
- |
C |
+ |
2.5 |
-/-/- |
|
56 |
57/M |
WM |
SIB |
4.0 |
NA |
- |
99% |
+ |
3.0 |
-/-/- |
|
57 |
39/M |
CML |
MUD |
6.0 |
CsA, My |
- |
C |
+ |
18.5**
|
-/+/+ |
|
58 |
51/M |
ALL |
MUD |
1.8 |
CsA, MTX |
- |
C |
- |
6.5 |
-/-/- |
|
|
Case |
Splenomegaly |
EBV††
|
CMV††
|
STAT3 mutation |
Treatment of T-LGLL |
Follow-up (m) |
Complication and outcome |
Reference |
|
|
1 |
- |
+ |
- |
- |
NA |
NA |
NA |
[5] |
|
2 |
+ |
- |
- |
- |
NA |
NA |
NA |
[5] |
|
3 |
- |
+ |
- |
+ |
NA |
NA |
NA |
[5] |
|
4 |
- |
+ |
- |
- |
NA |
NA |
NA |
[5] |
|
5 |
- |
+ |
- |
+ |
NA |
NA |
NA |
[5] |
|
6 |
- |
+ |
+ |
- |
NA |
NA |
NA |
[5] |
|
7 |
- |
+ |
- |
- |
NA |
NA |
NA |
[5] |
|
8 |
+ |
- |
- |
- |
NA |
NA |
NA |
[5] |
|
9 |
+ |
- |
- |
NA |
- |
35.5 |
Alive |
[6] |
|
10 |
+ |
- |
- |
NA |
Cp, MTX |
187.1 |
PRCA, On dialysis, Alive |
[6] |
|
11 |
+ |
+ |
+ |
NA |
Siro, S |
26.6 |
AIHA, Elevated GFR, Alive |
[6] |
|
12 |
- |
- |
- |
NA |
Siro |
18.1 |
Anti-dsDNA detected, Alive |
[6] |
|
13 |
- |
- |
- |
NA |
- |
11.3 |
Alive |
[6] |
|
14 |
+ |
- |
+ |
NA |
- |
14.1 |
Alive |
[6] |
|
15 |
NA |
NA |
NA |
NA |
Decreasing IS |
36.0 |
Perianal carcinoma, Deceased |
[7] |
|
16 |
NA |
- |
NA |
NA |
Cp |
14.0 |
Alive |
[13] |
|
17 |
NA |
- |
NA |
NA |
Cp |
14.0 |
Late-onset rejection, Alive |
[13] |
|
18 |
NA |
- |
NA |
NA |
Cp |
67.0 |
AITP, Alive |
[13] |
|
19 |
NA |
- |
NA |
NA |
Cp, MTX, ATG |
56.0 |
Alive |
[13] |
|
20 |
+ |
- |
- |
NA |
NA |
NA |
NA |
[16] |
|
21 |
NA‡‡
|
- |
+ |
- |
- |
5.0 |
Alive |
Our case |
|
22 |
+ |
+ |
+ |
- |
NA |
NA |
NA |
[5] |
|
23 |
- |
+ |
+ |
NA |
NA |
NA |
NA |
[5] |
|
24 |
- |
+ |
+ |
NA |
NA |
NA |
NA |
[5] |
|
25 |
- |
- |
+ |
- |
NA |
NA |
NA |
[5] |
|
26 |
NA‡‡
|
+ |
NA |
NA |
Done, not specified |
NA |
NA |
[8] |
|
27 |
NA |
- |
- |
+ |
MTX, Cp, tocafitinib |
11 |
Persistent neutropenia, Alive |
[9] |
|
28 |
+ |
- |
- |
- |
-§§
|
7.0 |
Alive |
[10] |
|
29 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
30 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
31 |
NA |
NA |
+ |
- |
NA |
NA |
NA |
[11] |
|
32 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
33 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
34 |
NA |
NA |
+ |
- |
NA |
NA |
Polymyositis, Unknown outcome |
[11] |
|
35 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
36 |
NA |
NA |
+ |
- |
NA |
NA |
NA |
[11] |
|
37 |
NA |
NA |
+ |
- |
NA |
NA |
NA |
[11] |
|
38 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
39 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
40 |
NA |
NA |
+ |
- |
NA |
NA |
NA |
[11] |
|
41 |
NA |
NA |
- |
- |
NA |
NA |
NA |
[11] |
|
42 |
NA |
NA |
- |
- |
NA |
NA |
AIHA, Unknown outcome |
[11] |
|
43 |
- |
NA |
NA |
NA |
Tac, S |
11.0 |
Deceased |
[12] |
|
44 |
- |
NA |
NA |
NA |
- |
37.0 |
Deceased |
[12] |
|
45 |
- |
NA |
- |
NA |
- |
53.0 |
Alive |
[14] |
|
46 |
- |
NA |
- |
NA |
- |
61.0 |
Alive |
[14] |
|
47 |
- |
NA |
+ |
NA |
- |
8.0 |
Alive |
[14] |
|
48 |
- |
NA |
+ |
NA |
- |
18.0 |
Deceased |
[14] |
|
49 |
- |
NA |
+ |
NA |
- |
13.0 |
Alive |
[14] |
|
50 |
NA |
NA |
+ |
NA |
- |
41.0 |
Bronchiolitis obliterans, Alive |
[15] |
|
51 |
NA |
NA |
+ |
NA |
- |
97.0 |
Alive |
[15] |
|
52 |
NA |
NA |
+ |
NA |
- |
19.0 |
Alive |
[15] |
|
53 |
NA |
NA |
+ |
NA |
- |
93.0 |
HBV reactivation, Alive |
[15] |
|
54 |
- |
+ |
- |
NA |
CsA, S |
0.3 |
Respiratory failure, Deceased |
[17] |
|
55 |
NA |
- |
- |
NA |
- |
6.0 |
Alive |
[18] |
|
56 |
NA |
- |
+ |
NA |
- |
18.0 |
Alive |
[18] |
|
57 |
NA |
- |
+ |
NA |
S |
4.5 |
Respiratory failure, Deceased |
[19] |
|
58 |
- |
- |
+ |
NA |
- |
19.0 |
Alive |
Our case |


|
두 번째 증례는 51세 남자로 1.8개월 전 시행한 alloHSCT 후 추적 골수검사를 위해 내원하였다. 환자는 필라델피아-양성 ALL로 화학요법 후 관해 상태에서 HLA 일치 비혈연 공여자로부터 조혈모세포를 이식받았다. Fludarabine/busulfan을 근간으로 한 저용량전처치법과 항흉선세포글로불린/methotrexate/cyclosporine을 이용한 GVHD 예방 프로토콜을 시행하였다. 이식 1개월 전부터 말초혈액에서 CMV DNA가 검출되기 시작하여 ganciclovir를 투여받고 있었다. 골수검사 시행 당시 백혈구 수 12.9×10
9/L, 혈색소 10.5 g/dL, 혈소판 수 244×10
9/L, 그리고 망상적혈구 수 1.71%이었다. 말초혈액 백혈구감별계산에서 절대호중구수 2.8×10
9/L, 절대림프구수 9.5×10
9/L, 그리고 큰과립림프구 수는 6.5×10
9/L이었다. 말초혈액 림프구아형검사에서 T 세포 85.8%, B 세포 4.1%, NK 세포 9.8%이었고, T 세포의 대부분(76.3%)은 CTL (CD3
+/CD8
+)이었다. 골수는 이식 후 정상적인 조혈모세포 재생 소견을 보였고, 큰과립림프구는 골수 유핵세포의 7.4%를 차지하였다. 골수검체로 시행한
TCRB와
TCRG 재배열 검사에서 모두 클론성이 확인되었고, 핵형은 “46,XX[
20]”이었다. 이러한 소견을 종합하여 골수진단은 T-LGLL을 동반한 조혈모세포 재생으로 보고하였다. 말초혈액에서 CMV DNA는 여전히 검출되었으나 엡스타인바바이러스(Epstein-Barr virus, EBV) DNA는 음성이었고, 짧은연쇄반복(short tandem repeat) 키메리즘 분석에서는 완전공여자키메리즘을 보였다. 이식 후 표준적인 보존치료 이외에 T-LGLL을 위한 투약은 시행하지 않았다. 이식 3개월 이후 CMV DNA는 음성으로 전환되었으며, 마지막 외래추적 시점(이식 후 19개월)까지 거부반응 및 GVHD 징후없이 생존하고 있다. 그러나 림프구증가증(마지막 추적검사의 림프구 백분율 63.4%, 절대림프구수 4.5×10
9/L)은 지속되고 있다.
T-LGLL이 림프종의 공식적인 아형으로 WHO 분류에 등재된 2002년 1월부터 2020년 6월까지 “T-cell large granular lymphocyte”와 “transplantation”을 키워드로 PubMed의 영어로 쓰여진 문헌검색 결과 SOT 또는 alloHSCT 후 발생한 큰과립림프구의 증식에 관한 23개의 문헌이 확인되었다. 이들 중 단클론성 또는 T-LGLL임이 명시되어 있으면서 환자의 특성이 개별적으로 기술되어 있는 15개의 문헌을 최종적으로 선택하였다[
5-
19]. 문헌에서 추출한 56예와 본 기관의 2예를 포함한 총 58증례의 임상적 특성을
Table 1에 요약하였고, 주요한 임상병리학적 지표를 SOT와 alloHSCT 환자군으로 나누어 비교하였다(
Table 2). SOT 환자군(N=21)은 신장이식 13예, 간이식 4예, 다중 장기이식 2예, 폐이식 1예, 그리고 심장이식 1예이었다. 신장이식 환자군의 기저 질환은 국소분절사구체경화증(focal segmental glomerulosclerosis, FSGS) 2예, 루푸스신장염(lupus nephritis) 1예, 감염후사구체신염 1예, 방광요관역류(vesicoureteral re°ex) 1예, 그리고 원인이 기술되어 있지 않은 말기신부전 8예였다. 간이식 환자군은 B형간염바이러스간경화 2예, C형간염바이러스간경화 1예, 그리고 일차경화담관염(primary scl-erosing cholangitis, PSC) 1예였다. 다중 장기이식의 경우 말기신부전/심근병증과 C형간염바이러스간경화/당뇨신장병증이 각각 1예씩이었고, 폐이식 환자는 만성폐쇄폐질환, 심장이식 환자는 심근병증이었다. AlloHSCT 환자군(N=37)은 혈연간이식 17예, 비혈연간이식 11예, 제대혈이식 3예였고, 6예에서는 공여자 정보를 확인할 수 없었다. 기저 혈액질환으로는 AML 12예, 림프종 10예, ALL 9예, CML 2예, 골수형성이상/골수증식종양 2예, 재생불량빈혈 2예였다. 전체 환자군에서 연령의 중앙값은 47.5세(범위: 11-69세)였고, 남성이 39명(67.2%)이었다. 이식 후 T-LGLL 발병까지 소요기간의 중앙값은 43.2개월(범위: 1.5-324개월)이었다. 큰과립림프구 수의 중앙값은 2.5×10
9/L (범위: 0.1-24.4×10
9/L)이었다. 비장종대는 31.0% (9/29)에서, 빈혈과 혈소판감소증은 38.5% (각각 15/39)에서, 호중구감소증은 16.7% (9/54)에서 관찰되었다. AlloHSCT 환자군에서 완전 또는 99% 공여자키메리즘의 빈도는 90.0% (18/20)이었고, GVHD는 73.5% (25/34)의 빈도를 보였으며, 생착실패는 5.9% (2/34)에서 연관되었다. 자가면역질환과의 연관성은 11예에서 기술되어 있었다: SOT 환자군(N=9)의 경우 5예(2번, 7번, 17번, 19번, 21번 증례)에서 자가면역성 기저질환(FSGS, 루푸스신장염, PSC, 그리고 PID)이, 4예(10번, 11번, 12번, 18번 증례)에서 T-LGLL와 동반된 또는 경과 중 발생한 자가면역 연관 소견(순적혈구형성부전, 자가면역용혈빈혈, 항-dsDNA 항체 검출, 자가면역혈소판감소증)이 확인되었다. 반면, alloHSCT 환자군의 경우 2예에서만 T-LGLL의 임상경과 중 다발근육염(34번 증례)과 자가면역용혈빈혈(42번 증례)을 경험했다는 기술이 있었다. EBV와 CMV 양성률은 각각 37.5% (12/32)와 46.0% (23/50)이었다. 추적기간의 중앙값은 18.05개월(범위: 0.3-187.1개월)이었고, 임상결과가 기술된 30명의 환자들 중 24명(80.0%)은 마지막 추적일까지 생존해 있었다.
Table 2
Comparison of clinical features between post-solid organ transplantation and post–allogeneic hematopoietic stem cell transplantation T-LGLL cases (combined cohort)
|
Variables |
Post-SOT (N = 21) |
Post-alloHSCT (N = 37) |
P-value*
|
|
Age, median (range) (yr) |
53 (20–69) |
47 (11–66) |
0.15 |
|
Male sex, N (%) |
15 (71.4) |
24 (64.9) |
0.773 |
|
Latency, median (range) (m) |
108 (12–324) |
5.5 (1.5–48)†
|
< 0.001
|
|
LGL count, median (range) (×109/L) |
2.4 (0.1–24.4) |
2.5 (0.9–18.5)‡
|
0.669 |
|
Splenomegaly, N (%) |
7/15 (46.7) |
2/14 (14.3) |
0.109 |
|
Neutropenia, N (%) |
5/17 (29.4) |
4 (10.8) |
0.121 |
|
Anemia, N (%) |
11 (52.4) |
4/18 (22.2) |
0.098 |
|
Thrombocytopenia, N (%) |
7 (33.3) |
8/18 (44.4) |
0.525 |
|
EBV positivity, N (%) |
7/20 (35.0) |
5/12 (41.7) |
0.724 |
|
CMV positivity, N (%) |
4/16 (25.0) |
19/34 (55.9) |
0.067
|
|
Follow-up period, median (range) (m) |
22.35 (5.0–187.1)§
|
18.0 (0.3–97.0)∥
|
0.397 |
|
Treatment for T-LGLL, N (%) |
8/12 (66.7) |
5/19 (26.3) |
0.06
|
|
Deceased patient, N (%) |
1/12 (8.3) |
5/18 (27.8) |
0.358 |

두 환자군 비교분석에서 가장 현저한 소견은 alloHSCT 환자군에서 SOT 군에 비해 유의하게 짧은 T-LGLL 발병 소요기간(각각의 중앙값 5.5개월과 108개월;
P<0.001)과 높은 경향의 CMV 양성률(각각 55.9%와 25.0%;
P=0.067)이다. 흥미롭게도 SOT 환자군 내에서도 CMV 양성인 경우(N=4) 음성인 경우(N=12)보다 T-LGLL 발병 소요기간이 유의하게 짧았다(각각의 중앙값 39.6개월과 150개월;
P=0.013). 이는 이식의 종류와 상관없이 이식 초반기 이식편 생착을 위한 면역억제 상태에서 CMV가 높은 빈도로 재활성화되고, 이에 따른 바이러스 항원 자극으로 CTL의 클론성 확장이 유발되었음을 강력히 시사한다. 또한 alloHSCT 환자군의 경우 대부분의 증례에서 완전공여자키메리즘을 보였고, GVHD가 높은 빈도로 발현되었다. 이러한 소견을 종합하면 CMV 항원에 의해 지속적으로 활성화된 항원표지세포에 의해 작동세포(effector cell)인 CTL (alloHSCT에서는 공여자유래 T세포, SOT에서는 수혜자 T세포)의 다클론증식(polyclonal proliferation)이 유발되고, 올리고클론 편중(oligoclonal skewing)을 거쳐 단클론 확장(monoclonal expansion)을 획득하여 T-LGLL이 발병하는 과정으로 설명할 수 있다[
5].
이식 후 큰과립림프구 증가는 낮지 않은 빈도로 관찰되는데, 한 조혈모세포이식 코호트에서는 7%의 빈도를 보고하였다[
14]. 반면 이식 후 T-LGLL은 매우 낮은 빈도(조혈모세포이식 환자군의 0.5%, 신장이식 환자군의 0.9%)를 보였다[
5,
6]. 이러한 큰과립림프구 증가와 T-LGLL 사이의 발생 빈도 차이는 CTL의 단클론성 획득 과정에서 지속적인 항원 자극 외에 부가적인 이차 타격(second hit)이 가해져야 함을 시사한다. T-LGLL 세포가 STAT3 단백의 과발현을 보인다는 사실은 오래전부터 알려져 있는데, 최근
STAT3 과발현의 분자유전학적 기전으로
STAT3 돌연변이가 부각되었다. 이 변이는 STAT3 단량체 사이의 소수성 견인력(hydrophobic attraction)을 항진시켜 다량체의 안정성을 증가시킴으로써 STAT3의 구조적 활성화에 기여하고, 활성화된 STAT3는 세포자멸(apoptosis) 경로에 내성을 보여 결국 T 세포 증식을 유발한다[
20].
STAT3 돌연변이는 전체 T-LGLL의 40% 정도에서 검출되나[
20], 본 증례 분석에서는 상대적으로 낮은 빈도(11.1%, 3/27)를 보였다. 이는 이식 상황에서는 큰과립림프구 증가에서 T-LGLL로의 진행에
STAT3 돌연변이 이외에 보다 다양한 기전이 관여하고 있음을 암시한다. 이와 관련하여 흥미로운 소견은 SOT 군에서 alloHSCT 군에 비해 자가면역질환과의 연관성을 시사하는 기술이 더 높은 빈도로 확인된다는 점이다. SOT 환자군에서의 유의하게 낮은 CMV 재활성화 빈도를 고려하면 환자에게 내재된 자가면역 반응에의 낮은 역치가 T-LGLL PTLD의 또 다른 발병 촉진 기전으로 여겨진다.
T-LGLL의 치료는 SOT 군에서 alloHSCT 군에 비해 더 많이 시행되었다(각각 66.7%와 26.3%; P=0.06). 이는 SOT 환자군에서 혈구감소증의 임상적 중요도가 더 위중하게 평가되기 때문으로 생각된다. 실제로 빈혈의 빈도는 SOT 군에서 alloHSCT 군에 비해 높은 경향을 보였다(각각 52.4%와 22.2%; P=0.098). 그러나 대다수 T-LGLL PTLD 환자는 양호한 임상경과를 보였으며, 사망한 증례도 T-LGLL 자체보다 복합적인 원인(다른 종양, GVHD, 감염 등) 때문인 것으로 보인다.
본 연구의 방식은 후향적 의무기록 분석과 문헌고찰이기 때문에 일부 정보의 누락은 피할 수 없다. 예를 들면 많은 증례에서 STAT3 돌연변이와 염색체 핵형 결과를 알 수 없었고, 주요한 자가면역질환 및 바이러스 지표도 모든 증례에서 확인되지는 않았다. 또한 T-LGLL이 저활동(indolent) 질환이고 대상 증례를 골수 아카이브에서 추출하였으므로, 골수검사를 시행하지 않은 T-LGLL 증례가 존재할 수 있다. 즉, 실제보다 T-LGLL의 빈도가 저평가되어 있을 가능성이 높다. 그러나 본 연구는 T-LGLL PTLD로는 국내 첫 보고이고, SOT와 alloHSCT T-LGLL PTLD의 임상병리학적 특징을 비교한 첫 시도이다. 이식 후 원인 불명의 혈구감소증은 환자와 임상의 모두에게 적지 않은 부담을 준다. 왜냐하면 혈구감소증의 정도가 심해지면 수혈의존성 및 감염과 같은 임상적으로 중요한 상황이 발생할 수 있기 때문이다. 따라서 이식 후 혈구감소증의 감별 진단에 T-LGLL PTLD를 포함시키는 것이 무엇보다도 중요하다. 진단검사의학과 전문의는 특히, CMV 양성 alloHSCT 환자나 자가면역질환과 연관된 SOT 환자인 경우 면밀한 전혈구검사와 말초혈액도말 모니터링을 통해 형태학적 단서인 큰과립림프구를 인지 및 계수하고, T-LGLL의 확진을 위해 적절한 추가 검사(TCR 재배열과 면역표현형 검사 등) 정보를 임상의에게 제공할 수 있어야 한다.
결론적으로, 본 증례 연구는 이식 초기 CMV 재활성화 환자들과 장기추적 중에 있는 자가면역질환 연관 이식 환자들 중 일부에서 T-LGLL PTLD가 발생할 수 있음을 보여준다. T-LGLL 진단이 지연되지 않으려면 진단검사의학과 전문의는 고도의 의심(high index of suspicion)을 통해 큰과립림프구 증가를 인지하고 확진을 위한 추가 검사를 적절히 활용해야 할 것이다.
Go to :






 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download