근년에 이루어진 혁신적인 의학 미생물학 분야는 metagenomic 기법을 이용한 마이크로바이옴 연구와 세균 동정 방법을 바꾼 matrix-assisted laser desorption ionization-time of flight mass spectrometry (MALDI-TOF MS, 매트릭스 보조 레이저 탈착 비행 질량분석법) 기술의 이용이다. MALDI-TOF MS는 세균 및 진균을 정확하고 빠르게 동정하는 방법으로서 기존에 사용하던 전통적인 동정 방법보다 매우 신속하고 정확하여 미생물 검사에 유용하기에 소개한다.
질량분석기는 분자의 질량을 재는 기기로 1886년에 Goldstein에 의해 처음 고안되었으며 1912년에 Thompson에 의해 더욱 개선되었다. 질량분석은 화학물질의 기체 이온을 전기자장에서 질량과 전하에 따라 분리된 것을 측정하여 그 물질을 알아내는 기법을 뜻한다. 현재 세균과 진균 동정에 사용하는 MALDI-TOF MS는 레이저를 이용하여 시료를 이온화하는 방법으로 단백질, DNA 등 분자량이 큰 물질을 분석하는데 유용하다. MALDI를 사용한 질량분석법은 1985년 일본 Shimadzu 회사의 Koichi Tanaka 연구원에 의하여 개발되었다. 즉, 극히 작은 금속 분말과 글리세린으로 검체를 처리함으로써 분자량이 큰 단백질 등을 분석하는 방법으로 2002년 화학부분 노벨상을 미국 Virginia Commonwealth 대학교의 John B. Fenn 교수(85세)와 함께 질량분광분석법 부문 연구로, 스위스 Federal Institute of Technology의 Kurt Wuethrich 교수(64세)가 핵자기공명법(Nuclear magnetic resonance spectroscopy) 부문 연구로 공동 수상하였다. 특히 Tanaka 연구원은 43세인 수상자이었음을 놀라게 하였었다. 이들의 연구는 검체 중의 세균체 혹은 배양된 미생물 집락의 단백질을 빠르고 정확하게 측정할 수 있는 혁신적인 방법이다[1,2]. 이 무렵 Hillenkamp와 Karas는 유기화합물 매트릭스를 쓰는 방법을 보고하고 MALDI라는 용어를 만들었다.
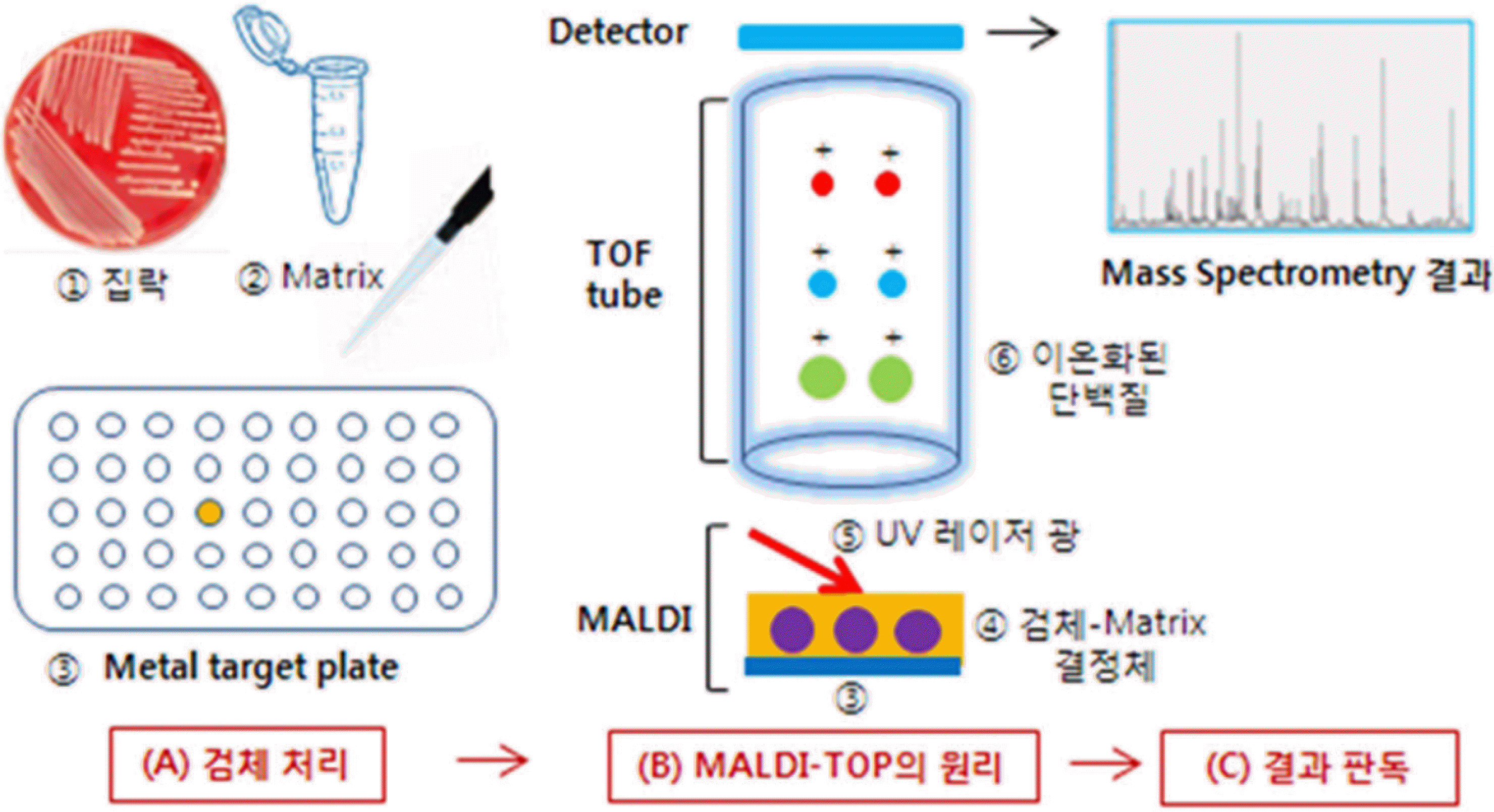
MALDi-TOF MS의 원리를 간단히 설명하면, 세균이나 진균의 집락(혹은 환자 검체)을 매트릭스라고 부르는 낮은 질량의 유기화합물과 섞어서 금속판에 한 방울 놓고 건조되면 결정을 이룬다. 결정체에 UV 레이저 광선을 쪼이면 레이저의 광자(photon)들과 매트릭스 분자들의 상호작용으로 검체 중의 단백질이 이온화된다. 생성된 이온들은 TOF tube를 통과하여 검출기에 도달한다. 이온들이 검출기에 도달하는데 걸리는 시간은 질량이 작으면 짧고 크면 길다. 검출기는 질량(mass)과 전하(charge)의 비율(m/z)을 측정하여 검출한 결과를 그라프로 표시한다(Fig. 1) [2]. 이 결과를 표준과 비교하여 균종을 동정한다. 균종에 따라서 단백질의 구성이 다르므로 균종 동정이 가능하게 된다. 이 방법을 기반으로 임상검체에서 통상적으로 분리되는 주요 산소성 및 무산소성 세균과 진균의 동정에 매우 유용함이 많이 보고되었고, 국내에서도 병원미생물 검사실, 연구기관 등에서 흔히 이용되고 있다[3-5].
최근 휴먼 마이크로바이옴 연구가 많아지면서 인체 내에 있는 미생물 역할을 규명하여, 각종 미생물이 다양한 질환의 발생과 예방, 인체와의 상호작용을 통하여 중요한 기능을 수행함이 보고되어 왔다. 이러한 연구를 위해서는 차세대 염기서열 분석 기술이 매우 중요한데, 일부 학자들은 culturomics 기법을 추가로 사용하는 경우 더 많은 정보를 얻을 수 있고, culturomics에서 배양된 많은 세균의 동정에는 MALDI-TOF MS가 유용하다고 하였다[6].
현재 국내에 소개된 기종은 Bruker Daltonics (Breman, Germany)와 bioMerieux (Marcy l’Etoile, France)의 국외 제품이 있고, 국내 제품으로는 ASTA (Suwon, Korea)가 이용되고 있다(Fig. 2).
MALDI-TOF MS는 세균 및 진균의 균종 동정 이외에도 주요 항균제 내성을 검출하는 여러 가지 방법이 소개되었다. 가장 흔히 연구된 방법들은 β-lactam 환(ring)을 가수분해하는 β-lactamase 활성 평가, 내성에 관여하는 biomarker의 검출, 항균제 유무에 따른 세균의 proteomic profile의 비교 등이 있다[7]. 이러한 방법들을 기반으로 하여 각종 내성균, 즉 carbapenem 내성 그람음성 막대균(Fig. 3) [8], methicillin 내성 포도알균(MRSA), colistin 내성 세균, 항결핵제 내성 검출 등에 우수함이 보고되었다. 향후에 시험 방법이 표준화되고 기존의 감수성 시험법과의 연관성이 정립되면 더욱 정확하고 신뢰성 있는 방법이 될 것으로 기대된다.
REFERENCES
1. Clark AE, Kaleta EJ, Arora A, Wolk DM. 2013; Matrix-assisted laser desorption ionization-time of flight mass spectrometry: a fundamental shift in the routine practice of clinical microbiology. Clin Microbiol Rev. 26:547–603. DOI: 10.1128/CMR.00072-12. PMID: 23824373. PMCID: PMC3719498.

2. Chong Y, Lee K, Kim HS, Kim SM, Shin JH, Jeong SH. 2017. Diagnostic microbiology. 6th ed. Seoheung;Seoul:
3. Kim M, Kwon MJ, Chung HS, Lee Y, Yong D, Jeong SH, et al. 2012; Evaluation of matrix-assisted laser desorption ionization-time of flight mass spectrometry for identification of aerobic bacteria in a clinical microbiology laboratory. Korean J Clin Microbiol. 15:60–6. DOI: 10.5145/KJCM.2012.15.2.60.

4. Won EJ, Shin JH, Lee K, Kim MN, Lee HS, Park YJ, et al. 2013; Accuracy of species-level identification of yeast isolates from blood cultures from 10 university hospitals in South Korea by use of the matrix-assisted laser desorption ionization-time of flight mass spectrometry-based Vitek MS system. J Clin Microbiol. 51:3063–5. DOI: 10.1128/JCM.00945-13. PMID: 23784123. PMCID: PMC3754637.

5. Lee Y, Sung JY, Kim H, Yong D, Lee K. 2017; Comparison of a new matrix-assisted laser desorption/ionization time-of-flight mass spectrometry platform, ASTA MicroIDSys, with Bruker Biotyper for species identification. Ann Lab Med. 37:531–5. DOI: 10.3343/alm.2017.37.6.531. PMID: 28840993. PMCID: PMC5587828.

6. Lagier JC, Dubourg G, Million M, Cadoret F, Bilen M, Fenollar F, et al. 2018; Culturing the human microbiota and culturomics. Nat Rev Microbiol. 16:540–50. DOI: 10.1038/s41579-018-0041-0. PMID: 29937540.

7. Florio W, Baldeschi L, Rizzato C, Tavanti A, Ghelardi E, Lupetti A. 2020; Detection of antibiotic-resistance by MALDI-TOF mass spectrometry: an expanding area. Front Cell Infect Microbiol. 10:572909. DOI: 10.3389/fcimb.2020.572909. PMID: 33262954. PMCID: PMC7686347.

8. Lasserre C, De Saint Martin De Saint Martin, Cuzon G, Bogaerts P, Lamar E, Glupczynski Y, et al. 2015; Efficient detection of carbapenemase activity in Enterobacteriaceae by matrix-assisted laser desorption ionization-time of flight mass spectrometry in less than 30 minutes. J Clin Microbiol. 53:2163–71. DOI: 10.1128/JCM.03467-14. PMID: 25926485. PMCID: PMC4473196.

9. Trees E, Ng TFF, MacCannell D, Rota PA, Gerner-Smidt P. Carroll KC, Pfaller MA, Landry ML, McAdam AJ, Patel R, Richter SS, editors. 2019. Manual of clinical microbiology. Manual of clinical microbiology. 12th ed. ASM Press;Washington DC: p. 167–96.
10. Clark CM, Costa MS, Sanchez LM, Murphy BT. 2018; Coupling MALDI-TOF mass spectrometry protein and specialized metabolite analyses to rapidly discriminate bacterial function. Proc Natl Acad Sci U S A. 115:4981–6. DOI: 10.1073/pnas.1801247115. PMID: 29686101. PMCID: PMC5949002.

11. Iles RK, Zmuidinaite R, Iles JK, Carnell G, Sampson A, Heeney JL. 2020; Development of a clinical MALDI-ToF mass spectrometry assay for SARS-CoV-2: rational design and multi-disciplinary team work. Diagnostics (Basel). 10:746. DOI: 10.3390/diagnostics10100746. PMID: 32987950. PMCID: PMC7600155.

12. Nachtigall FM, Pereira A, Trofymchuk OS, Santos LS. 2020; Detection of SARS-CoV-2 in nasal swabs using MALDI-MS. Nat Biotechnol. 38:1168–73. DOI: 10.1038/s41587-020-0644-7. PMID: 32733106.





 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download