Abstract
Objectives
The purpose of this study was to evaluate and report the antibacterial efficacy in relation to oral disease-causing bacteria using a mouthwash containing 0.05% CPC in an in vitro test.
Methods
The sterilization test and susceptibility assay of mouthwash containing 0.05% CPC were investigated against Streptococcus mutans, Streptococcus sobrinus, and Lactobacillus acidophilus; Streptococcus sanguinis as oral bacteria related to dental caries; Enterococcus faecalis as apical periodontitis-related bacteria; and Actinomyces israelii, Aggregatibacter actinomycetemcomitans, Fusobacterium nucleatum, Prevotella intermedia, Prevotella nigrescence, Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, and Filifactor alocis as periodontal disease-related bacteria.
Results
In the sterilization test, most of the bacteria had more than 99.99% sterilizing power for all samples but compared to other bacteria, the sterilizing power of these samples was not successful for L. acidophilus and E. faecalis bacteria. When comparing the sterilization power between the samples, sample 3 (0.05% CPC+20% ethanol) was the strongest.
Go to : 
구강 내 바이오필름은 다양한 종의 세균으로 구성되어 있으며, 구강 내 바이오필름의 세균 구성의 변화로 인하여 구강질환이 발생하게 된다1). 치면세균막 내의 치아우식증 유발 세균에 의해 생성된 산은 치질 내의 무기질을 탈회시켜 치아우식증을 발생하게 하여 치아를 파괴시킨다2).
구강 내 세균으로 발생하는 대표적인 구강질환으로 치아우식증과 치주질환이 있으며, 치아우식증은 Streptococcus mutans, Streptococcus sobrinus와 같은 세균에 의해 발생되며3,4), 치면세균막 내 세균의 대사산물인 젖산 등의 유기산을 생성하여 치아의 파괴를 일으키게 된다.
구중 청량제는 대표적인 화학적 치면세균막 조절 방법으로 사용되는 물질로5), 크게 구강질환 예방, 구강질환 치료, 구취감소 등의 다양한 목적을 위하여 사용되고 있으며6), 최근에는 구강질환 유발 세균에 대한 항균 효과를 가지고 있는 물질을 포함된 구중 청량제가 늘어나고 있다7). 구강질환 예방물질로 사용되는 대표적인 성분으로 양이온성 항균물질인 클로르헥시딘(Chlorhexidine)이 가장 널리 사용되고 있으나8), 장기간 사용 시 구강 내 착색 및 미각 장애 등의 부작용을 유발한다는 보고되었다9). 염화세틸피리디늄(cetylpyridinium chloride, CPC)은 클로르헥시딘과 동일한 양이온성 항균물질로 세균 표면의 음전하와 결합하여 항균효과를 가지고 있으며10,11), 구강 조직에 대한 위해작용이 적다는 특징이 있다12). Haps 등(2008)은 CPC가 구강 내 잔류효과가 클로르헥시딘과 비교하여 상대적으로 낮아 오랜 기간 사용이 가능하며, 치은염 완화 효과가 있다고 보고하였다13).
본 연구는 농도 0.05%의 CPC를 포함한 구중 청량제를 이용하여 치아우식증 유발 세균과 관련하여 항균 효능을 실험실적 시험으로 평가하여 보고자 하였으며, 이를 통해 추후 구강질환 예방을 위한 구중 청량제의 성분으로 사용 시 기초자료로 이용하고자 하여 실험을 시행하였다.
Go to : 
항균력 시험을 위해서 세균성 구강질환 관련 세균을 선택하였으며, 치아우식 관련 세균으로는 Streptococcus mutans ATCC 25175, Streptococcus sobrinus ATCC 27607 및 Lactobacillus acidophilus ATCC 9224를 이용하였으며, 심내막염 관련 세균으로 Streptococcus sanguinis ATCC 10556를 이용하였다.
S. mutans, S. sobrinus 및 S. sanguinis는 tryptic soy 액체배지(TSB; BD biosciences, San Jose, CA, USA)를 이용하여 37℃ 호기 상태에서 배양하였다.
준비된 구중 청량제를 50 ml 원추 튜브에 10 g씩 분배하여 넣고, 증류수를 이용하여 40 ml까지 채운 후, vortex 믹서를 이용하여 1분간 혼합하였다. 이후 10,000×g에서 10분간 원심분리하였고, 상층액을 깨끗한 튜브로 옮겨 구강세균에 대한 항균력 시험에 사용하였다.
항균력 시험에 사용될 시약은 다섯군으로 나누어 준비하였다. CPC를 기초로 하여 불화나트륨과 에탄올의 비율을 다르게 하여 Table 1과 같이 준비하였다.
A, B군은 0.05% CPC와 0.02% 불화나트륨을 기초로 하여 에탄올의 농도를 다르게 하여 준비하였으며, C, D군은 0.05% CPC를 기초로 하여 에탄올 농도를 다르게 하였으며, E군은 0.05% CPC, 0.02% 불화나트륨 및 7% 에탄올에 라이소자임을 추가하였다.
각각의 세균에 대한 특정 액체배지에서 배양된 세균을 4,000×g에서 5분간 원심분리하고 5 ml의 각각 세균 배양에 해당하는 깨끗한 액체배지를 넣고 세균 측정 챔버(Bacterial counting chamber; Marienfeld, Lauda-Königshofen, Germany)를 이용하여 세균 양을 측정하였다. 측정된 세균 부유액에 다시 각각 세균 배양에 해당하는 깨끗한 배지를 이용하여 통성혐기성 세균은 1×107 cell/ml 되도록 조정하여 시험에 사용한다. 50 ml 원주형튜브(SPL LifeSciences, Gyeonggido)에 준비된 5군의 CPC 시료를 10 ml 넣고 세균 부유액 100 ml을 넣고 1분 동안 반응시킨 후, 40 ml의 각 세균의 배지를 넣고, 각각의 세균 배양 해당배지를 이용하여 10에서 105까지 연속희석하고 각각의 희석된 세균 부유액을 고체배지에 접종하였다. S. mutans, S. sobrinus 및 S. sanguinis는 Mitis-salivarius 고체배지(BD Bioscience, San Jose, CA, USA)를 36시간 배양하고 집락 수를 측정하였다. 생균수 계산 및 살균감소율은 아래의 결정에 따라 결정하였다.
모든 실험의 최초 희석 단계에서는 각각의 적용 배지를 이용하여 중화시키는 과정을 거쳐 시험을 시행하였으며, 배지에서 세균이 증식한 경우, 배지상의 균 수에 희석 배수를 곱하여 산출하였고, 배지에서 세균이 증식하지 않은 경우는 중화단계에서 이루어진 희석배수를 곱하여 [10미만(<10)]으로 표시하였다. 모든 단계의 세균수의 측정은 고체배지를 이용하여 실시하였으며, 생균수 계산은 [식1.]에 따라 측정하였고 세균감소율은 [식2.]에 따라 결정하였다.
민감도 시험은 Clinical & Laboratory Standard Institute의 방법을 이용하여 액체배지에서 배양된 세균을 4,000×g에서 5분간 원심분리하고 각각 세균에 대한 TSB 액체배지를 넣고 세균 측정 챔버를 이용하여 세균 양을 측정하였다. 측정된 세균 부유액에 깨끗한 배지를 이용하여 S. mutans, S. sobrinus 및 S. sanguinis는 1.0×106 cell/ml이 되도록 조정하여 시험에 사용한다. 시료에 대한 민감도 측정을 위해서 96-well plate의 B-G의 오 well에 깨끗한 TSB배지 180 µl를 1-12번 열에 분주하였다. 이후 C-12 well에는 A군 시료, D-12에는 B군 시료, E-12에는 C군 시료, F-12에는 D군 시료, G-12에는 E군 시료를 각각 180 µl씩 첨가하였다. 이후, multi-pipette을 이용하여 각 시료를 2배 연속 희석하였다. 세균 농도를 측정한 세균부유액을 20 µl씩 희석된 배지에 접종하고, plate는 37도에서 16시간 배양하였다. 세균성장여부는 분광광도계(BioTek, Winooski, VT, USA)를 이용하여 660 nm 파장에서 흡광도를 측정하여 조사하였다.
통계학적 유의성 검사는 IBM SPSS Statistics 24.0 (IBM Inc., Armonk, New York, USA)을 사용하여 군간 비교는 2-sample t-test 및 Mann-Whitney test로 분석하였으며, 군내 비교는 paired t-test, Wilcoxon’s signed rank test로 분석하였다. 유의수준은 0.05로 하였다.
Go to : 
S. mutans에 대한 살균시험 결과, 초기 접종균수[1.0×106 CFU/ml]에서 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [0.98× 106 CFU/ml]로 측정되었으며, 실험군 모두에서 [10<(10미만) CFU/ml]로 감소되었다(Table 2).
Sterilization test of the mouthwash against S. mutans
(Unit: CFU/ml)
S. sobrinus에 대한 살균시험 결과, 초기 접종균수[1.0×106 CFU/ml]에서 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [1.05× 106 CFU/ml]로 측정되었으며, 모든 그룹의 시료에서 [10<(10미만) CFU/ml]로 감소되었다(Table 3).
Sterilization test of the mouthwash against S. sobrinus
(Unit: CFU/ml)
S. sanguinis에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [1.10×106 CFU/ml]로 측정되었으며, 대조군과 비교하여 모든 시료에서 [10<(10미만) CFU/ml]로 감소되었다(Table 4).
Sterilization test of the mouthwash against S. sanguinis
(Unit: CFU/ml)
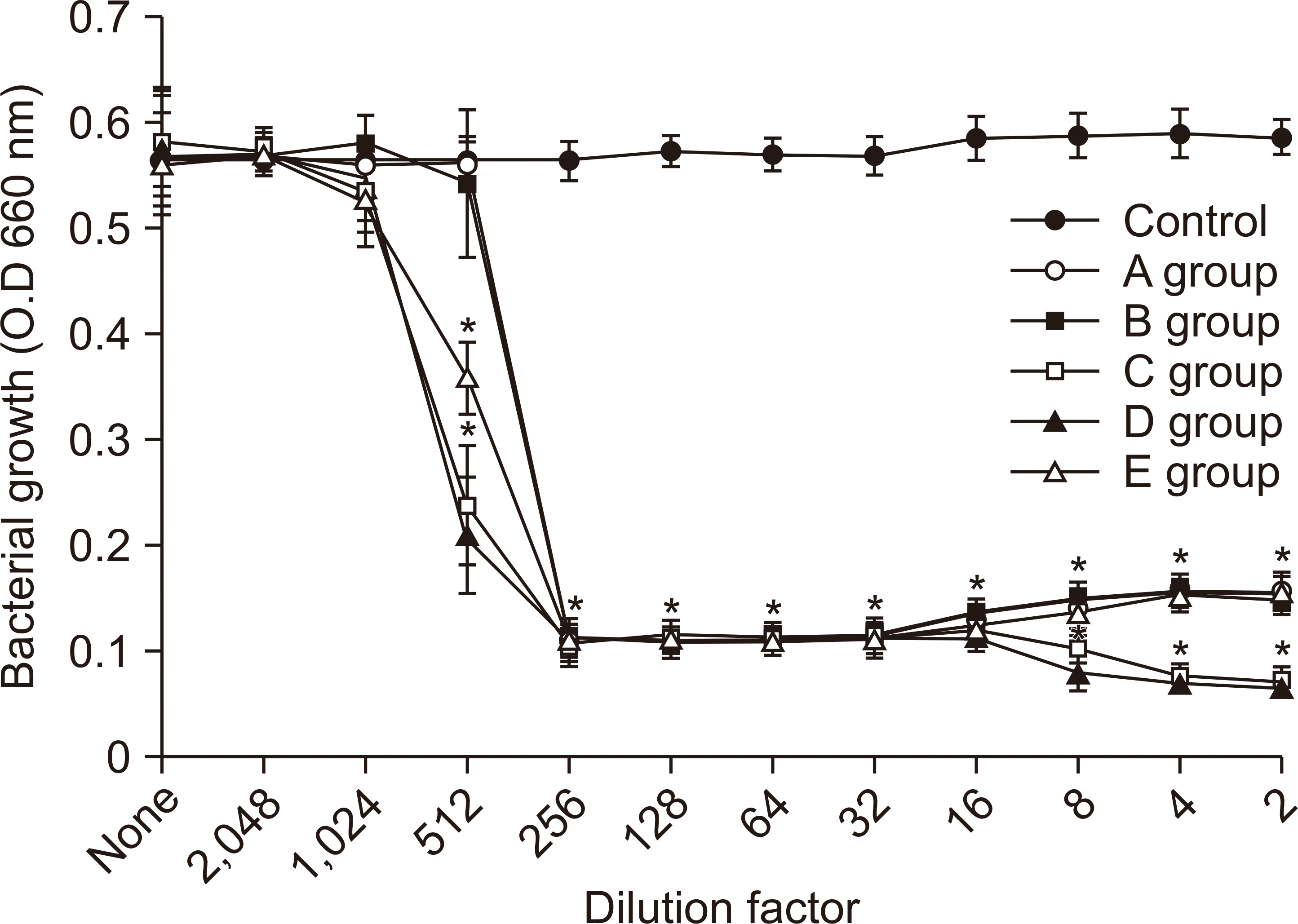
S. mutans에 대한 항균력 시험 결과는 Fig. 1과 같았다. 항균력 시험 결과는 모든 그룹이 256배 희석한 시료에서 S. mutans의 성장이 완전히 억제되었다. 그룹 C와 그룹 D 시료가 512배 희석한 시료에서 세균의 성장을 가장 많이 억제시켰다.
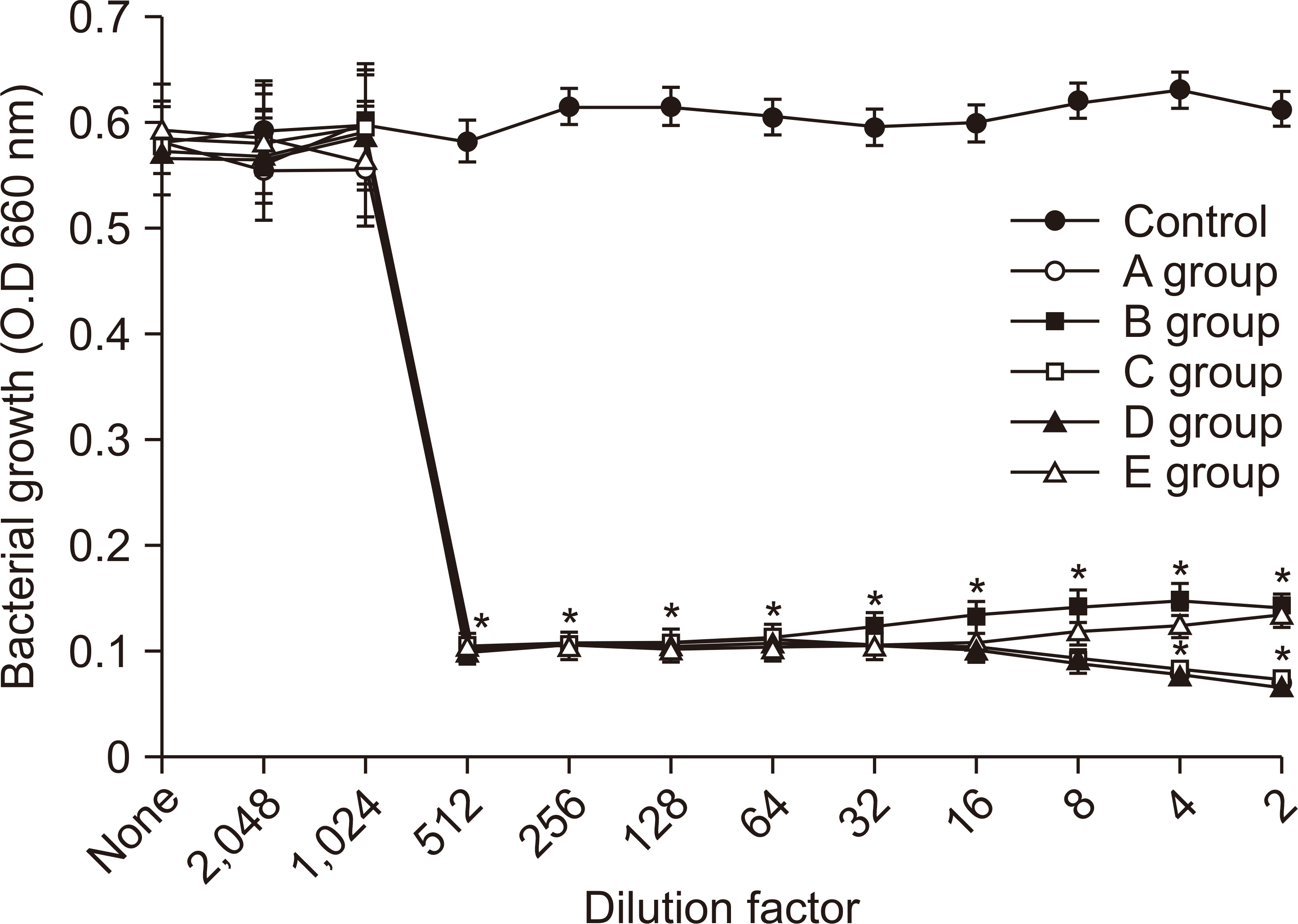
S. sobrinus에 대한 항균력 시험 결과는 Fig. 2와 같았다. 대조군과 비교하여 모든 그룹의 512배 희석한 시료에서 세균의 성장이 억제되었다.
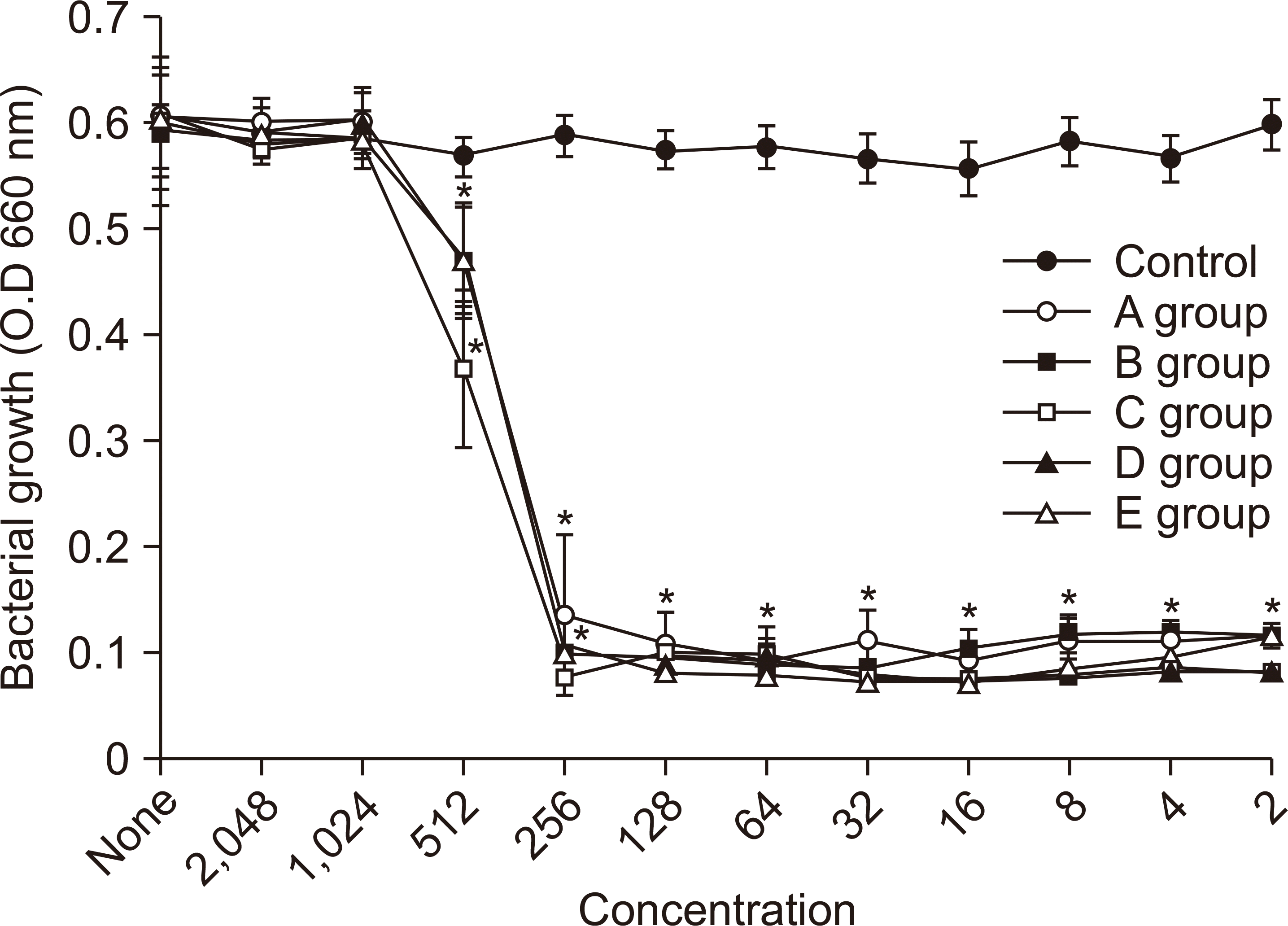
S. sanguinis에 대한 항균력 시험 결과는 Fig. 3와 같았다. 모든 그룹의 256배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 그룹 C의 시료가 512배 희석한 시료에서 세균의 성장을 가장 많이 억제시켰다.
Go to : 
구강질환은 세균성 질환으로 크게 치아우식증와 치주질환으로 나눌 수 있다. 구강질환 유발 세균들을 제거하기 위해서 항균력이 포함된 치약이나 구중 청량제를 개발하고 있으며, 이러한 이유로 구강용품의 항균력은 중요시되고 있다. 구중 청량제는 치면세균막 침착의 방지, 구강 내 염증 물질에 대한 억제 등이 효과를 가지고 있어야 하며, 이를 위해서는 구강 조직에 침투되어야 하고 구강 내에서 가능한 장기간 효능 농도가 유지되어야 한다는 것이다14).
구강질환 예방을 위해서 칫솔질, 혀솔질, 치실 등 물리적 치면세균막 조절법과 병행하여 구강질환 유발 세균의 성장과 증식을 화학적으로 억제할 수 있는 항균물질이 사용되고 있다. 구중 청량제로 가장 널리 알려졌으며, 구강질환 유발 세균에 대하여 강력한 항균력을 가진 클로르헥시딘은 여러 가지 부작용으로 인하여 장기간 사용이 어렵다15). 구강 내 착색 및 장기간 사용 시 미각장애 등의 부작용을 가지고 있는 클로르헥시딘과 비교하여 염화세틸피리디늄은 구강 내 잔류 농도가 낮아서 장기간 사용이 가능하다고 보고되었으며16), 일반적으로 사용되는 농도는 0.025-0.1%이다17). 염화세틸피리디늄은 클로르헥시딘과 같은 양이온성 항균물질로 4차 암모늄계(quaternary ammonium) 화합물이며18), 박테리아 표면의 음전하와 염화세틸피리디늄 분자의 양전하와 결합하며, 이를 통하여 항균 작용의 촉진과 함께 치은염 완화에 효과적이라고 보고된바 있다13,19).
본 연구에서는 염화세틸피리디늄이 함유된 구중 청량제를 이용하여 치아우식증 유발 세균에 대한 살균력 및 항균력 평가를 하였다. 구강질환 유발 세균에 대한 살균력 검사를 수행하였을 때, 치아우식증 관련 세균인 S. mutans, S. sobrinus, S. sanguinis 3종의 구강 유해균에 대해서 99.99%의 살균력을 보이는 것으로 관찰되었다(P<0.05). 모든 시료에서 치아우식 관련 세균인 S. mutans와 S. sobrinus에 대해서는 강한 항균력을 보였다.
이러한 결과를 종합해 보면 염화세틸피리디늄을 함유한 구중 청량제는 치아우식증 유발 세균에 대하여 살균력과 항균효과를 가지고 있음을 확인할 수 있었다. 그러나 일부 세균에 대하여서는 다소 약한 항균력을 보였으나 이와 관련하여서는 추가적인 연구가 필요하며, 또한 세균에만 한정된 실험이 아닌 바이오필름 내 세균에 대한 추가적인 연구가 필요할 것으로 사료된다.
Go to : 
본 연구는 농도 0.05%의 CPC를 포함한 구중 청량제를 이용하여 치아우식증 유발 세균과 관련하여 항균 효능을 실험실적 시험으로 평가하여 보고자 실험을 시행한 결과 다음과 같은 결론을 얻었다.
1. S. mutans에 대한 살균시험 결과, 0.05% CPC 함유 구중 청량제에 대해 99.99% 이상 살균력을 보였다(P<0.05). 항균력 시험에서 256배 희석한 시료에서 S. mutans의 성장이 완전히 억제되었다(P<0.05).
2. S. sobrinus에 대한 살균시험 결과, 0.05% CPC 함유 구중 청량제에 대해 99.99% 이상 살균력을 보였다(P<0.05). 항균력 시험에서 512배 희석한 시료에서 S. sobrinus의 성장이 완전히 억제되었다(P<0.05).
3. S. sanguinis에 대한 살균시험 결과, 0.05% CPC 함유 구중 청량제에 대해 99.99% 이상 살균력을 보였다(P<0.05). 항균력 시험에서 256배 희석한 시료에서 S. sanguinis의 성장이 완전히 억제되었다(P<0.05).
이러한 연구결과, 0.05% CPC 함유 구중 청량제는 치아우식증 예방효과를 기대할 수 있음을 확인할 수 있었다.
Go to : 
References
1. ten Cate JM. 2006; Biofilms, a new approach to the microbiology of dental plaque. Odontology. 94:1–9. DOI: 10.1007/s10266-006-0063-3. PMID: 16998612.

2. Hamada S, Koga T, Ooshima T. 1984; Virulence factors of Streptococcus mutans and dental caries prevention. J Dent Res. 63:407–411. DOI: 10.1177/00220345840630031001. PMID: 6230378.
3. Loesche WJ. 1986; Role of Streptococcus mutans in human dental decay. Microbiol Rev. 50:353–380. DOI: 10.1128/mr.50.4.353-380.1986. PMID: 3540569. PMCID: PMC373078.
4. Kim TI, Choi EJ, Chung CP, Han SB, Ku Y. 2002; Antimicorbial effect of Zea Mays L. and Magnoliae cortex extract mixtures on periodontal pathogen and effect on human gingival fibroblast cellular activity. J Korean Acad Periodontol. 32:249–255. DOI: 10.5051/jkape.2002.32.1.249.

5. Lee ES. 2011; Inhibitory effects of several commercial oral rinses on Streptococcus mutans biofilm formation. J Korean Acad Dent Health. 35:289–296.
6. Shin SC, Lee H. 1998; Clinical study of mouth rinse containing sodium fluoride, cetylpyridinium chloride and urusodesoxycholinic acid on dental plaque and gingivitis. J Korean Acad Dent Health. 22:121–134.
7. Gunsolley JC. 2010; Clinical efficacy of antimicrobial mouthrinses. J Dent. 38:6–10. DOI: 10.1016/S0300-5712(10)70004-X. PMID: 20621242.

8. Bames GP, Roberts DW, Katz RV, Woolridege ED. 1976; Effects of two cetylpyridinium chloride-containing mouthwashes on bacterial plaque. J Periodontol. 47:419–422. DOI: 10.1902/jop.1976.47.7.419. PMID: 1065740.
9. Fardal O, Tumbull RS. 1986; A review of the literature on use of chlorhexidine in dentistry. J Am Dent Assoc. 112:863–869. DOI: 10.14219/jada.archive.1986.0118. PMID: 2940282.
10. Garcia-Godoy F, Klukowska MA, Zhang YH, Anastasia K, Cheng R, Gabbard M, et al. 2014; Comparative bioavailability and antimicrobial activity of cetylpyridinium chloride mouthrinses in vitro and in vivo. Am J Dent. 27:185–190. PMID: 25831600.
11. Sreenivasan PK, Haraszthy VI, Zambon JJ. 2013; Antimicrobial efficacy of 0.05% cetylpyridinium chloride mouthrinses. Lett Appl Microbiol. 56:14–20. DOI: 10.1111/lam.12008. PMID: 23039819.

12. James P, Worthington HV, Parnell C, Harding M, Lamont T, Cheung A, Whelton H, Riley P. 2017; Chlorhexidine mouthrinse as an adjunctive treatment for gingival health. Cochrane Database Syst Rev. 3:CD008676. DOI: 10.1002/14651858.CD008676.pub2. PMID: 28362061. PMCID: PMC6464488.

13. Haps S, Slot DE, Berchier CE, Van der Weijden GA. 2008; The effect of cetylpyridinium chloride-containing mouth rinses as adjuncts to toothbrushing on plaque and parameters of gingival inflammation: a systematic review. Int J Dent Hyg. 6:290–303. DOI: 10.1111/j.1601-5037.2008.00344.x. PMID: 19138180.

14. Linka WA, Golenia E, Zgoda MM, Kołodziejczyk MK. 2014; The use of semi-synthetic polymers in the formulation of sucking and chewable tablets containing sage extract and zinc gluconate. Polim Med. 44:237–245. PMID: 25932905.
15. Fardal O, Tumbull RS. 1986; A review of the literature on use of chlorhexidine in dentistry. J Am Dent Assoc. 112:863–869. DOI: 10.14219/jada.archive.1986.0118. PMID: 2940282.
16. Mandel ID. 1988; Chemotherapeutic agents for controlling plaque and gingivitis. J Clin Periodontol. 15:488. DOI: 10.1111/j.1600-051X.1988.tb01020.x. PMID: 3053790.

17. Llewelyn J. 1980; A double-blind crossover trial on the effect of cetylpyridinium chloride 0.05 per cent (Merocet) on plaque accumulation. Br Dent J. 148:103–104. DOI: 10.1038/sj.bdj.4804396. PMID: 6986884.

18. Kim CY, Kang MS, Kim HG, Kwon HK. 1995; A study on the effects of cetylpyridinium chloride and bamboo salt containing mouthrinses on the inhibition of gingivitis. J Korean Acad Dent Health. 19:219–228.
19. Lim K, Mustapha A. 2007; Inhibition of Escherichia coli O157:H7, Listeria monocytogenes and Staphylococcus aureus on sliced roast beef by cetylpyridinium chloride and acidified sodium chlorite. Food Microbiol. 24:89–94. DOI: 10.1016/j.fm.2006.04.005. PMID: 16943099.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download