Abstract
Centrally mediated abdominal pain syndrome (CAPS), known as functional abdominal pain syndrome in the Rome III criteria of functional gastrointestinal diseases, has a reported population prevalence of between 0.5% and 2.1%, with a female preponderance. The pathogenesis of CAPS has not been completely established, and various studies are being conducted. On the other hand, central nervous system sensitization with disinhibition of the pain signaling pathways appears to play a more important role than the up-regulation of peripheral afferent neuronal excitability. The diagnosis of CAPS is based on the Rome IV criteria (2016) and is established around the gastrointestinal symptoms combination. Various new treatment trials and effective patient-physician relationships showed progressive results.
복통은 매우 흔한 증상으로 소화기내과를 방문하는 경우의 20-50%에 해당하며, 이 중에 50% 정도는 원인을 찾지 못하는 실정이다.1 특히 다양한 복통에서 기능성 위장관 질환(functional abdominal disorder)이라고 분류하는 경우는 기질적, 구조적, 생리적 또는 생화학적으로 설명이 되지 않는 만성적이며 반복적인 위장관 증상들을 의미한다. 복통은 말초신경의 수용체로부터의 신경전달이 미주신경 구심경로 또는 척수신경(교감신경)의 구심경로를 따라 중추신경계에 전달하게 되는 통각 신경로를 통해 전달된다(Fig. 1).2 기능성 위장관 질환에서의 복통의 중요한 병태생리의 하나는 감각신경의 감작(sensitization)으로 알려져 있으며, 대부분은 말초신경의 감각수용체에서 기원하는 말초 감작(peripheral sensitization)으로부터 기원하지만, 일부에서는 말초신경이 아닌 보다 더 상위 수준인 척수후각, 뇌간, 대뇌의 중추 감작(central sensitization)이 병태생리로 작용하는 경우도 존재한다(Fig. 2).2
Centrally mediated abdominal pain syndrome (CAPS)3은 로마 기준 IV에서 새롭게 등장한 질병명으로(Table 1), 로마 기준 III에서는 기능성 복통 증후군(functional abdominal pain syndrome, FAPS)이 이에 해당한다(Table 2). 아직까지 정확한 한글용어가 제정되지 않은 상태이며, ‘중추신경계 매개 복통 증후군’으로 번역하는 것이 적절할 것으로 사료된다. 로마 기준 IV에서 이전에 강조되었던 기능성(functional) 이라는 의미가 희석하고, 새로운 연구 분야인 생물정신사회학적 개념이 삽입된 결과가 질병명 변경의 배경으로 해석해야 할 것이다.4 생물정신사회적 개념 모델에 따르면 유년기의 다양한 경험과 정신사회적 요인들이 상호작용을 이루고, 신체의 다양한 생리학적 변화가 서로 상호작용을 이루면서 증상의 발현과 증상 정도, 삶의 질 등에 상호 영향을 준다. 과민성 장증후군(irritable bowel syndrome, IBS)이나 기능성 소화불량증(functional dyspepsia, FD)과 같은 질환의 복통의 병태생리는 말단 장기의 낮은 정도의 염증이나 다양한 자극원에 의한 구심성 신경의 내장 과민성(visceral hypersensitivity)이 제시되고 있다.3,5 하지만 기능성 위장관 질환의 일부의 복통은 이전의 병태생리로는 잘 설명이 안되고, 오히려 장-뇌 상호 작용의 장애가 더 중요한 원인으로 작용하여 말초 위장관 질환보다는 중추신경계 원인에 의한 복통으로 설명해야 하는 경우가 CAPS이다.6
본고에서는 중추신경의 중추 감작으로 인하여 복통이 유발되는 중추신경계 매개 복통 증후군의 이해를 돕기 위하여 CAPS의 정의, 병태 생리, 진단, 치료에 대해 살펴보고자 한다.
로마 기준 IV에서 CAPS의 진단 기준7은 최소 진단 6개월 전부터 시작된 복통으로 1) 지속적이거나, 거의 지속적인 복통, 2) 통증과 생리적 사건(식사, 배변 또는 생리)의 관계가 없거나 드물게 관계하는 경우, 3) 통증으로 일상적인 기능(직장일, 친밀한 행사, 사회생활/여가생활, 가족생활, 자신과 타인에 대한 돌봄 활동의 장애)의 일부가 제한되는 경우, 4) 꾀병이 아닌 경우, 5) 통증이 다른 구조적 또는 기능적 위장관 장애 또는 다른 의학적 상태로는 설명이 되지 않는 경우, 다섯 가지가 모두 포함된 경우이다(Table 1).3,6
CAPS는 거의 지속적인 복부 통증이 유일한 주요 증상으로, 복통 이외의 다른 소화기 동반 증상도 거의 없고, 식이에 따른 변화나 배변 습관의 변화와도 연관성이 낮은 특성으로 IBS나 FD와 구별할 수 있다. 즉, IBS에서 설사 또는 변비의 증상과 함께 복통이 동반되는 경우라면 CAPS는 설사와 변비와 같은 증상은 거의 없으면서 지속적인 복통이 발생하는 경우이다. 다른 시각으로 본다면 넓은 IBS의 분포를 소화기 증상의 정도와 복통의 정도로 스펙트럼을 나눈다면 CAPS는 IBS의 스펙트럼의 맨 끝에 있다고 할 수도 있다.7 그러므로 IBS와 CAPS가 동시에 나타나기도 하는데, 이러한 경우에도 CAPS는 소화기 증상은 크게 문제가 되지 않고 복부 통증이 우세하게 나타날 수 있다는 것이다.
증상의 원인을 분석하기 위한 다양한 병력청취에서 CAPS는 사회심리학적 요인과 더 일반화된 중추신경계 과민성(central hypersensitivity)이 우세한 특성을 가지고 있다.7 다른 기능성 소화관 질환과 마찬가지로 CAPS도 현재 이용되는 다양한 진단 검사 방법으로 종양이나 염증 질환과 같은 기질적인 원인이나, 갑상선 질환과 같은 호르몬 연관 질환 또는 대사 질환과의 연관성으로는 설명되지 않는다. 또한, 진단 기준에는 포함되지 않지만 정신건강의학적 질환과 관련이 많으나, 정신과적 질환의 진단에 필요한 특정 프로파일이 없는 것이 특징이다.3,6
CAPS에 대한 관련된 역학 연구는 아직 없어서 정확한 유병률을 알 수는 없다. 하지만 1990년대에 미국의 약 5,500 가구를 대상으로 설문을 이용한 기능성 위장관 질환에 대한 역학 연구8에서 만성 복통(chronic abdominal pain)으로 분류된 경우가 2.2%였고, 여성(2.6%)에서 남성(1.7%)보다 두 배 정도 흔하고, 나이는 35세 이하에서 2.3%, 35-44세까지가 2.6%이다가 45세 이상에서는 1.9%로 유병률이 감소하는 추세를 보이며, 이 중에 절반은 증상으로 인하여 의료기관을 방문한 적이 있다는 연구 결과를 바탕으로, 전 인구로 추정하면 약 1.7% (1.3-2.2%) 정도였다.
한국에서의 CAPS에 대한 역학 연구를 시행한 적은 없으나, 로마 기준 III를 기준으로 설문조사를 하였던 연구에서 의료기관을 방문한 기능성 소화관 질환 환자의 약 1%가 만성 복통 증후군으로 진단할 수 있는 경우였다.9
CAPS의 병태생리는 IBS나 FD와 같은 흔한 기능성 소화관 질환과는 구분되는 만성 통증 증후군에서 추정된다.12 일반적인 기능성 소화관 질환의 병태생리는 생물학적(biological), 심리적(psychological), 사회적 요인이 복합적으로 작용하고,12 유전적 소인, 유아기 또는 유년기의 경험, 성인 시기의 스트레스 유발 요인, 부족한 사회적 지지와 같은 심리적 요인이 다양한 위장관 감각 기능과 운동 기능의 이상에 기여하지만,12 CAPS의 경우 소화관의 기능보다는 통증과의 연관성만이 매우 크다는 것이다.7
CAPS 이전의 진단명인 FAPS의 병태생리에 따르면 말초의 상행성 구심성 통증 신호의 증가(말초의 민감화), 척수 후각과 중추 감작, 하행성 억제 신호의 변화, 최종적으로 통증의 중추 증폭(central amplification)의 결과로 해석하였다(Fig. 3).12 즉, 소화기 장기에서 느끼는 통증이 미주신경과 척수신경을 통해서 대뇌와 변연계로 전달되는 각 단계인 말초신경, 후근 신경절의 신호가 모두 민감해져서 이에 대한 반응으로 미주신경이 활성화되는 과정이 반복되어, 중추신경계의 통증에 대한 반응이 감작되어 심한 복통이 생긴다는 것이다(Fig. 2). 최근에는 증가된 말초의 구심성 흥분성(afferent excitability)보다 통증 신호의 탈억제(disinhibiton)와 중추 감작을 CAPS의 주된 병태생리로 제시되고 있다.7 이 과정에는 혐오스러운 유아기의 사건이나 심리사회적인 스트레스와 강하게 연관된 유전적, 환경적, 행동적 요인이 복합적으로 작용하는 것으로 여겨지고 있다. 이러한 요인들이 내재적 통증 시스템을 조절할 수 있으며,5 이에 따라 증가된 말초 구심성 흥분성(excitability)보다는 통증 신호의 탈억제와 함께 중추 감작을 발달시키고, 진행하는 비정상적인 말초 자극이 없을 때도 증상이 지속되거나, 최소한의 자극에도 증상이 악화되어 지속적이거나 거의 지속적인 복통을 일으킬 수 있다.3
중추 감작의 개념을 제시한 Sarkar 등13의 동물 실험에서 원위부 식도에 위산을 노출하면 원위부 식도뿐만 아니라, 중추 감작으로 위산이 노출되지 않은 근위부 식도에도 통각과민이 나타난다고 보고하였다. 구불 결장의 반복적인 자극은 구불 결장뿐만 아니라 중추 감작으로 인해 직장의 통각과민도유발한다는 것이 알려졌고,14 중추 감작이 다른 장기들 사이에서도 역할을 하여 사람의 원위부 식도에 위산 또는 캡사이신(capsaicin) 노출과 직장 민감성 증가와 연관 있다는 보고도있다.15 IBS에서 직장 내 풍선 확장 실험으로 정상인에 비해IBS군에서 직장 감각 역치값이 낮고, 직장 내 풍선 확장에 대한 과민성을 보이지만 FAPS 진단군에서는 직장 내 풍선 확장에서 직장 감각 역치값이 낮지 않았다는 연구16가 있어서FAPS에서의 통증은 내장 과민성에 의한 가능성보다는 하행성 통증 조절계의 차이에 의한 것이라는 주장을 뒷받침한다.16
복통의 발생 기전이 IBS나 FD 같은 다른 functional gastrointestinal disorder (FGID)에서 발생하는 복통은 식이, 배변, 점막 염증, 장내 세균 등이 주로 장내 말초신경에 관여하여 통증의 구심성 신경을 자극하는 과정에서 문제가 발생하여 복통을 초래한다. 이와 다르게 CAPS는 구심성 신경에서 올라온 통증 자극을 조절하는 뇌의 조절 과정에서의 문제로 증상이 발생한다고 알려져 있다.17 그러므로 스트레스, 우울, 불안, 신체화 경향, 대처방식의 문제 등 정신사회적 요인의 연관성이 더 흔하다.17 FGID에서 과거의 사건과 정신사회적 스트레스 요인에 의한 증가된 통증 보고와 뇌 기능 변화의 강한 연관성에 대한 여러 보고가 있다.18,19 언급된 다양한 요인은 CAPS의 발생과 발달에도 영향을 주고, 다양한 정신적인 요인은 통증의 경험을 증폭시킬 수 있으며, 나아가 CAPS의 치료에서 정신적인 개입이 중요하게 작용할 수 있음을 보여준다.5
CAPS는 신경병성 통증(neuropathic pain)의 한 종류일 수도 있다고 추정되는 근거로는 중추신경 감작으로 추정되는 병태 생리와 치료에 중추신경에 작용하는 신경 조절제가 사용된다는 점이고, 증상의 임상적 특징이 신경병성 통증과 유사하다는 것이다. 이질통증(allodynia)이나 통각과민(hyperalgesia), 지속적이고 자발적인 증상의 양상, 낮은 마약성 진통제 효과 등의 신경병성 통증의 임상적 특징을 가지는 것으로 알려져 있다.20
병력 청취에 있어서 가장 중요한 CAPS의 복통의 특징을 살펴보면,7 복통 양상이 지속적이거나, 거의 지속적이다. 복통 빈도는 매우 빈번하며, 재발을 잘한다. 복통 정도는 다양하며, 일상생활의 장애가 될 정도라서 결근이나 결석, 집안일 수행의 제한, 사회 활동의 제약 등과 같이 종종 심각할 수도 있다. 복통 연관 위장관 증상은 있을 수도 있고 때때로 악화되기도 하지만 비정상적인 배변 습관이 심한 복통과의 연관성은 낮은 특징이 있다. 복통이 다른 증상보다 더 중요하고, 우세한 특징을 가지므로 복통의 특징에 대한 자세한 병력 청취가 진단에서 가장 중요한 단서가 된다고 볼 수 있다.
CAPS의 통증을 좀 더 자세히 알아보면 IBS와 같이 경련성(colicky) 복통이지만 더 오래 지속되고 통증의 위치가 세밀하지 않고 광범위한 해부학적 구역에서 나타난다.7 때때로 통증의 발생에 대한 명확한 유발(trigger) 요인이 있기도 하지만 명확한 유발 요인이 없는 경우가 대부분이다. 증상 발생의 유발 요인으로는 복부 또는 복부 이외의 수술, 위장염 같은 감염 등이 있다. 또한 섬유근육통(fibromyalgia), 만성 피로 증후군(chronic fatigue syndrome), 만성 두통, 요통과 같은 다른 만성 통증성 질환이나, 다른 의학적으로 설명되지 않은 질환이 동반되기도 한다. 낮은 생활의 질이나 낮은 기능 수준으로 심리사회적으로 스트레스를 받는 경우도 흔하다.
만성 복통이 불안이나 우울과 같은 기분 장애와 연관 있어, 특이적인 불안이 일반적인 불안보다 더 직접적으로 복통에 영향을 준다.21 CAPS는 다양한 신체형 장애(신체화 장애, 전환장애, 건강염려증 등)에서 나타날 수 있으며, 신체화 장애의 약 30%에서 복통이 있고, 빈도로는 두통, 요통에 이어 세 번째로 흔한 신체화 증상이다.22 가족의 사망, 개인적으로 의미 있는 수술(자궁절제술이나 장루술), 임신과 연관된 좋지 않은 결과(유산, 사산)와 같은 해결되지 않는 상실 후에 증상이 시작되거나 악화되는 경우가 CAPS에서 흔하다.23,24 성적, 신체적 학대를 경험한 경우가 흔하지만 진단에 특이적이지는 않지만 경과에서 좋지 않은 신체 상태, 약물 치료에 무반응, 진단 및 치료 검사의 증가, 빈번한 병원 방문을 예측한다. 이러한 정신적 외상으로 내장통 역치가 감소하지 않더라도 전신적인 신체 감각 증가를 일으킬 수도 있다.25,26
CAPS는 일관된 정신심리분석(psychological profile)이 나타나지 않지만, 심리사회적 장애/문제가 있는 경우는 불량한 예후를 시사한다. CAPS에서 불안, 우울, 신체화 장애 등의 정신건강의학적 진단의 진단 기준을 만족시키지만,27 일차적인 정신건강의학적 질환을 가진 경우와는 다르게 CAPS에서는 이러한 정신건강의학적 질병이 CAPS의 증상에 기여한다는 것을 받아들이는 것을 거부한다. 성적, 신체적 학대의 과거력이나 해결되지 않는 상실(예, 가족의 사망, 수술)이 흔하지만,23,28 이러한 과거력이 CAPS 진단에 반드시 필요한 것은 아니다. 다양한 과거력은 증상의 중증도에는 영향을 줄 수가 있다. 특히, 학대의 과거력은 진단과는 독립적으로 불량한 예후를 시사한다.29
로마 기준 IV 이외에 CAPS의 진단을 용이하게 하는 증상 연관된 행동으로는 언어적 또는 비언어적 방법으로 다양한 강도의 통증 호소, 극심한 증상을 긴급히 보고, 추가 검사를 요구, 정신 질환의 병력, 빈번한 의료 이용, 과거 의료 서비스에 불만족, 마약성 진통제의 요구, 증상의 완치에 관심을 집중, 생물정신사회적 모델(disturbed biopsychosocial model)로 모두 설명되지 않는 애매함, 자기 관리에 대한 개인적 책임에 제한 등이 있다.7
병력 청취와 신체 검사 후, 기질적 질환을 배제하는 검사를 최소한으로 실시하는 것이 원칙이다.30,31 이러한 원칙은 검사를 위한 시간을 줄이고 즉시 적극적인 치료를 시작해야 한다는 것이다. 검사는 염증 표지자를 포함한 기본 혈액 및 생화학 검사, 갑상선 검사 등이 정상임을 확인해야 하고, 경고 증상(체중감소, 빈혈, 출혈 등)이 있는 경우에는 초음파나 복부 전산화단층촬영 등의 영상 검사나 내시경 등을 시행한다. 기본 검사 결과에서 이상 소견이 없고 복부 증상이 로마 기준에 합당하면 CAPS로 진단할 수 있다.
CAPS의 감별 진단으로 복벽 통증(abdominal wall pain)이 있다. 통증의 기원이 복벽인 경우를 감별하기 위한 Carnett 징후(sign)는 만성 복벽 통증이 의심되는 경우에서 반드시 해야 할 진찰이다. 원리는 복벽의 근육이 긴장하면 복벽에서 기원하는 통증의 정도가 증가하는 특성을 이용한 것이다. 피검자를 복부가 이완된 상태로 눕히고, 진찰자는 복부의 근육 방향을 따라서 촉진하여 국소적인 통증을 느끼는 최대 압통 부위를 찾는 것이 첫 단계이다. 다음 단계는 진찰자가 압통 부위에 지속적으로 압력을 가하면서 복벽의 긴장을 올리기 위하여 양쪽 다리를 들어올리거나, 머리나 어깨를 들어올리게 하여 복부 근육을 수축시키도록 한다. 이때에 압통점에서의 통증이 증가하면 Carnett 징후 양성으로 판정하고, 통증의 원인이 복벽에 있는 것으로 판정된다. 이는 복부 피부신경 포착 증후군(anterior cutaneous nerve entrapment syndrome)의 징후로 진찰 시 반드시 확인해야 한다.32 복부 근육 수축으로 복부 압통이 감소하면 Carnett 징후는 음성이며, 이는 통증의 원인이 복벽이 아니라는 것을 시사한다.
복부 피부신경 포착 증후군은 복벽에 복부의 피부신경이 포착되어 나타나는 통증 증후군으로, 통증은 복벽의 근육에 포착된 피부신경으로부터 유발되는 말초성 신경병증의 병태생리이므로 말초신경에 대하여 국소 스테로이드나 진통제 주입으로 치료가 가능하다. 따라서 복부 피부신경 포착 증후군은 CAPS 진단을 위해 반드시 배제해야 할 중요한 감별 진단이다. 일부 전문가들은 드물지만 CAPS에서도 Carnett 징후 양성을 보고하고 있는데, 이는 중추 감작 때문으로 추정하고 있다.17
CAPS 치료에 대한 연구는 많지 않으며, 점차 다양한 방법들이 시도되고 있는 실정이다. 만성 복통의 일차적 조절 장기가 중추신경계임을 인지하는 것이 CAPS의 임상 양상을 이해하고 진단 및 치료 전략을 짜는 데 필수적이다. 또한 다른 기능성 질환의 치료와 유사하게 환자-의사의 신뢰관계를 형성하는 것이 중요하다. 본인의 진단을 수용할 수 있고 완치가 어려우므로, 환자에게 치료 목표가 증상의 호전과 기능의 회복이라는 것을 이해시켜야 한다. CAPS의 주된 치료 전략은 약물 치료와 행동 치료이다. CAPS의 병태생리에 대한 충분한 설명이 필요하고, 복통의 기원이 복부 장기의 이상이 아니고, 내부 통증 신호를 억제하지 않는 뇌의 중추신경계에서 발생하며, 생리심리사회적 모델(biopsychosocial model) 내에서 이전의 부정적인 사건의 불운한 표현임을 환자에게 이해시켜야 한다.7
약물적 치료 방법으로는 신경병성 통증을 위해 사용되는 장-뇌 신경조절제가 사용되는데, 삼환계 항우울제(tricyclic antidepressants, TCA), 세로토닌-노르에피네프린 재흡수 억제제(serotonin and norepinephrine reuptake Inhibitors, SNRI)를 일차적으로 사용할 수 있다(Table 3).7,33,34 TCA나 SNRI를 선택하는 이유는 이 약물들은 세로토닌 경로와 노르에피네프린 경로에 모두 작용할 수 있어서 기분 향상과 통증 감소의 효과를 동시에 할 수 있기 때문이다. 반면에 선택적 세로토닌 재흡수 억제제(selective serotonin reuptake inhibitors, SSRI)는 세로토닌 경로의 특징을 가지지만, 노르에피네프린 경로의 작용이 부족하여 기분 향상에는 도움이 되지만 통증 감소 효과는 부족하다(Fig. 3).
약물은 저용량으로 4-6주간 시작하여 서서히 효과를 기다린 후, 불완전한 반응을 보일 때는 비슷한 기간 동안 점차 용량을 증량할 수 있다. CAPS의 치료 시 한 가지 약물을 고용량으로 투여 후 효과가 없으면 다른 약물로 교체하는 것은 증상 호전까지 기간이 길고 불완전한 치료 반응과 부작용으로 인한 치료 실패를 초래할 수 있다. 한 가지 약물 치료에 효과가 없을 때는 다른 수용체 부위나 다른 뇌의 영역에 작용하는 2개 이상의 약물을 저용량으로 복합해서 사용하는 증강 치료 방법(augmentation protocol)을 사용할 수 있다.35 이러한 치료에는 TCA, SNRI, SSRI 외에도, quetiapine, olanzapine, sulpiride 등의 비전형적 항정신병약물(atypical antipsychotics), buspirone 등의 세로토닌1 효능제(5-HT1 agonist), mirtazapine, mianserin 등과 같은 사환계 항우울제(tetracyclyic antidepressant), gabapentin, pregabalin 등과 같은 델타 리간드 작용제(delta ligand agents) 등도 사용될 수 있다.
기능성 소화기 질환에서 도움이 된다고 알려진 정신 치료(psychotherapy)를 약물 치료와 병행하는 다학제적(multidisciplinary) 치료 방법은 CAPS 치료에 도움이 되고,36 정신역동심리 치료(psychodynamic interpersonal psycho-therapy), 최면 치료(gut-directed hypnotherapy), 명상(mindfulness)/수용 전념 치료(acceptance and commitment therapy), 인지 행동 치료(cognitive behavioral therapy) 등이 있다.37
TCA는 대상포진 후 신경통(postherpetic neuralgia)이나 당뇨병성 신경병증, 섬유근육통 같은 다양한 질환에 사용되는 정신과 약물이다. 정신병리학적 증상(psychopathology)이 덜 우세하거나 거의 없는 많은 통증 증후군에 효과적이다. 보통은 정신건강의학과의 사용 용량보다 저용량(subpsychiatric dose)으로 투여를 시작하기 때문에, TCA의 진통 효과는 아마도 항우울 효과와 관련이 없을 것으로 생각하고 있다. TCA는 IBS에서 많은 연구가 이루어졌는데, 중등도에서 중증 IBS에서 통증을 경감시키고 삶의 질이 호전된다.38 또한 TCA는 FD 통증 치료에 도움이 되며, 특히 FD의 아형 중에서 식후불편증후군(postprandial discomfort syndrome)보다 명치통증증후군(epigastric pain syndrome)에서 좀 더 효과가 있었다.39 TCA의 가장 흔한 부작용은 입 마름, 졸림, 초조(agitation), 변비, 급성 배뇨장애, 수면 장애 등이 있다.2
SNRI는 TCA와 비교하여 상대적으로 적은 부작용을 가지므로, 변비가 심하거나 TCA 부작용으로 사용이 제한될 때 대안으로 사용될 수 있다. 특히 진통과 항우울의 이중 효과를 가지므로, 통증 증후군을 가진 우울한 환자에서 사용될 수 있다. 가장 흔한 부작용은 오심이며, 오심은 1주일 후 사라지거나 음식과 같이 섭취하면 감소한다. 노르에피네프린 재흡수억제가 진통 효과에 가장 중요하므로 이러한 특징으로 약 용량이 결정되는데, duloxetine은 30-90 mg/일 사용될 수 있으며, venlafaxine은 저용량에서는 노르에피네프린 재흡수 억제의 효과가 적으므로 최소 225 mg/일 이상 사용해야 도움이된다.2
SSRI는 실험 모델에서 증명된 것처럼 에피네프린 시냅스 경로의 효과의 부족으로 인해, TCA에 비해 진통 효과가 덜 하다. FD에서 amitriptyline (TCA 계열)과 escitalopram (SSRI 계열), 위약을 비교한 다기관 연구에서 위약에 비해 TCA는 증상의 의미 있는 감소를 보였으나, SSRI는 의미 있는 증상 호전이 없었다.39 SSRI는 TCA 또는 SNRI에 비해 강한 내장 진통제의 효과는 적으므로 불안, 우울, 임상적으로 명확한 심리적 고통이 동반된 경우 도움이 될 수 있다. 부작용으로는 대개는 경미하지만, 오심, 설사, 성기능 장애, 불안이나 떨림, 불면, 악몽 등의 신경정신학적 증상이 생길 수 있다.
비정형적 항정신병약물(atypical antipsychotics)은 전형적 항정신병제제에 대비되는 말로 제2, 3세대 항정신병약물로도 불리며, 이전 항정신병약물에 비해 부작용이 적은 것이 특징이다. 대표적인 quetiapine은 불안, 수면 장애, 연관된 정신과적 동반 증상을 가진 경우와 섬유근육통과 같은 통증성 질환의 증강 치료에 저용량으로 사용되고 있다. 만성 복통을 가진 경우에서 불안을 감소시키고, 정상 수면 형태로 회복시키고, 직접적인 진통 효과를 통해 증상 완화에 도움을 줄 수 있다. 전체적으로 적절한 임상 반응을 보이지 않는 경우에서 TCA나 SNRI의 효과를 증가시키는 것으로 보인다.
진통제(예, 아스피린, NSAIDs)의 대부분은 작용기전이 체성 신경에 의한 통증에 효과적으로 작용하므로, CAPS의 통증에는 효과가 적다. 마약성 진통제(narcotic analgesics)는 중독과 마약 장 증후군(narcotic bowel syndrome)의 발생이나 다른 위장관 부작용 때문에 반드시 피해야 한다.40
그 외 정신작용약(psychotropic agents), mirtazapine 같은 사환계 항우울제(tetracyclic antidepressant)는 노르에피네프린 활성을 증가시키고 세로토닌 1A 활성을 증가시켜서 항구역과 식욕 촉진에 도움을 주어 FD 환자에서 체중 증량에 효과적이다. Buspirone은 비벤조디아제핀 항불안제제로서 항불안제의 효과를 증가시키고 세로토닌1 효능제로 FD의 증상을 향상시킬 수 있다.
REFERENCES
1. Wen BZ, Pan QY. 1988; Functional bowel disorders in apparently healthy Chinese people. Zhonghua Liu Xing Bing Xue Za Zhi. 9:345–349. PMID: 3245962.
2. Törnblom H, Drossman DA. 2018; Psychotropics, antidepressants, and visceral analgesics in functional gastrointestinal disorders. Curr Gastroenterol Rep. 20:58. DOI: 10.1007/s11894-018-0664-3. PMID: 30397821. PMCID: PMC6223713.

3. Drossman DA, Hasler WL. 2016; Rome IV-functional GI disorders: disorders of gut-brain interaction. Gastroenterology. 150:1257–1261. DOI: 10.1053/j.gastro.2016.03.035. PMID: 27147121.

4. Ryu HS, Choi SC. 2017; Understanding the Rome IV: background to the Rome IV revision. Korean J Med. 92:349–353. DOI: 10.3904/kjm.2017.92.4.349.

5. Van Oudenhove L, Crowell MD, Drossman DA, et al. 2016; Biopsychosocial aspects of functional gastrointestinal disorders. Gastroenterology. 150:1355–1367. DOI: 10.1053/j.gastro.2016.02.027. PMID: 27144624.
6. Schmulson MJ, Drossman DA. 2017; What is new in Rome IV. J Neurogastroenterol Motil. 23:151–163. DOI: 10.5056/jnm16214. PMID: 28274109. PMCID: PMC5383110.

7. Keefer L, Drossman DA, Guthrie E, et al. 2016; Centrally mediated disorders of gastrointestinal pain. Gastroenterology. 150:1408–1419. DOI: 10.1053/j.gastro.2016.02.034. PMID: 27144628.

8. Drossman DA, Li Z, Andruzzi E, et al. 1993; U.S. householder survey of functional gastrointestinal disorders. Prevalence, sociodemography, and health impact. Dig Dis Sci. 38:1569–1580. DOI: 10.1007/BF01303162. PMID: 8359066.
9. Kim ES, Lee BJ, Kim YS, Lee SI, Park H. 2008; Validation of Rome III criteria in the diagnosis of functional gastrointestinal disorders in Korean patients. Kor J Neurogastroenterol Motil. 14:39–44.
10. Thompson WG, Irvine EJ, Pare P, Ferrazzi S, Rance L. 2002; Functional gastrointestinal disorders in Canada: first population-based survey using Rome II criteria with suggestions for improving the questionnaire. Dig Dis Sci. 47:225–235. DOI: 10.1023/A:1013208713670. PMID: 11837727.
11. Bharucha AE, Camilleri M. 2001; Functional abdominal pain in the elderly. Gastroenterol Clin North Am. 30:517–529. DOI: 10.1016/S0889-8553(05)70193-X. PMID: 11432303.

12. Farmer AD, Aziz Q. 2014; Mechanisms and management of functional abdominal pain. J R Soc Med. 107:347–354. DOI: 10.1177/0141076814540880. PMID: 25193056. PMCID: PMC4206626.

13. Sarkar S, Aziz Q, Woolf CJ, Hobson AR, Thompson DG. 2000; Contribution of central sensitisation to the development of non-cardiac chest pain. Lancet. 356:1154–1159. DOI: 10.1016/S0140-6736(00)02758-6. PMID: 11030295.

14. Munakata J, Naliboff B, Harraf F, et al. 1997; Repetitive sigmoid stimulation induces rectal hyperalgesia in patients with irritable bowel syndrome. Gastroenterology. 112:55–63. DOI: 10.1016/S0016-5085(97)70219-1. PMID: 8978343.

15. Brock C, Andresen T, Frøkjaer JB, et al. 2010; Central pain mechanisms following combined acid and capsaicin perfusion of the human oesophagus. Eur J Pain. 14:273–281. DOI: 10.1016/j.ejpain.2009.05.013. PMID: 19541517.

16. Nozu T, Kudaira M. 2009; Altered rectal sensory response induced by balloon distention in patients with functional abdominal pain syndrome. Biopsychosoc Med. 3:13. DOI: 10.1186/1751-0759-3-13. PMID: 19925683. PMCID: PMC2784791.

17. Sperber AD, Drossman DA. 2011; Review article: the functional abdominal pain syndrome. Aliment Pharmacol Ther. 33:514–524. DOI: 10.1111/j.1365-2036.2010.04561.x. PMID: 21204888.

18. Mayer EA, Collins SM. 2002; Evolving pathophysiologic models of functional gastrointestinal disorders. Gastroenterology. 122:2032–2048. DOI: 10.1053/gast.2002.33584. PMID: 12055608.

19. Van Oudenhove L, Vandenberghe J, Dupont P, et al. 2010; Regional brain activity in functional dyspepsia: a H(2)(15)O-PET study on the role of gastric sensitivity and abuse history. Gastroenterology. 139:36–47. DOI: 10.1053/j.gastro.2010.04.015. PMID: 20406641.

20. Searle RD, Howell SJ, Bennett MI. 2012; Diagnosing postoperative neuropathic pain: a Delphi survey. Br J Anaesth. 109:240–244. DOI: 10.1093/bja/aes147. PMID: 22649184.

21. McCracken LM, Zayfert C, Gross RT. 1992; The pain anxiety symptoms scale: development and validation of a scale to measure fear of pain. Pain. 50:67–73. DOI: 10.1016/0304-3959(92)90113-P. PMID: 1513605.

22. El-Rufaie OE, Al-Sabosy MA, Bener A, Abuzeid MS. 1999; Somatized mental disorder among primary care Arab patients: I. Prevalence and clinical and sociodemographic characteristics. J Psychosom Res. 46:549–555. DOI: 10.1016/S0022-3999(98)00101-9. PMID: 10454171.
23. Drossman DA. 1982; Patients with psychogenic abdominal pain: six years' observation in the medical setting. Am J Psychiatry. 139:1549–1557. DOI: 10.1176/ajp.139.12.1549. PMID: 7149053.
24. Hislop IG. 1979; Childhood deprivation: an antecedent of the irritable bowel syndrome. Med J Aust. 1:372–374. DOI: 10.5694/j.1326-5377.1979.tb126963.x. PMID: 470749.

25. Mayer EA, Gebhart GF. 1994; Basic and clinical aspects of visceral hyperalgesia. Gastroenterology. 107:271–293. DOI: 10.1016/0016-5085(94)90086-8. PMID: 8020671.

26. Ringel Y, Whitehead WE, Toner BB, et al. 2004; Sexual and physical abuse are not associated with rectal hypersensitivity in patients with irritable bowel syndrome. Gut. 53:838–842. DOI: 10.1136/gut.2003.021725. PMID: 15138210. PMCID: PMC1774075.

27. Drossman DA. 1995; Diagnosing and treating patients with refractory functional gastrointestinal disorders. Ann Intern Med. 123:688–697. DOI: 10.7326/0003-4819-123-9-199511010-00008. PMID: 7574225.

28. Leserman J, Drossman DA, Li Z, Toomey TC, Nachman G, Glogau L. 1996; Sexual and physical abuse history in gastroenterology practice: how types of abuse impact health status. Psychosom Med. 58:4–15. DOI: 10.1097/00006842-199601000-00002. PMID: 8677288.
29. Drossman DA, Leserman J, Hu JB. 1996; Gastrointestinal diagnosis, abuse history, and effects on health status. Gastroenterology. 111:1159–1161. DOI: 10.1016/S0016-5085(96)70092-6. PMID: 8831619.

30. Sperber AD, Drossman DA. 2010; Functional abdominal pain syndrome: constant or frequently recurring abdominal pain. Am J Gastroenterol. 105:770–774. DOI: 10.1038/ajg.2010.68. PMID: 20372129.

31. Chey WD, Nojkov B, Rubenstein JH, Dobhan RR, Greenson JK, Cash BD. 2010; The yield of colonoscopy in patients with non-constipated irritable bowel syndrome: results from a prospective, controlled US trial. Am J Gastroenterol. 105:859–865. DOI: 10.1038/ajg.2010.55. PMID: 20179696. PMCID: PMC2887227.

32. Glissen Brown JR, Bernstein GR, Friedenberg FK, Ehrlich AC. 2016; Chronic abdominal wall pain: an under-recognized diagnosis leading to unnecessary testing. J Clin Gastroenterol. 50:828–835. DOI: 10.1097/MCG.0000000000000636. PMID: 27548731.
33. Drossman DA, Tack J, Ford AC, Szigethy E, Törnblom H, Van Oudenhove L. 2018; Neuromodulators for functional gastrointestinal disorders (disorders of gut-brain interaction): a Rome foundation working team report. Gastroenterology. 154:1140–1171. e. DOI: 10.1053/j.gastro.2017.11.279. PMID: 29274869.

34. Sobin WH, Heinrich TW, Drossman DA. 2017; Central neuromodulators for treating functional GI disorders: a primer. Am J Gastroenterol. 112:693–702. DOI: 10.1038/ajg.2017.57. PMID: 28349992.

35. Trivedi MH, Fava M, Wisniewski SR, et al. 2006; Medication augmentation after the failure of SSRIs for depression. N Engl J Med. 354:1243–1252. DOI: 10.1056/NEJMoa052964. PMID: 16554526.

36. Clouse RE, Mayer EA, Aziz Q, et al. 2006; Functional abdominal pain syndrome. Gastroenterology. 130:1492–1497. DOI: 10.1053/j.gastro.2005.11.062. PMID: 16678562.

37. Keefer L, Mandal S. 2015; The potential role of behavioral therapies in the management of centrally mediated abdominal pain. Neurogastroenterol Motil. 27:313–323. DOI: 10.1111/nmo.12474. PMID: 25428520.

38. Ford AC, Talley NJ, Schoenfeld PS, Quigley EM, Moayyedi P. 2009; Efficacy of antidepressants and psychological therapies in irritable bowel syndrome: systematic review and meta-analysis. Gut. 58:367–378. DOI: 10.1136/gut.2008.163162. PMID: 19001059.

39. Talley NJ, Locke GR, Saito YA, et al. 2015; Effect of amitriptyline and escitalopram on functional dyspepsia: a multicenter, randomized controlled study. Gastroenterology. 149:340–9.e2. DOI: 10.1053/j.gastro.2015.04.020. PMID: 25921377. PMCID: PMC4516571.

40. Grunkemeier DM, Cassara JE, Dalton CB, Drossman DA. 2007; The narcotic bowel syndrome: clinical features, pathophysiology, and management. Clin Gastroenterol Hepatol. 5:1126–1122. DOI: 10.1016/j.cgh.2007.06.013. PMID: 17916540. PMCID: PMC2074872.

Fig. 1
Abdominal pain pathways. A human has two pathways in the abdominal pain pathways. One is the sensory neuronal pathway of the vagus nerve, and the other is the sensory neuronal pathway of the sympathetic nerve. The types of sympathetic ganglion vary according to each organ.
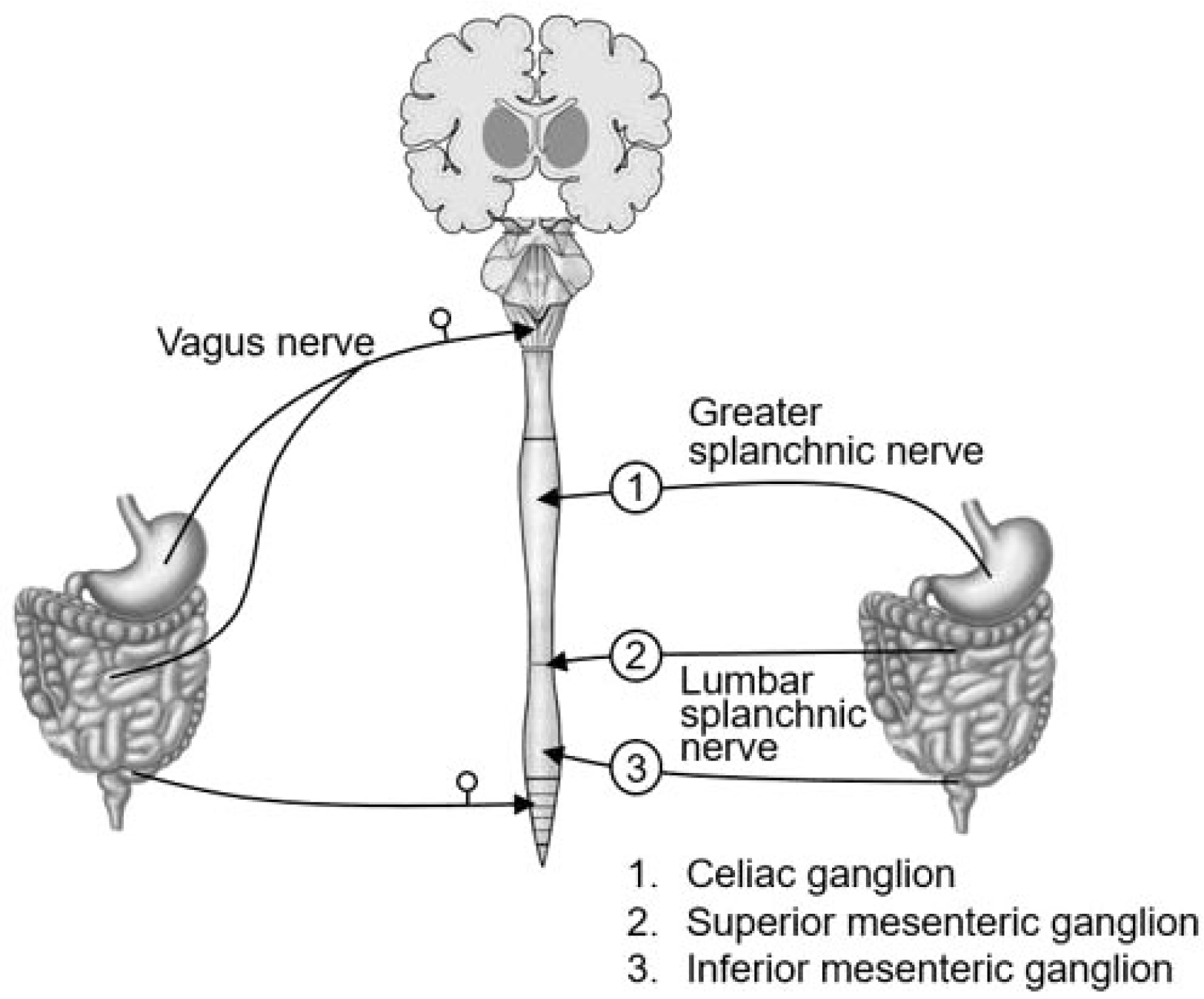
Fig. 2
Peripheral and central sensitization. The spinothalamic tract consists of peripheral neurons and central neurons. The terminals of the peripheral nerves are called sensory receptors (nociceptors). These various sensitizations are called peripheral sensitization. The sensitization that occurs in the synapses in the dorsal horn, brain stem, and cerebral cortex is called central sensitization.
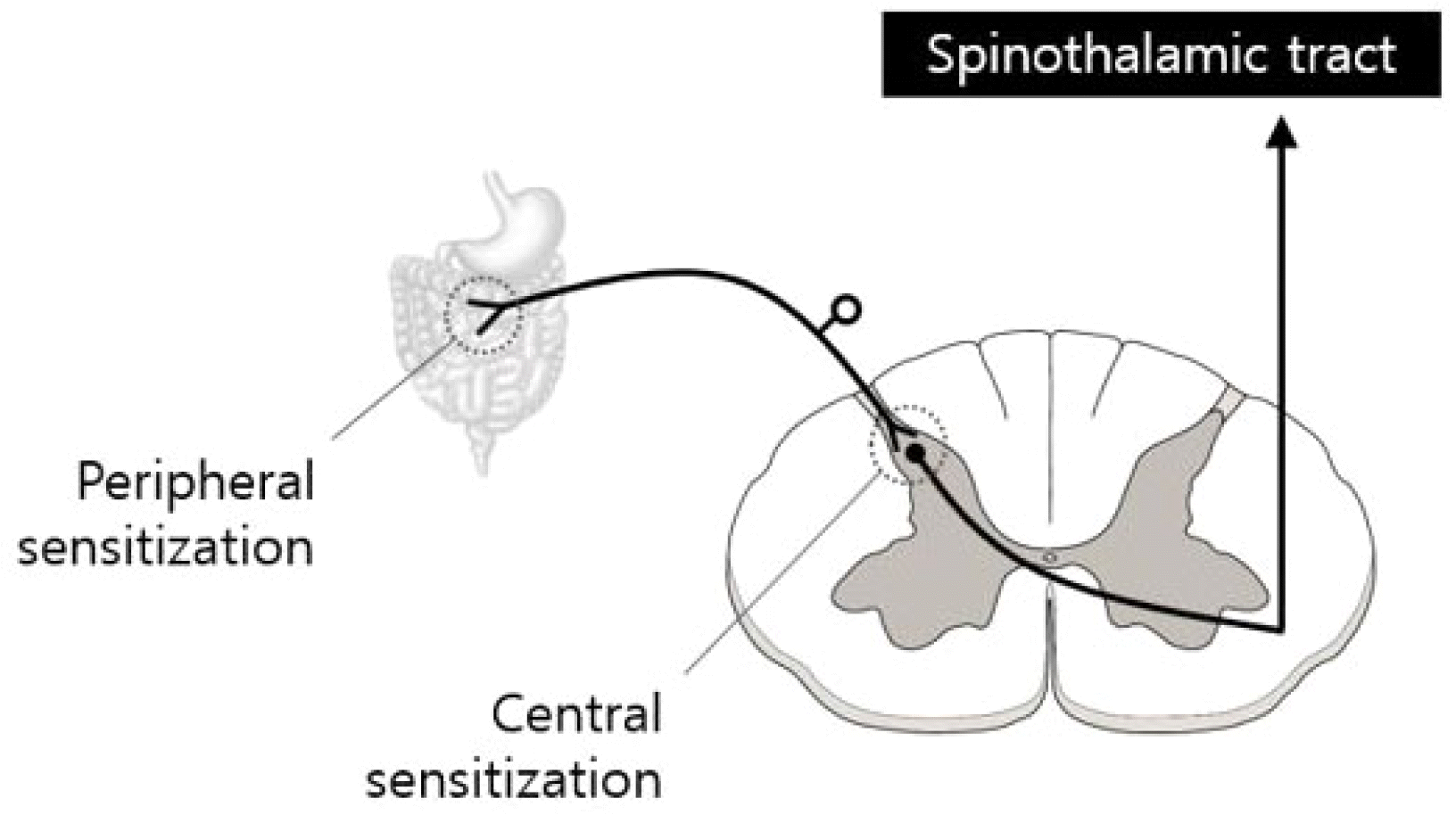
Fig. 3
Pain modulators and analgesics. Pain can be modulated by drugs acting on each level. Drugs that act on the nociceptors are called peripheral acting medicines, and those that act on higher levels (dorsal horn, brain stem, cerebral cortex) are called central acting medicines.
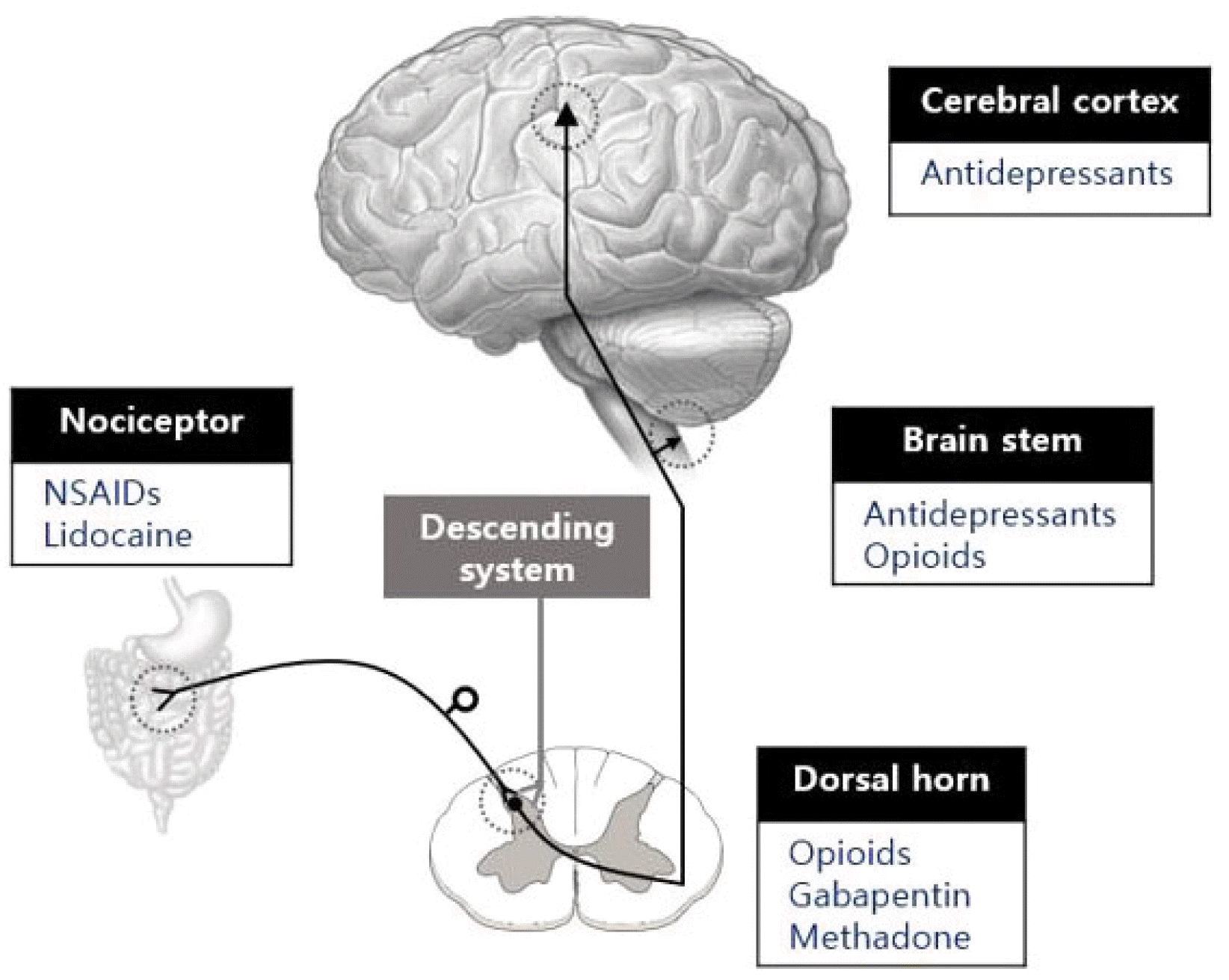
Table 1
Rome IV Diagnostic Criteria for Centrally Mediated Abdominal Pain Syndrome
Table 2
Rome II Diagnostic Criteria for Functional Abdominal Pain Syndrome
Table 3
Central Neuromodulators for CAPS




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download