Adler SP., Finney JW., Manganello AM. Prevention of child-to-mother transmission of cytomegalovirus among pregnant women. J Pediatr. 2004. 145:485–91.

American Academy of Pediatrics, Joint Committee on Infant Hearing. Year 2007 position statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics. 2007. 120:898–921.
Barber V., Calvert A., Vandrevala T., Star C., Khalil A., Griffiths P, et al. Prevention of acquisition of cytomegalovirus infection in pregnancy through hygiene-based behavioral interventions: a systematic review and gap analysis. Pediatr Infect Dis J. 2020. 39:949–54.

Bardanzellu F., Fanos V., Reali A. Human breast milk-acquired cytomegalovirus infection: certainties, doubts and perspectives. Curr Pediatr Rev. 2019. 15:30–41.

Bate SL., Dollard SC., Cannon MJ. Cytomegalovirus seroprevalence in the United States: the national health and nutrition examination surveys, 1988–2004. Clin Infect Dis. 2010. 50:1439–47.

Bodçus M., Hubinont C., Goubau P. Increased risk of cytomegalovirus transmission in utero during late gestation. Obstet Gynecol. 1999. 93(5 Pt 1):658–60.
Boppana SB., Rivera LB., Fowler KB., Mach M., Britt WJ. Intrauterine transmission of cytomegalovirus to infants of women with preconceptional immunity. N Engl J Med. 2001. 344:1366–71.

Boppana SB., Ross SA., Fowler KB. Congenital cytomegalovirus infection: clinical outcome. Clin Infect Dis. 2013. 57(Suppl 4):S178–81.

Boppana SB., Ross SA., Novak Z., Shimamura M., Tolan RW Jr., Palmer AL, et al. Dried blood spot real-time polymerase chain reaction assays to screen newborns for congenital cytomegalovirus infection. JAMA. 2010. 303:1375–82.

Boppana SB., Ross SA., Shimamura M., Palmer AL., Ahmed A., Michaels MG, et al. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. N Engl J Med. 2011. 364:2111–8.

Cannon MJ., Schmid DS., Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev Med Virol. 2010. 20:202–13.

Carlson A., Norwitz ER., Stiller RJ. Cytomegalovirus infection in pregnancy: should all women be screened? Rev Obstet Gynecol. 2010. 3:172–9.
Chiopris G., Veronese P., Cusenza F., Procaccianti M., Perrone S., Daccø V, et al. Congenital cytomegalovirus infection: update on diagnosis and treatment. Microorganisms. 2020. 8:1516.

Coats DK., Demmler GJ., Paysse EA., Du LT., Libby C. Ophthalmologic findings in children with congenital cytomegalovirus infection. J AAPOS. 2000. 4:110–6.

Colomba C., Giuffrç M., La Placa S., Cascio A., Trizzino M., De Grazia S, et al. Congenital cytomegalovirus related intestinal malrotation: a case report. Ital J Pediatr. 2016. 42:105.

Dahle AJ., Fowler KB., Wright JD., Boppana SB., Britt WJ., Pass RF. Longitudinal investigation of hearing disorders in children with congenital cytomegalovirus. J Am Acad Audiol. 2000. 11:283–90.
De la Calle M., Baquero-Artigao F., Rodrçguez-Molino P., Cabanes M., Cabrera M., Antolin E, et al. Combined treatment with immunoglobulin and valaciclovir in pregnant women with cytomegalovirus infection and high risk of symptomatic fetal disease. J Matern Fetal Neonatal Med. 2020. 15:1–5.

Dollard SC., Grosse SD., Ross DS. New estimates of the prevalence of neurological and sensory sequelae and mortality associated with congenital cytomegalovirus infection. Rev Med Virol. 2007. 17:355–63.

Dreher AM., Arora N., Fowler KB., Novak Z., Britt W., Boppana SB, et al. Spectrum of disease and outcome in children with symptomatic congenital cytomegalovirus infection. J Pediatr. 2014. 164:855–9.

Enders G., Daiminger A., Bçder U., Exler S., Enders M. Intrauterine transmission and clinical outcome of 248 pregnancies with primary cytomegalovirus infection in relation to gestational age. J Clin Virol. 2011. 52:244–6.

Fabbri E., Revello MG., Furione M. Prognostic markers of symptomatic congenital human cytomegalovirus infection in fetal blood. BJOG. 2011. 118:448–56.

Foulon I., Naessens A., Foulon W., Casteels A., Gordts F. Hearing loss in children with congenital cytomegalovirus infection in relation to the maternal trimester in which the maternal primary infection occurred. Pediatrics. 2008. 122:1123–7.

Grosse SD., Ross DS., Dollard SC. Congenital cytomegalovirus (CMV) infection as a cause of permanent bilateral hearing loss: a quantitative assessment. J Clin Virol. 2008. 41:57–62.

Kenneson A., Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol. 2007. 17:253–76.

Kim JY., Lee YK., Ko SY., Shin SM. Diagnostic clues for congenital cytomegalovirus infection: association with newborn hearing screening tests. Neonatal Med. 2019. 26:96–101.

Leruez-Ville M., Ghout I., Bussiçres L., Stirnemann J., Magny JF., Couderc S, et al. In utero treatment of congenital cytomegalovirus infection with valacyclovir in a multicenter, open-label, phase II study. Am J Obstet Gynecol. 2016a. 215:462.e1–462.e10.

Leruez-Ville M., Ren S., Magny JF., Jacquemard F., Couderc S., Garcia P, et al. Accuracy of prenatal ultrasound screening to identify fetuses infected by cytomegalovirus which will develop severe long-term sequelae. Ultrasound Obstet Gynecol. 2021. 57:97–104.

Leruez-Ville M., Stirnemann J., Sellier Y., Guilleminot T., Dejean A., Magny JF, et al. Feasibility of predicting the outcome of fetal infection with cytomegalovirus at the time of prenatal diagnosis. Am J Obstet Gynecol. 2016b. 215:342.e1–9.

Leruez-Ville M., Ville Y. Fetal cytomegalovirus infection. Best Pract Res Clin Obstet Gynaecol. 2017. 38:97–107.

Manicklal S., Emery VC., Lazzarotto T., Boppana SB., Gupta RK. The “silent” global burden of congenital cytomegalovirus. Clin Microbiol Rev. 2013. 26:86–102.

Navti OB., Al-Belushi M., Konje JC. FRCOG. Cytomegalovirus infection in pregnancy - an update. Eur J Obstet Gynecol Reprod Biol. 2021. 258:216–22.

Nigro G., Adler SP., Torre RL., Best AM. Passive immunization during pregnancy for congenital cytomegalovirus infection. N Engl J Med. 2005. 353:1350–62.

Pass RF., Anderson B. Mother-to-child transmission of cytomegalovirus and prevention of congenital infection. J Pediatric Infect Dis Soc. 2014. 3(Suppl 1(Suppl 1)):S2–6.

Pass RF., Fowler KB., Boppana SB., Britt WJ., Stagno S. Congenital cytomegalovirus infection following first trimester maternal infection: symptoms at birth and outcome. J Clin Virol. 2006. 35:216–20.

Retzler J., Hex N., Bartlett C., Webb A., Wood S., Star C, et al. Economic cost of congenital CMV in the UK. Arch Dis Child. 2019. 104:559–63.

Revello MG., Lazzarotto T., Guerra B., Spinillo A., Ferrazzi E., Kustermann A, et al. A randomized trial of hyperimmune globulin to prevent congenital cytomegalovirus. N Engl J Med. 2014. 370:1316–26.

Revello MG., Tibaldi C., Masuelli G., Frisina V., Sacchi A., Furione M, et al. Prevention of primary cytomegalovirus infection in pregnancy. EBioMedicine. 2015. 2:1205–10.

Schaefer MR., Holttum J., Olson M., Westenberg D., Rubin N., Schleiss MR, et al. Development and assessment of a prenatal cytomegalovirus (cmv) educational survey: implementation and impact in a metropolitan university-based clinic. Int J Womens Health. 2020. 12:1205–14.
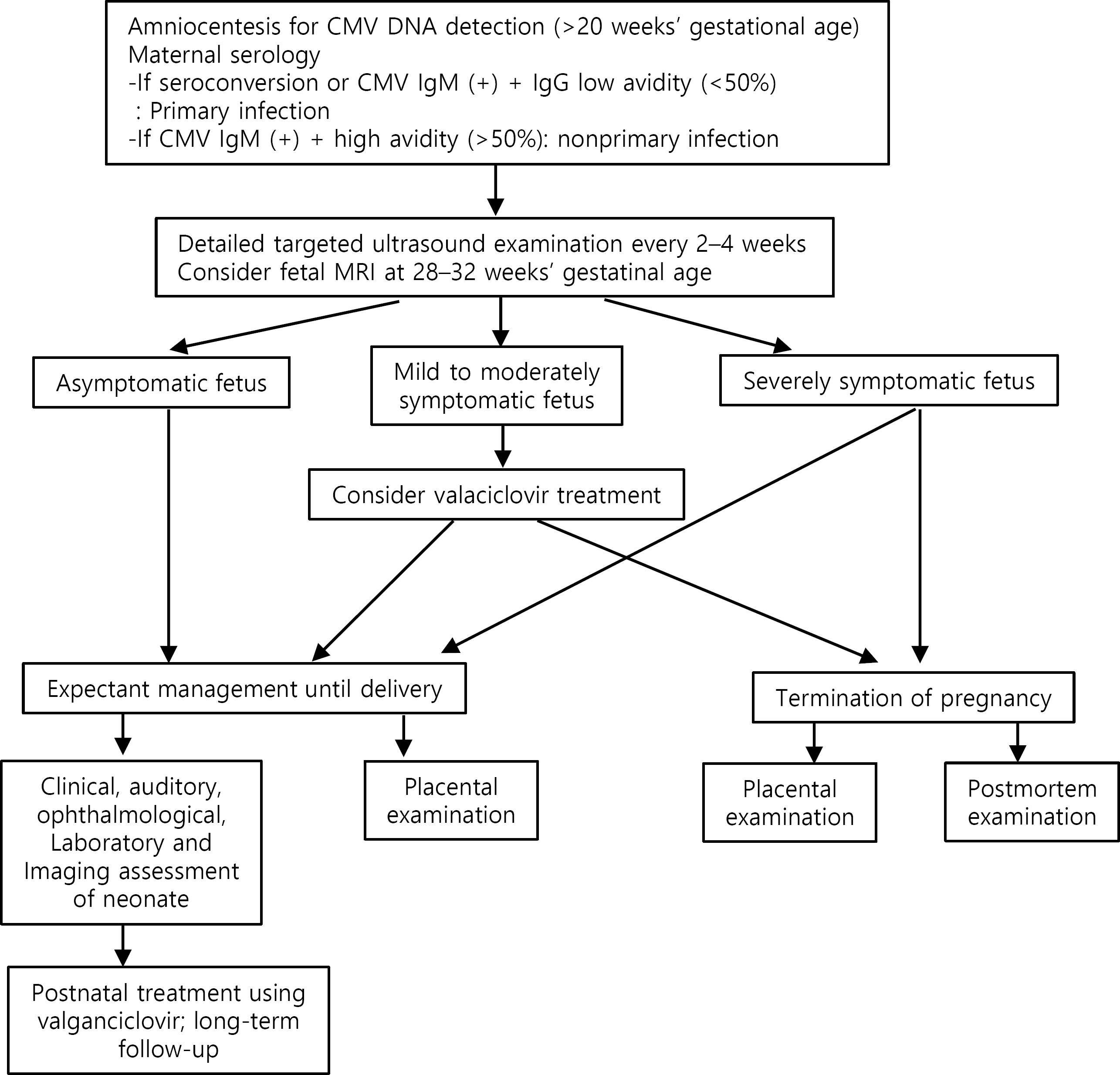
Society for Maternal-Fetal Medicine (SMFM). Hughes BL., Gyamfi-Bannerman C. Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol. 2016. 214:B5–11.

Xu H., Zhang L., Xuan XY., Zhu M., Tang J., Zhao XK. Intrauterine cytomegalovirus infection: a possible risk for cerebral palsy and related to its clinical features, neuroimaging findings: a retrospective study. BMC Pediatr. 2020. 20:555.

Yinon Y., Farine D., Yudin MH. No. 240-Cytomegalovirus infection in pregnancy. J Obstet Gynaecol Can. 2018. 40:e134–41.

Yinon Y., Farine D., Yudin MH. Maternal Fetal Medicine Committee. Infectious Diseases Committee. Cytomegalovirus infection in pregnancy. J Obstet Gynaecol Can. 2010. 32:348–54.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download