Abstract
Patients with esophageal dysphagia need a step-by-step approach for diagnosis and treatment. Endoscopic with biopsy and barium esophagogram are the essential tests evaluating anatomical abnormality and esophageal bolus stasis. Further imaging or esophageal function tests such as high-resolution esophageal manometry, functional endoluminal imaging probe, CT or endoscopic ultrasound are required. In the case of dysphagia due to esophageal motility disorder, whether it is the major motility disorder or minor motility disorder should be identified in high resolution manometry. Major motility disorders show esophagogastric junction obstruction or major peristaltic defects. In this case, the severity of the symptoms should be assessed and patients who need endoscopic or surgical treatment targeting lower esophageal sphincter should be screened. Impaired lower esophageal sphincter relaxation (achalasia, esophagogastric junction outflow obstruction, esophageal spasm or abnormal hypercontraction (jackhammer esophagus), hypotensive contraction (ineffective esophageal motility, failed peristalsis), esophageal hypersensitivity (noncardiac chest pain), gastroesophageal reflux disease and esophageal bolus stasis are the possible mechanisms causing dysphagia symptoms. The proper medical treatment depends on underlying mechanisms.
식도 증상은 염증이나 종양 등의 기질적 질환뿐 아니라 역류성 식도염, 식도 운동 이상, 식도 과민성 등의 기능성 식도 질환 등으로 생긴다. 삼킴곤란을 호소하는 경우에는 자세한 병력을 청취하여 인후두부 삼킴곤란인지 식도 삼킴곤란인지 구별하는 것이 중요하다. 식도 삼킴곤란이 있으면서 역류가 동반되면 내시경과 바륨식도 조영술 등을 시행하여 우선 식도 체부나 위식도 접합부의 막힘 또는 폐쇄가 있는지 검사해야 한다. 경우에 따라서는 식도 내압 검사, 보행성 식도 산도 검사 등의 식도 기능 검사가 필요하다. 본고에서는 식도 삼킴곤란증의 접근과 치료 전략, 식도 운동 질환에서의 삼킴곤란의 내과적 치료 방법과 그 효과에 대하여 알아보고자 한다.
식도 삼킴곤란은 다음과 같은 순서로 접근한다. 1) 자세한병력청취, 2) 삼킴곤란의 진단 검사로 내시경과 바륨조영술을 시행하고 필요하면 컴퓨터단층촬영, 내시경 초음파 검사 등과 다양한 식도 기능 검사를 시행한다. 3) 삼킴곤란 증상이 식도의 운동 이상에 의한 경우, 주요 식도 운동 질환(major motility disorder)인지 부식도 운동 질환(minor motility disorder)인지 우선 감별한다. 주요 운동 질환이라면 증상과 검사 소견으로 중증도를 평가한다. 4) 주된 증상이 어떤 병리적 기전으로 유발되는가 살펴본다. 5) 하부식도 괄약근의 폐쇄를 완화하기 위한 침습적 내시경적 치료(식도풍선확장술, 보툴리눔 독소 주입, 경구식도근절개술) 또는 수술적 치료(복강경 헬러근 절개술)가 우선되는 경우를 선별한다. 6) 내과적 치료를 시행할 경우 주요한 병리기전을 타깃으로 한 약제를 선택한다.
인후두부 삼킴곤란의 흔한 증상은 음식 삼킴을 시작하는 것이 힘들거나, 삼킬 때 사래 들림(기침), 코로 음식 역류, 코나 입으로 분비물 과다 등이 있다. 식도 삼킴곤란의 흔한 증상은 삼킴 시작 수 초 이후 목이나 가슴 부위에 막히는 느낌,음식물이나 위산의 역류, 연하 시 통증, 가슴 통증 등이다. 식도 삼킴곤란과 역류가 동반되었다면 우선 식도 체부나 위식도접합부의 막힘 또는 폐쇄가 있는지 검사해야 한다.
식도의 삼킴곤란은 폐쇄성 연하곤란, 비폐쇄성 연하곤란, 위산역류와 관련된 증상으로 구분할 수 있다.1 내시경과 바륨 식도 조영술로 호산구 식도염 또는 침윤성 염증 질환, 종양 등 식도의 기질적 질환과 해부학적 이상 아칼라지아와 기능적 위식도 접합부 폐쇄를 감별 진단할 수 있다. 또한 식도 내 종괴의 저류와 저류의 심한 정도를 알 수 있다. 식도 기능 검사인 식도 내압 검사, 보행성 식도 산도 검사는 폐쇄 증상(연하곤란과 역류), 위식도 역류 질환의 전형적 증상과 비전형적 증상, 트림, 되새김증후군 등을 구별하여 평가할 수 있다.1 식도의 고해상도 내압 검사(high-resolution esophageal manometry)는 식도체부와 상, 하부 식도 괄약근의 압력 변화를 마치 등고선의 원리를 이용한 컬러 영상으로 구현한다. 연하 시 식도 운동의 변화를 압력에 따른 컬러 변화로 쉽게 알 수 있어 식도 조영술과 더불어 식도 운동 기능을 평가할 수 있다. 고해상도 내압 검사의 가장 큰 이점은 하부식도 괄약근, 횡경막, 위분문부로 형성되는 위식도 접합부를 각각 분리하여 파악함으로써 위식도 접합부의 해부학적 또는 기능이상을 주요 병인으로 하는 아칼라지아, 식도열공허니아, 위식도 역류 질환을 진단할 수 있다. 특히 아칼라지아의 아형 분류를 가능하게 하여 아형별로 예후를 판단하고, 하부식도 괄약근을 타깃으로 한 경구식도근 절개술의 치료 효과를 예측하고 반응을 평가하는 데 유용하다. 내시경과 식도 조영술, 식도 기능 검사의 결과를 종합하고 증상과 연관 지어 해석하므로 진단과 앞으로의 치료 계획을 세우는 데 도움이 된다.2
식도 고해상도 내압 검사는 제3판 개정 시카고 분류(Chicago classification ver. 3)를 이용하여 분류한다.2 시카고 분류는 식도의 운동 질환을 크게 주요 식도 운동 질환과 부식도 운동 질환으로 크게 구분한다(Table 1). 주요 식도 운동 질환은 무증상의 정상 성인에서는 관찰되지 않는다. 연하곤란 등의 증상을 동반하며 식도 운동 이상을 일으키는 병리기전이 있으므로 병리기전을 타깃으로 한 치료가 필요하다. 주요 식도 운동 질환에는 위식도 접합부 폐쇄를 특징으로 하는 아칼라지아와 위식도 접합부 출구 폐쇄(esophagogastric junction [EGJ] outflow obstruction), 연동운동 장애(defect of peristalsis)를 특징으로 하는 무연동(aperistalsis), 호두까기식도(nutcracker esophagus) 또는 jackhammer esophagus), 경련성 수축(esophageal spasm) 등이 포함된다. 부식도 운동 질환은 증상이 있는 경우도 있지만 무증상인 경우도 있다. 식도 내 음식물 이동(bolus transit)은 정상일 때도 있고, 느려진 이동을 보일 때도 있다. 그러므로 임상적 중요성이 명확하지 않고, 무증상인 경우 치료가 필요하지 않다. 부식도 운동 질환에는 1) 연동운동과 식도내 음식물 이동이 모두 불완전한(minor defect of peristalsis with incomplete bolus transit) 분절수축(fragmented contraction)과 비효과적 식도 운동(ineffective esophageal motility), 2) 연동운동과 식도 내 음식물 이동이 정상인 고압 수축(hypercontraction), 조기 수축(rapid contraction)이 포함된다(Fig. 1). 저압성 식도수축이나, 식도수축의 부분적 결손을특징으로 하는 비효과적 식도 운동은 주로 위식도 역류 질환과동반된다. 그러므로 삼킴곤란 증상이 있는 비효과적 식도 운동은 위식도 역류 질환에 대한 치료와 식도수축 압력을 높이기위한 치료가 필요하다.3
식도 운동 질환이 증상을 일으키는 병리기전은 다음과 같다. 1) 식도 경련(spasm)이나 식도체부의 과수축(abnormal esophageal hyper contraction), 2) 식도내강 내 종괴의 저류로 인한 이차적인 식도의 비정상적인 운동, 3) 위식도 접합부의 폐쇄, 4) 식도점막의 과민성, 5) 위식도 역류 질환, 6) 여러 기전이 복합으로 작용하는 경우(예, 호두까기식도와 위식도 접합부 폐쇄가 같이 있는 경우), 7) 위식도 역류 질환과 연관되는 경우 등이다(Table 2).
식도 경련 질환은 미만성 또는 국소적 식도 경련과 제3형 아칼라지아, 식도 과수축을 특징으로 하는 호두까기식도를 포함한다. 식도 경련 질환의 치료 방법을 선택할 때 고려할 점은 1) 위식도 접합부의 폐쇄를 동반하는가, 2) 비정상적으로 높아진 식도체부의 수축압력을 줄일 수 있는가 하는 것이다. 식도경련과 위식도 접합부의 폐쇄가 같이 있다면 내과적 약물 치료보다는 식도근 절개술, 특히 위식도 접합부에서 식도체부까지 넓은 범위의 경구 식도 근절개술이 효과적일 수 있다. 내과치료로는 식도평활근 이완제인 질산염, 칼슘 채널 차단제, phosphodiesterase-5 억제제 등을 고려한다.5,6
질산염은 식도 경련 증상을 완화하고 내압 검사 소견을 호전시킨다. Isosorbide dinitrate는 조직 내 산화질소(nitric oxide)를 증가시켜 평활근을 이완한다. 보통 식전 5-10분에 5-10 mg을 설하 투여한다. 삼킴곤란이나 흉통이 있다면 증상이 있을 때 on demand 용법으로 투여한다.7
칼슘 채널 차단제는 식도평활근을 이완시켜 식도 내 음식물 이동과 배출을 호전시킨다. 식사 10-15분 전에 diltiazem 180-240 mg/d 및 nifedipine 10-30 mg 약 10-15 mg을 복용한다.8
Sildenafil과 같은 phosphodiesterase-5 억제제는 cyclic guanosine monophosphate에 의해 산화질소(nitric oxide)의 분해를 방해하여 식도평활근을 이완시킨다. Sildenafil (50 mg/d)은 미만성 식도 경련 환자에서 증상을 완화시킨다.9 부작용으로 어지러움, 두통이 있으며 약이 비싸 사용이 제한되기도 한다.
아칼라지아 환자의 치료의 목표는 연하곤란 증상을 완화하고 연관된 합병증을 줄이는 것이다.16 흔히 쓰이는 약제는 칼슘통로 억제제(nifedipine 10-30 mg 식전 설하투여), 질산염 (isosorbide dinitrate 5 mg 식전 설하투여)이다. 항콜린제(atropine, dicyclomine, and cimetropiumbromide), 베타 아드레날린 작용제(beta-adrenergic agonists, terbutaline), theophylline을 사용하기도 하며 sildenafil (50 mg)도 효과가 있다.16 Cimetropium bromide와 같은 항콜린제는 하부식도 괄약근 압력을 감소시켜 식도 이동 속도를 빠르게 한다.전체적으로 약제치료는 13-65%의 환자에서 하부식도 괄약근압력을 줄이고 0-87%의 환자에서 증상을 호전시킨다.4,17 약제 효과가 짧게 지속되기 때문에(30-120분) 여러 번 투여가필요하며 두통, 저혈압, 족부 부종 등의 부작용이 있다. 이들약제에 대한 임상 반응을 단기간이며 증상의 완화가 완전하지않고 효과가 시간이 지남에 따라 감소하며 약제 치료에 비해풍선확장술이나 경구 식도, 근절개술 등 하부식도 괄약근을타깃으로 한 더 확실한 치료 방법이 있기 때문에 아칼라지아의 약제 치료는 내시경 치료나 수술적 치료에 적합하지 않거나, 수술을 거부하거나 실패한 환자에서 시도될 수 있다.
고령이거나 전신상태가 불량하여 풍선확장술이나 경구 식도 근절개술 같은 침습적 내시경 시술이나 수술적 근절개술을 시행하지 못하는 경우 하부식도 괄약근에 보툴리눔 독소를 주입하면 아칼라지아의 증상을 호전시키고 연하곤란 역류 흉통, 하부식도 괄약근을 이완시켜 식도 비움을 개선시킨다.18 하지만 여러 연구들은 단기간의 효과를 보여준다. 한 번의 주입으로는 효과가 단기간 지속되어 수개월 이후에 재발하는 경우가 흔하다. 보통 보툴리눔톡신 100 Unit을 4개의 용량으로 나누어 하부 식도괄약근 상방에 4분위의 방향으로 나누어 주입한다.17 보툴리눔 독소의 투여 용량과 투여 시기는 정해진 바 없으나 다기관 무작위 연구에서는 30일 간격으로 100 U를 두 번 주입한 경우가 가장 효과적인 치료 스케줄이었다.18 9년간의 후향적 분석 연구에서 보툴리눔 독소의 증상 호전 효과는 21.0%의 아칼라지아 환자에서 평균 6.2개월 지속되었고, 평균 1.7회, (범위 1-7회)의 추가 투여가 필요하였으며, 43.0%의 아칼라지아 환자는 보툴리눔 독소 이외 추가적인 다른 치료가 필요하였다.19 보툴리눔 독소 주입은 흉통(4.3%), 가슴 쓰림(0.7%) 식도의 천공, 종격동 염증을 유발할 수 있다.19 하지만 합병증 위험도가 낮은, 상태적으로 안전한 시술이다.
비효과적 식도수축이나 고압성 연동운동에서 보이는 식도삼킴곤란의 내과적 치료는 주된 병리기전에 따라 선택한다(Table 4). 비효과적 식도수축은 위식도 역류 질환과 동반하는 경우가 많으므로 주된 내과적 치료는 위장운동촉진제(prokinetics) 또는 위산분비억제제이며 PPI에 반응하지 않는 위식도 역류 질환에서 위장운동촉진제 추가 투여를 시도할 수 있다. 위장운동촉진제 단독 또는 PPI와의 병합치료가 식도 운동과 증상에 미치는 효과를 Table 5에 정리하였다.
PPI 단독 치료에 비해 PPI과 위장운동촉진제 병용투여에 대한 메타 분석이 보고되었다. 2019년 2월 이전에 PubMed와 코크란 데이터베이스(the Cochrane Library databases)를 이용하여 1,437명의 환자를 포함하는 총 14개의 연구 메타 분석결과 PPI 단독 치료에 비해 PPI와 위장운동촉진제 병용투여는 내시경적인 개선 정도는 차이가 없었지만(RR=0.996, 95% CI 0.929-1.068, p=0.917), 증상 (RR=1.185, 95% CI 1.042-1.0348, p=0.045)과 삶의 질을 유의하게 호전시켰다.20
REFERENCES
1. Gyawali CP, Carlson DA, Chen JW, Patel A, Wong RJ, Yadlapati RH. 2020; ACG clinical guidelines: clinical use of esophageal physiologic testing. Am J Gastroenterol. 115:1412–1428. DOI: 10.14309/ajg.0000000000000734. PMID: 32769426.

2. Kahrilas PJ, Bredenoord AJ, Carlson DA, Pandolfino JE. 2018; Advances in management of esophageal motility disorders. Clin Gastroenterol Hepatol. 16:1692–1700. DOI: 10.1016/j.cgh.2018.04.026. PMID: 29702296. PMCID: PMC6317712.

3. Kahrilas PJ, Bredenoord AJ, Fox M, et al. 2015; The Chicago Classification of esophageal motility disorders, v3.0. Neurogastroenterol Motil. 27:160–174. DOI: 10.1111/nmo.12477. PMID: 25469569. PMCID: PMC4308501.


4. Jung HK, Hong SJ, Lee OY, et al. 2020; 2019 Seoul consensus on esophageal achalasia guidelines. J Neurogastroenterol Motil. 26:180–203. DOI: 10.5056/jnm20014. PMID: 32235027. PMCID: PMC7176504.



5. Khalaf M, Chowdhary S, Elias PS, Castell D. 2018; Distal esophageal spasm: a review. Am J Med. 131:1034–1040. DOI: 10.1016/j.amjmed.2018.02.031. PMID: 29605413.


6. Roman S, Kahrilas PJ. 2013; Management of spastic disorders of the esophagus. Gastroenterol Clin North Am. 42:27–43. DOI: 10.1016/j.gtc.2012.11.002. PMID: 23452629. PMCID: PMC3618975.



7. Konturek JW, Gillessen A, Domschke W. 1995; Diffuse esophageal spasm: a malfunction that involves nitric oxide? Scand J Gastroenterol. 30:1041–1045. DOI: 10.3109/00365529509101604. PMID: 8578161.


8. Orlando RC, Bozymski EM. 1973; Clinical and manometric effects of nitroglycerin in diffuse esophageal spasm. N Engl J Med. 289:23–25. DOI: 10.1056/NEJM197307052890106. PMID: 4196712.


9. Eherer AJ, Schwetz I, Hammer HF, et al. 2002; Effect of sildenafil on oesophageal motor function in healthy subjects and patients with oesophageal motor disorders. Gut. 50:758–764. DOI: 10.1136/gut.50.6.758. PMID: 12010875. PMCID: PMC1773249.



11. Pimentel M, Bonorris GG, Chow EJ, Lin HC. 2001; Peppermint oil improves the manometric findings in diffuse esophageal spasm. J Clin Gastroenterol. 33:27–31. DOI: 10.1097/00004836-200107000-00007. PMID: 11418786.


12. Khalaf MHG, Chowdhary S, Elmunzer BJ, Elias PS, Castell D. 2019; Impact of peppermint therapy on dysphagia and non-cardiac chest pain: a pilot study. Dig Dis Sci. 64:2214–2218. DOI: 10.1007/s10620-019-05523-8. PMID: 30771044.


13. Cannon RO 3rd, Quyyumi AA, Mincemoyer R, et al. 1994; Imipramine in patients with chest pain despite normal coronary angiograms. N Engl J Med. 330:1411–1417. DOI: 10.1056/NEJM199405193302003. PMID: 8159194.


14. Clouse RE, Lustman PJ, Eckert TC, Ferney DM, Griffith LS. 1987; Low-dose trazodone for symptomatic patients with esophageal contraction abnormalities. A double-blind, placebo-controlled trial. Gastroenterology. 92:1027–1036. DOI: 10.1016/0016-5085(87)90979-6. PMID: 3549420.

15. Achem SR. 2007; Management of esophageal chest pain. Gastroenterol Hepatol (N Y). 3:765–767. PMID: 21960783. PMCID: PMC3104155.


16. Hoogerwerf WA, Pasricha PJ, Thosani N, et al. 2001; Pharmacologic therapy in treating achalasia. Gastrointest Endosc Clin N Am. 11:311–324. vii. PMID: 11319064.


17. Vaezi MF, Pandolfino JE, Yadlapati RH, Greer KB, Kavitt RT. 2020; ACG clinical guidelines: diagnosis and management of achalasia. Am J Gastroenterol. 115:1393–1411. DOI: 10.14309/ajg.0000000000000731. PMID: 32773454.


18. Annese V, Bassotti G, Coccia G, et al. 2000; A multicentre randomised study of intrasphincteric botulinum toxin in patients with oesophageal achalasia. GISMAD Achalasia Study Group. Gut. 46:597–600. DOI: 10.1136/gut.46.5.597. PMID: 10764700. PMCID: PMC1727941.


19. Friedenberg F, Gollamudi S, Parkman HP. 2004; The use of botulinum toxin for the treatment of gastrointestinal motility disorders. Dig Dis Sci. 49:165–175. DOI: 10.1023/B:DDAS.0000017434.53075.80. PMID: 15104353.
20. Ren LH, Chen WX, Qian LJ, Li S, Gu M, Shi RH. 2014; Addition of prokinetics to PPI therapy in gastroesophageal reflux disease: a meta-analysis. World J Gastroenterol. 20:2412–2419. DOI: 10.3748/wjg.v20.i9.2412. PMID: 24605040. PMCID: PMC3942846.



Fig. 1
Major and minor esophageal motility disorders (according to the Chicago classification, ver. 3. (A) achalasia; type1 (complete aperistalsis), type 2 (panesophageal pressurization), type 3 (spastic achalasia), (B) esophgagogastric junction outflow obstruction, (C) diffuse esophageal spasm, (D) jackhammer esophagus, (E) abscent contraction, (F) failed contraction (G) tranzitional zone defect; (H) hypertensive peristalsis.
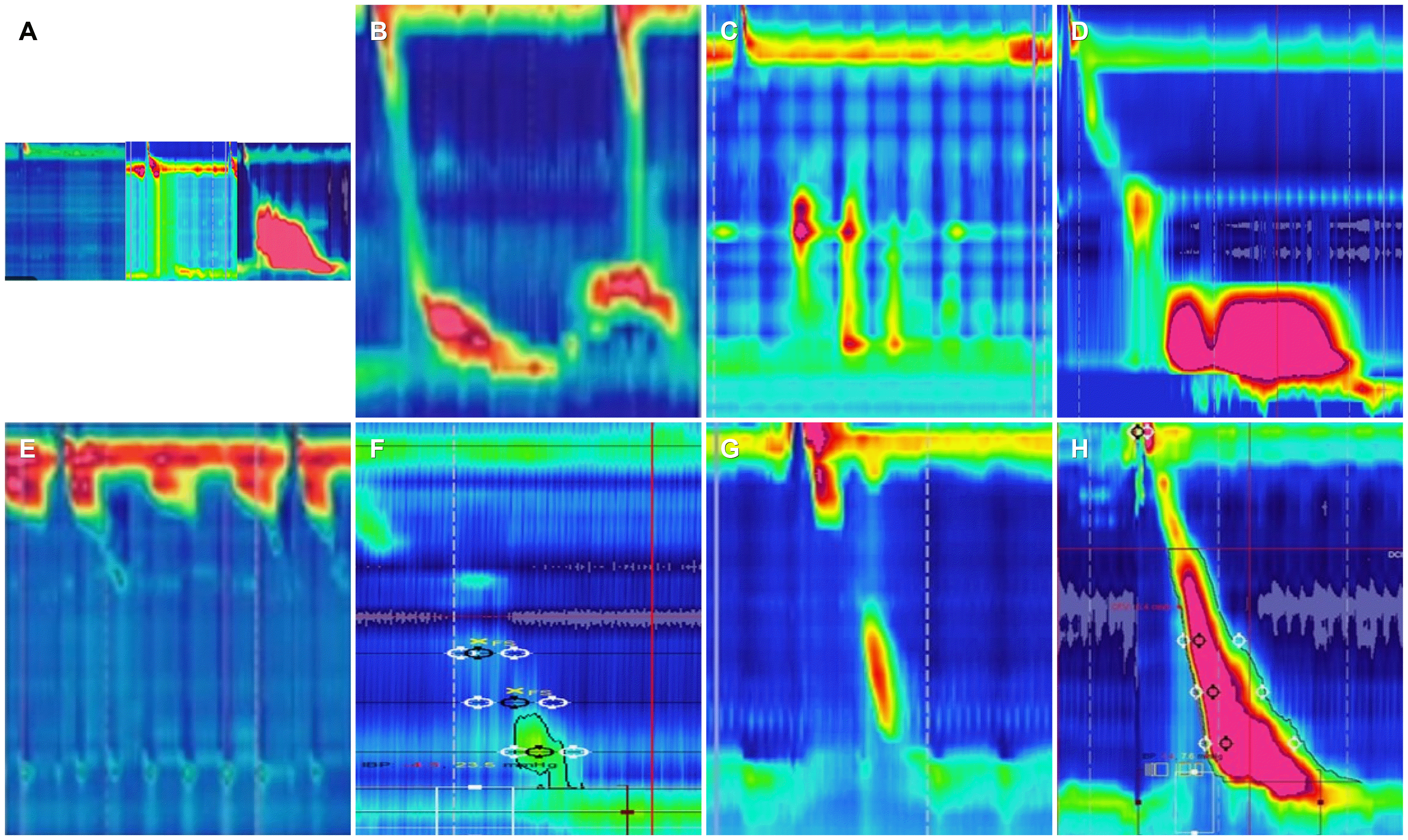
Table 1
Chicago Classification of Primary Esophageal Motility Disorders, Ver. 3
Table 2
Possible Mechanisms of Esophageal Dysphagia
Table 3
Treatment of Major Motility Disorder
Table 4
Undelying Mechanism and Treatment of Minor Motor Abnormality (Ineffective Esophageal Motility and Hypertensive Contraction)
Table 5
Prokinetics in the Treatment of Ineffective Esophageal Motility




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download