초록
목적
기능성 소화불량증은 상복부 통증, 소화불량과 같은 다양한 상복부 증상을 포괄하는 질환으로서 다양한 병태 생리에서 유래한 다양한 증상의 발현을 찾아볼 수 있는 질환이다. 현재 이에 대해 효과적이면서 순응도가 높은 치료법을 찾기 어려운 상태로, 본 임상시험에서는 기존 기능성 소화불량증 치료의 두 근간인 프로톤펌프억제제인 라베프라졸과 위장관 운동 촉진제인 모사프라이드 서방정 병용요법인 UIC201609 및 UIC201610의 효과 및 안전성을 시험하고자 하였다.
대상 및 방법
이 연구는 다기관, 이중눈가림, 무작위 배정으로 시행된 연구로 총 30명이 임상시험에 포함되었다. 부작용으로 유효성 평가가 누락된 시험군 1명을 제외한 29명에 대한 결과가 최종 분석되었다. 대조군으로 라베프라졸 10 mg 1일 1회 복용군, 모사프라이드 15 mg 서방정 1일 1회 복용군을 각각 두었으며, 실험군으로 라베프라졸 10 mg 1일 1회 및 모사프라이드 15 mg 서방정 병용제제인 UIC201609/UIC201610 1일 1회 실험군을 두었다. 연구의 결과변수로 Nepean Dyspepsia Index-Korean 버전의 8가지 항목의 총점 변화량을 투약 시작 2주, 4주 시점에 분석하였고 안전성에 관한 정보를 수집하였다.
결과
실험군과 대조군 사이의 나이, 성별, 신체계측, 음주 및 흡연에 있어 인구학적인 차이는 관찰되지 않았다. 또한 기능성 소화불량증 아형인 EPS과 PDS 비율에서도 그룹 간 차이가 관찰되지 않았다. 약물 순응도에서 세 군 모두에서 평균 95% 이상 실험약물 복용이 완료되었다. 이 연구의 1차 유효성 변수인 투약 4주 시점의 증상 점수 변화량에서 모사프라이드 단일군에서 증상 점수(33.4±15.6) 감소, 라베프라졸 단일군(29.4±17.1)에서, 실험군인 UIC201609/UIC201610 병용군(33.4±11.8)에서 감소를 보였으며, 그룹 간 유의미한 자이는 관찰되지 않았다. UIC201609/UIC201610 병용군은 Nepean Dyspepsia Index-Korean의 상복부의 통증 또는, 상복부 쓰림을 호전시키는 비율이 대조군에 비해 높았으나 통계적으로 유의한 변화를 보이지는 못하였다. 안전성 분석에서도 유의미한 차이는 확인되지 않았다.
Abstract
Backgrounds/Aims
Functional dyspepsia is a disease involving a range of upper gastrointestinal symptoms derived from various pathophysiologies. Tablets containing a combination of rabeprazole and controlled-release (CR) mosapride were recently developed. To investigate a more effective treatment, this trial evaluated the efficacy and safety of UIC201609/UIC201610 as a preliminary study.
Methods
A multicenter, double-blind, randomized study was performed on 30 subjects. UIC201609/UIC201610 (combination of rabeprazole and CR mosapride) was the case group, and the two control groups were rabeprazole 10 mg once a day and mosapride 15 mg CR tablet once a day. As a primary efficacy endpoint of the study, the changes in the total score of eight items of the Nepean Dyspepsia Index-Korean version were analyzed at 2 weeks and 4 weeks. The outcomes regarding safety were collected.
Results
The total symptom score of Nepean Dyspepsia Index-Korean decreased in the rabeprazole single group (29.4±17.1), mosapride CR single group (33.4±15.6), and UIC201609/UIC201610 group (33.4±11.8) at 4 weeks without significant differences. On the other hand, the UIC201609/UIC201610 combination group showed more score reduction of pain in the upper abdomen, burning in the upper abdomen compared to each control group, but it did not reach statistical significance. No difference was found in safety analysis.
Conclusions
UIC201609/UIC201610 once daily showed some improvement in epigastric pain and dyspepsia in patients with functional dyspepsia, but there was no significance. Further study based on the advanced clinical trial design will be needed to confirm the efficacy of UIC201609/UIC201610 combination therapy in the future.
기능성 소화불량증은 뚜렷한 기질적 질환이 없이 발생하는 만성적이면서도 반복적인 상부위장관 증상을 특징으로 하는 일종의 질환군이다.1,2 기능성 소화불량증은 소화성 궤양, 위장관 악성 종양, 위식도 역류 질환, 췌장염과 같은 구조적 혹은 생화학적 이상과 같은 기질적 질환이 없으면서 만성적이며 반복적인 위장관 증상을 유발하는 증후군으로 정의되며 혈액 검사, 헬리코박터 파일로리(Helicobacter pylori), 내시경 검사가 진단에 필요하다.3-5 로마 기준 IV에 의하면 기능성 소화불량증은 명치부위 통증, 쓰림, 식후 포만감, 조기 만복감을 바탕으로 상복부통증 증후군(epigastric pain syndrome, EPS)과 식후불편 증후군(postprandial distress syndrome, PDS)으로 구분되며 국내에서 약 10%의 유병률을 가지고 있는 것으로 알려져 있다.1,2,4,6
기능성 소화불량증의 병태생리 기전은 위산분비의 과다, 위배출 및 적응 장애, 십이지장 및 공장의 운동 장애, 내장감각신경의 과민성이 관여하고 있을 것으로 추정되고 있다.1 또한 헬리코박터 파일로리와 같은 세균감염과 유전, 환경적인 요인, 음식물 섭취와의 관련성, 사회심리적인 인자들이 작용하였을 가능성도 함께 제시되고 있다. 따라서 각각의 가능한 병태생리기전을 먼저 파악한 뒤 이에 맞추어 치료 계획을 세울 것이 권유되고 있다.
병태생리를 먼저 파악한 후 환자의 증상 및 아형에 따라 히스타민 수용체 길항제, 프로톤펌프억제제 등이 위산분비억제를 위해 사용할 수 있으며,7 식후 포만감 및 만복감에 대해 위장관 운동 촉진제 사용이 추천된다.8 2020년 발표된 기능성 소화불량증 한국 가이드라인에 따르면 아형에 따라 EPS면 위산분비억제 약물을 근간으로, PDS면 위장관 운동 촉진제를 근간으로 한 치료가 추천된다.4,9 하지만 두 아형을 중복해서 가지고 있는 중복 증후군(overlap syndrome)이 흔하고 상호간 이행하는 경우가 많아 이 두 가지를 같이 사용하는 경우가 많다.
위장관 운동 촉진제에는 크게 dopamine (D)2 수용체 차단제와 5-HT4 수용체 작용제로 분류 가능하다. D2 수용체 차단제의 경우 장기간 사용에 따른 부작용이 문제시되어 이보다 5-HT4 수용체 작용제가 장기 처방이 가능하여 최근 널리 선호되고 있다.8 모사프라이드(mosapride)는 장 근육 신경총의 5-HT4 수용체의 선택적 작용제(agonist)로 작용하는 약으로아세틸콜린 유리를 유발하여 위장관 운동을 촉진한다. 모사프라이드는 여러 연구에서 위배출 향상 효과를 보여주었으며 역류성 식도염에서도 증상 완화 효과를 보여주었다. 하지만 하루한 번 투여가 가능한 프로톤펌프억제제에 비해 5-HT4 작용제는하루 3회 투여하는 약물이어서 순응도에 악영향을 끼치는 요소로 작용해 왔다. 최근 1일 1회 복용이 가능한 모사프라이드 서방정(mosapride controlled-release 15 mg)이 사용 가능하게 됨에 따라,4 하루 1회 투여가 가능한 프로톤펌프억제제와 쉽게 조합할 수 있게 되어 이 연구를 기획하게 되었다.
이러한 배경에 따라 본 연구자들은 기능성 소화불량증으로 진단된 대상자들에게서 기존의 프로톤펌프억제제, 모사프라이드 서방정 1일 1회 복용법을 각각 두 가지의 대조군으로 설정하고 시험군으로는 UIC201609/UIC201610 (프로톤펌프억제제/모사프라이드 서방정) 병용요법의 효과 및 안전성을 확인해 보고자 다기관, 무작위배정, 위약대조 임상시험을 예비 조사 형식으로 시행하게 되었다.
본 연구는 다기관, 무작위배정, 위약대조 임상시험으로2019년 4월부터 2020년 10월까지 시행되었다. 시험대상자 선정을 위하여 만 19세 이상의 성인 남녀에서 Rome IV 진단설문지로 기능성 소화불량증 진단 기준을 만족하는 대상자 중에서 괴로운 식후 포만감, 조기 포만감, 상복부 통증 혹은 쓰림 중 1가지 이상의 증상이 최소 6개월 전에 시작되었고 최근 3개월 동안 지속되었으며, 증상을 설명할 수 있는 기질적인 질환이 없는 것으로 확인된 대상자만을 이 연구에 포함하였다. 특히 이 연구에서는 Nepean Dyspepsia Index-Korean (NDI-K) version을 사용한 선행 연구의 평가 기준을 본 연구의 시험대상자 평가 및 선정에 사용하였다.10 또한 스크리닝 시 NDI-K 8 가지의 증상*점수(빈도, 강도, 괴로운 정도)의 총점이 44 이상인 기능성 위장장애의 증상을 확실히 가지고 있는 대상자만을 이 연구에 포함시키려 하였다. 더불어 스크리닝 4주 이내의 상부위장관 내시경 검사에서 관련 기질적인 병변이 확인되지 않았는지 확인하였으며, 추가로 H. pylori 현성 감염 상태이거나, 위장관 출혈, 기계적 장폐쇄, 위마비 등 기질적 질환이 배제되었는지 확인하였다. H. pylori 감염 상태는 요소분해효소 검사(campylobacter-like organism test) 또는 요소호기 검사(13C-urea breath test) 결과 음성으로 증명하였다. 또한 간경변, 정상 상한치 3배 이상의 간수치 상승, 신기능 이상(Ccr <30 mL/min), 조절되지 않는 당뇨병(HbA1c >9%), 조절되지 않는 고혈압(SBP/DBP ≥180/110 mmHg), 중증의 정신 질환, 알코올 중독의 경우에도 제외 기준에 해당한다. 또한 임신 상태, 수유부인 경우, 적절한 피임을 할 의지가 없거나 타 임상시험용 약물을 복용 중인 경우, 전신 스테로이드, 항우울제, 진경제, 항바이러스제, 위점막보호제 및 위저부 이완제, 내장감각조절제 등을 복용하는 경우도 본 시험의 제외 기준에 해당하였다.
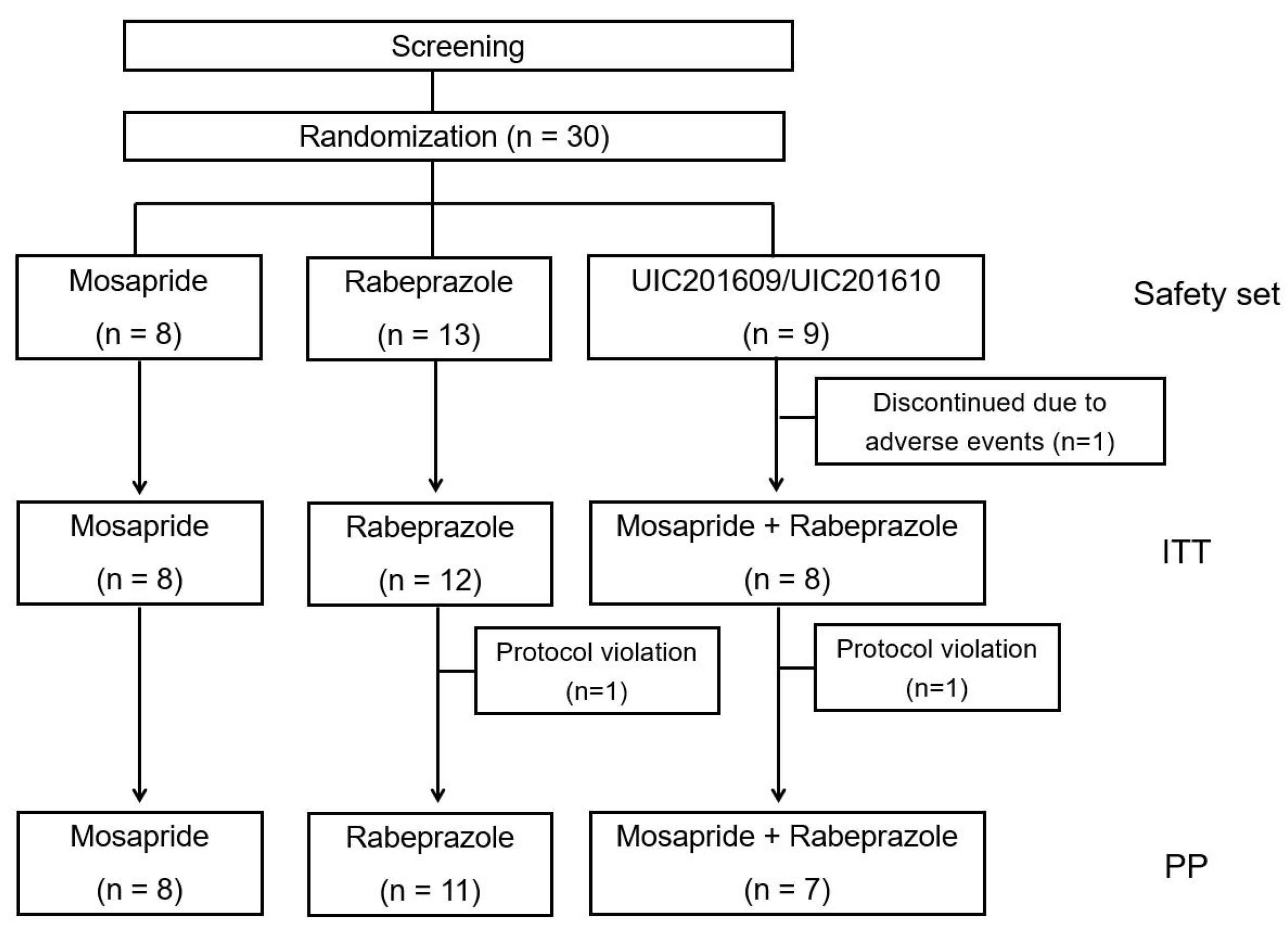
연구대상자 수 산정을 위해 NDI-K version 증상 점수차를 약 20점으로 가정하고, 시험군(mosapride+rabeprazole)과 각각의 대조군(대조군 1: mosapride, 대조군 2: rabeprazole)의 1:1:1 배정, 양측 유의수준 0.05 및 검정력 90% 하에서 각 대조군 대비 시험군의 효과가 우월함을 입증하기 위해 필요한 최소 대상자 수는 각 군 당 115명, 탈락률 20%를 고려하여 각 군 당 144명, 총 432명으로 설정하였으나 NDI-K 44점 이상을 첫 등록 기준으로 하고 다시 2주간의 도입기 후 44점 이상을 다시 확인하는 방식으로 확실한 FD임을 확인하는 방식 등으로 해서 환자 등록이 매우 어려워 30명이 등록한 시점에서의 예비 시험 형식으로 분석하게 되었다. 총 30명의 임상시험자는 무작위 배정이 실시되어 대조군 및 시험군에 배정되었다. 연구 도중 부작용 의심 사례로 인한 동의 철회 사례 1건 발생으로 총 29명에 대한 결과 분석이 시행되었다. 이후 시험군과 대조군에서 투약 방법 위반으로 각각 1명씩 추가로 탈락이 발생하여 27명이 per protocol 분석에 포함되었다(Fig. 1). 임상시험 계획은 분당서울대학교병원(IRB No. B-1908-559-003), 강남세브란스병원(IRB No. 2019-0438-001), 원광대학교병원(IRB No. 2019-08-009), 아주대학교병원(IRB No. AJIRB-MED-CT3-19-303) 임상시험 윤리위원회의 승인을 받았으며, 모든 환자에게 서면으로 동의를 받았다.
본 임상시험은 모사프라이드 서방정과 라베프라졸을 병합 투여하는 UIC201609/UIC201610 (모사프라이드 서방정 mosapride citrate, controlled release 15 mg; 라베프라졸 rabeprazole sodium 10 mg) 실험군과 위약을 투여하는 대조군의 두 군으로 구성된다. 임상시험을 위해 본 연구의 시험약인 UIC201609 및 UIC201610과 색상과 형태가 동일한 위약을 준비하였다. 본격적인 임상약 투입에 앞서 2주간의 휴약기를 수행하기 위해 각각의 위약을 아침 식전 1일 1회 경구로 2주간 투약하고, NDI-K 44점 이상이면서 도입기 위약의 순응도가 70% 이상인 경우에만 다음 4주간의 치료기로 진행하였다. 본 임상시험의 대조군인 모사프라이드 투여군은 모사프라이드 15 mg 서방정 1정 및 라베프라졸 위약 1정을 하루 1회 아침 식전에 투약하였고, 라베프라졸 투여군은 라베프라졸 10 mg 1정 및 모사프라이드 위약 1정을 하루 1회 아침 식전에 투약하였다. 본 임상시험의 실험군인 UIC201609/UIC201610 병용요법군은 모사프라이드 15 mg 서방정, 라베프라졸 10 mg 각 1정씩을 하루 1회 아침 식전에 투여하였다. 약물 투여 최소 2주 전에 동의서, 신체계측, 임신 검사, 활력징후, 혈액 검사, 소변 검사 등을 시행하였고, 약물 투여 4주 시점에도 활력징후, 신체검진, 혈액 검사를 시행하여 결과를 비교하였다. 무작위 배정은 블록을 사용하였고 비뚤림을 최소화하기 위하여 양측 눈가림을 적용하였다. 시험 기간 동안 임상시험에 영향을 줄 수 있는 약물 복용 여부를 매 방문 시마다 확인하였고, 약물 순응도 또한 매 방문 시마다 설문을 통해 확인하였다.
1차 유효성을 평가하기 위해 베이스라인 대비 4주 시점에서의 NDI-K에서 8가지 소화불량에 특이적인 증상의 총점 변화량을 기록하였다.11 NDI-K 증상 평가는 8가지 항목에 대해 수행되었는데, 항목 각각에 대하여 베이스라인, 2주차, 4주차에 설문이 수행되었다. 상복부의 통증(NDI-K 1, 아프거나 뻐근한 경우), 상복부의 불쾌감 또는 불편감(NDI-K 2, 통증이나 쓰린 것이 아님), 상복부가 쓰리다(NDI-K 3, 속쓰림, 따갑다, 화끈거린다), 보통 분량의 식사를 먹지 못함(NDI-K 4), 식후 포만감(NDI-K 5, 속이 가득 차있다, 그득하다, 소화가 안된다), 상복부 압박감(NDI-K 6), 상복부 팽만감 혹은 팽창감(NDI-K 7, 속이 빵빵한/가스 찬 느낌), 구역 혹은 메스꺼움(NDI-K 8)이었다. 각각의 항목은 증상의 빈도, 증상의 정도, 증상으로 인한 괴로운 정도를 각각 점수화 하여 평가하였다. 증상의 빈도는 2주 동안 전혀 없었던 경우 0점, 하루에서 4일 있었던 경우는 1점, 5일에서 8일 있었던 경우는 3점, 거의 매일 있었던 경우는 4점이었다. 증상의 정도는 전혀 없었던 경우는 0점, 매우 약하였던 경우는 1점, 약하게 나타났던 경우는2점, 조금 심하게 있었던 경우는 3점, 심하였던 경우는 4점,매우 심하였던 경우는 5점이었다. 증상으로 인한 괴로운 정도는 전혀 없었던 경우는 0점, 매우 미약하였던 경우는 1점, 미약한 경우는 2점, 심하였던 경우는 3점, 매우 심하게 괴로웠던경우는 4점으로 분류하였다. 아울러 위장 증상으로 인한 일상생활에서의 수면, 직업활동, 여가생활, 감정 등 다양한 주관적증상을 포함한 삶의 질 평가를 위하여 28개 항목으로 이루어진 설문지를 받았다.
2차 유효성 평가를 위해 4주 시점의 증상 개선도를 NDI-K 8가지 증상 총점이 베이스라인 대비 75% 이상 감소한 경우를 현저한 효과(significant), 50-74% 감소한 경우를 중등도 효과(moderate), 25-49% 감소한 경우를 경도 효과(mild), 25% 미만으로 감소한 경우를 무효 또는 악화(little of no)로 구분하여 결과를 수집하였다. 또한 2주 및 4주 시점에 NDI-K 8가지 증상 각각의 총점 변화량도 함께 기록하였다.
NDI-K 삶의 질 평가 및 전반적 개선도 평가는 시험대상자가 평가하도록 하였다. 삶의 질에 관한 질문은 5영역의 총 25문항으로 구성되며, 긴장/수면 9문항, 일상 생활의 방해 6문항,먹고 마시기 3문항, 지식/조절 4문항, 일/공부 3문항을 포함한다. 각 문항은 최저 1점에서 최고 5점이지만 계산 시에는 높은 점수가 삶의 질이 좋은 것을 의미하도록 문항 점수를 거꾸로 한다. 마지막 페이지는 시험대상자에게 각 영역이 얼마나중요한지 5단계의 가중치를 준다. 예를 들어 수면의 중요성을5단계 중 3으로 환자가 평가하면 각 문항 점수에 가중치 ‘3’을곱한다. 각 문항 점수에 가중치를 곱한 숫자를 모두 합하면영역 점수가 된다. 최종 NDI-K 점수는 최저 0점에서 최고100점으로 환산하기 위해 각 영역 점수에서 최저값을 뺀 점수를 영역의 범위로 나눈다. 전반적 개선도 평가는 7단계 항목인 ‘매우 개선, 개선, 다소 개선, 변화 없음, 다소 악화, 악화, 매우 악화’로 구성되며, ‘매우 개선, 개선’으로 응답한 비율을 전반적 개선도로 평가하였다.
약물안전성 평가를 위해 매 방문 시마다 이상 사례에 대한 설문을 시행하였고 치료군 간 이상반응, 이상약물 및 중대한 이상반응 발현율에 차이가 있는지 비교 분석되었다. 안전도 평가를 위해 1) 피부 및 조직 관련 부작용, 2) 감염성 부작용, 3) 신경계통의 부작용이 있는지 각각의 항목별로 수집하였다.
유효성 평가변수는 치료의도자(intention-to-treat) 분석으로 이루어졌으며 무작위배정 이후 임상시험용 의약품을 투여 받았고, 베이스라인 이후 일차 유효성 평가 변수에 대한 자료를 얻을 수 있었던 시험대상자를 대상으로 하였다. Per protocol 분석은 임상시험을 완료하였고, 임상시험 계획서의 절차 상 중대한 위반사항(중도탈락, 선정/제외 기준 위반, 병용금지약물 복용, 복약순응도 80% 미만, 무작위배정 위반)이 없는 시험대상자를 대상으로 하였다.
연속형 변수는 관측 대상 수, 평균±표준편차로 제시하고, 범주형 변수는 빈도와 백분율을 제시하였다. 범주형 변수들에 대해서는 피어슨 카이제곱 검정 또는 피셔 정확성 검정으로 분석하였다. 연속형 변수들에 대하여 ANCOVA로 분석하였다. 모든 p-value는 소수점 2자리까지 제시하고, 0.05 미만이면 유의한 것으로 간주하였다. 통계처리는 윈도우용 SPSS 소프트웨어 ver. 22.0 (SPSS Inc, Chicago, IL, USA)를 사용하였다.
시험 대상자의 평균연령, 성별, 신체계측, 흡연에서 대조군과 시험군 사이의 차이는 관찰되지 않았다. 다만, 현재 지속 음주를 하는 대상자의 비율이 모사프라이드 서방정 단독군(UIC201609)에서 다른 대조, 시험군과 비교하였을 때 통계적으로 유의하게 높게 관찰되었다(p-value 0.02). 하지만 증상 발현 및 기능성 위장장애 아형의 비율에서도 세 그룹 간 유의미한 차이가 관찰되지 않았다(Table 1).
1) 순응도 및 4주차의 NDI-K 증상 총점 변화량
복약 순응도는 대조군과 시험군 모두에서 평균 95% 이상 확인할 수 있었다(Table 2). 사전에 설정한대로 75%, 50%, 25%를 기준선으로 증상 점수 변화량을 세 그룹으로 분류하였을 때, 세 그룹 간 증상 총점 호전의 등급에는 유의미한 차이가 존재하지 않았다. 일차 유효성 평가변수인 4주차의 증상 점수 총점 변화량을 보았을 때 시험군인 UIC201609/UIC201610 병용요법 그룹에서 평균 33.4±11.8의 호전을 보였으나 대조군인 모사프라이드 서방정 단독 그룹(33.4±15.6), 라베프라졸 단독군(29.4±17.1)에서도 호전 소견이 확인되어 그룹 간에 통계적으로 유의미한 격차는 없었다(Table 2). PDS, EPS 사이의 유효성 평가에서도 유의미한 변화를 찾을 수 없었다.
2) NDI-K 8대 증상 별 점수 변화량
베이스라인 대비 2, 4주 시점에서의 NDI-K 개별 증상의 총점 변화량이 수집되었다. 총 8개의 증상에 대해 변화량 조사와 통계분석이 함께 수행되었다. 이 중 UIC201609/UIC201610 병용군은 NDI-K 8개 세부 항목 중 4주차의 상복부의 통증(NDI-K 1, 2.9±3.1, 2.9±2.7 vs. 4.0±2.5) (Fig. 2A), 상복부가 쓰림(NDI-K 3, 2.9±2.5, 2.4±3.0 vs. 5.1±3.3) (Fig. 2C) 항목에서 대조군에 비해 증상 별 점수 감소량이 컸으나 통계적으로 유의한 변화를 보이지는 못하였다. 또한 증상의 빈도, 정도, 괴로운 정도에 따른 분석에서도 통계적으로 유의성 있는 차이를 나타낸 항목은 관찰되지 않았다(Fig. 2B, D, E, F, G, H).
3) 위장 증상으로 인한 삶의 질 변화
위장 증상으로 인한 일상생활에서의 수면, 직업 활동, 여가생활, 감정 변화를 조사하기 위하여 시행한 25개 항목으로 이루어진 삶의 질 평가설문에서, UIC201609/UIC201610 병용군은 4주 시점에서 23.6±26.0으로 모사프라이드 서방정 단독 그룹의 10.5±32.9, 라베프라졸 단독 대조군 25.3±23.6에 비해 통계적으로 유의한 차이는 관찰되지 않았다(p-value 0.10).
4) 전반적 개선도
4주 시점에서의 전반적 개선도 설문에서 ‘매우 개선됨', ‘개선됨'으로 응답한 비율이 실험군(62.5%)에서 다른 두 대조군(모사프라이드 단독 25.0%, 라베프라졸 단독 58.3%)에 비해 높았으나 통계적 유의성은 없었다(p-value 0.10).
UIC201609/UIC201610 병용요법 그룹에서 약물 치료 중 임상 연구 도중 충수돌기염이 발생한 대상자 1명이 동의 철회한 사례가 있었다. 그 외 모사프라이드 단독 그룹에서 1명이 치료 중 어지러움이 발생하였으며, 라베프라졸 단독 그룹에서 1명이 피부병변이 발생하였으나 시험약물 투여에는 문제가 없었다. 임상시험 시작 시점과 마지막 4주차 방문에서 백혈구, 적혈구, 호중구, 림프구, 단핵구, 호산구, 호염기구, 혈색소, 헤마토크리트, 혈소판의 혈액학적 검사수치 변화량 및 간수치, 황달, 알부민, 단백질, 혈청 크레아티닌, 콜레스테롤, 중성지방, 혈당이 조사되었으나 각 그룹 모두에서 유의미한 수준의 차이를 보이지 않았다. 또한 활력징후 및 신체검진에서도 통계적으로 유의한 차이는 확인되지 않았다.
기능성 위장장애는 한국인이 가장 흔하게 경험할 수 있는 질환의 하나로,6 만성적인 상부위장관 증상이 있으면서 혈액학적, 내시경적, 영상의학적 검사에서 특이 소견이 관찰되지 않는 경우로 정의된다.1 일반적으로 기능성 소화불량증이 포괄하고 있는 다양한 증상에서 알 수 있듯이 여러 병태생리 기전이 함께 작용하고 있고,12 따라서 적절한 약물을 선택하여 처방하는 것이 진료에 임하는 의사의 중요한 역할이기도 하다.1,4 이에 대해 적절한 가이드라인을 제시하기 위하여 ROME III 기준에서부터 기능성 위장장애를 EPS와 PDS의 두 가지 아형으로 분류하기 시작하였고,13,14 이를 바탕으로 치료법에 대한 연구가 이어져 오고 있다. 요약하면 EPS 아형의 경우 위산분비억제제인 프로톤펌프억제제를 근간으로 치료를 하는 것이 권고되며,7 식후불편증후군의 경우 위장관 운동 촉진제를 근간으로 하는 치료를 권유한다는 것이다.1,7,9,13 하지만 실제 진료에서 두 가지 아형은 공존할 수 있는 경우가 흔하기 때문에 한 가지 약물만 처방하는 경우는 매우 드물고, 프로톤펌프억제제 및 위장관 운동 촉진제를 조합해서 사용하는 경우가 매우 흔하다.4,15
위장관 운동 촉진제는 작용 범위와 기전에 따라 여러 가지로 나뉜다. 크게 도파민 수용체 D2 길항제와 5-HT4 수용체 작용제로 분류할 수 있다. 하지만 레보설피리드, 메토클로프라미드처럼 두 가지 수용체에 모두 작용하는 경우도 있다.4 다만 중요한 것은 D2 길항제의 경우 장기간 사용 시 추체외로 증상 등 심각한 부작용을 유발할 수 있다는 점이다.16,17 그 때문에 가급적 짧은 기간 1주일 내외로 사용할 것이 권고되고 있다. 반면 생약 추출물인 DA-9701과 더불어 모사프라이드는 장기간 사용에 비교적 안전한 것으로 알려져 있다.18,19 하지만 기존의 위장관 운동 촉진제 모두 1일 3회 투여가 권장되는 약이기 때문에 하루 1회 투여가 가능한 프로톤펌프억제제와 조합할 경우 순응도 저하의 우려가 있지 않을까 추측된다. 비록 본 연구에서 증명되지는 못하였으나 모사프라이드 서방정과 1일 1회 복용 위산분비억제제와의 조합이 향후 순응도 개선에 긍정적 효과를 불러올 수 있을지 여부는 향후 연구를 지켜보아야 할 것으로 생각된다.
최근 모사프라이드 15 mg 서방정이 임상에서 사용 가능하게 되었으며, 2020년 개정된 한국의 기능성 위장장애 가이드라인에도 등재되어, 이를 바탕으로 한 본 연구가 기획되었다.
이 연구는 설계 단계부터 약 2주간의 도입기를 통하여 다른 약물의 영향을 최소화하였으며, 이는 동시에 여러 기관에서 투약을 받는 환자들이 많은 우리나라의 환경을 감안하였을 때 꼭 필요한 과정이라 생각되어 본 연구에서 시도하였다. 또한 위약 대조군을 통하여 위약효과와 연구자 및 대상자에 의한 결과 판정의 비뚤림을 방지할 수 있는 과정은 잘 수행되었다. 결과를 보았을 때 연구 대상자의 증상 점수는 세 그룹 모두 하향을 보였다. 연구 계획 시 가정하였던 것처럼 단독 대조군에 비해서 UIC201609/UIC201610 병용요법이 유의미하게 우월한 효과를 보이진 못하였으나, 세 군 모두에서 뚜렷한 감소를 보여 각 약제의 효능은 확인되었다고 볼 수 있다. 한편 이차 유효성 변수인 NDI-K 각 증상 별 점수 감소에서 특히 PDS 타입 증상에 해당하는 구역, 식후 포만감, 식사량 면에서 UIC201609/UIC201610 병용요법군이 더 큰 증상 점수 감소폭을 보이는 듯한 경향이 관찰되었고, 전반적 개선도에서도 병용요법군이 통계적으로 유의하지는 않았으나 개선된 비율이 단독요법군과 비교하여 더 높은 것으로 확인되었다. 비록8가지 선택된 증상 모두에서 통계적으로 유의미한 차이를 보이지 못하였으나 본 연구의 실험군에서 사용된 모사프라이드 15 mg 서방정으로 인한 증상개선 효과는 향후 후속 임상 연구에서 그 효과를 증명해 볼 수 있지 않을까 하는 기대를 가질 수 있게 한다. 한편 본 연구에서 UIC201609/UIC201610 투여에도 불구하고 궤양 유사 증상 및 역류 관련 세부 항목에서 큰 호전을 보이지 못하였다. 기능성 위장장애 가이드라인을 포함한 다양한 연구들에서 EPS의 경우 프로톤펌프억제제 치료가 중요한 것으로 되어 있다. 이 연구에서 사용된 라베프라졸은 10 mg 용량이 사용되었는데, 이는 프로톤펌프억제제로서 라베프라졸의 표준용량인 20 mg의 절반에 해당한다. 비록 프로톤펌프억제제의 용량 반응 관계에 대해서는 연구에 이질성이 많아 아직 결론 내리기 힘든 문제로 여겨지지만 향후 연구에서는 20 mg으로 증량을 고려해 보는 것이 좋을 것으로 생각된다.
이 연구에서는 몇 가지 단점이 확인된다. 무엇보다 연구 계획 단계에서 설정된 수의 대상자 모집을 하지 못하였고, 이것이 유의미한 결과 도출 실패의 가장 큰 원인으로 보인다. 이연구는 설계 단계에서부터 위장관의 기질적 원인을 최대한 배제하고 확실한 기능성 위장장애 대상자만을 포함하기 위해 H. pylori 음성인 경우만을 등록하였다. 또한 NDI-K 44점 이상을 첫 등록 기준으로 하고 2주간의 도입기 후 44점 이상을다시 확인하는 방식으로 추가 방문을 하게 한 결과 연구 기간이 길어지게 되었다. 또한 대상자 모집 시 4주 이내 시행한위내시경 결과에서 위장의 구조적 문제가 없었던 경우로 한정하였는데, 이는 종양 및 궤양 같은 위장관의 기질적 질환을확실히 배제한다는 목적을 위해서 필요한 과정이었으나, 검진이 활성화된 한국의 여건상 연구 대상자들이 1년 이내에 추가적으로 위내시경을 받아야 한다는 것에 대한 거부감이 대상자모집에 어려움으로 작용하였다. 만약 후속 연구가 기획된다면연구대상자 모집에 있어 구조적, 기질적 질환을 배재하는 방법 및 헬리코박터 관련 질환 배제를 위한 신속하고도 적절한프로토콜 확립에 무엇보다 주의를 기울여야 할 것이다. 요약하면 이 임상시험은 기능성 위장장애 치료의 두 근간인 프로톤펌프억제제 및 위장관 운동 촉진제제 서방정의 병용제제인UIC201609/UIC201610 1일 1회 투여법의 효과를 검증하기위한 연구로서, 개개의 임상시험 약물의 효과는 확인되었으나UIC201609/UIC201610 병용 투여군의 유의성을 확인한다는연구 목적은 달성하지 못하였다. 향후 약물의 용량, 결과 변수확인에 있어서 발전된 연구 설계를 도입한 추가적인 연구가필요하다.
Notes
REFERENCES
1. Stanghellini V, Chan FK, Hasler WL, et al. 2016; Gastroduodenal disorders. Gastroenterology. 150:1380–1392. DOI: 10.1053/j.gastro.2016.02.011. PMID: 27147122.


2. Kim SE, Park HK, Kim N, et al. 2014; Prevalence and risk factors of functional dyspepsia: a nationwide multicenter prospective study in Korea. J Clin Gastroenterol. 48:e12–e18. DOI: 10.1097/MCG.0b013e31828f4bc9. PMID: 23632355.
3. Lee JY, Kim N, Nam RH, In Choi S, Lee JW, Lee DH. 2019; Primary and secondary antibiotic resistance of Helicobacter pylori in Korea from 2003 to 2018. Helicobacter. 24:e12660. DOI: 10.1111/hel.12660. PMCID: PMC6790945.

4. Oh JH, Kwon JG, Jung HK, et al. 2020; Clinical practice guidelines for functional dyspepsia in Korea. J Neurogastroenterol Motil. 26:29–50. DOI: 10.5056/jnm19209. PMID: 31917913. PMCID: PMC6955183.



5. Lee JH, Choi KD, Jung HY, et al. 2018; Seroprevalence of Helicobacter pylori in Korea: a multicenter, nationwide study conducted in 2015 and 2016. Helicobacter. 23:e12463. DOI: 10.1111/hel.12463. PMID: 29345022. PMCID: PMC5900911.
6. Kim SE, Kim N, Lee JY, et al. 2018; Prevalence and risk factors of functional dyspepsia in health check-up population: a nationwide multicenter prospective study. J Neurogastroenterol Motil. 24:603–613. DOI: 10.5056/jnm18068. PMID: 29938463. PMCID: PMC6175566.



7. Pinto-Sanchez MI, Yuan Y, Bercik P, Moayyedi P. 2017; Proton pump inhibitors for functional dyspepsia. Cochrane Database Syst Rev. 3:CD011194. DOI: 10.1002/14651858.CD011194.pub3. PMID: 29161458. PMCID: PMC6485982.

8. Quigley EM. 2015; Prokinetics in the management of functional gastrointestinal disorders. J Neurogastroenterol Motil. 21:330–336. DOI: 10.5056/jnm15094. PMID: 26130629. PMCID: PMC4496896.



9. Pittayanon R, Yuan Y, Bollegala NP, et al. 2019; Prokinetics for functional dyspepsia: a systematic review and meta-analysis of randomized control trials. Am J Gastroenterol. 114:233–243. DOI: 10.1038/s41395-018-0258-6. PMID: 30337705.


10. Jones M, Talley NJ. 2009; Minimum clinically important difference for the Nepean Dyspepsia Index, a validated quality of life scale for functional dyspepsia. Am J Gastroenterol. 104:1483–1488. DOI: 10.1038/ajg.2009.136. PMID: 19491862.

11. Cho YK, Choi MG, Kim SH, et al. 2004; The effect of mosapride on quality of life in functional dyspepsia. Korean J Gastroenterol. 43:160–167.

12. Tack J, Bisschops R, Sarnelli G. 2004; Pathophysiology and treatment of functional dyspepsia. Gastroenterology. 127:1239–1255. DOI: 10.1053/j.gastro.2004.05.030. PMID: 15481001.


13. Miwa H, Ghoshal UC, Gonlachanvit S, et al. 2012; Asian consensus report on functional dyspepsia. J Neurogastroenterol Motil. 18:150–168. DOI: 10.5056/jnm.2012.18.2.150. PMID: 22523724. PMCID: PMC3325300.



14. Tack J, Talley NJ, Camilleri M, et al. 2006; Functional gastroduodenal disorders. Gastroenterology. 130:1466–1479. DOI: 10.1053/j.gastro.2005.11.059. PMID: 16678560.


15. Yang YJ, Bang CS, Baik GH, et al. 2017; Prokinetics for the treatment of functional dyspepsia: Bayesian network meta-analysis. BMC Gastroenterol. 17:83. DOI: 10.1186/s12876-017-0639-0. PMID: 28651565. PMCID: PMC5485548.



16. Shin HW, Kim MJ, Kim JS, Lee MC, Chung SJ. 2009; Levosulpiride-induced movement disorders. Mov Disord. 24:2249–2253. DOI: 10.1002/mds.22805. PMID: 19795476.


17. Frommeyer G, Fischer C, Ellermann C, et al. 2017; Severe proarrhythmic potential of the antiemetic agents ondansetron and domperidone. Cardiovasc Toxicol. 17:451–457. DOI: 10.1007/s12012-017-9403-5. PMID: 28185059.


18. Jung HK, Lee KJ, Choi MG, et al. 2016; Efficacy of DA-9701 (motilitone) in functional dyspepsia compared to pantoprazole: a multicenter, randomized, double-blind, non-inferiority study. J Neurogastroenterol Motil. 22:254–263. DOI: 10.5056/jnm15178. PMID: 26811504. PMCID: PMC4819864.



19. Bang CS, Kim JH, Baik GH, et al. 2015; Mosapride treatment for functional dyspepsia: a meta-analysis. J Gastroenterol Hepatol. 0:28–42. DOI: 10.1111/jgh.12662. PMID: 25041564.

Fig. 2
Changes in score according to each symptom of Nepean Dyspepsia Index-Korean (NDI-K) version. (A) Pain in upper abdomen. (B) Discomfort in upper abdomen. (C) Burning in upper abdomen. (D) Inability to finish regular meal. (E) Fullness after eating. (F) Pressure in upper abdomen. (G) Bloating in upper abdomen. (H) Nausea.
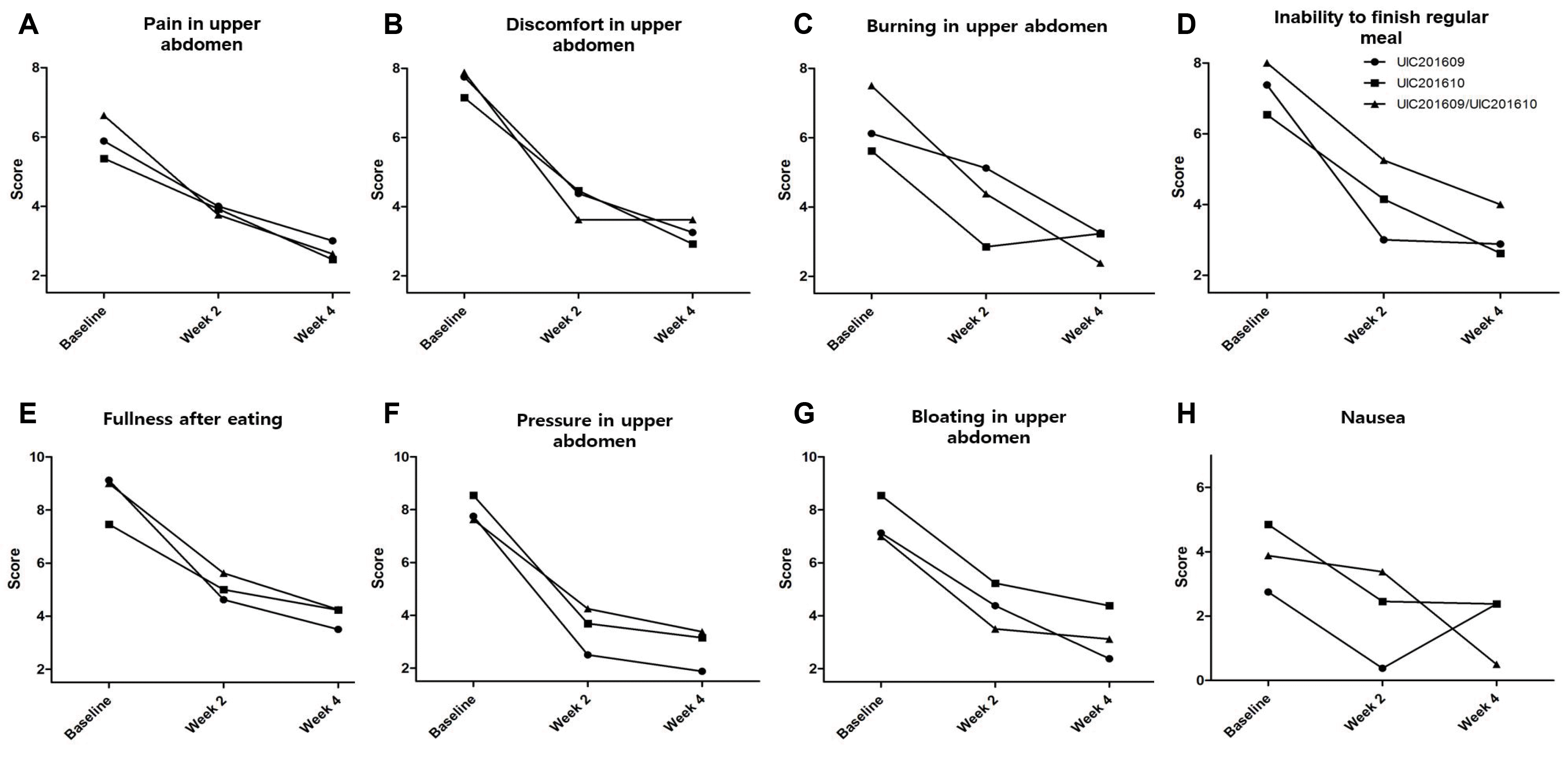
Table 1
Demographic and Baseline Characteristics of Subjects
| Mosapride CR 15 mg | Rabeprazole 10 mg | Mosapride CR+Rabeprazole | p-value | |
|---|---|---|---|---|
| Number | 8 | 13 | 9 | |
| Age (years) | 50.5±10.9 | 43.9±13.0 | 54.2±16.9 | 0.26 |
| Sex (male/female) | 1/7 | 1/12 | 2/7 | 0.61a |
| Hight (cm) | 161.3±7.4 | 165.0±5.8 | 160.6±5.6 | 0.27 |
| Weight (kg) | 62.0±11.1 | 58.5±11.5 | 59.8±6.8 | 0.78 |
| Smoking (n) | 0.51a | |||
| Never | 8 | 12 | 9 | |
| Ex-smoker | ||||
| Current | 1 | |||
| Alcohol (n) | 0.02a | |||
| None | 2 | 11 | 6 | |
| Past | ||||
| Current | 6 | 2 | 3 | |
| Symptom duration (mo) | 13.16±14.3 | 10.0±5.3 | 7.7±3.4 | 0.43 |
| Subtypes of functional dyspepsia (n) | 0.20 | |||
| EPS | 4 | 8 | 6 | |
| PDS | 7 | 11 | 8 | |
| EPS+PDS | 3 | 6 | 5 |
Table 2
Compliance and Treatment Efficacy at 4 Weeks




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download