Abstract
Superficial nonampullary duodenal epithelial tumors are considered rare but have been increasingly recognized in recent years. Accordingly, the importance of endoscopic treatment for the lesions are also increasing. An endoscopic resection can be considered for duodenal adenoma and mucosal cancer. The choice of resection method should be made based on the size of the lesion, endoscopic findings, pathologic diagnosis, and risk of procedure-related complication. For small adenomas <10 mm in size, endoscopic mucosal resection (EMR), cold snare polypectomy, and underwater EMR can be considered. An en bloc or piecemeal resection using EMR or underwater EMR can be selected for 10-20 mm sized adenomas. For lesions ≥20 mm in size or suspicious for mucosal cancer, an endoscopic submucosal dissection followed by closure of the mucosal defect conducted by an experienced endoscopist is appropriate.
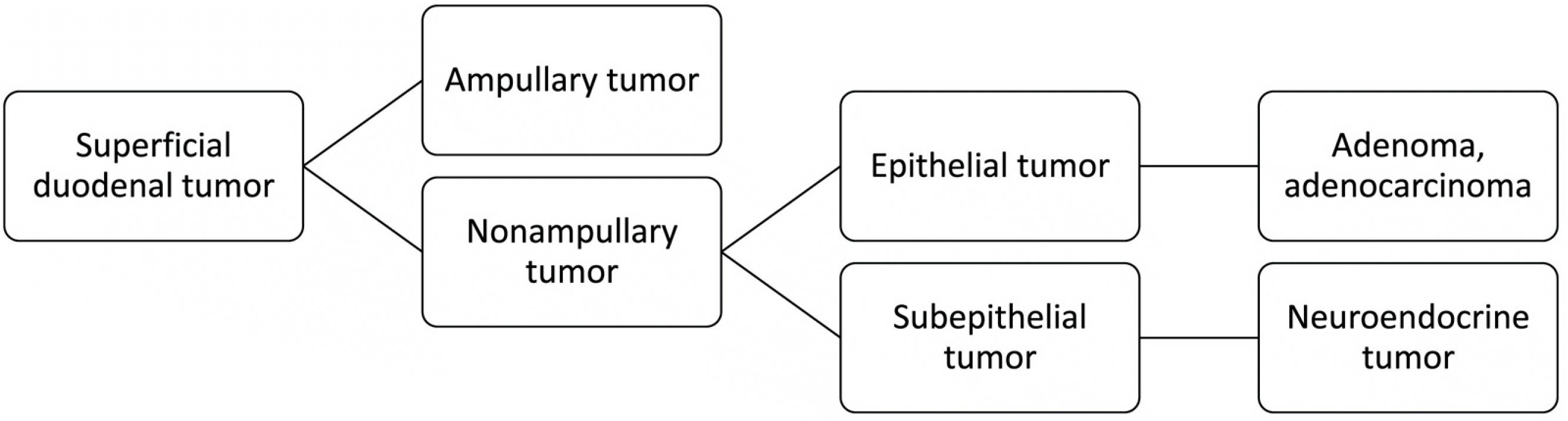
십이지장 표재성 종양은 십이지장의 점막 및 점막하층에 발생하는 종양으로 정의되며, 유두부 종양과 비유두부 종양으로 나눌 수 있다(Fig. 1).1 비유두부 십이지장 표재성 종양은 다시 십이지장 샘종과 샘암이 포함된 상피 병변과 신경내분비종양이 포함된 상피하 병변으로 나눌 수 있다. 십이지장 신경내분비종양의 내시경 치료에 관해서는 과거에 여러 논의가 있었다. 주로 10 mm 이하의 G1 병변이 내시경 절제술의 대상이 되며, 내시경 점막 절제술(endoscopic mucosal resection, EMR; EMR with ligation, EMR-L; or precut EMR, EMR-P)이나 내시경 점막하 박리술(endoscopic submucosal dissection, ESD)이 사용된다. 2014년 보고된 국내 다기관 연구에서, 일괄 절제율은 95%, 내시경적 완전 절제율 98%로 높았으며, 병리학적 완전 절제율은 41%에 불과하였으나 17개월 추적 기간 동안 재발 소견은 없었다.2 한편, 비유두부 십이지장 표재성 상피 종양(superficial nonampullary duodenal epithelial tumor, SNADET)의 내시경 치료 방법과 안전성에 관해서는 상대적으로 최근에 이르러서 활발하게 논의되고 있다. 과거에는 SNADET이 드물게 발생하고 악성도도 높지 않다고 생각되었으나, 최근에는 내시경 장비 및 기술의 발전과 함께 SNADET에 대한 인식이 증가하면서 발생률도 증가하고 있다.3 SNADET에 대한 수술적 치료는 췌십이지장절제술(pancreaticoduodenectomy)과 같이 수술 후 이환율이 높을 수 있기 때문에, 다른 위장관 부위처럼 내시경 절제술을 고려할 수 있다. 그러나, 여전히 낮은 유병률과 십이지장의 해부학적 특징 및 이로 인한 시술의 특성 등으로 인하여 SNADET에 대한 내시경 치료는 아직 표준화되어 있지 않다. 본고에서는 SNADET의 내시경 치료 대상과 십이지장의 해부학적 특성 그리고 개별 내시경 치료 방법의 효과와 안전성에 대해서 정리해보고자 한다.
SNADET의 내시경 치료 대상은 아직 확립되지 않았다. 그러나 지금까지 보고된 문헌들을 살펴보면 저도 이형성 샘종, 고도 이형성 샘종, 점막에 국한된 샘암이 치료 대상이라고 할 수 있다. 저도 및 고도 이형성 샘종은 점막암으로 진행할 위험이 있기 때문에 내시경 절제술의 대상이 된다. 2010년 보고된비유두부 십이지장 샘종의 자연 경과에 관한 연구에서 43명의 저도 이형성 샘종 환자를 평균 29개월 추적하였을 때 16%는 고도 이형성 샘종으로, 5%는 점막암으로 진행하였다.4 한편, 3명에서 고도 이형성 샘종은 평균 14개월 추적 관찰 동안점막암으로 진행하지는 않았으나, 내시경 절제술을 시행하였을 때 한 명은 최종 조직 검사 결과 샘암으로 진단되었다. 한편, 점막암은 림프절 전이 위험이 낮기 때문에 내시경 치료의대상이 될 수 있다. 2014년 보고된 일본 연구에서 수술적 치료를 받은 27명의 십이지장 샘암 환자 중 22명의 점막암에서는 림프절 전이가 없었던 반면, 5명의 점막하층을 침범이 있는 경우 중 1명에서 림프절 전이가 진단되었다.5 2020년 보고된 다른 연구에서는 림프절 절제를 포함한 수술을 시행 받은비유두부 십이지장 샘암 환자 46명의 데이터를 보고하였는데, 이 중 점막암 34명 중에는 림프절 전이가 없었던 반면,점막하암 12명 중 5명(42%)에서 림프절 전이가 발견되었다.6 2015년 보고된 또 다른 일본 연구에서 내시경 절제술을 받은저도 이형성 샘종 환자 57명, 고도 이형성 샘종 및 점막암환자 60명 및 점막하암 환자 3명을 합한 120명 중 1년 이상추적 관찰한 71명을 중앙값 51개월간 추적하였을 때 십이지장암의 재발 및 관련 사망이 없었다.7 그러나, 이러한 근거들은 위암이나 대장암과 비교하였을 때 십이지장암의 낮은 유병률로 인하여 그 증례 수가 적고, 그에 따른 근거 수준도 아직 부족하다.
내시경 치료 전 생검 겸자를 이용한 조직 검사로 진단하는 것은 치료를 계획하는 데 도움이 될 수 있다. 저도 이형성 샘종과 달리 고도 이형성 샘종이나 점막암에서는 일괄 절제나 완전 절제를 위하여 침습도가 좀 더 높은 내시경 절제 방법을 선택해야 할 수 있기 때문이다. 그러나, 생검 겸자를 통한 조직 검사의 정확도가 높지 않다. 시술 전 조직 생검에서 샘종으로 진단된 경우의 20%는 내시경 절제 조직에서 샘암으로 진단되었으며, 샘암 진단에서 조직 생검의 민감도가 37.5%에 불과하다고 보고된 바 있다.8 게다가, 조직 생검은 병변의 섬유화를 유발하여 점막하 주입 시 non-lifting sign이 발생하고, 절제술이 어렵게 되는 원인이 될 수 있다. EMR이 가능할 것으로 판단되었던 61명의 증례 중 15 증례(24.6%)에서 조직 생검으로 인한 섬유화로 ESD가 필요하였다는 보고가 있다.8 따라서, 내시경 소견만으로 병리 조직 소견을 예측하는 것이 불필요한 섬유화를 줄이는 데 도움이 될 수 있는데, 아직까지 확립된 내시경 소견은 없다. 최근 연구에 따르면 병변이 10 mm 미만의 크기, 백색, 함몰이 없는 융기성 형태, 균일한 결절 형태를 보이는 경우 저도 이형성 샘종을 시사하고, 10 mm 이상의 크기, 연분홍 혹은 붉은색, 함몰 부위, 불균일한 결절 형태나 결절 형태가 소실된 경우에는 고도 이형성 샘종이나 점막암을 의심할 수 있다.9
SNADET에 대한 내시경 치료는 십이지장의 해부학적 특징과 이로 인한 어려움을 충분히 고려한 뒤 진행하는 것이 좋다. 첫째, 십이지장은 상부위장관 내시경이 위강 내에서 굴곡을 형성한 뒤에 도달할 수 있는 가장 깊은 부위로 내시경의 조작이 어렵다. 둘째, 십이지장은 내강이 좁아서 내시경 반전이 불가하며 구부를 지나 제2부로 진입하는 굴곡 부위도 있기때문에 적절한 시야를 유지하기 어렵다. 셋째, 점막하층에 주입한 용액이 주름을 따라 주변으로 쉽게 퍼져나가 병변의 융기를 형성하고 유지하는 것이 어렵다. 넷째, 고유근층이 매우 얇아서 내시경 시술 중 약간의 손상으로도 천공이 발생할 위험이 높다. 다섯째, 췌장액 및 답즙이 분비되기 때문에 내시경 절제술 후 점막 결손 부위가 이에 노출되면 지연성 출혈 및 천공으로 이어질 수 있고, 특히 지연성 천공은 후복막 부위의 복막염 등 중증 합병증으로 이어질 수 있다.
1) EMR
EMR은 대장 용종 제거 목적으로 가장 흔하게 사용되는 시술이며 내시경 의사들에게 가장 익숙한 시술이다. 일괄 절제가 불가능한 큰 병변도 부분 절제로 제거할 수 있다는 장점도 있다(Table 1). 그러나 위나 대장과 비교하여 SNADET에 대한 EMR은 일괄 절제율이 낮고 출혈 및 천공 합병증 비율이 높다. 2016년 보고된 체계적 문헌고찰에서 485예 십이지장 용종에 대한 EMR 결과를 보고하였다.10 포함된 연구들에서 보고한 용종의 크기는 13-35 mm였고, 90%가 샘종, 1.9%가 샘암이었다. EMR을 통한 일괄 절제는 45%에서만 가능하였고 55%는 부분 절제가 필요하였으나, 93%에서 완전 절제가 가능하였다. 출혈은 16%에서 발생하였고 이 중 지연성 출혈은 5%에서 발생하였다. 천공은 1%에서 발생하였으며, 시술 중 발생한 천공은 내시경적 봉합이 가능하였으나, 지연성 천공은 수술이 필요하였다. 6-72개월의 추적 기간 동안 재발률은 15%였으며, 그중 62%가 내시경으로 제거가 가능하였다. 2015년 일본 단일 기관에서 113명의 환자에서 121예의 십이지장 샘종 및 샘암을 제거한 결과를 보고하였는데, 일괄 절제는 63%에서 가능하였으나 병변의 크기가 20 mm 이상인 경우에는 일괄 절제율이 21% (3/14)에 불과하였다.7 이 연구에서도 지연성 출혈은 12%에서 발생하였다. 그러나, 천공은 발생하지 않았으며, 51개월 추적 기간 동안 국소 재발은 없었다. 최근에는 미국, 호주, 유럽 등 서구권에서 시행한 EMR 결과들이 보고되었는데, 일괄 절제율은 24-53%, 출혈 8-12%, 천공 0-4%로 보고되었다.11-13 이들 연구의 특징은 10-15개월 추적 기간 동안 국소 재발이 17-31%로 높았다는 것이다. 그러나 이들 국소 재발은 대부분 내시경 시술을 통해 제거가 가능하였다. 병변의 크기가 클수록 출혈 및 국소 재발의 위험이증가하며,12,14 부분 절제를 시행하였거나 바터 팽대부 원위부에 위치한 병변이 지연성 천공과 연관이 있다고 보고되었다.15 국내 연구도 17-45예의 치료 결과들이 여러 기관에서 발표되었다.16-20 이들 연구에서 병변 크기의 중앙값은 8-13 mm였으며, 일괄 절제율은 78-97%, 내시경적 완전 절제율은 87-94%,병리학적 완전 절제율은 71-87%였다. 합병증에서도 출혈이 2-9%, 지연성 출혈은 0-4%, 천공은 0-5%로 보고되었으며 지연성 천공은 보고되지 않았다. 6-29개월 추적 기간 동안 재발률도 0-5%로 양호하였다. 이러한 결과를 요약하면, EMR은20 mm 미만 크기의 SNADET에서 일차적으로 시행할 수 있는 시술이다. 그러나, 크기가 큰 병변을 부분 절제로 제거한경우 지연성 출혈 및 천공 그리고 국소 재발에 대한 주의가필요하다.
2) 저온 용종 절제술(cold snare polypectomy, CSP)
CSP는 고주파전류 없이 올가미를 이용하여 용종을 절제하는 시술로, 10 mm 미만 크기의 작은 대장 용종을 제거하는 목적으로 사용되고 있다. CSP는 고주파전류를 사용하지 않아 열손상이 없고 절제면의 깊이가 낮기 때문에 출혈 및 천공의 위험이 낮다는 것이 장점이다. 2017년 일본에서 22명 환자 30개 샘종을 대상으로 CSP 결과를 보고하였다.21 평균 4 mm (범위, 2-6 mm) 크기의 병변에 대해서 CSP를 시행한 결과 97%에서 일괄 절제가 가능하였고, 출혈 및 천공이 발생하지 않았다. 비록 절제면 음성을 보인 경우는 68%에 불과하였지만, 3개월 추적 내시경 검사에서 국소 재발 소견은 관찰되지 않았다. CSP는 특히 다수의 SNADET이 발생하는 가족성샘종폴립증 환자에서 유용할 것으로 생각된다. 2016년 일본에서 보고된 환자군 연구에서는 4명의 가족성샘종폴립증 환자에서 2-16 mm 크기의 126개 SNADET들이 제거되었으며, 1명은 복통, 1명은 시술 당일 밤에 흑변을 본 것 이외의 합병증은 발생하지 않았다.22 따라서, CSP는 10 mm 미만 크기, 특히 6 mm 이하 크기의 SNADET을 제거하기 위한 목적으로 혹은 가족성샘종폴립증 환자에서 발생한 다수의 SNADET을 제거하는 데 안전하고 유용하게 사용될 수 있다.
3) Underwater EMR (UEMR)
UEMR 역시 대장 용종 절제술을 위해서 제안된 시술 방법이다. 내시경을 통해 관강의 공기를 제거한 뒤 물을 채우면, 고유근층은 원래의 모양을 유지하는 가운데 점막층이 물에 떠오르면서 편평한 모양의 병변도 돌출 형태가 되어 마치 점막하 주입과 비슷한 효과를 내게 되고, 점막하 주입 없이도 올가미를 통한 절제가 가능해진다. UEMR의 장점은 점막하 주입을 하지 않기 때문에 EMR로 가능한 것보다 더 큰 병변도 일괄 절제가 가능하고, 관강을 물로 채우기 때문에 고주파전류를 통한 소작 과정에서 고유근층의 열 손상 및 이로 인한 지연성 천공 위험이 적으며, 절제 후 점막 결손도 점막하 주입을시행한 EMR보다 작아 지혈 클립을 이용한 봉합이 수월하다는 것이다.
SNADET에 대한 UEMR은 2013년 미국에서 환자군 연구로 처음 보고되었다.23 이 연구에서는 20 mm 이상, 중앙값 35 mm 크기의 측방발육형 샘종을 가진 11명의 환자에서 부분 절제 UEMR을 시행하였다. 모든 병변은 완전 절제가 가능하였고, 천공 합병증은 없었으나, 3명(27%)에서 지연성 출혈, 1명(9%)에서 의식 저하 및 저나트륨혈증 등 수분중독증이 발생하였다. 4개월 추적 검사에서 재발은 없었다.
이후 후속 연구들은 일본에서 활발하게 진행되었는데, 첫 연구와는 달리 20 mm 미만 크기의 SNADET을 일괄 절제로 제거하면서 합병증을 줄이기 위한 목적으로 시행되었다. 2018-2019년에 걸쳐 보고된 연구들에서, 약 300명의 환자들을 대상으로 20 mm 미만의 중앙값 10-12 mm 크기의 SNADET에 대해서 일괄 절제율 79-87%, 지연성 출혈 0-7%, 지연성 천공 0-0.6%로 보고되었다.24-27 단점은 일괄 절제가 되었더라도 측부 절제면 음성으로 보고된 비율은 19-67%로 낮았으며, 역시 20 mm 이상의 병변에서는 일괄 절제율이 14%에 불과하였다는 것이다. 그 결과 국소 재발은 3-13%로 보고되었으나, 대부분 내시경으로 조절이 가능하였다. 주목할 부분은 한 명의 환자에서 경도의 흡인성 폐렴이 발생하였다는 것이다.27 또한, EMR와 UEMR를 비교한 코호트 연구에서 UEMR은 EMR에 비해 시술 중 ESD로 변경하는 비율이 낮았다고 보고하였다.25 다만, 일괄 절제율과 측부 절제면 음성 비율이 낮았다. 2020년 보고된 체계적 고찰 연구에서도 8개 연구 258개 병변의 결과를 발표하였는데, 평균 크기는 19.4 mm였고, 일괄 절제율은 84.6%, 제거된 병변 중 24.7%가 고도 이형성 샘종 혹은 점막암이었으며, 합병증 발생률은 6.9%였다.28 그러나 이 연구에서는 병리적 완전 절제율에 대해서는 보고하지 않았다. 이를 종합하면, UEMR은 20 mm 미만 크기의 SNADET을 제거할 때 기존 EMR보다 일괄 절제율을 높이고, 지연성 천공 합병증 위험을 낮출 수 있는 대안이다. 다만, 병리학적 완전 절제율이 낮아 저도 이형성 샘종과 달리 고도 이형성 샘종 및 샘암에서는 부적절할 수 있다. 또한, 일반적으로 내시경을 시행하는 왼쪽으로 누운 자세에서 십이이장 구부와 제2부는 중력의 반대 방향으로 물이 잘 채워지지 않는 부위이다. 이 부위를 물로 채우는 것이 기술적으로 어려울 수 있고, 하부 위장관과는 달리 이 부위에 다량의 물을 주입하다가 구역과 함께 흡인으로 이어질 위험도 있다. 따라서, 수분중독증 및 흡인성 폐렴에 대한 주의가 필요하다.
1) ESD
ESD는 15-20 mm 이상의 SNADET에 대해서도 일괄 절제율과 완전 절제율이 높다는 장점이 있다. 기존 보고에서 중앙값 13-27 mm 크기의 병변에 대해서 일괄 절제율이 79-100%였고, 병리학적 완전 절제율이 83-93%였다.5,29-32 그러나 지연성 출혈이 21-39%에서 발생하였고 천공이 21-39%로 매우 높은 빈도로 발생하였다. 특히, 지연성 천공이 1-14%에서 발생하였는데, 시술 중 발생한 천공과는 달리 지연성 천공은 항생제 치료, 농양 배액 이후 수술적 치료까지 이어지는 경우가 많았다. 그 결과 시술 중 조절되지 않는 천공 혹은 지연성 천공으로 수술적 치료로 진행되는 비율이 1-14%였다. 일반적으로 ESD는 EMR보다 크기가 큰 병변에 대해서 시행되므로 합병증 위험이 높을 수밖에 없지만, 병변의 크기에 따라 나누어 비교하였을 때 20 mm 미만 크기의 병변에서도 천공 합병증이 EMR은 1.8%에서 발생한 반면 ESD는 24.0%에서 발생하였다.29 따라서, EMR로 제거가 가능한 SNADET에 대해서ESD를 시행하는 것은 부적절할 수 있다. ESD는 20 mm 이상크기의 병변이거나, 점막암이 의심되거나 또는 섬유화가 동반된 경우에 추천될 수 있다.
SNADET에 대한 ESD는 시술 자체의 안전성과 시술 중 조절되지 않는 천공으로 인한 수술 가능성을 고려하여 전신 마취 후 시행하는 것이 추천된다. 천공 위험을 낮추기 위한 방법으로 시술 중 사용할 수 있는 방법과 시술 후 사용할 수 있는 방법이 있다. 시술 중 사용할 수 있는 방법은 최근 보고된 pocket creation method를 적용한 십이지장 ESD가 있다.33 Pocket creation method는 병변 주변 점막에 작은 절개를 만든 뒤, 구경이 좁은 투명 캡을 장착한 내시경을 통해 점막하층 박리를 진행하여 pocket을 만드는 절제 방법이다. 이 방법은 pocket 내부에서 절제 조직이 잘 견인되고 내시경선단을 안정적으로 유지할 수 있으며, 절제면 및 고유근층에수평으로 내시경을 위치시킬 수 있다는 장점이 있다. 이 방법은 기존의 ESD와 비교하여 천공을 29% (5/17)에서 7%(2/28)로 유의하게 낮출 수 있다고 보고하였다. 한편, ESD 시술 후 사용할 수 있는 방법은 지연성 출혈 및 천공을 줄이기위한 목적으로 점막 결손을 봉합하는 것이다.
2) 점막 결손 봉합
SNADET에 대한 ESD 후 지연성 출혈 및 천공 위험이 높은데, 이는 시술 후 발생한 점막 결손에 췌장액 및 답즙이 노출되기 때문이라는 주장이 많이 있다. SNADET의 EMR 후에도 바터 팽대부 원위부에 위치한 병변이 지연성 천공과 연관
이 있다고 보고된 바 있으며,15 십이지장 내측벽에 위치한 병변의 경우 EMR 및 ESD 후 합병증으로 인한 재원 기간이길고 출혈 합병증 위험도 높다고 보고되었다.32 한편, ESD 후점막 결손 봉합을 시행한 경우 지연성 출혈이 유의하게 감소한다는 보고가 있었으며,34 이후 최근 일본에서 보고한 대규모ESD 연구들에서도 모두 점막 결손 봉합을 시행하였다고 보고하며, 이것이 지연성 천공의 감소로 이어졌다고 주장하고있다.29,32
EMR에 의한 작은 점막 결손은 클립을 통한 봉합이 가능하다. 하지만, 큰 병변에 대한 부분 절제 EMR이나 ESD를 시행한 경우에는 클립을 통한 봉합이 어려우며, 일부 클립의 탈락이 지연성 천공으로 이어질 수 있다.35 ESD에 의한 큰 점막 결손의 봉합 방법으로 가장 잘 알려진 방법 중의 하나는 endoloop and clips method이다. 두 개의 겸자공을 가진 내시경을 통해서 박리성 올가미와 지혈 클립을 이용한 봉합 방법으로, 대장내시경 천공의 봉합에도 사용되는 방법이다.36 십이지장 ESD 후 점막 결손에 대해서 최근 소개된 방법으로는 string clip suture method가 있다.37,38 단일 겸자공 내시경으로 시술이 가능한 이 방법은 실을 묶은 클립을 점막 결손의 원위부에 고정시키고, 두 번째 클립을 점막 결손의 근위부에 실과 함께 고정시킨 뒤, 실을 당겨서 점막 결손의 크기를 줄이는 방법이다. 이후에는 수 차례 추가 클립 고정을 통하여 봉합을 시행하는 방법이다. 이 방법을 통해 완전히 봉합이 이루어지는 경우에는 지연성 출혈 및 천공 등 합병증 비율이 유의하게 감소하였다고 보고되었다.39 그 외에도 over-the-scope clip40을 이용한 봉합이나 polyethylene glycol sheet와 fibrin glue을 이용한 봉합 방법35도 십이지장 ESD 후 점막 결손의 봉합에 효과가 있었다고 보고되었다. 봉합 방법 사이에 합병증의 감소 효과에 차이가 있다는 보고는 없다. 어떤 봉합 방법을 사용하느냐 보다는 봉합 시도를 하였느냐 그리고 완전한 봉합을 달성하였느냐가 합병증 감소에 중요하다는 것이 여러 연구들에서 공통된 주장이다.
SNADET은 여전히 드물지만 발생률이 점차 증가하고 있어, 이에 대한 내시경 치료의 중요성도 점차 증가할 것으로 생각된다. 십이지장 저도 이형성 샘종, 고도 이형성 샘종, 점막암이 SNADET에 대한 내시경 치료 대상이다. SNADET에 대한 내시경 치료 방법은 병변의 크기, 내시경 소견, 조직 검사 소견과 함께 높은 합병증 위험을 고려하여 결정하는 것이좋다(Fig. 2). 10 mm 미만 크기의 저도 이형성 샘종에 대해서는 일차적으로 EMR을 시행할 수 있고, CSP 및 UEMR을 대안으로 고려할 수 있다. 10-20 mm 크기의 샘종에 대해서는EMR 혹은 UEMR을 이용한 일괄 혹은 분할 절제를 고려할수 있다. 20 mm 이상 크기이거나 점막암의 경우에는 ESD후 점막 결손 봉합을 고려할 수 있다. 그러나 높은 합병증 비율을 고려할 때 반드시 경험이 충분한 내시경 의사에 의해서만 시행하는 것이 좋겠다.
REFERENCES
1. Kakushima N, Yoshida M, Yabuuchi Y, et al. 2020; Present status of endoscopic submucosal dissection for non-ampullary duodenal epithelial tumors. Clin Endosc. 53:652–658. DOI: 10.5946/ce.2019.184. PMID: 31937098. PMCID: PMC7719431.



2. Kim GH, Kim JI, Jeon SW, et al. 2014; Endoscopic resection for duodenal carcinoid tumors: a multicenter, retrospective study. J Gastroenterol Hepatol. 29:318–324. DOI: 10.1111/jgh.12390. PMID: 24117946.


3. Goda K, Kikuchi D, Yamamoto Y, et al. 2014; Endoscopic diagnosis of superficial non-ampullary duodenal epithelial tumors in Japan: multicenter case series. Dig Endosc. 26 Suppl 2:23–29. DOI: 10.1111/den.12277. PMID: 24750144.


4. Okada K, Fujisaki J, Kasuga A, et al. 2011; Sporadic nonampullary duodenal adenoma in the natural history of duodenal cancer: a study of follow-up surveillance. Am J Gastroenterol. 106:357–364. DOI: 10.1038/ajg.2010.422. PMID: 21139577.


5. Kakushima N, Ono H, Takao T, Kanemoto H, Sasaki K. 2014; Method and timing of resection of superficial non-ampullary duodenal epithelial tumors. Dig Endosc. 26 Suppl 2:35–40. DOI: 10.1111/den.12259. PMID: 24750146.


6. Yoshimizu S, Kawachi H, Yamamoto Y, et al. 2020; Clinicopathological features and risk factors for lymph node metastasis in early-stage non-ampullary duodenal adenocarcinoma. J Gastroenterol. 55:754–762. DOI: 10.1007/s00535-020-01696-6. PMID: 32533301.


7. Nonaka S, Oda I, Tada K, et al. 2015; Clinical outcome of endoscopic resection for nonampullary duodenal tumors. Endoscopy. 47:129–135. DOI: 10.1055/s-0034-1390774. PMID: 25314330.


8. Kinoshita S, Nishizawa T, Ochiai Y, et al. 2017; Accuracy of biopsy for the preoperative diagnosis of superficial nonampullary duodenal adenocarcinoma. Gastrointest Endosc. 86:329–332. DOI: 10.1016/j.gie.2016.12.007. PMID: 28003118.


9. Kakushima N, Yoshida M, Iwai T, et al. 2017; A simple endoscopic scoring system to differentiate between duodenal adenoma and carcinoma. Endosc Int Open. 5:E763–E768. DOI: 10.1055/s-0043-113567. PMID: 28791326. PMCID: PMC5546900.

10. Navaneethan U, Hasan MK, Lourdusamy V, Zhu X, Hawes RH, Varadarajulu S. 2016; Efficacy and safety of endoscopic mucosal resection of non-ampullary duodenal polyps: a systematic review. Endosc Int Open. 4:E699–E708. DOI: 10.1055/s-0042-107069. PMID: 27556081. PMCID: PMC4993908.

11. Pérez-Cuadrado-Robles E, Quénéhervé L, Margos W, et al. 2018; Comparative analysis of ESD versus EMR in a large european series of non-ampullary superficial duodenal tumors. Endosc Int Open. 6:E1008–E1014. DOI: 10.1055/a-0577-7546. PMID: 30083592. PMCID: PMC6075950.

12. Singh A, Siddiqui UD, Konda VJ, et al. 2016; Safety and efficacy of EMR for sporadic, nonampullary duodenal adenomas: a single U.S. center experience (with video). Gastrointest Endosc. 84:700–708. DOI: 10.1016/j.gie.2016.03.1467. PMID: 27063918.

13. Tomizawa Y, Ginsberg GG. 2018; Clinical outcome of EMR of sporadic, nonampullary, duodenal adenomas: a 10-year retrospective. Gastrointest Endosc. 87:1270–1278. DOI: 10.1016/j.gie.2017.12.026. PMID: 29317270.


14. Klein A, Nayyar D, Bahin FF, et al. 2016; Endoscopic mucosal resection of large and giant lateral spreading lesions of the duodenum: success, adverse events, and long-term outcomes. Gastrointest Endosc. 84:688–696. DOI: 10.1016/j.gie.2016.02.049. PMID: 26975231.


15. Inoue T, Uedo N, Yamashina T, et al. 2014; Delayed perforation: a hazardous complication of endoscopic resection for non-ampullary duodenal neoplasm. Dig Endosc. 26:220–227. DOI: 10.1111/den.12104. PMID: 23621427.

16. Kim HK, Chung WC, Lee BI, Cho YS. 2010; Efficacy and long-term outcome of endoscopic treatment of sporadic nonampullary duodenal adenoma. Gut Liver. 4:373–377. DOI: 10.5009/gnl.2010.4.3.373. PMID: 20981216. PMCID: PMC2956351.



17. Min YW, Min BH, Kim ER, et al. 2013; Efficacy and safety of endoscopic treatment for nonampullary sporadic duodenal adenomas. Dig Dis Sci. 58:2926–2932. DOI: 10.1007/s10620-013-2708-8. PMID: 23695872.


18. Park SM, Ham JH, Kim BW, et al. 2015; Feasibility of endoscopic resection for sessile nonampullary duodenal tumors: a multicenter retrospective study. Gastroenterol Res Pract. 2015:692492. DOI: 10.1155/2015/692492. PMID: 25810715. PMCID: PMC4355118.

19. Seo JY, Hong SJ, Han JP, et al. 2014; Usefulness and safety of endoscopic treatment for nonampullary duodenal adenoma and adenocarcinoma. J Gastroenterol Hepatol. 29:1692–1698. DOI: 10.1111/jgh.12601. PMID: 24720570.


20. Sohn JW, Jeon SW, Cho CM, et al. 2010; Endoscopic resection of duodenal neoplasms: a single-center study. Surg Endosc. 24:3195–3200. DOI: 10.1007/s00464-010-1114-y. PMID: 20490557.


21. Maruoka D, Matsumura T, Kasamatsu S, et al. 2017; Cold polypectomy for duodenal adenomas: a prospective clinical trial. Endoscopy. 49:776–783. DOI: 10.1055/s-0043-107028. PMID: 28493238.

22. Hamada K, Takeuchi Y, Ishikawa H, et al. 2016; Feasibility of cold snare polypectomy for multiple duodenal adenomas in patients with familial adenomatous polyposis: a pilot study. Dig Dis Sci. 61:2755–2759. DOI: 10.1007/s10620-016-4165-7. PMID: 27126203.


23. Binmoeller KF, Shah JN, Bhat YM, Kane SD. 2013; "Underwater" EMR of sporadic laterally spreading nonampullary duodenal adenomas (with video). Gastrointest Endosc. 78:496–502. DOI: 10.1016/j.gie.2013.03.1330. PMID: 23642790.


24. Iwagami H, Takeuchi Y, Yamasaki Y, et al. 2020; Feasibility of underwater endoscopic mucosal resection and management of residues for superficial non-ampullary duodenal epithelial neoplasms. Dig Endosc. 32:565–573. DOI: 10.1111/den.13541. PMID: 31550394.


25. Kiguchi Y, Kato M, Nakayama A, et al. 2020; Feasibility study comparing underwater endoscopic mucosal resection and conventional endoscopic mucosal resection for superficial non-ampullary duodenal epithelial tumor < 20 mm. Dig Endosc. 32:753–760. DOI: 10.1111/den.13524. PMID: 31498932.

26. Shibukawa G, Irisawa A, Sato A, et al. 2018; Endoscopic mucosal resection performed underwater for nonampullary duodenal epithelial tumor: evaluation of feasibility and safety. Gastroenterol Res Pract. 2018:7490961. DOI: 10.1155/2018/7490961. PMID: 30158967. PMCID: PMC6109562.

27. Yamasaki Y, Uedo N, Takeuchi Y, et al. 2018; Underwater endoscopic mucosal resection for superficial nonampullary duodenal adenomas. Endoscopy. 50:154–158. DOI: 10.1055/s-0043-119214.


28. Bhogal N, Mohan B, Chandan S, et al. 2020; Efficacy and safety of underwater endoscopic mucosal resection for superficial non-ampullary duodenal epithelial tumors: a systematic review and meta-analysis. Ann Gastroenterol. 33:379–384. DOI: 10.20524/aog.2020.0504. PMCID: PMC7315707.


29. Hoteya S, Furuhata T, Takahito T, et al. 2017; Endoscopic submucosal dissection and endoscopic mucosal resection for non-ampullary superficial duodenal tumor. Digestion. 95:36–42. DOI: 10.1159/000452363. PMID: 28052275.


30. Jung JH, Choi KD, Ahn JY, et al. 2013; Endoscopic submucosal dissection for sessile, nonampullary duodenal adenomas. Endoscopy. 45:133–135. DOI: 10.1055/s-0032-1326178. PMID: 23364841.


31. Matsumoto S, Miyatani H, Yoshida Y. 2013; Endoscopic submucosal dissection for duodenal tumors: a single-center experience. Endoscopy. 45:136–137. DOI: 10.1055/s-0032-1310123. PMID: 22930172.


32. Yahagi N, Kato M, Ochiai Y, et al. 2018; Outcomes of endoscopic resection for superficial duodenal epithelial neoplasia. Gastrointest Endosc. 88:676–682. DOI: 10.1016/j.gie.2018.05.002. PMID: 29753040.


33. Miura Y, Shinozaki S, Hayashi Y, Sakamoto H, Lefor AK, Yamamoto H. 2017; Duodenal endoscopic submucosal dissection is feasible using the pocket-creation method. Endoscopy. 49:8–14. DOI: 10.1055/s-0042-116315. PMID: 27875854.


34. Hoteya S, Kaise M, Iizuka T, et al. 2015; Delayed bleeding after endoscopic submucosal dissection for non-ampullary superficial duodenal neoplasias might be prevented by prophylactic endoscopic closure: analysis of risk factors. Dig Endosc. 27:323–330. DOI: 10.1111/den.12377. PMID: 25186455.


35. Takimoto K, Imai Y, Matsuyama K. 2014; Endoscopic tissue shielding method with polyglycolic acid sheets and fibrin glue to prevent delayed perforation after duodenal endoscopic submucosal dissection. Dig Endosc. 26 Suppl 2:46–49. DOI: 10.1111/den.12280. PMID: 24750148.


36. Akimoto T, Goto O, Nishizawa T, Yahagi N. 2017; Endoscopic closure after intraluminal surgery. Dig Endosc. 29:547–558. DOI: 10.1111/den.12839. PMID: 28181699.


37. Nishizawa T, Akimoto T, Uraoka T, et al. 2018; Endoscopic string clip suturing method: a prospective pilot study (with video). Gastrointest Endosc. 87:1074–1078. DOI: 10.1016/j.gie.2017.11.007. PMID: 29154910.

38. Yahagi N, Nishizawa T, Akimoto T, Ochiai Y, Goto O. 2016; New endoscopic suturing method: string clip suturing method. Gastrointest Endosc. 84:1064–1065. DOI: 10.1016/j.gie.2016.05.054. PMID: 27327846.


39. Kato M, Ochiai Y, Fukuhara S, et al. 2019; Clinical impact of closure of the mucosal defect after duodenal endoscopic submucosal dissection. Gastrointest Endosc. 89:87–93. DOI: 10.1016/j.gie.2018.07.026. PMID: 30055156.


40. Tashima T, Ohata K, Sakai E, et al. 2018; Efficacy of an over-the-scope clip for preventing adverse events after duodenal endoscopic submucosal dissection: a prospective interventional study. Endoscopy. 50:487–496. DOI: 10.1055/s-0044-102255. PMID: 29499578.


Fig. 2
Suggested treatment strategy for superficial nonampullary duodenal tumors. SNADET, superficial nonampullary duodenal epithelial tumor; EMR, endoscopic mucosal resection; CSP, cold snare polypectomy; UEMR, underwater endoscopic mucosal resection; ESD, endoscopic submucosal dissection.
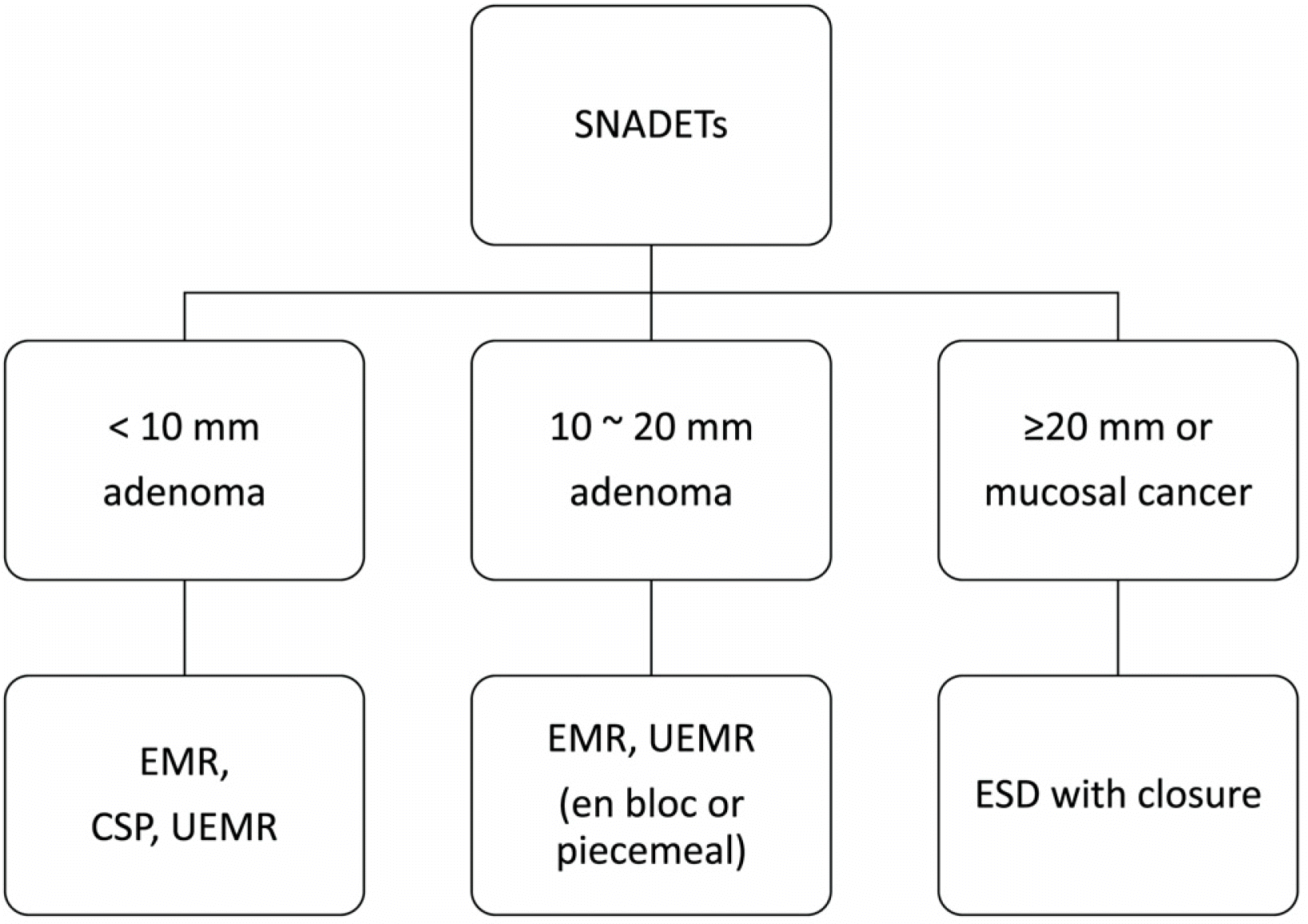
Table 1
Endoscopic Treatment Methods for Superficial Nonampullary Duodenal Tumors




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download