Abstract
Purpose
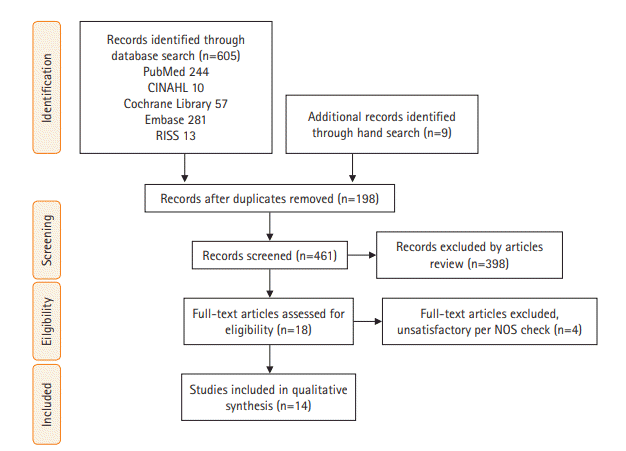
Methods
Results
Conclusion
Notes
Authors’ contributions
Conceptualization and Formal analysis: Chae J, Kim HK; Funding acquisition: Kim HK; Writing–original draft: Kim HK; Writing–review & editing: Chae J, Kim HK.
References
Table 1.
| Reference | First author | Publication year | Selection | Comparability | Outcome | Quality† |
|---|---|---|---|---|---|---|
| [21] | Hong | 2014 | **** | ** | *** | Good |
| [22] | Vafeiadi | 2014 | ***** | ** | *** | Good |
| [23] | Jiang | 2015 | ** | ** | **** | Fair |
| [24] | Aker | 2016 | *** | ** | *** | Good |
| [25] | Jusko | 2016 | *** | ** | *** | Good |
| [26] | Bougas | 2018 | **** | ** | *** | Good |
| [27] | Fioravanti | 2018 | *** | ** | *** | Good |
| [28] | Haug | 2018 | *** | * | ** | Good |
| [29] | Impinen | 2018 | ***** | ** | *** | Good |
| [30] | Kampouri | 2018 | *** | ** | *** | Good |
| [31] | Clemente | 2019 | *** | * | ** | Good |
| [32] | Madhloum | 2019 | ** | ** | *** | Fair |
| [33] | Philippat | 2019 | ** | * | *** | Fair |
| [34] | Shah | 2020 | **** | * | *** | Good |
† Good quality: 3 or 4 stars in the selection domain AND 1 or 2 stars in the comparability domain AND 2 or 3 stars in the outcome/exposure domain; fair quality: 2 stars in the selection domain AND 1 or 2 stars in the comparability domain AND 2 or 3 stars in the outcome/exposure domain; poor quality: 0 or 1 star in the selection domain OR 0 stars in the comparability domain OR 0 or 1 stars in the outcome/exposure domain.
Table 2.
| Reference | First author | Selected | Country | Title of cohort | Study design | Participant | Recruit/analysis (n) | Maternal exposure | Maternal or infantile outcome | Follow-up |
|---|---|---|---|---|---|---|---|---|---|---|
| [21] | Hong | 2014 | Republic of Korea | MOCEH | Prospective cohort | Mother-child pairs | 1,475/1,150 | Heavy metal | Physical development | At 6, 12, and 24 months |
| [22] | Vafeiadi | 2014 | Europe (5 countries)† | NewGeneris | Prospective cohort | Mother-child pairs | 967/269 | Chemicals | Gestational age and weight | At birth |
| [23] | Jiang | 2015 | China | Lanzhou cohort | Prospective cohort | Mother-child pairs | 14,359/10,542 | Cooking fuel | Birth weight | At birth |
| [24] | Aker | 2016 | Puerto Rico | PROTECT | Prospective cohort | Pregnant women | 179/106 | Chemicals | Hormonal level | At 16–20 and 24–28 weeks of gestation |
| [25] | Jusko | 2016 | United States | PCB | Prospective cohort | Mother-child pairs | 1,134/973 | Chemicals | Antibody level | At 6 month |
| [26] | Bougas | 2018 | France | PARIS | Prospective cohort | Mother-child pairs | 3,840/788 | Air pollution | Lung function | At 8–9 years |
| [27] | Fioravanti | 2018 | Italy | GASPII | Prospective cohort | Mother-child pairs | 719/581 | Air pollution | Obesity | At 4 and 8 years |
| [28] | Haug | 2018 | Europe (6 countries)‡ | HELIX | Prospective cohort | Mother-child pairs | 31,472/1,301 | Chemicals and heavy metals | Chemicals and heavy metals | Between 6 and 12 years |
| [29] | Impinen | 2018 | Norway | ECA | Prospective cohort | Mother-child pairs | 3,754/641 | Chemicals | Immunosuppression | At 2 and 10 years |
| [30] | Kampouri | 2018 | Greece | RHEA | Prospective cohort | Mother-child pairs | 1,363/849 | Smoking and feeding | Cognitive behavior | At 4 year |
| [31] | Clemente | 2019 | Europe (6 countries)‡ | HELIX | Prospective cohort | Mother-child pairs | 31,472/1,396 | Air pollution | Cell aging | At 1 year |
| [32] | Madhloum | 2019 | Belgium | ENVIRONAGE | Prospective cohort | Mother-child pairs | 762/427 | Air pollution | Blood pressure | At birth |
| [33] | Philippat | 2019 | France | EDEN | Prospective cohort | Mother-son pairs | 998/473 | Chemicals | Physical development | At birth |
| [34] | Shah | 2020 | Republic of Korea | MOCEH | Prospective cohort | Mother-child pairs | 1,751/442 | Heavy metals and air pollution | Physical, neurologic, and behavioral development | At birth, 6 month, 1, 2, 3, 4, 5, and 6 years |
ECA: Environment and Children Asthma; EDEN: Etude des Déterminants pré et postnatals du développement et de la santé de l’Enfant; ENVIRONAGE: ENVIRonmental influence ON early AGEing; GASPII: Gene and Environment Prospective Study in Infancy in Italy; NewGeneris: Newborns and Genotoxic exposure risks; HELIX: Human Early Life Exposome; MOCEH: Mothers and Children’s Environmental Health Study; PARIS: Pollution and Asthma Risk; PCB: polychlorinated biphenyls; PROTECT: Puerto Rico Test for Exploring Contamination Threats.
Table 3.
| Reference | First author | Selected | Pollutant | Outcome measure | Conclusion |
|---|---|---|---|---|---|
| [21] | Hong | 2014 | Lead | Infants’ weight and height | Lead exposure was associated with low infantile weight and height. |
| [22] | Vafeiadi | 2014 | Dioxin-like plasma activity | Birth weight and gestational age | Dioxin exposure was associated with low birth weight and short gestational age. |
| [23] | Jiang | 2015 | Coal, biomass, and electromagnetic stove | Birth weight | Using coal and biomass as cooking fuel were associated with low birth weight. |
| [24] | Aker | 2016 | BPA, BP-3, 2,4-DCP, 2,5-DCP, TCS, MPB, BPB, and PPB | Estradiol, progesterone, estradiol/progesterone, SHBG, TSH, FT3, and FT4 | Phenol exposure was associated with decrease of progesterone. Paraben exposure was associated with increase of SHBG and decrease of estrogen and progesterone. |
| [25] | Jusko | 2016 | PCB-153 and DDE | BCG-immunoglobulin G and A | PCB and DDE exposure was associated with low BCG-immunoglobulin G and A. |
| [26] | Bougas | 2018 | NO2 | Pulmonary function test index | NO2 exposure was associated with low forced vital capacity (FVC). |
| [27] | Fioravanti | 2018 | NO2, NOx, PM10, and PM2.5 | Weight, height, waist, hip circumference, body mass index, and high-density lipoprotein | NO2, NOx, PM10, and PM2.5 exposure was not associated with weight, height, waist, hip circumference, BMI, and HDL. |
| [28] | Haug | 2018 | 40 chemicals and heavy metals | 40 chemicals and heavy metals | For persistent compounds and heavy metals correlations between maternal exposure and child outcomes were moderately high. |
| [29] | Impinen | 2018 | PFAS (PFUnDA, PTOS, PFOA, PFOSA, and PFNA) | Atopic dermatitis, pulmonary function, rhinitis, asthma, obstructive airway disease, allergy, and respiratory infection | PFAS exposure was associated with high atopic dermatitis, rhinitis, asthma, allergy, respiratory tract infections, and reduce pulmonary function. |
| [30] | Kampouri | 2018 | Television watching, smoking, and breast feeding | Attention deficit hyperactivity disorder test | No smoking and breastfeeding were associated with low attention deficit hyperactivity disorder score. |
| [31] | Clemente | 2019 | NO2 and PM2.5 | Leukocyte telomere length | NO2 and PM2.5exposure was associated with short telomere length. |
| [32] | Madhloum | 2019 | NO2, black carbon, PM10, and PM2.5 | Systolic and diastolic blood pressure | Air pollution was associated with high systolic and diastolic blood pressure. |
| [33] | Philippat | 2019 | Phthalate and phenol in urine | Ratio of placenta and birth weight | Phthalate exposure was associated with low placental weight and placental-to-birth weight ratio. |
| [34] | Shah | 2020 | Lead, mercury, manganese, cadmium, and PM | Head circumference, weight, mental and physical development index, behavioral problems, intelligent quotation, autistic behavior, and atopic dermatitis | Heavy metal and air pollutant exposure was associated with low birth weight, low cognition, high atopic dermatitis, and high behavioral problems. |
BPA; bisphenol A; BPB; bisphenol B; BPF: bisphenol-F; BP-3; benzophenone-3; 2,4-DCP: 2,4-dichlorophenol; 2,5-DCP: 2,5-dichlorophenol; DDE: 1,1-dichloro-2,2-bis (p-chlorophenyl) ethylene; FT3: free triiodothyronine; FT4: free thyroxine; MPB: methylparaben; NO2: nitrogen dioxide; NOx: nitrogen oxides; PCB: polychlorinated biphenyls; PFAS: perfluoralkyl substance; PFOA: perfluorooctanoic acid; PFNA: perfluorononanoic acid; PFOS: perfluorooctane sulfonic acid; PFOSA: perfluorooctanesulfonamide, PFUnDA: perfluoroundecanoic acid; PM: particulate matter; PPB: propylparaben; SHBG: sex-hormone-binding globulin; TCS: triclosan; T4: total thyroxine; TSH: thyroid-stimulating hormone.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download