초록
배경
위험관리는 최선의 의료서비스를 제공하기 위한 질 관리 노력의 하나인데 국내 검사실에서는 아직 생소한 개념이다. 우수검사실 신임인증에 새롭게 도입된 위험관리의 개념을 국내 검사실에서 쉽게 이해하고 효율적으로 적용할 수 있도록 다양한 위험관리 기법을 활용하여 한국형 위험관리 사례를 개발하고자 하였다.
방법
한국 임상검사실 위험관리의 적절한 범위를 제안하기 위하여 가이드라인 및 참고자료를 검토하였다. 위험관리 관련 논문이나 가이드라인에서 예시로 사용한 도구를 중심으로 임상검사실에 적합하고 사용하기 용이한 몇 가지 도구를 골라 이용하기로 하였다. 연구진이 일하고 있는 각 검사실에서의 실제 사례를 위험관리 범주 별로 분류한 후 위험관리 예시를 개발하였다.
Abstract
Background
Risk management is one of the quality management efforts to provide the best medical services, but the concept is still unfamiliar to clinical laboratories in Korea. Risk management-related checklists have been introduced in the certification of good laboratory practice. In this study, we have tried to develop risk management examples using various tools, for easy understanding and efficient application of risk management in clinical laboratories.
Methods
Reference materials were reviewed to suggest the appropriate scope of risk management for Korean clinical laboratories. Several tools that are suitable for and easy to use in the clinical laboratory were chosen, based on the tools used as examples in the references. Examples of risk management have been developed for each risk management category.
Results
The scope of risk management in the clinical laboratory has been expanded to include the operation of the laboratory, not just the testing processes. Risk management categories were divided into laboratory operations (strategies, finance, and operation) and test processes (preanalytic, analytic, and postanalytic). Risk management cases were selected to include various risk management categories. Scenario analysis, failure mode and effects analysis (FMEA), failure reporting, analysis, and corrective action system (FRACAS), root cause analysis, and fishbone diagram tools were used.
위험(risk)이란 불확실성이 목표에 미치는 영향으로 정의되며, 기댓값에 대한 편차로 표현되기도 한다[1]. 위험관리(risk management)란 위험과 관련하여 조직을 이끌고 통제하기 위한 총체적 활동으로 정의되며, 가치를 창출하거나 보호하는 것에 목적을 둔다[1]. 조직은 위험관리를 통해 전략을 수립하고, 목표를 달성하고, 정보에 입각한 의사결정을 내림으로써, 성과를 개선하고 혁신을 장려한다[1]. 위험관리는 금융, 제조, 운송, 서비스 분야에서는 이미 오래 전부터 사용하고 있었지만, 의료분야 특히 임상검사실에는 2000년 이후에 도입되었다. 위험관리의 개념이 의료분야 및 임상검사실에까지 확대된 것은 의료기술이 발달하고 복잡해짐에 따라 세계 어느 곳이든 동일하고 최대로 향상된 의료서비스를 제공하기 위한 품질 관리 노력의 하나라 할 수 있다.
위험관리 과정은 위험관리 활동 범위와 상황 정립 후 위험을 사정(査定, assessment)하고 처리한 후 이를 관찰 및 검토, 기록 및 보고, 소통 및 협의하는 단계로 이루어진다[1]. 위험 사정은 무엇이 위험인지 찾는 위험 식별(identification), 위험의 속성을 이해하고 정량하는 위험 분석(analysis), 그리고 위험이 허용범위 이내인지 또는 조치가 필요한지 판단하는 위험 평가(evaluation)로 이루어진다[1]. 위험관리 과정 수행을 위해 다양한 도구들이 이미 소개되어 있다[2]. 조직의 모든 구성원이 위험관리에 책임이 있지만, 위험관리를 조직운영에 통합하고 위험관리체계를 구축하는 데는 최고경영자의 역할이 특히 중요하다[1]. 조직의 의사결정의 중요성에 맞춰 규모를 조정하고, 시간 및 기타 자원의 제약과 기회비용을 고려하여 도구를 선택한다[2].
진단검사의학재단에서는 국제인증프로그램 수행기관인 International Society for Quality in Health Care (ISQua) [3]의 요구를 충족하기 위해 위험관리 관련 문항을 우수검사실 신임인증 검사실운영 분야 심사점검표에 신설하여 시범 운영하고 있다[4]. 또한 3주기 급성기병원 인증조사 표준지침서[5]에서도 위험관리 개념을 도입하였다(Supplementary 1, 2, 3). 그러나 위험관리는 국내 진단검사의학 검사실에 아직 생소한 개념이어서 많은 검사실들이 인증 준비에 어려움을 겪고 있다. 각 검사실에서 비슷한 활동은 하고 있으나 체계적으로 시행되지 않는 문제점도 있다. 이에 저자들은 국내 검사실이 위험관리에 기반한 검사실 품질관리를 손쉽게 접근할 수 있도록 다양한 상황에서의 한국형 위험관리 사례를 개발하고자 하였다. 또한 독자의 이해를 돕기 위하여 검사실 위험관리에 대한 개념과 범위, 그리고 사용 가능한 도구에 대해서도 부연 설명하고자 한다. 위험관리 도구를 잘 이해하고 적절하고 연속적으로 사용하면 인증 준비뿐 아니라 실제 검사실의 질향상을 도모할 수 있을 것이다.
한국 임상검사실 위험관리의 적절한 범위를 제안하기 위하여 다음과 같은 가이드라인 및 참고자료를 검토하였다: 1) ISQua Gui-delines and Principles for the Development of Health and Social Care Standards, 5th Edition, 2018 [3]; 2) 3주기 급성기병원 인증조사 표준지침서[5]; 3) IFCC WG LEPS (Working Group, Laboratory Error and Patient Safety) [6]; 4) CLSI guidelines EP23 Laboratory Quality Control Based on Risk Management, 1st Edition [7]
다양한 상황에서의 위험관리 사례를 개발하기 위하여 위험관리 범주를 나누었다. 또한 여러 가지의 위험관리 도구[2, 8]를 검토한 후 위험관리 관련 논문이나 가이드라인에서 예시로 사용한 도구를 중심으로 임상검사실에 적합하고 사용하기 용이한 도구를 골라 예시로 사용하기로 하였다. 연구진이 일하고 있는 각 검사실(가천대 길병원, 강동경희대학교병원, 아주대학교병원, 인제대학교 일산백병원)에서의 실제 사례를 위험관리 범주 별로 분류한 후 위험관리 예시를 개발하였다. 약 6개월(2019. 5-10)간의 기간 동안 각 기관별로 2-3개의 사례를 발굴하고 적절한 위험관리 도구를 적용하여 분석하였다.
임상검사실의 위험관리 영역은 검사과정과 결과 관리뿐 아니라 검사실 전반의 조직운영, 전략, 재정, 고객서비스, 사건사고, 인력, 시설안전, 정보, 구매재고, 문서, 내외부평가 관리에 이르기까지 광범위하다. 따라서 검사실의 모든 행정 및 검사업무를 할 때는 “위험-기반 사고(risk-based thinking)”를 바탕으로 한 품질경영시스템을 구축하는 것이 중요하다[9]. 검사실 전반의 질 향상을 위해서 한국 임상검사실 위험관리 범위를 검사과정 및 결과에만 국한하지 않고 검사실 운영에까지 확대하는 것이 필요하다. 이에 저자들은 위험관리 범주를 검사실운영(전략, 재정, 운영) 및 검사업무(검사전, 검사중, 검사후)로 나누었다.
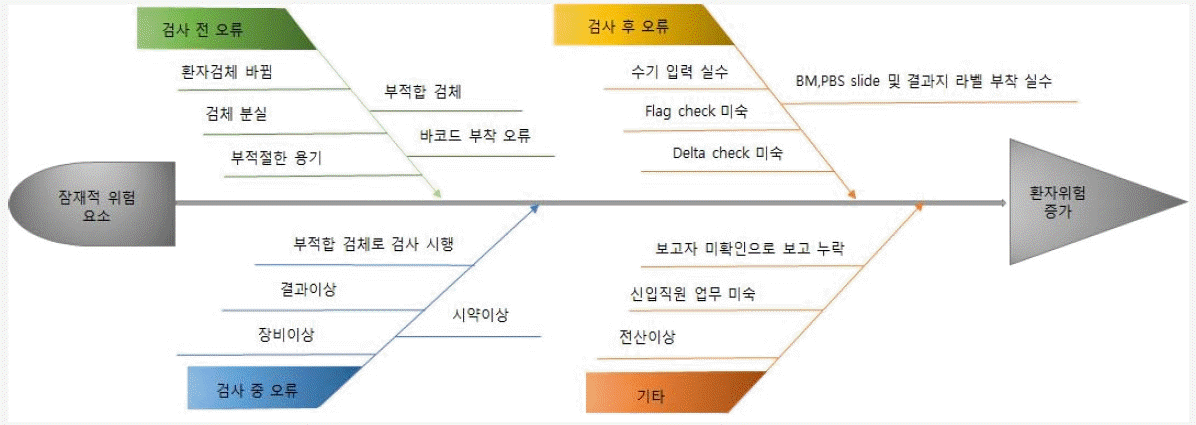
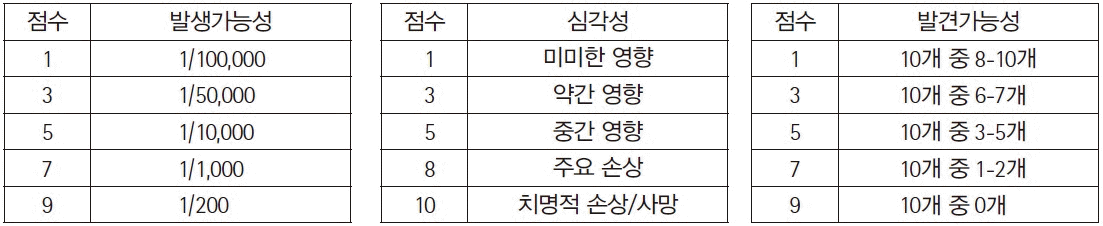
연구에 참여한 각 검사실에서 개발한 위험관리 사례 중 연구자 회의를 통해 다양한 범주가 포함되도록 5개의 사례를 선정하였다(Tables 1-5). 사례 1은 검사실운영 중 전략 범주에 해당하는 위험관리 예시이며, 사례 2는 검사실운영 중 재정 범주, 사례 3은 검사업무 중 검사전단계, 사례 4는 검사업무 중 검사중단계, 사례 5는 검사업무 중 검사전, 중, 후 전체단계에 해당하는 위험관리 예시이다. 시나리오분석, 오류유형 및 영향분석(failure mode and effects analysis, FMEA), 오류보고 및 시정조치 시스템(failure reporting, analysis, and corrective action system, FRACAS), 근본원인분석법(root cause analysis), 물고기뼈 도해(fishbone diagram) 등 다양한 도구가 사용되었다.
진단검사의학재단에서는 위험관리 관련 문항을 우수검사실 신임인증 검사실운영 분야 심사점검표에 2017년에 신설하여 2020년 현재까지 권장문항으로 운영하고 있다. 위험관리 개념에 생소한 검사실에서 해당 문항에 따른 준비를 할 때 참고할 수 있도록 본 연구에서는 임상검사실의 위험관리 범위와 한국형 위험관리 예시를 개발하고 각 단계별 예시를 논문의 결과로 실었다. 추가적인 위험분석 사례는 진단검사의학재단 홈페이지에 내용이 공개되어 있다.
과거에는 검사과정 중에 생기는 오류를 줄이는 측정시스템의 안정성에 검사실 품질관리의 초점을 맞추어 왔다. 주로 정도관리 검체를 이용한 통계적 정도관리 도구가 많이 사용되었다. 최근에는 잘못된 검사결과로 인해 환자가 위해를 받을 수 있는 모든 것을 검사실 품질관리에서 다루고 있다. 따라서 검사 전, 중, 후 과정에서 발생할 수 있는 모든 검사관련 오류가 관리 대상에 포함되었다. 또한 이미 벌어진 위험상황에 대한 조치뿐 아니라 앞으로 일어날 수 있는 위험까지 관리하는 사전행동적(proactive) 위험관리까지 필요하다. 또한 임상검사실의 지속 및 발전을 위해 경영 자체에 대한 위험관리도 필요하다. 여기에는 검사실 전반의 조직운영, 전략, 재정, 고객서비스, 사건사고, 인력, 시설안전, 정보, 구매재고, 문서, 내외부평가 관리에 이르기까지 광범위하다[1]. 이 영역의 위험관리에 대해서는 구체적인 가이드라인은 없으나 ISO31000 [1]의 원칙을 기반으로 금융, 제조와 같은 다른 분야의 기업에서 하는 일반적인 위험관리 방식을 따르면 되리라 생각한다.
위험관리는 원칙(principle), 체계(framework), 과정(process)으로 구성된다. 위험관리 원칙은 위험관리의 의도와 목적을 분명히 나타낼 수 있도록 한다[1]. 위험관리 체계는 위험관리가 조직의 주요활동과 기능에 통합되게 하는 것을 목표로 하며 위험관리 원칙을 고려하여 정한다[1]. 위험관리 과정은 위험관리 활동 범위와 상황 정립 후 위험을 사정하고 처리한 후 이를 관찰 및 검토, 기록 및 보고, 소통 및 협의하는 단계로 이루어진다[1]. 위험관리 과정은 다양한 도구를 이용하여 수행할 수 있다. 효과적이고 효율적인 위험관리를 위해서는 조직 내에 구성요소를 수립하고 조정 및 개선해야 한다[1]. 위험관리의 효과는 최고경영진의 의사결정에 위험관리가 녹아 들었는지에 따라 좌우된다[1]. 따라서 ISO 9001:2015 [10]에서는 기관이 위험-기반 사고 개념을 이해하고 계획의 기반으로 사용할 것을 요구한다. 이는 질관리시스템 과정을 계획, 도입할 때 위험-기반 사고를 적용해야 함을 의미하며, 문서화된 정보의 범위를 결정하는 데 도움이 될 것이다. 위험-기반 사고를 도입함으로써 이전 판에 비해 규범적인 요구사항이 줄고 성과-기반 요구사항이 증가하였다[10]. 검사실의 모든 행정 및 검사업무를 할 때는 “위험-기반 사고”를 바탕으로 한 품질경영시스템을 구축하는 것이 중요하다.
기관이 위험관리 계획을 해야 하지만 위험관리 과정 및 문서화의 구체적인 방법은 정해져 있지 않으며, 자유롭게 선택할 수 있다[10]. 수십 가지의 위험사정 도구 중 의사결정의 중요성에 맞춰 규모를 조정하고, 시간 및 기타 자원의 제약과 기회비용을 고려하여 기법을 선택한다[10]. 이해관계자가 선호하는 산출물의 형태 및 데이터의 가용성과 신뢰성을 기준으로 정성 또는 정량기법을 선택한다[10]. 본 연구에서는 여러 위험분석 도구 중에서 임상검사실에서 쉽고 유용하게 이용할 수 있는 시나리오분석, 근본원인분석법, FMEA, FRACAS, 물고기뼈 도해를 예시로 활용하였다.
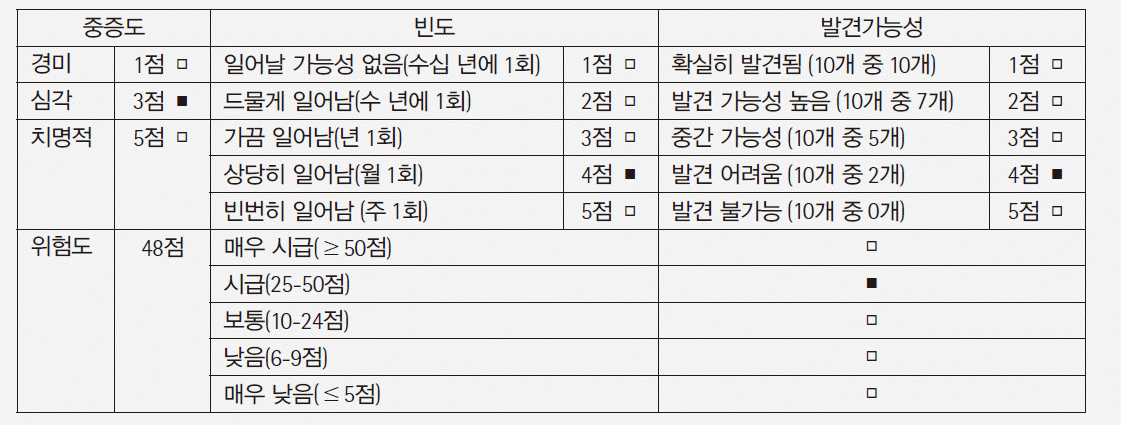
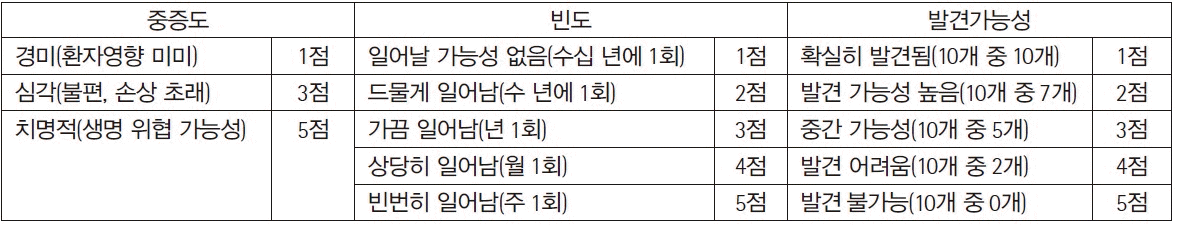
시나리오분석은 각 시나리오 상황을 가정하고 그 상황에서 생길 수 있는 일들을 상상하거나 현재에 대입해보아 확인한다. 공식적으로 또는 비공식적으로, 질적으로 또는 양적으로 분석을 시행할 수 있다[2]. 근본원인분석법은 적절한 해결책을 찾기 위해, 표면적 현상 보다는 문제의 근본 원인을 찾기 위해 노력하는 것이다. 대개는 여러 가지 표면적 원인도 하나의 근본원인으로부터 기인한 것이 많다[2]. FMEA는 앞으로 벌어질 수도 있는 오류가 시스템 또는 과정에 어떤 영향을 끼치는지 체계적으로 검토하여 잠재적 오류유형을 확인하고, 각 오류의 영향을 측정하여, 이를 방지하고 감지하기 위한 제어조치를 정하는 것이다. 여기에 위험도 추산을 포함하는 경우 ‘오류유형, 영향 및 위험도 분석(Failure Mode, Effects, and Criticality Analysis, FMECA)’라고 부르기도 한다[2]. FRACAS는 이미 일어난 오류를 확인 및 분석하여 시정조치를 도입하는 프로세스이다. FMEA나 FRACAS는 상향식(bottoms-up) 분석으로 간주된다[2]. 물고기뼈 도해는 원인을 주요 범주로 구분하여 물고기 등뼈처럼 표시한다. 범주마다 구체적인 원인을 설명하는 가지와 하위 가지를 그릴 수 있다[2].
본 연구에서 예시로 사용하지는 않았으나 유용한 위험분석 도구에는 결함나무 분석(fault tree analysis, FTA)과 원인-효과 분석(cause-effect analysis)이 있다. FTA는 잠재적 오류를 확인하기 위해 시스템이나 기기를 체계적으로 검토하여 주요 시스템 오류를 가정하고 무엇이 오류를 일으켰는지 확인하는 방법이다. FTA는 “하향식(top-down)”분석으로 간주되며 오류 사건과 사용자 오류가 조합된 경우를 분석하는 데 있어 FMEA보다 더 효율적이다. 복잡한 시스템에 대한 포괄적인 하향식 및 상향식 위험도 분석을 위해 FTA와 FMEA를 함께 사용할 수도 있다[2]. 원인-효과 분석에서 원인과 결과 다이어그램은 일반적으로 정성적으로 사용된다. 문제의 발생 확률을 1로 가정하고 그 관련성에 대한 믿음의 정도에 근거하여 일반적인 원인에 대한 확률을 부여한 후 하위 원인에 대한 확률을 부여한다[2].
본 논문에서는 우수검사실 인증문항에 새롭게 도입된 위험관리의 개념을 검사실에서 쉽게 접근할 수 있도록 임상검사실의 위험관리 범위와 예시를 제시하였다. 이 연구 결과가 우수검사실 신임인증 및 의료기관인증평가를 준비하는 검사실에 실무적인 도움이 되고, 보다 체계적인 위험관리를 통해 각 검사실의 검사 전반에 걸친 질 향상을 가져올 것으로 기대한다.
REFERENCES
1. The International Organization for Standardization. 2018. Risk management - Guidelines, ISO 31000:2018. International Standard Organization;Geneva, Switzerland:
2. The International Organization for Standardization. 2019. Risk management - Risk assessment techniques. International Standard Organization;Geneva, Switzerland:
3. The International Society for Quality in Health Care. Guidelines and principles for the development of health and social care standards. 5th ed. https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEwi0547pqcbuAhVEIIgKHe5lCOcQFjACegQIAhAC&url=https%3A%2F%2Flogin.isqua.org%2Fnavless%2Fresources%2Fresource%2F820&usg=AOvVaw3iHythiCEYB9PwoeRM8oay. Updated on Sep 2018.
4. Korean Society for Laboratory Medicine/Laboratory Medicine Foundation. 2019. Accreditation checklist - Laboratory Medicine General. Korean Society for Laboratory Medicine/Laboratory Medicine Foundation;Seoul:
5. Korea Institute for Healthcare Accreditation. 2019. Accrediataion checklist for acute care hospitals. 3rd ed. Seoul:
6. IFCC Working Group. Laboratory Errors and Patient Safety (WG-LEPS). https://www.ifcc.org/ifcc-education-division/working-groups-special-projects/laboratory-errors-and-patient-safety-wg-leps/. Last accessed on Feb 2021.
7. Clinical and Laboratory Standard Institute. 2011. Laboratory quality control based on risk management; Approved guideline. CLSI document EP23-ATM. Clinical and Laboratory Standards Institute;Wayne, PA:
8. Clinical and Laboratory Standard Institute. 2009. Risk management techni-ques to identify and control laboratory error sources; Approved guideline-Second Edition. CLSI guideline EP18-A2. Clinical and Laboratory Standards Institute;Wayne, PA:
9. The International Organization for Standardization. 2018. Occupational health and safety management systems - Requirements with guidance for use. ISO 45001:2018. International Standard Organization;Geneva, Switzerland:
10. The International Organization for Standardization. 2015. Quality management systems - Requirements. ISO 9001:2015. International Standard Organization;Geneva, Switzerland:
Table 1
Example 1 of risk management in clinical laboratory
Table 2
Example 2 of risk management in clinical laboratory
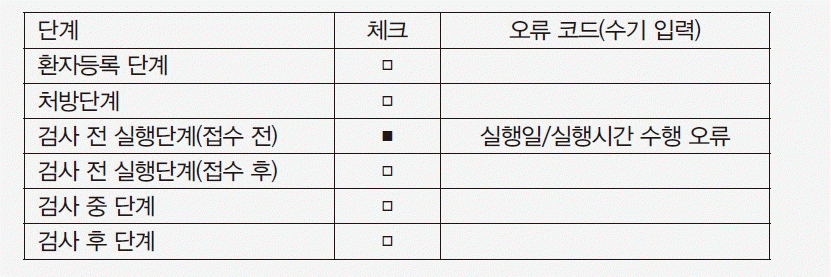
Table 3
Example 3 of risk management in clinical laboratoryAbbreviation: FRACAS, Failure reporting, analysis, and corrective action system.
Table 4
Example 4 of risk management in clinical laboratory
Table 5
Example 5 of risk management in clinical laboratory




 PDF
PDF Citation
Citation Print
Print



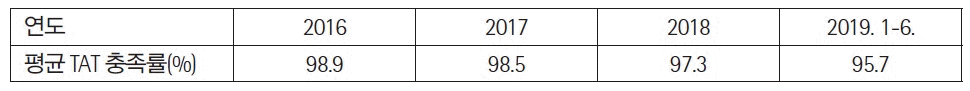


 XML Download
XML Download