초록
MN1-ETV6 유전자재배열은 급성골수성백혈병, 골수형성이상증후군을 포함한 골수구계종양(myeloid neoplasm) 환자에서 매우 드물게 검출되며 일반적으로 진단 당시에 검출된다. 저자들은 급성골수성백혈병 진단 당시에는 정상 핵형이었으나, 항암치료 후 재발 시 MN1-ETV6 유전자재배열을 동반한 국내 첫 증례를 경험하였기에 이를 보고하고자 한다.
Abstract
MN1-ETV6 rearrangement is rarely detected in patients with myeloid neoplasms, such as acute myeloid leukemia, myelodysplastic syndrome, and myelodysplastic/myeloproliferative neoplasms. Usually, MN1-ETV6 rearrangement is found at diagnosis. Here, we report the first Korean AML patient with MN1-ETV6 gene rearrangement in a case of relapse exhibiting normal karyotype at early diagnosis.
MN1-ETV6 유전자재배열은 급성골수성백혈병(acute myeloid leukemia, AML), 골수형성이상증후군(myelodysplastic syndrome, MDS) 및 골수형성이상/골수증식종양(myelodysplastic/myeloproliferative neoplasms, MDS/MPN)을 포함한 골수구계종양(myeloid neoplasm) 환자에서 매우 드물게 검출되며[1-4], 현재까지 전세계적으로 약 30례 정도가 알려져 있으나 국내에서는 보고되지 않았다. MN1-ETV6 단독으로 검출되기도 하지만[2, 5] 주로 급성골수성백혈병의 진단 당시에 다른 염색체이상과 함께 동반되며, 임상적으로 나쁜 예후 인자와 연관되어 있다[3, 6, 7]. 저자들은 급성골수성백혈병 진단 당시에는 정상 핵형이었으나, 항암치료 후 재발 시 MN1-ETV6 유전자재배열을 동반한 국내 첫 증례를 경험하였기에 문헌고찰과 함께 보고하고자 한다.
57세 여자환자가 백혈구감소증으로 내원하였다. 환자는 과거력상 8년 전 제2형 당뇨병 진단을 받았으며, 12년 전 유두갑상샘암종(papillary thyroid cancer)으로 온갑상샘적출술(total thyroidectomy)을 받았다. 백혈구감소증은 내원 6개월 전부터 지속되었으며, 갑상선 약물을 끊은 후에도 호전을 보이지 않았다. 내원 당시 백혈구 1.41×109/L, 혈색소 12.6 g/dL, 혈소판 233×109/L이었으며, 말초혈액도말 검사상 7%의 모세포(blasts)가 관찰되었다. 이후 시행된 골수검사에서는 전체 유핵세포 중 67.4%에서 모세포가 관찰되었고, 유세포검사에서는 CD34 (87.6%), CD38 (95.0%), HLA-DR (87.9%), CD13 (74.4%), CD33 (57.5%), CD117 (72.7%), anti-MPO (positive)를 나타내어 급성골수성백혈병에 부합하였다. 골수 검체로 시행한 염색체검사에서 분석한 25개의 모든 분열중기세포에서 정상 핵형(normal karyotype)을 나타내었으며, Hemavision (Hemavision-28n, DNA diagnostic, Risskov, Denmark) 키트로 시행된 다중역전사중합효소연쇄반응(multiplex reverse-transcriptase PCR [RT-PCR]) 검사에서 28종의 유전자재배열에 대해서 모두 음성 결과를 보였다.
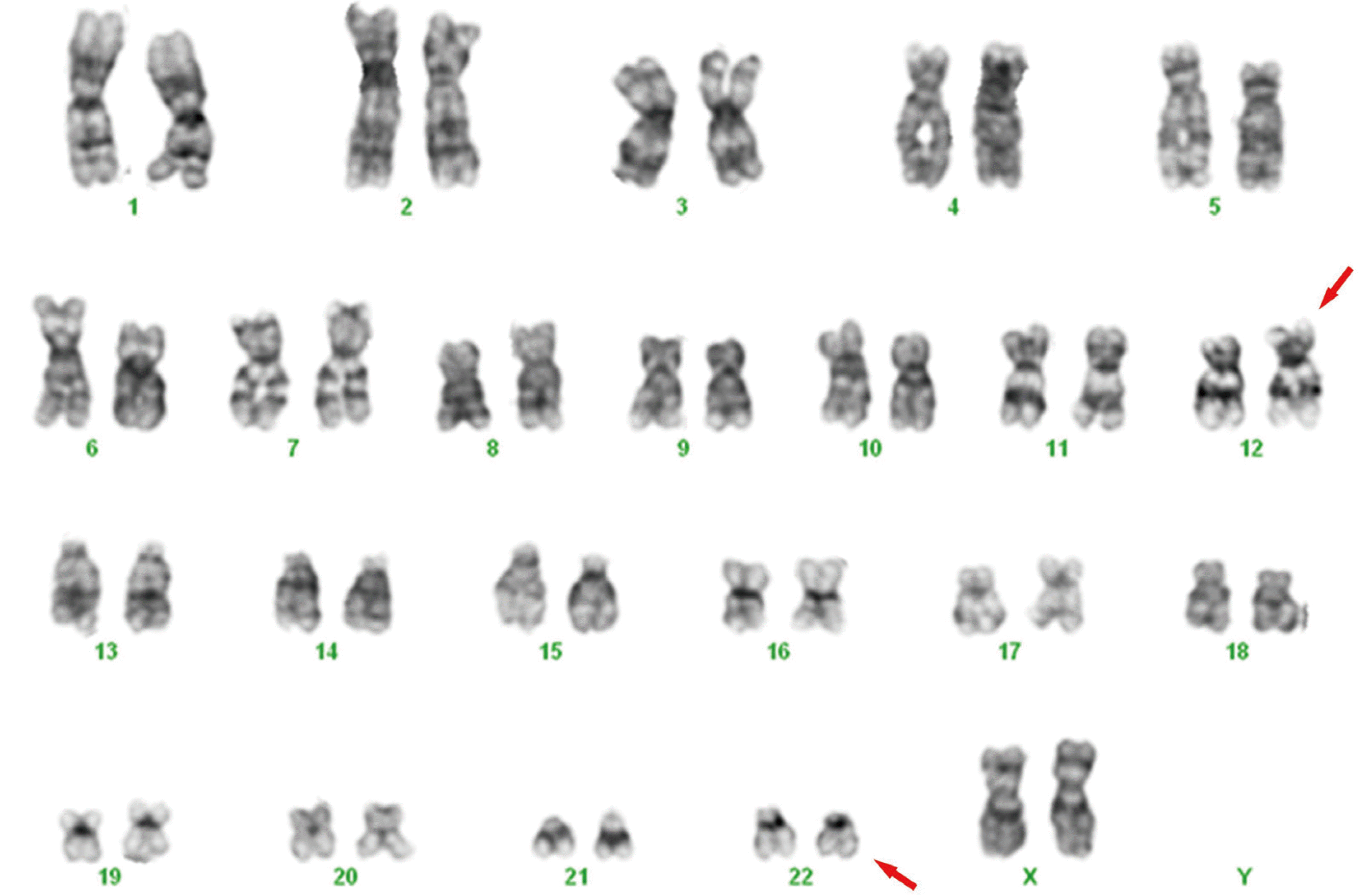
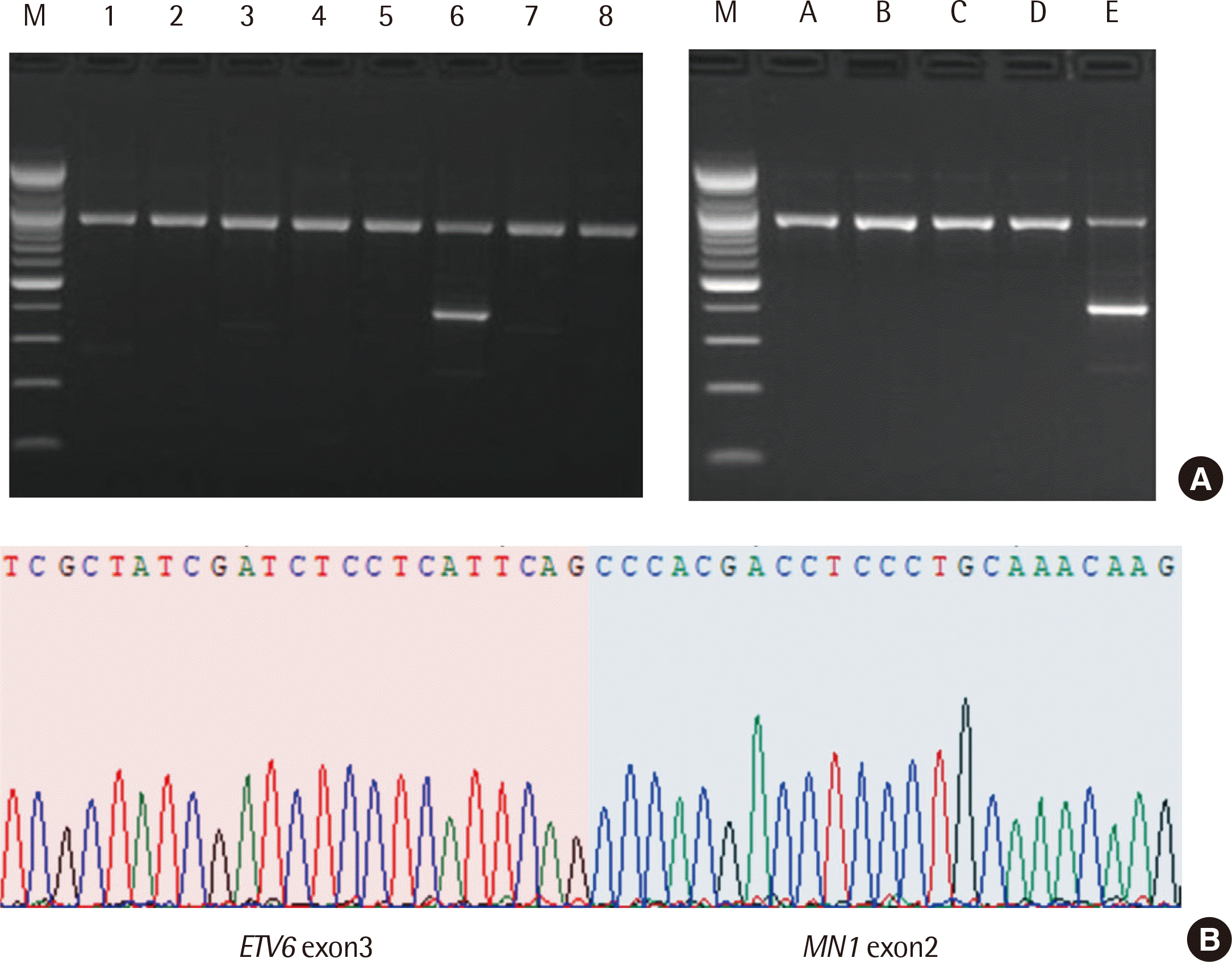
Cytarabine과 idarubicin으로 급성골수성백혈병에 대한 항암치료를 시행하였고, 5개월 뒤 추적 골수검사에서 완전 관해(complete remission) 판정을 받았으나, 다시 6개월 이후 추적 검사에서 일반혈액검사에서 백혈구 1.84×109/L, 혈색소 10.4 g/dL, 혈소판 123×109/L로 범혈구감소증 소견을 나타내었다. 말초혈액도말 검사에서 3%의 모세포가 관찰되었고, 골수검사에서는 67.0%의 모세포가 관찰되어 급성골수성백혈병의 재발이 의심되었다. 재발 당시 시행된 염색체검사에서 분석한 20개의 분열중기세포에서 46,XX,t (12;22) (p13;q12)를 나타내었고(Fig. 1), 다중역전사중합효소연쇄반응 검사에서 진단 당시 검출되지 않았던 MN1-ETV6 유전자재배열 양성 소견을 나타내었다. TA 클로닝과 염기서열분석을 통해서 MN1-ETV6 융합유전자에 대한 분석을 시행하였고, ETV6 유전자의 exon 3 (NM_001987.4)과 MN1 유전자의 exon 2 (NM_002430.3) 사이의 융합절단점(fusion breakpoint)을 확인하였다(Fig. 2). 환자는 mitoxantrone, etoposide, cytarabine의 약제로 추가적인 유도항암화학요법(induction chemotherapy)을 시행하였으나, 완전 관해를 얻지 못하였고, 이후 혈연 공여자로부터 HLA 반 일치 동종조혈모세포이식(haploidentical allogeneic hematopoietic stem cell transplantation)을 시행 받았다. 환자는 이식을 받고 5개월 후 급성골수성백혈병의 재발에서 회복되지 못하고 사망하였다.
급성골수성백혈병은 유전적으로 균일하지 않은(genetic heterogeneity) 복합적 질환군으로서 아형에 따라서 다양한 유전자재배열과 돌연변이가 검출된다[8]. 백혈병에서 동반되는 유전자재배열은 급성골수성백혈병의 진단과 치료 반응에 대한 평가 및 재발 여부 등의 판단 시 도움을 줄 수 있을 뿐만 아니라, BCR-ABL1 유전자재배열에서와 같이 tyrosine kinase inhibitor와 같은 약물의 표적 치료 타겟으로 활용되는 사례도 있다[9]. 따라서, 백혈병 진단에 동반되는 세포유전학적 및 분자유전학적 이상을 규명하는 것은 환자의 진단 및 치료와 직결될 수 있는 중요한 요소 중 하나라고 해도 과언이 아니다.
MN1-ETV6 유전자재배열은 희귀 유전자재배열의 일종으로 현재까지 전세계적으로 약 30례의 급성골수성백혈병과 골수형성이상증후군 및 골수형성이상/골수증식종양에서 보고되었다[1-3, 7]. MN1-ETV6 유전자재배열이 검출된 환자들의 임상적 특성으로는 백혈병 유발 및 항암제에 대한 치료 저항성과 다약제 내성[5, 6, 10], 생존 기간 감소와 관련 있다고 알려져 있으며, 적은 증례로 인해 동종골수이식의 효용성도 명확하게 밝혀져 있지 않다[3, 4, 7]. 주로 첫 진단 당시(de novo)에 다른 추가적인 염색체 이상을 동반하여 MN1-ETV6 유전자재배열이 검출되는 것으로 알려져 있으며[3, 7], 항암 치료나 방사선치료 후에 이차적으로 발생되기도 한다[3, 10, 11]. 본 환자는 특이하게도 급성골수성백혈병 진단 시 정상 핵형을 나타내었으나, 이후 재발 시에 t(12;22) 및 MN1-ETV6 유전자재배열을 동반하였다. 재발과 연관된 정확한 병리 기전을 규명하기는 어려우나, 본 환자에서는 진단 당시 MN1-ETV6을 아클론(subclone)으로 가지고 있었거나, 치료 이후 저항성 획득과 연관되어 클론성 변화가 일어난 것으로 추정된다. 하지만, 본 증례에서 확인하였던 ETV6 exon3-MN1 exon2 유전자재배열은 primer 서열 정보가 공개되지 않은 Hemavision 키트에서 검출된 RT-PCR 결과물을 이용하여 TA 클로닝 하였기에, MN1의 주 기능 부위를 부호화하는 MN1 exon1이 포함된 MN1-ETV6 유전자재배열을 확인하지 못하였고, 다만 reciprocal fusion인 ETV6-MN1만을 확인할 수 있었다[12].
최근 국내에서는 급성백혈병 환자의 진단에 차세대염기서열분석(next-generation sequencing)을 이용한 유전자돌연변이 검사가 활발하게 이루어지고 있다[13]. 본 증례에서와 같이 정상 핵형이었던 혈액암 환자에서 재발 시 유전자재배열 혹은 유전자돌연변이가 추가 검출될 수 있기 때문에, 항암치료 후 치료저항성과 연관된 클론 변화의 관점에서 보았을 때, 적극적인 진단적 접근이 필요한 것으로 사료된다. 따라서, 진단 시 정상 핵형을 나타낸 혈액암 환자의 경과 관찰 및 재발이나 치료 실패가 의심되는 경우들에 있어서도 다중역전사중합효소연쇄반응 검사 같은 분자유전학적 검사들이 적극적으로 시행될 수 있도록 하는 것은 궁극적으로 희귀 혈액암 환자들의 진단과 치료에 많은 도움을 줄 수 있을 것으로 기대된다. 이러한 노력을 지속함으로써, 개별 희귀 혈액암 환자들에 대한 추가적인 진단 정보를 제공할 수 있게 할 뿐만 아니라, 장래에 제2의 BCR-ABL1과 같은 분자표적 치료의 대상이 될 수 있는 후보 유전자들을 혈액암 환자들에서 발굴해 나가는데 기여할 수 있을 것이다.
REFERENCES
1. Buijs A, van Rompaey L, Molijn AC, Davis JN, Vertegaal AC, Potter MD, et al. 2000; The MN1-TEL fusion protein, encoded by the translocation (12;22) (p13;q11) in myeloid leukemia, is a transcription factor with transforming activity. Mol Cell Biol. 20:9281–93. DOI: 10.1128/MCB.20.24.9281-9293.2000. PMID: 11094079. PMCID: PMC102185.


2. Buijs A, Sherr S, van Baal S, van Bezouw S, van der Plas D, Geurts van Kessel A, et al. 1995; Translocation (12; 22)(p13; q11) in myeloproliferative disorders results in fusion of the ETS-like TEL gene on 12p13 to the MN1 gene on 22q11. Oncogene. 10:1511–9.

3. Shao H, Cen J, Chen S, Qiu H, Pan J. 2018; Myeloid neoplasms with t(12;22)(p13;q12)/MN1-EVT6: a systematic review of 12 cases. Ann Hematol. 97:417–24. DOI: 10.1007/s00277-017-3208-2. PMID: 29273914.

4. Shao H, Yang Q, Gong Y, Bai S, Zhang J, Wang Y, et al. 2019; [Molecular cytogenetic characterization of five patients with myeloid leukemia and t(12;22)(p13;q12)]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 36:112–5.

5. Nofrini V, Berchicci L, La Starza R, Gorello P, Di Giacomo D, Arcioni F, et al. 2011; MN1-ETV6 fusion gene arising from MDS with 5q. Leuk Res. 35:e123–6. DOI: 10.1016/j.leukres.2011.03.019. PMID: 21600651.
6. Chen S, Xue Y, Zhu X, Wu Y, Pan J. 2007; Minimally differentiated acute myeloid leukemia with t(12;22)(p13;q11) translocation showing primary multidrug resistance and expressing multiple multidrug-resistant proteins. Acta Haematol. 118:38–41. DOI: 10.1159/000101997. PMID: 17476096.


7. Heim S, Mitelman F, editors. 2015. Cancer cytogenetics: Chromosomal and molecular genetic aberrations of tumor cells. 4th ed. John Wiley & Sons;Hoboken, NJ: DOI: 10.1002/9781118795569.
8. Swerdlow SH, Campo E, et al. 2017. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Inrernational Agency for Research on Cancer;Lyon, France: p. 421.
9. Estey EH. 2018; Acute myeloid leukemia: 2019 update on risk-stratification and management. Am J Hematol. 93:1267–91. DOI: 10.1002/ajh.25214. PMID: 30328165.


10. Nakazato H, Shiozaki H, Zhou M, Nakatsu M, Motoji T, Mizoguchi H, et al. 2001; TEL/MN1 fusion in a de novo acute myeloid leukaemia-M2 patient who showed strong resistance to treatment. Br J Haematol. 113:1079–81. DOI: 10.1046/j.1365-2141.2001.02821-5.x. PMID: 11442509.

11. Vieira L, Marques B, Ambrósio AP, Chumbo M, Reis AB, Junior EC, et al. 2000; TEL and MN1 fusion in myelodysplastic syndrome: new evidence for a therapy-related event. Br J Haematol. 110:238–9. DOI: 10.1046/j.1365-2141.2000.02072-4.x. PMID: 10931009.
12. Wang T, Chen X, Hui S, Ni J, Yin Y, Cao W, et al. 2020; Ectopia associated MN1 fusions and aberrant activation in myeloid neoplasms with t(12;22) (p13;q12). Cancer Gene Ther. 1–9. DOI: 10.1038/s41417-019-0159-x. PMID: 31902945. PMCID: PMC7661342.
13. Kim IS, Lee JY, Kong SY, Lee ST, Huh J, Nam MH, et al. 2020; Revision of laboratory testing guidelines for initial diagnosis of hematologic neoplasms. Lab Med Online. 10:10–24. DOI: 10.3343/lmo.2020.10.1.10.





 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download