Abstract
Lymphedema is a chronic and progressive disease that affects many of the patients who underwent cancer ablative surgery and decreases the quality of life of them. Surgical management including lymphovenous shunting and vascularized lymph node transfer become popular in the field of microsurgery. For the better outcome of microsurgical approach to lymphedema, understanding of multiple image modalities is essential. Also, understanding other conservative management tools is crucial for setting reasonable algorism for lymphedema management.
림프부종이란 단백질이 풍부한 체액이 간질(interstitium)에 축적되어 지방층이 두꺼워지고 섬유화와 연부조직 염증이 생기는 만성적, 진행성 질환이다[1]. 림프부종은 주로 상지나 하지에 발생하지만 성기, 얼굴, 등을 비롯해 신체 어느 부위에서나 발생할 수 있고, 선천성 림프부종의 경우 일부에서는 림프류(lymphocele)나 유미흉(chylothorax)과 동반되어 나타나기도 한다[2,3].
선천성 림프부종은 10만 명당 1.2명에서 발생하고 주로 20세 이전에 발견된다. 선천성 림부부종의 발생에 영향을 미치는 유전자 변이는 지금까지 20개 이상 발견되었는데, 그중 FLT4 (VEGFR3), CCBE1, FOXC2가 대표적인 변이 유전자이다. 2차성 림프부종의 99% 이상이 감염이나 종양절제술 후에 발생한다[1,2,4]. 두경부종양 수술 후 4%, 유방암 수술 후 20%, 산부인과 수술 후 20%, 흑색종 수술 후 16%, 비뇨기 수술 후 10%에서 림프부종이 발생하는 것으로 알려져 있다[5-7].
부종이 발생하면 침범한 부위의 둘레와 무게가 증가하여 옷을 입거나 신발을 신기 어려워진다. 늘어난 무게로 걷거나 일상생활을 하는 것도 힘들어지고 일부 환자들은 부종이 발생한 부위에 통증을 느낀다[8]. 또한 림프부종으로 인해 생긴 외모의 변형으로 사회생활을 하지 못하고 우울증을 겪는 경우도 흔하다.
림프 시스템은 분자량이 큰 물질과 면역 세포, 지방 유미미립(lipid chylomicrons)을 운반하는 역할을 한다. 간질과 림프절 이전 부위(prelymphatic part)에 고여 있는 분자량이 큰 물질과 림프액은 모세혈관과 간질의 압력 차, 간질과 혈장의 삼투압 차이로 어느 한쪽으로 흐르게 되는데[9], 림프부종 환자에서는 이러한 균형이 무너지게 되어 림프액이 정상적으로 흐르지 못하고, 간질에 림프액이 고이게 된다. 림프액은 조직 압력이 상대적으로 낮은 지방층에 대부분 고이게 되어 질병이 진행할수록 지방층의 두께가 두꺼워진다[10-13].
발과 발가락의 부종으로 인해 두 번째 발가락 발등의 피부를 손가락으로 잡아 들었을 때 피부를 들어 올릴 수 없다면 Kaposi-Stemmer sign 양성이라고 하는데, 이는 림프부종의 특이적인 증상이다[14].
부종은 초기에는 오목부종(pitting edema)를 보이다 부종이 진행하면 오목부종은 사라진다. 치료 없이 병변이 진행하게 되면 피부는 검고 두꺼워지고, 결국엔 유두종대 혹은 사마귀 모양 병변이 발생하게 된다. 이러한 피부 변화로 감염의 위험이 증가하고, 감염으로 인해 부종이 악화되는 악순환이 발생하게 된다.
단순한 부종 방지 스타킹을 신는 것보다는 비탄력성 붕대를 사용하는 것이 2배 이상 효과가 있는 것으로 알려져 있다[15]. 붕대를 감는 것만으로도 부피가 30%에서 39%까지 감소하고, 림프 마사지를 시행할 경우 추가적으로 7% 감소된다[16,17]. 비탄력 붕대 압박, 피부 보습과 위생 관리, 림프 마사지, 적절한 운동을 동시에 시행하는 경우에 한 달 안에 부종이 있는 다리의 부피가 59.1%에서 62.7%까지 감소하는 것으로 알려져 있다[18,19]. 이러한 결과는 모두 전향적 무작위 배정 임상연구를 통해 얻은 결과들이고, 2020년 암 생존자를 위한 National Comprehensive Cancer Network 가이드라인을 통해서도 압박 치료와 적절한 운동의 중요성이 강조되고 있다[20]. 림프부종이 의심되는 사람에서 초기에 적절한 압박치료를 시행하는 것만으로도 부종의 진행을 막을 수 있다고 알려져 있다[21,22].
수술적 치료는 압박 치료를 포함한 보존적 치료가 효과가 없을 때 시도할 수 있다. 림프부종의 수술적 치료는 크게 기능적 수술과 절제술로 나눌 수 있다. 림프부종의 기능적 수술은 림프 시스템의 역할을 증대시켜 림프부종을 치료하는 수술을 말한다. 기능적 수술에는 림프관 정맥 문합술과 혈관화 림프절 이식술이 있다. 10년간 림프관 정맥 문합술을 시행한 1,800개의 사지를 검사한 한 연구는 67%의 환자에서 둘레가 감소했다고 하였고[23], 다른 연구도 54.9%의 환자에서 수술의 효과가 있었다고 보고하였다[24]. 그러나 아직까지 전향적 무작위 배정 비교 연구가 없기 때문에 확실한 효과가 있다고 결론을 내리기는 어렵다. 절제술은 림프관 정맥 문합술이나 혈관화 림프절 이식술을 시행할 수 없거나, 시행 후에 효과가 없는 경우에 시행할 수 있다. 현재 전 세계 많은 성형외과 의사들이 림프부종 수술을 시행하고, 그 효과를 조사하고 있기에 10년 안에는 신뢰할 만한 연구 결과가 많이 나올 것이라 기대한다.
림프관 섬광조영술은 민감도(96%)와 특이도(100%)가 높아 림프부종의 확진 방법으로 사용된다. 손가락과 발가락 사이에 99mTc-sulfur colloid 같은 추적 단백질을 주입하고, 일정 시간이 지난 후에 단백질이 림프 시스템에 흡수되면 감마 카메라를 이용해 방출되는 신호를 감지하게 된다. 측정하는 시간은 필요에 따라 조절할 수 있는데 일반적으로 주입 직후나, 주입 후 한 시간이나 두 시간에 촬영할 수 있다. 이 검사를 통해 추적 단백질이 피하지방층에 고여 있는 것을 알 수 있고, 림프절에 흡수되는 것, 곁가지를 통해 림프액이 근위부로 이동하는 것도 알 수 있다(Fig. 1). 시간 간격을 두고 촬영할 경우 곁가지를 통한 흐름이나 확장된 림프관의 존재 유무도 알 수 있다. 하지만 해상도가 낮아 림프관이나 림프절의 위치를 정확히 알 수 없고, 림프절에 추적 단백질이 흡수되지 않으면 림프절 상태를 알 수 없다[25,26].
자기공명영상 림프관 조영술은 림프관 섬광조영술과 비슷하게 손가락과 발가락 사이 피하에 6–10 nm보다 크고 100 nm보다 작은 상자성(paramagnetic) 물질을 넣고 이 물질이 림프관을 통해 주행하여 림프절에 흡수되는 것을 관찰하는 검사이다[27-29]. 영상은 주입 후 30분에서 1시간 후 한 번 촬영할 수도 있고, 8–10분 간격으로 여러 차례 측정할 수도 있다[28]. 여러 차례 촬영할 경우에 정맥과 림프관을 구분하기가 더 용이하다. 자기공명영상 림프관 조영술을 사용하면 림프액이 피하지방층이나 피부에 고여 있는 것도 확인할 수 있을 뿐만 아니라, 지방층의 두께 및 림프액의 축적 정도도 알 수 있다. 또한, 이를 사용하여 림프액이 흐르는, 즉 기능을 하는 림프관의 정확한 위치를 찾을 수 있다(Fig. 2). 이 검사의 단점은 아직 국민건강보험 처리가 되지 않아 비용이 높고, 폐쇄공포증이 있는 환자에서는 사용할 수 없으며, 판독 초기에 림프관과 정맥의 구별이 쉽지 않을 수 있다는 것이다. 자기공명영상 림프관 조영술에서 관찰되는 림프관은 모두 기능을 하고 림프액이 흐르는 림프관이기 때문에, 수술 전 이 검사에서 림프관이 보인다면 림프 정맥 문합술을 시도해 볼 수 있고, 수술에 사용할 림프관의 위치도 특정할 수 있다[11,26,28-30].
8–15 MHz의 Duplex 초음파를 이용하여 림프 정맥 문합술에 사용하는 림프관과 정맥을 찾을 수 있다. 림프액이 흐르고 있는 림프관도 찾을 수 있고, 림프관의 경화 정도나 림프관의 크기도 측정할 수 있다. 일부 논문에서는 70 MHz 장비를 사용하여 보다 정확하고 선명하게 림프관을 찾는 사례들이 보고되고 있다[34] (Fig. 4). 수술 전이나 수술 중에도 비침습적으로 림프관을 촬영할 수 있는 장점이 있지만, 수술하는 의사가 직접 시행해야 보다 정확한 정보를 얻을 수 있고, 신뢰할 만한 결과를 얻기까지 많은 훈련이 필요하다는 단점이 있다[34,35].
림프관 정맥 문합술은 림프부종이 발생한 부위의 림프관과 림프관 주변의 정맥을 미세수술로 연결하는 수술로, 림프액이 림프관에서 정맥으로 흐르게 하는 우회 수술이라 볼 수 있다(Fig. 5). 림프의 압력으로 우회로를 통해 림프가 배액되는 원리이기 때문에, 기능을 하는 림프관을 찾는 것이 제일 중요하다. ICG 림프 조영술이나 자기공명명상에서 조영이 증가된 림프관이 있다면 그 림프관들을 사용하여 림프관 정맥 문합술을 시행할 수 있다. ICG 림프 조영술이나 자기공명영상에서 림프관이 보이지 않는다면, 문합술 이후에 배액이 충분하게 일어나지 않거나 혈전으로 문합 부위가 막혔을 가능성이 높다. 일반적으로 림프액의 흐름은 주변 근육의 수축과 림프관 안의 평활근육의 움직임에 의해 유지된다고 한다[40]. 하지만 림프부종 환자에서는 림프관 내의 높은 압력으로 인해 림프관 내경이 확장되고 시간이 경과하면 경화증이 발생하면서 평활근의 기능이 소실되고 자체 펌프 기능이 없어진다. 그렇기 때문에 림프 정맥 문합술에서는 역류가 없고 압력이 낮은 정맥을 찾아 문합술을 시행하고, 수술 후 압박과 적절한 운동을 하는 것이 필요하겠다. 여러 논문에서 림프 문합술을 통해 림프부종을 줄였다는 보고가 발표되었고, 부종의 감소뿐만 아니라 피부 두께와 림프 모세관의 밀도 감소를 보였다[41].
수술을 부종이 있는 부위보다 먼 곳에 dye (blue dye나 fluorescent dye)나 ICG를 주입한다면 림프관을 보다 쉽게 찾을 수 있다. 피부 진피 아래까지 절개하고 지방층이 나오기 시작하면 정맥을 볼 수 있다. 1 mm 전후의 정맥이라면 문합술에 사용하기 적합하다. 적당한 정맥을 찾았다면 원위부로 충분히 박리하여, 이보다 깊은 층에 존재하는 림프관을 찾는 데 방해가 되지 않도록 한다. 2 mm보다 큰 정맥이라면 원위부로 더 박리하여 정맥에서 분지되는 작은 가지를 찾는 것을 추천한다. 그 이후에 조심스럽게 더 깊이 지방층을 박리하면 얕은 근막 바로 아래로 지름이 큰 림프관을 찾을 수 있다. 이 림프관이 림프관 정맥 문합술에 사용되는 깊은 림프관이다(Fig. 6). 문합하는 방법은 매우 다양하다. 초기에는 림프관과 정맥을 단단(end-to-end)연결을 하였으나 최근에는 림프관 본연의 흐름을 유지하기 위해 림프관의 옆구리에 정맥의 원위부를 연결하는 끝옆(side-to-end) 연결을 주로 시행한다. 12배 이상의 배율이 있는 현미경이 필요하고, 20배 이상이라면 작은 림프관 봉합도 보다 용이하게 시행할 수 있다. 봉합을 위해 11-0, 12-0 봉합사를 이용하는데, 우리나라에는 12-0 봉합사가 아직 수입되거나 생산되지 않아 사용할 수 없다. 림프관이 워낙 얇고 투명하기 때문에, 구멍을 낼 때 림프관 외막을 충분히 제거한 후 펜으로 염색을 시행하면 봉합 시 봉합해야 하는 구멍의 경계를 보다 쉽게 찾을 수 있다. 구멍을 내는 방법도 다양한데, 크기가 워낙 작기 때문에 미세 가위로도 원하는 크기의 구멍을 전층으로 만드는 것이 쉽지 않아 저자들은 11번 수술용 칼을 이용하여 세로 틈새를 만들고 이를 벌려 적절한 크기의 구멍을 만든다. 적절한 봉합이 완료되었다면 림프액이 정맥으로 흘러 정맥이 투명해지는 것을 확인할 수 있다(Fig. 7). 적외선 카메라와 ICG를 사용한다면 정맥이 근위부로 조영되는 것도 확인할 수 있다(Fig. 5D). 0.3 mm보다 작은 림프관은 봉합이 어려울 뿐만 아니라 림프액의 흐름이 적고 압력도 낮아, 기술적으로 가능하더라도 추천하지 않는다. 작은 정맥이 없는 경우에는 측측(side-to-side) 연결도 쉽게 시행할 수 있다. 한 명의 환자 혹은 한 개의 사지에서 몇 개의 림프 정맥 문합술을 시행하는 것이 바람직한가에 대한 결론은 아직 없다[42,43]. 그렇지만 지방 흡입이나 절제술에 비해 부작용이 적고 수술 후 회복도 빨라 최근에는 림프부종의 수술적 치료에 있어서 가장 먼저 시행하는 수술법이다.
혈관화 림프절 이식술은 림프절과 주변 조직을 일부 채취하여 림프부종이 있는 부위에 이식하는 수술이다. 림프절 이식술의 효과에 대해서는 여러 가지 가설이 존재한다. 첫 번째는 이식된 림프절에서 정맥으로 우회가 일어난다는 것이다[44,45]. 다른 가설은 이식된 림프절 주변에서 신행혈관 촉진인자(vascular endothelial growth factor, VEGF)의 도움으로 림프관이 새롭게 자라 나와 림프액이 배액된다는 논리이다[46]. 림프절을 채취하는 부위나 림프절을 이식하는 부위에 대한 의견도 매우 다양하다[47]. 혈관화 림프절 이식술에 사용되는 림프절은 턱밑, 쇄골 위, 서혜부, 외측 흉부, 대망, 공장간 림프절 등이 있다. 혈관화된 림프절만 이식할 수도 있고, 주변 림프 혈관을 포함하는 지방 조직을 함께 이식하기도 한다(Fig. 8). 또한 최근에는 림프 혈관을 포함하는 지방 조직을 림프절 이식술 없이 이식하기도 한다[48].
림프부종이 진행하였거나, 림프 혈관을 찾을 수 없는 경우, 혹은 다른 수술들 이후에 효과가 없는 환자에서 지방 흡입술을 고려해 볼 수 있다. 림프부종에서 림프액의 저류가 대부분 근막보다 얕은 층인 지방층에 있기 때문에, 지방흡입술을 이용하면 림프액이 고일 수 있는 공간을 줄이고 생성되는 림프액의 양도 줄일 수 있다[57]. 지방 흡입술 후에 최소 6–12개월간 압박붕대 치료가 필수적이기 때문에, 수술 전에 압박치료를 먼저 시행해보고, 이를 잘 견디는 환자들을 대상으로 지방 흡입술을 시행하는 것을 추천한다[58]. 4개의 연구 105명의 환자에서 지방흡입을 시행하였는데, 이 논문에서는 부종으로 늘어난 지방의 96.6%를 제거하였고, 수술 후에도 압박 스타킹을 착용하게 하였다. 그 중 3개의 논문에서는 수술 후 환자의 삶의 질(quality of life)이 개선되고 우울증, 불안이 감소하였다[59].
수술적 절제는 1912년 처음 Charles procedure로 소개된 수술방법으로, 그 이후에 많은 개선이 있었다. 수술적 절제는 림프부종이 말기로 진행하여 섬유화와 경화가 심해지고, 봉와직염이 자주 생기고, 외형의 변형이 심하고, 거동이 불가능할 때, 혹은 육종으로의 변이를 배제할 수 없을 때 시행하게 된다. 수술을 하게 되면 림프관을 모두 제거하게 되는 단점이 있고, 비후성 반흔이 생기거나 절제술을 시행하지 못한 말초 부위 즉 손이나 발의 부종이 심해지는 경우가 있다. 피부와 지방을 모두 제거하지 않고, 일부분의 피부와 피부 밑 지방만을 제거한 후 남은 피부와 연결된 천공지를 살려 피판술을 시행하는 방법을 시행하면 피부 이식으로 인한 흉터는 조금 감소시킬 수 있다[60].
수술을 언제 시행할 것인가에 대한 질문에 대해서도 논란이 많다. 일본의 의사들, 그리고 일부 연구에서는 체계화된 압박 치료 없이 초기에 환자들을 수술하는 것이 병의 진행을 막는 데 도움이 된다고 보고하였다[63,64]. 한편으로 수십 년 동안 압박 치료를 시행한 연구에서는 초기 질환에서 압박 치료만으로 충분히 효과를 볼 수 있기 때문에, ISL 병기 stage I과 같은 질환 초기에는 압박 치료를 하고 호전이 없는 환자들에서 수술을 추천하고 있다[1,18,21,63-65]. 최근에는 ISL 병기 II–III처럼 병기가 진행한 환자들에서도 림프관 정맥 문합술 혹은 림프절 이식술을 시행하면 부종이 감소될 수 있다는 보고도 있다[66,67]. 환자를 직접 진료하는 의사들은 본인이 가지고 있는 무기를 이용해 환자를 치료하려는 경향이 있다. 림프부종의 치료에 있어서도 다른 분야 전문가들의 이야기를 들어보고, 토론을 통해 환자에 대한 치료 알고리즘을 만드는 것이 중요하다 하겠다.
영상의학과, 핵의학과, 재활의학과, 그리고 성형외과가 팀을 이루어 다학제 진료를 시행한다면, 수술 전 검사부터 수술 후 관리까지 보다 더 체계적인 진료가 가능해진다. 처음 림프부종 영상검사를 시행하다보면 자기공명영상 림프관조영술에서 림프관을 찾지 못하는 경우도 있고, 림프관 섬광조영술에서 수술에 도움이 되는 시간대의 영상이 누락되는 경우도 있다. 충분한 논의를 통해서 각 수술에 필요한 적절한 영상 자료를 만들어 나가고, 수술 전후의 압박 치료도 재활의학과에 의뢰하여 체계적인 관리를 받게 한다면, 수술 결과도 더 좋아지고 환자의 신뢰도 더 얻을 수 있을 것이다.
REFERENCES
1. Warren AG, Brorson H, Borud LJ, Slavin SA. Lymphedema: a comprehensive review. Ann Plast Surg. 2007; 59:464–72.

2. Brouillard P, Boon L, Vikkula M. Genetics of lymphatic anomalies. J Clin Invest. 2014; 124:898–904.



3. Turpin S, Lambert R. Lymphoscintigraphy of chylous anomalies: chylothorax, chyloperitoneum, chyluria, and lymphangiomatosis-15-year experience in a pediatric setting and review of the literature. J Nucl Med Technol. 2018; 46:123–8.


5. Yao K, Tu H, Li YH, et al. Modified technique of radical inguinal lymphadenectomy for penile carcinoma: morbidity and outcome. J Urol. 2010; 184:546–52.


6. Van der Zee AG, Oonk MH, De Hullu JA, et al. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol. 2008; 26:884–9.


7. DiSipio T, Rye S, Newman B, Hayes S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol. 2013; 14:500–15.


8. Becker C, Arrive L, Saaristo A, et al. Surgical treatment of congenital lymphedema. Clin Plast Surg. 2012; 39:377–84.


9. Gashev AA, Zawieja DC. Hydrodynamic regulation of lymphatic transport and the impact of aging. Pathophysiology. 2010; 17:277–87.



10. Borri M, Gordon KD, Hughes JC, et al. Magnetic resonance imaging-based assessment of breast cancer-related lymphoedema tissue composition. Invest Radiol. 2017; 52:554–61.



11. Kim G, Smith MP, Donohoe KJ, Johnson AR, Singhal D, Tsai LL. MRI staging of upper extremity secondary lymphedema: correlation with clinical measurements. Eur Radiol. 2020; 30:4686–94.


12. Zampell JC, Aschen S, Weitman ES, et al. Regulation of adipogenesis by lymphatic fluid stasis: part I. Adipogenesis, fibrosis, and inflammation. Plast Reconstr Surg. 2012; 129:825–34.


13. Chu SY, Wang SC, Chan WH, et al. Volumetric differences in the suprafascial and subfascial compartments of patients with secondary unilateral lower limb lymphedema. Plast Reconstr Surg. 2020; 145:1528–37.


14. Kerchner K, Fleischer A, Yosipovitch G. Lower extremity lymphedema update: pathophysiology, diagnosis, and treatment guidelines. J Am Acad Dermatol. 2008; 59:324–31.

15. Badger CM, Peacock JL, Mortimer PS. A randomized, controlled, parallel-group clinical trial comparing multilayer bandaging followed by hosiery versus hosiery alone in the treatment of patients with lymphedema of the limb. Cancer. 2000; 88:2832–7.


16. Ezzo J, Manheimer E, McNeely ML, et al. Manual lymphatic drainage for lymphedema following breast cancer treatment. Cochrane Database Syst Rev. 2015; (5):CD003475.

17. Shao Y, Zhong DS. Manual lymphatic drainage for breast cancer-related lymphoedema. Eur J Cancer Care (Engl). 2017; 26:10.1111/ecc.12517.


18. Ko DS, Lerner R, Klose G, Cosimi AB. Effective treatment of lymphedema of the extremities. Arch Surg. 1998; 133:452–8.


19. Jeffs E, Ream E, Shewbridge A, et al. Exploring patient perception of success and benefit in self-management of breast cancer-related arm lymphoedema. Eur J Oncol Nurs. 2016; 20:173–83.


20. National Comprehensive Cancer Network (NCCN). NCCN guidelines: clinical practice guidelines in oncology. Survivorship version 2, 2020 [Internet]. Plymouth Meeting (PA): NCCN;2020. Jul. 14. [cited 2021 Jan 12]. Available from: https://www.nccn.org/professionals/physician_gls/default.aspx.
21. Shah C, Arthur DW, Wazer D, Khan A, Ridner S, Vicini F. The impact of early detection and intervention of breast cancer-related lymphedema: a systematic review. Cancer Med. 2016; 5:1154–62.



22. Lasinski BB, McKillip Thrift K, Squire D, et al. A systematic review of the evidence for complete decongestive therapy in the treatment of lymphedema from 2004 to 2011. PM R. 2012; 4:580–601.


23. Cormier JN, Rourke L, Crosby M, Chang D, Armer J. The surgical treatment of lymphedema: a systematic review of the contemporary literature (2004-2010). Ann Surg Oncol. 2012; 19:642–51.


24. Campisi C, Bellini C, Campisi C, Accogli S, Bonioli E, Boccardo F. Microsurgery for lymphedema: clinical research and long-term results. Microsurgery. 2010; 30:256–60.


25. Stecker MS, Fan CM. Lymphangiography for thoracic duct interventions. Tech Vasc Interv Radiol. 2016; 19:277–85.


26. O'Donnell TF Jr, Rasmussen JC, Sevick-Muraca EM. New diagnostic modalities in the evaluation of lymphedema. J Vasc Surg Venous Lymphat Disord. 2017; 5:261–73.


27. Notohamiprodjo M, Weiss M, Baumeister RG, et al. MR lymphangiography at 3.0 T: correlation with lymphoscintigraphy. Radiology. 2012; 264:78–87.

28. Mitsumori LM, McDonald ES, Wilson GJ, Neligan PC, Minoshima S, Maki JH. MR lymphangiography: how I do it. J Magn Reson Imaging. 2015; 42:1465–77.


29. Mitsumori LM, McDonald ES, Neligan PC, Maki JH. Peripheral magnetic resonance lymphangiography: techniques and applications. Tech Vasc Interv Radiol. 2016; 19:262–72.


30. Mazzei FG, Gentili F, Guerrini S, et al. MR lymphangiography: a practical guide to perform it and a brief review of the literature from a technical point of view. Biomed Res Int. 2017; 2017:2598358.

31. Chen WF, Lensing JN, Bowen M. Indocyanine green lymphography can be falsely negative in early extremity lymphedema. J Plast Reconstr Aesthet Surg. 2020; 73:391–407.

32. Narushima M, Yamamoto T, Ogata F, Yoshimatsu H, Mihara M, Koshima I. Indocyanine green lymphography findings in limb lymphedema. J Reconstr Microsurg. 2016; 32:72–9.


33. Yamamoto T, Yamamoto N, Doi K, et al. Indocyanine green-enhanced lymphography for upper extremity lymphedema: a novel severity staging system using dermal backflow patterns. Plast Reconstr Surg. 2011; 128:941–7.

34. Hayashi A, Visconti G, Yamamoto T, et al. Intraoperative imaging of lymphatic vessel using ultra high-frequency ultrasound. J Plast Reconstr Aesthet Surg. 2018; 71:778–80.


35. Hayashi A, Hayashi N, Yoshimatsu H, Yamamoto T. Effective and efficient lymphaticovenular anastomosis using preoperative ultrasound detection technique of lymphatic vessels in lower extremity lymphedema. J Surg Oncol. 2018; 117:290–8.


37. International Society of Lymphology. The diagnosis and treatment of peripheral lymphedema: 2013 Consensus Document of the International Society of Lymphology. Lymphology. 2013; 46:1–11.

38. Mihara M, Hayashi Y, Hara H, et al. High-accuracy diagnosis and regional classification of lymphedema using indocyanine green fluorescent lymphography after gynecologic cancer treatment. Ann Plast Surg. 2014; 72:204–8.


39. Garza RM, Ooi ASH, Falk J, Chang DW. The relationship between clinical and indocyanine green staging in lymphedema. Lymphat Res Biol. 2019; 17:329–33.


40. Yamaguchi K, Kimata Y, Yamada K, Suami H. Peripheral venous angle plasty: a new lymphovenous anastomosis technique for lower extremity lymphedema. Plast Reconstr Surg. 2012; 130:233e–235e.
41. Torrisi JS, Joseph WJ, Ghanta S, et al. Lymphaticovenous bypass decreases pathologic skin changes in upper extremity breast cancer-related lymphedema. Lymphat Res Biol. 2015; 13:46–53.



42. Yamamoto T, Yamamoto N, Numahata T, et al. Navigation lymphatic supermicrosurgery for the treatment of cancer-related peripheral lymphedema. Vasc Endovascular Surg. 2014; 48:139–43.


43. AlJindan FK, Lin CY, Cheng MH. Comparison of outcomes between side-to-end and end-to-end lymphovenous anastomoses for early-grade extremity lymphedema. Plast Reconstr Surg. 2019; 144:486–96.


44. Patel KM, Lin CY, Cheng MH. From theory to evidence: long-term evaluation of the mechanism of action and flap integration of distal vascularized lymph node transfers. J Reconstr Microsurg. 2015; 31:26–30.


45. Cheng MH, Huang JJ, Wu CW, et al. The mechanism of vascularized lymph node transfer for lymphedema: natural lymphaticovenous drainage. Plast Reconstr Surg. 2014; 133:192e–198e.
46. Aschen SZ, Farias-Eisner G, Cuzzone DA, et al. Lymph node transplantation results in spontaneous lymphatic reconnection and restoration of lymphatic flow. Plast Reconstr Surg. 2014; 133:301–10.



47. Scaglioni MF, Arvanitakis M, Chen YC, Giovanoli P, Chia-Shen Yang J, Chang EI. Comprehensive review of vascularized lymph node transfers for lymphedema: outcomes and complications. Microsurgery. 2018; 38:222–9.


48. Koshima I, Narushima M, Mihara M, et al. Lymphadiposal flaps and lymphaticovenular anastomoses for severe leg edema: functional reconstruction for lymph drainage system. J Reconstr Microsurg. 2016; 32:50–5.

49. Blum KS, Hadamitzky C, Gratz KF, Pabst R. Effects of autotransplanted lymph node fragments on the lymphatic system in the pig model. Breast Cancer Res Treat. 2010; 120:59–66.


50. Tobbia D, Semple J, Baker A, Dumont D, Johnston M. Experimental assessment of autologous lymph node transplantation as treatment of postsurgical lymphedema. Plast Reconstr Surg. 2009; 124:777–86.


51. Nicoli F, Constantinides J, Ciudad P, et al. Free lymph node flap transfer and laser-assisted liposuction: a combined technique for the treatment of moderate upper limb lymphedema. Lasers Med Sci. 2015; 30:1377–85.


52. Travis EC, Shugg S, McEwan WM. Lymph node grafting in the treatment of upper limb lymphoedema: a clinical trial. ANZ J Surg. 2015; 85:631–5.


53. Honkonen KM, Visuri MT, Tervala TV, et al. Lymph node transfer and perinodal lymphatic growth factor treatment for lymphedema. Ann Surg. 2013; 257:961–7.

54. Cornelissen AJ, Qiu SS, Lopez Penha T, et al. Outcomes of vascularized versus non-vascularized lymph node transplant in animal models for lymphedema. Review of the literature. J Surg Oncol. 2017; 115:32–6.


55. Ito R, Suami H. Overview of lymph node transfer for lymphedema treatment. Plast Reconstr Surg. 2014; 134:548–56.


56. Raju A, Chang DW. Vascularized lymph node transfer for treatment of lymphedema: a comprehensive literature review. Ann Surg. 2015; 261:1013–23.
57. Greene AK, Voss SD, Maclellan RA. Liposuction for swelling in patients with lymphedema. N Engl J Med. 2017; 377:1788–9.

59. Carl HM, Walia G, Bello R, et al. Systematic review of the surgical treatment of extremity lymphedema. J Reconstr Microsurg. 2017; 33:412–25.


60. Ciudad P, Manrique OJ, Adabi K, et al. Combined double vascularized lymph node transfers and modified radical reduction with preservation of perforators for advanced stages of lymphedema. J Surg Oncol. 2019; 119:439–48.


61. Garza RM, Chang DW. Lymphovenous bypass for the treatment of lymphedema. J Surg Oncol. 2018; 118:743–9.


62. Ito R, Wu CT, Lin MC, Cheng MH. Successful treatment of early-stage lower extremity lymphedema with side-to-end lymphovenous anastomosis with indocyanine green lymphography assisted. Microsurgery. 2016; 36:310–5.


63. Gallagher K, Marulanda K, Gray S. Surgical intervention for lymphedema. Surg Oncol Clin N Am. 2018; 27:195–215.


64. Bernas M, Thiadens SR, Smoot B, Armer JM, Stewart P, Granzow J. Lymphedema following cancer therapy: overview and options. Clin Exp Metastasis. 2018; 35:547–51.


65. Olszewski WL. Lymphovenous microsurgical shunts in treatment of lymphedema of lower limbs: a 45-year experience of one surgeon/one center. Eur J Vasc Endovasc Surg. 2013; 45:282–90.


Fig. 1.
Lymphoscintigraphy of left leg lymphedema. Dermal backflow is shown in the entire left leg. Written informed consent was obtained for publication of this study and accompanying images.
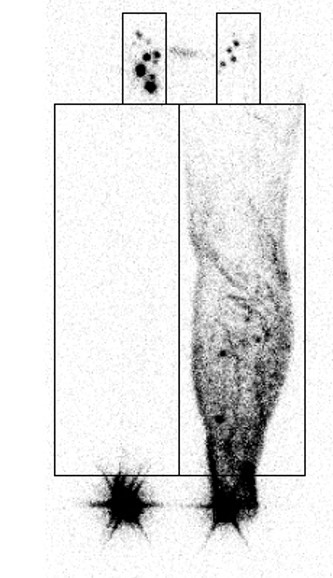
Fig. 2.
Magnetic resonance lymphoscintigraphy of the upper arm with lymphedema. Dermal backflow and the tortuous lymphatic vessel (arrows) were found in the fat layer. Written informed consent was obtained for publication of this study and accompanying images.
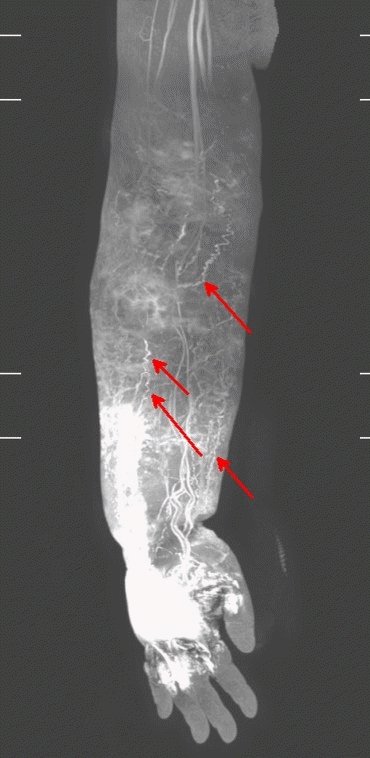
Fig. 3.
Indocyanine green lymphography of hand dorsum. There is a dermal backflow. Written informed consent was obtained for publication of this study and accompanying images.

Fig. 4.
Duplex color Doppler visualizes cutaneous vein (red arrow) and lymphatic vessel located in deeper layer (green arrow). Written informed consent was obtained for publication of this study and accompanying images.

Fig. 5.
Sixty four-years-old female suffered from the left leg for 15 years after ovarian cancer surgery. (A) The patient showed severe swelling of the thigh even after compressive decongestive therapy. (B) Magnetic resonance lymphangiography showed a good functioning lymphatic vessel at the lower leg. (C, D) Three lymphovenous anastomoses were done, and there was good lymphatic flow in indocyanine green lymphangiography intraoperatively by an embedded infrared camera in microscopy. (E) Reduction of thigh circumference was maintained after 6 months of lymphovenous shunting surgery. Written informed consent was obtained for publication of this study and accompanying images.
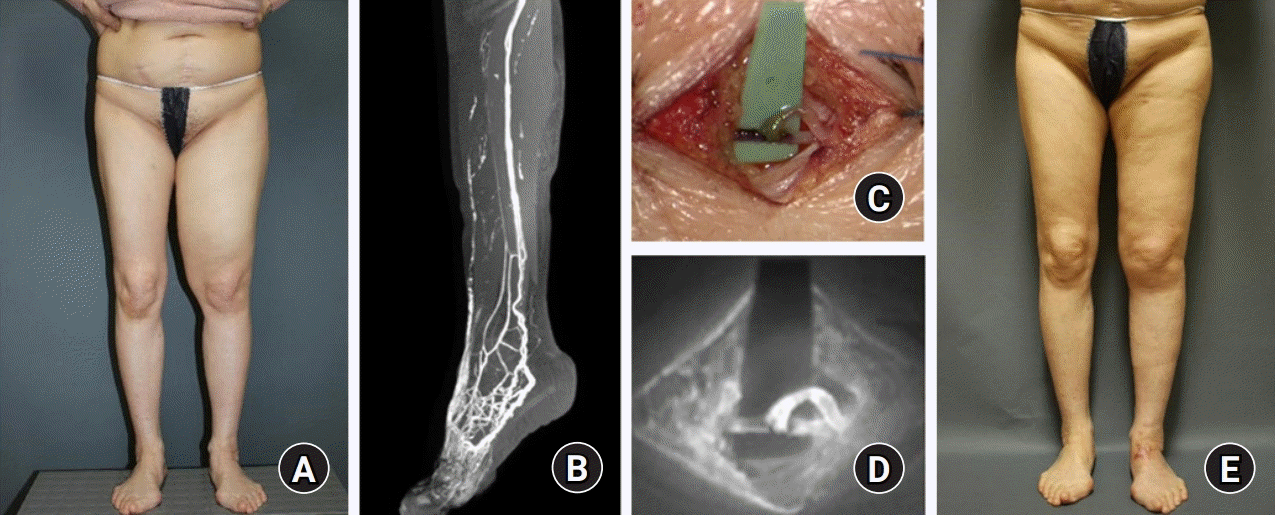
Fig. 6.
Two lymphatic vessels were found in the fat layer after making a skin incision. Fluorescent dye was injected before making a skin incision. These deep lymphatic vessels were sized 0.3 mm and 0.5 mm. Written informed consent was obtained for publication of this study and accompanying images.
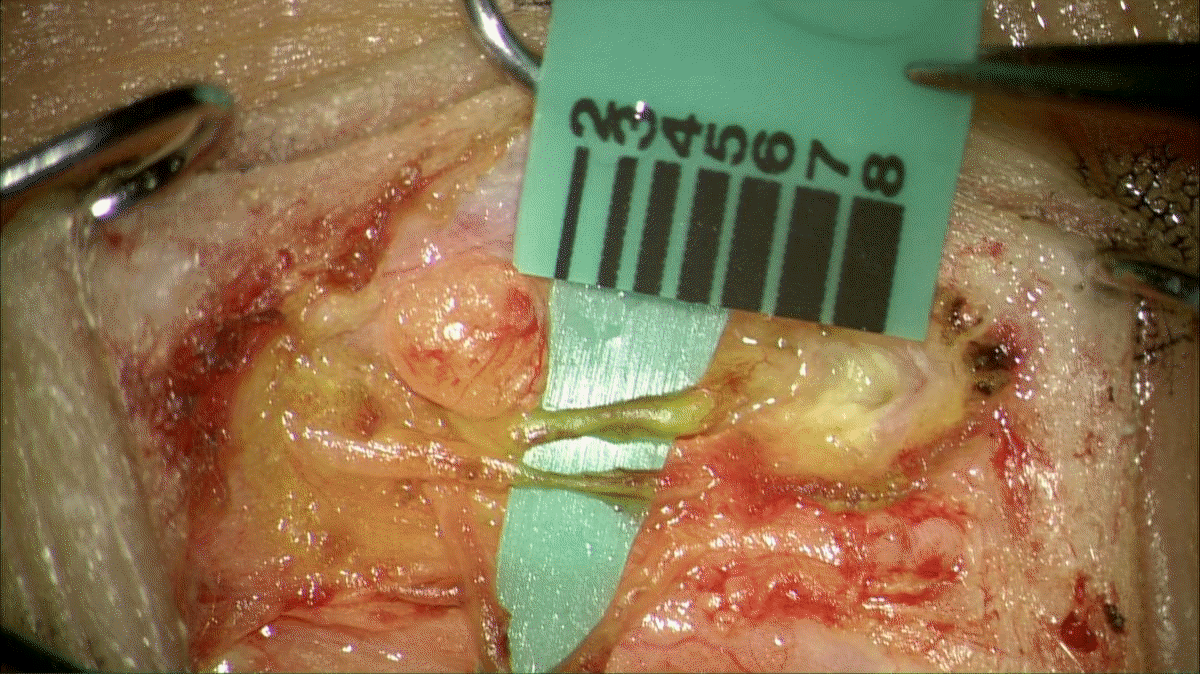
Fig. 7.
Three lymphovenous shunting were done through a 1-cm skin incision on the ankle. Veins (red arrows) showed a clear lumen after shunting due to good lymphatic flow to the proximal vein from lymphatic vessels (green arrows). Written informed consent was obtained for publication of this study and accompanying images.
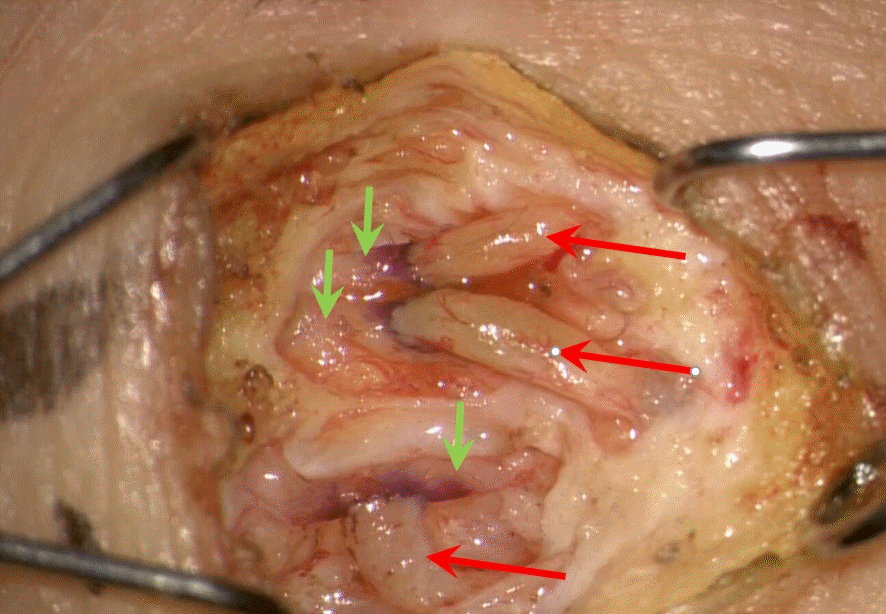
Fig. 8.
One vascular lymph node and skin flap, including lymphatic vessel in the deep fat layer, was harvested from the groin. Written informed consent was obtained for publication of this study and accompanying images. Written informed consent was obtained for publication of this study and accompanying images.

Table 1.
Lymphedema staging according to the 2013 Consensus document of the International Society of Lymphology




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download