초록
Kytococcus 속은 피부 상재균으로 인체 감염을 드물게 유발한다. K. schroeteri는 인공판막을 가진 환자에서 감염성 심내막염과 백혈병 환자에서 혈류감염을 일으키는 것으로 보고되었다. 연구자들은 K. schroeteri에 의한 감염성 심내막염 1예를 보고하고자 한다. 내원 5개월 전 대동맥박리로 수술 및 판막치환술을 받은 46세 남자가 감염성 심내막염 의심 소견으로 입원하였다. 3쌍의 혈액 배양 중 하나의 호기성 혈액배양병에서 그람 양성 알균이 검출되었고 VITEK 2 (bioMérieux, USA)에서는 Dermacoccus nishinomiyaensis/Kytococcus sedentarius로 동정되었다. 하지만, micro ex LT Biotyper (Bruker Daltonics, Germany)는 K. schroeteri (2.037) 의 결과를 보였고, 16S rRNA 유전자 염기서열 분석은 K. schroeteri 와 99.79%의 일치도를 보였다. 환자는 초기에 gentamicin, vancomycin, rifampin을 포함한 항생제를 투여받았다. 이후 4회의 연속 된 추적 말초혈액배양에서 미생물이 관찰되지 않았고, 감염성 심내 막염에서 회복하였다. 저자들이 알고 있는 한, 본 증례는 K. schroeteri에 의한 감염성 심내막염의 국내 첫 증례이다
Go to : 
Abstract
Kytococcus spp. is a skin bacterial flora that rarely causes human infections. K. schroeteri has been reported to cause infective endocarditis and bloodstream infections in patients with prosthetic valves and leukemia, respectively. In this study, we report a case of infective endocarditis caused by K. schroeteri. A 46-year-old man who underwent valve replacement surgery for aortic dissection 5 months ago was admitted. The patient had intermittent fever, suggestive of infective endocarditis. Gram-positive bacteria were detected in one aerobic blood culture bottle among 3 pairs of blood cultures and identified as Dermacoccus nishinomiyaensis/K. sedentarius by the VITEK® 2 system (bioMérieux, USA). However, K. schroeteri was identified by the microflexTM LT biotyper (Bruker Daltonics, Germany; score 2.037), and the sequence of the 16S rRNA showed 99.79% similarity with that of K. schroeteri. The patient received antibiotics, including gentamicin, vancomycin, and rifampin. Four sequential follow-up peripheral blood cultures were negative for microorganisms, and the patient recovered from infective endocarditis. To our knowledge, this is the first reported case of infective endocarditis caused by K. schroeteri in Korea.
Go to : 
Kytococcus 속은 호기성, 비포자 형성, 비운동성, 카탈라아제 양성, 그람양성 구균이다[1]. Kytococcus 속은 피부 상재균으로 생각되며, 이에 의한 인체감염은 드물게 보고되고 있다. K. schroeteri는 주로 인공판막을 가진 환자에서 감염성 심내막염[1-6]을 비롯하여, 백혈병 환자에서 감염을 일으킴이 보고되어 있다[7, 8]. 국내에서는 기존에 알려진 위험요인이 없는 환자에서 이 균의 폐렴에 의한 균혈증이 보고된 바 있다[9]. 저자들은 Kytococcus schroeteri에 의한 국내 첫 감염성 심내막염 증례를 경험하여 이에 대한 문헌 고찰과 함께 보고하고자 한다. 본 연구는 서울대학교병원 기관생명윤리위원회의 승인을 받았다(IRB No. 2001-156-1099).
Go to : 
고혈압과 경도의 대동맥판막 역류증이 동반된 대동맥근부 확장증으로 본원 순환기내과 추적관찰 중이던 46세 남자 환자가 내원 5개월 전 흉통으로 타병원에서 대동맥박리, Stanford A형을 진단 받아 Bentall 수술(인공대동맥 및 인공 대동맥판막치환술)을 받았고, 이후 심방조동으로 내원 3개월 전 고주파 전극도자 절제술(radiofrequency catheter ablation, RFCA)을 시행 받았다. 이후 저녁과 밤에 간헐적 열감이 있고 체온은 37.5-37.6°C로 측정되며, 오한이 동반되었다. 내원 3-4일 전부터는 왼손가락 끝 통증이 있어 타원에 내원하였으나, 감염성 심내막염 의심 소견으로 입원 대기 중 본원 진료를 원하여 응급실을 통해 입원하였다. 입원 시 이학적 검사 상 체온은 37.7°C, 맥박수는 70회/분, 혈압은 138/75 mm/Hg였고, 왼쪽 셋째 및 넷째 손가락 끝에 오슬러결절이 관찰되었다. 혈액 검사상 백혈구 수치 10.37×109/L 및 호중구 비율 82%로 상승한 소견과, C-반응 단백(C-reactive protein [CRP] 4.93 mg/dL) 상승과 섬유소원(514 mg/dL)의 상승 소견을 보였다.
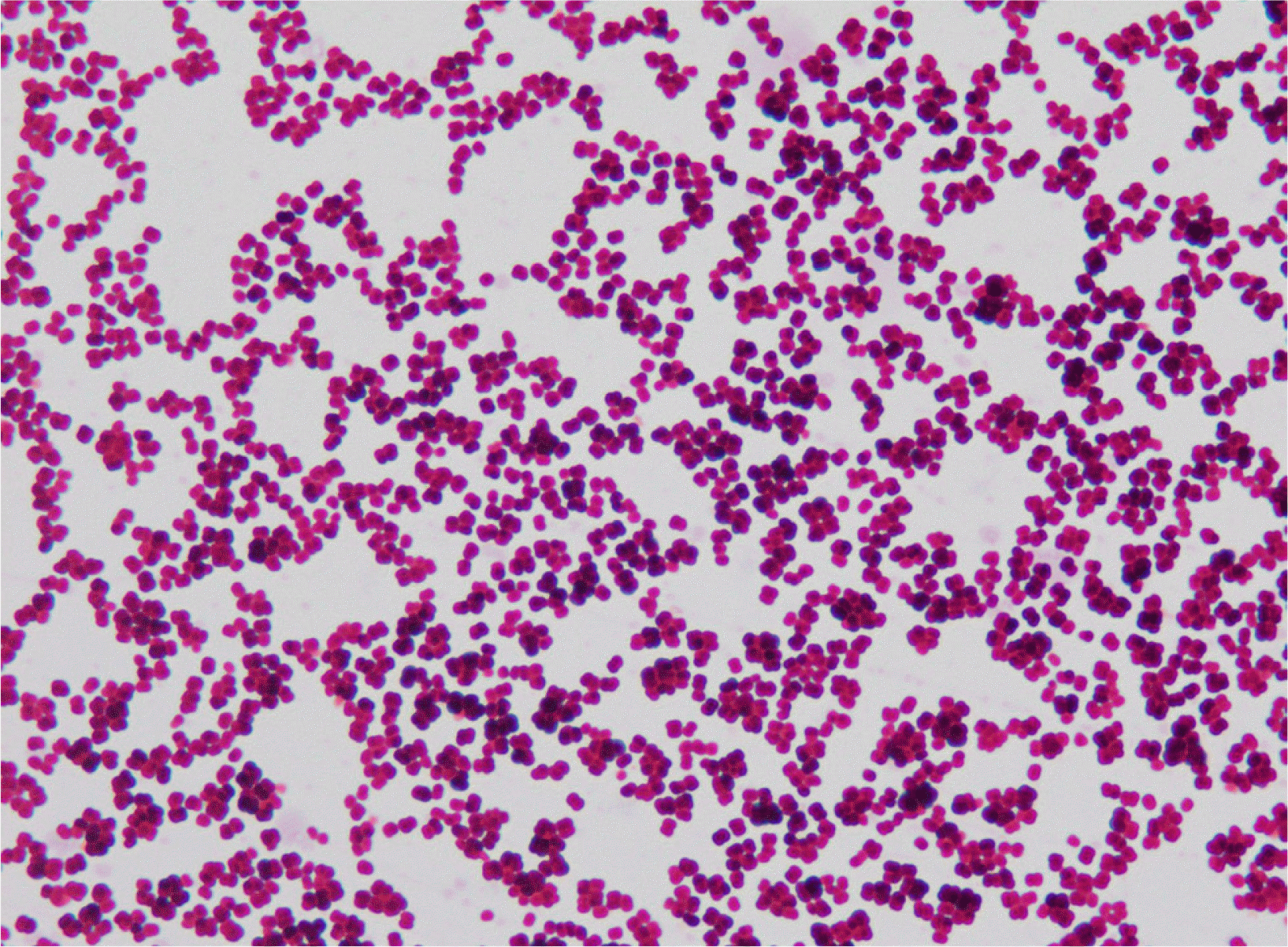
응급실 내원 당일 말초정맥에서 채취한 3쌍의 혈액배양은 각각 Bactec Plus Aerobic/F 병과 Lytic/10, Anaerobic/F (Becton Dickinson, Sparks, MD, USA) 병에 접종하여 Bactec FX 시스템(Becton Dickinson)에서 배양하였다. 하나의 호기성 혈액배양병에서 86시간 후에 그람 양성 알균이 검출되었고, 쌍알균 혹은 사륜알균의 군집을 이루었다(Fig. 1). 분리된 그람 양성 알균은 혈액한천배지에서는 자랐으나, MacConkey 배지에서는 자라지 않았다. VITEK 2 (bioMérieux, Durham, NC, USA)의 GP ID card를 이용하여 Dermacoccus nishinomiyaensis/Kytococcus sedentarius (excellent level)로 동정되었다. 균은 matrix-assisted laser desorption ionization time of fight mass spectrometry (MALDI-TOF MS, microflex LT, Bruker Daltonics, Bremen, Germany)를 이용하여 동정하였다. 집락은 직접 도말법을 이용해 도말했고, MALDI Biotyper RTC software 3.1과 6903 MSP (main spectra) Library를 사용하여 K. schroeteri (score 2.037)로 동정되었다. 정확한 균종 확인을 위해 마크로젠(Seoul, Korea)을 통해 16S rRNA 유전자 염기서열 분석을 시행하였다. 본 증례에서 분리된 균주의 DNA 증폭에 사용한 시발체는 5´-AGAGTTTGATCMTGGCTCAG-3´ (27F)과 5´-TACGGYTACCTT-GTTACGACTT-3´ (1492R)였으며, 16S rRNA 염기서열 분석에 사용한 시발체는 5´-GGATTAGATACCCTGGTA-3´ (785F)와 5´-CCGTCAATTCMTTTRAGTTT-3´ (907R)였다. 16S rRNA 유전자 염기서열을 BLAST database (http://www.ncbi.nlm.nih.gov/blast/)에서 검색한 결과 K. schroeteri Muenster 2000 (DSM 13884, RefSeq accession no: NR_028935.1)와 99.79% (1447/1450)의 일치도, K. sedentarius DSM 20547 (RefSeq accession no: NR_074714.2)와 98.14% (1424/1451)의 일치도를 보여, K. schroeteri로 동정하였다.
Mueller-Hinton 한천배지를 이용하여 항생제 감수성검사를 시행하였다. 최소억제농도(minimal inhibitory concentration, MIC)를 얻기 위해 penicillin, vancomycin, erythromycin, clindamycin, oxacillin, teicoplanin, trimethoprim/sulfamethoxazole, ciprofloxacin, levofloxacin, cefotaxime, ceftriaxone, imipenem, meropenem에 대해 E-test (bioMérieux)를 진행하였다 Kytococcus 속에 대한 최소억제농도 해석은 penicillin, vancomycin, erythromycin, clindamycin은 CLSI guideline M45 Ed3의 Micrococcus 속 기준을 따랐고[10], oxacillin, teicoplanin, trimethoprim/sulfamethoxazole, ciprofloxacin, levofloxacin은 CLSI guideline M100 S29의 Staphylococcus 속 기준을 따랐다[11]. 그 결과, penicillin, oxacillin에 대해 내성, clindamycin, ciprofloxacin에 대해 중간내성, vancomycin, erythromycin, teicoplanin, trimethoprim/sulfamethoxazole, levofloxacin에 감수성을 보였다(Table 1).
Antimicrobial susceptibility of Kytococcus schroeteri clinical isolate from blood culture determined by the E-test
입원 당일 3쌍의 혈액배양 후 gentamicin, vancomycin, rifampin 투약을 시작하였으나, rifampin은 내성 획득 우려로 투약 당일에 중단하였다. 입원 1일째 시행한 경흉부 심초음파 검사 및 경식도 심초음파 검사상 이상소견 없었고, 입원 4일째 시행한 전신 18F-FDG PET 검사상 상행대동맥의 혈관이식편의 광범위한 대사항진으로 염증성 병소 소견을 보였다. 입원 6일째부터 rifampin을 다시 투약하였고, 입원 13일째는 gentamicin을 중단하였다. 내원 22일째에 약열이 의심되어 vancomycin을 teicoplanin으로 변경하였다. 내원 35일째에 약열을 의심하여 teicoplanin과 rifampin을 중단하고, ciprofloxacin으로 변경하였고, 이후 5일간 투약 후 발열이 호전되어 입원 39일째에 퇴원하였다.
이후 입원 11일, 19일, 34일, 37일째에도 각각 3쌍 말초혈액배양을 시행하였으나 모두 5일간의 배양에서 음성으로 보고되었다.
Go to : 
Kytococcus 속은 이전에 Micrococcus 속에 속해 있었으나 Micrococcus 속과 다르게 penicillin과 methicillin에 내성이고, arginine dihydrolase 활성을 보이며, 16S rRNA 염기서열도 차이를 보여 재분류되었다[12]. K. schoroeteri는 2002년에 심내막염 환자의 혈액에서 처음 분리되었고[1], 최근 K. aerolatus가 실내 공기에서 분리되었다[13]. K. sedentarius와 마찬가지로 K. schroeteri도 피부의 상재균으로 알려져 있다. K. schroeteri에 의한 인체 감염은 매우 드물며 크게 두 종류의 환자군에서 발견된다[14]. 첫 번째는 인공판막, 인공관절, 뇌실-복강간 션트(VP shunt)와 같은 인공삽입물을 가진 환자에서 감염성 심내막염 등의 인공삽입물 관련 감염이다. 두 번째는 혈액종양에 걸렸거나 스테로이드를 복용한 면역저하환자에서 폐렴 및 폐렴에 따른 균혈증으로 나타난다.
이 증례에서 입원 당시 시행한 3쌍의 말초혈액배양 검사 중 하나의 호기성 병에서만 86시간의 배양 후 K. schroeteri가 확인되었다. 국내 첫 K. schroeteri에 의한 균혈증 증례에서는 3쌍의 말초혈액배양 중 하나의 혐기성 병에서만 확인되었는데[9], 국외 증례에서는 호기성 병에서 배양되었다[6-8]. 검출된 균이 오염균일 가능성을 완전히 배제할 수는 없으나, 인공판막과 연관하여 K. schroeteri에 의한 감염성 심내막염 증례가 지속적으로 보고되었고, 4회의 추가 혈액배양에서 오염균을 비롯한 다른 균이 검출되지 않아 원인균으로 판단하였다. 임상 진단기준에 따라 환자의 감염성 심내막염 가능성을 평가해보면 다음과 같다. Modified Duke criteria에 따르면 환자는 기저 심장질환이 있고, 오슬러 결절이 관찰되며, 3 쌍의 혈액배양 중 1쌍의 혈액배양병에서만 균이 배양되었으나 비전형적인 균으로 3개의 소 기준을 만족하여 감염성 심내막염 가능성이 있는 소견이었다[15]. 추가적으로 European Society of Cardiology 2015 modified criteria에 따르면, 환자는 인공판막이 있으며 전신 18F-FDG PET에서 상행대동맥의 혈관이식편에 염증성 병소 소견을 보여 1개의 주 기준을 추가로 만족하였다[16]. 따라서 환자는 확실한 감염성 심내막염 소견으로 판단할 수 있었다.
Kytococcus schroeteri는 VITEK 2 GP card에서 부정확하게 동정됨을 확인하였고, 이는 기존 보고와 일치하였다[7]. MALDI-TOF MS는 임상미생물검사실에서 신속하고 정확한 동정을 위해 널리 쓰이고 있다[17]. 국내 보고를 포함한 기존 증례에서는 MALDI-TOF MS로 동정에 실패했다고 보고하였으나[6, 9], 본 증례에서는 정확히 동정되었는데 이는 라이브러리의 버전에 따른 차이로 추측된다. 현재 Bruker 6903 MSP Library에 Kytococcus 속으로는 K. sedentarius와 K. schroeteri가 등재되어 있으며, 본 증례의 MALDI-TOF MS 결과 상 K. schroeteri (2.037)에 이어 K. sedentarius (1.341)의 결과를 보여, Kytococcus 속 내에서 정확히 구분할 수 있음을 확인하였다. CLSI guideline에서 16S rRNA 염기서열 분석으로 Kytococcus 속을 종 수준으로 동정하기 위해서는 1,000 bp 이상 염기서열을 분석해야 한다고 기술하고 있다[18]. 이에 따라 16S rRNA 염기서열분석으로 정확히 동정할 수 있었다.
Kytococcus 속은 Micrococcus 속과 다르게 penicillin과 oxacillin에 내성이다[14]. 그 외 K. schroeteri의 항생제 감수성 검사결과는 ciprofloxacin에 중간내성 내지는 내성, gentamicin, vancomycin, rifampin, teicoplanin, trimethoprim/sulfamethosazole, levofloxacin, moxifloxacin 등에 감수성으로 보고되고 있다[5, 7]. 본 증례에서 분리된 K. schroeteri도 이와 대부분 일치하는 결과를 보였다. 본 증례에서는 초기에 gentamicin, vancomycin, rifampin을 투여하였고, 약열을 의심하여 내원 22일에 teicoplanin, 내원 35일에 ciprofloxacin으로 항균제를 변경하여 투여하였다. 항균제 투여 이후 4회의 추적 말초혈액배양 결과 음성으로, 적절히 치료되었음을 확인할 수 있었다.
감염성 심내막염은 노령 인구에서 퇴행성 판막질환의 증가, 병원내 감염, 인조판막 치환술 환자의 증가, 혈관내 약물투여 환자 및 혈액투석 환자의 증가 등으로 증가하고 있다[19]. 심내막염 원인균 중 Staphylococcus 속과 Enterococcus 속이 증가하는 추세이고, 혈액배양 음성은 감소하는 추세이다[19, 20]. 적절한 항생제 치료를 위해 배양, 동정 및 항생제 감수성 검사결과가 중요한데, 드물게 동정되는 균종에 대해 MALDI-TOF MS를 통해 정확한 동정이 가능하게 되었다.
이 증례는 K. schroeteri에 의한 심내막염의 국내 첫 보고이다. 환자는 대동맥박리로 대동맥 및 대동맥판막 치환술을 받았고, 이후 간헐적인 열감이 지속되다 응급실을 통해 내원하였다. 이후 gentamicin, vancomycin, rifampin 등의 항생제로 균혈증은 음전되고 감염성 심내막염이 치료되었다. 인공판막은 K. schroeteri에 의한 심내막염의 위험요인으로 추정되며, 정확한 균종 동정을 위해서는 MALDI-TOF MS 및 16S rRNA 염기서열 분석이 유용하다.
Go to : 
REFERENCES
1. Becker K, Schumann P, Wüllenweber J, Schulte M, Weil HP, Stackebrandt E, et al. 2002; Kytococcus schroeteri sp. nov., a novel Gram-positive actinobacterium isolated from a human clinical source. Int J Syst Evol Microbiol. 52:1609–14. DOI: 10.1099/00207713-52-5-1609. PMID: 12361263.

2. Le Brun C, Bouet J, Gautier P, Avril J-L, Gaillot O. 2005; Kytococcus schroeteri endocarditis. Emerg Infect Dis. 11:179–80. DOI: 10.3201/eid1101.040761. PMID: 15714667. PMCID: PMC3294353.


3. Mnif B, Boujelbène I, Mahjoubi F, Gdoura R, Trabelsi I, Moalla S, et al. 2006; Endocarditis due to Kytococcus schroeteri: case report and review of the literature. J Clin Microbiol. 44:1187–9. DOI: 10.1128/JCM.44.3.1187-1189.2006. PMID: 16517928. PMCID: PMC1393139.


4. Renvoise A, Roux V, Casalta JP, Thuny F, Riberi A. 2008; Kytococcus schroeteri, a rare agent of endocarditis. Int J Infect Dis. 12:223–7. DOI: 10.1016/j.ijid.2007.06.011. PMID: 17919958.

5. Yousri T, Hawari M, Saad R, Langley S. 2010; Kytococcus schroeteri prosthetic valve endocarditis. BMJ Case Rep. 2010:bcr0620103064. DOI: 10.1136/bcr.06.2010.3064. PMID: 22778375. PMCID: PMC3028120.
6. Tamtami WNAI, Yaquobi FAI, Jardani AAI, Riyami MAI, Cormican M. 2019; First report of Kytococcus schroeteri prosthetic valve endocarditis in Oman. J Microbiol Exp. 7:247–8.
7. Blennow O, Westling K, Fröding I, Ozenci V. 2012; Pneumonia and bacteremia due to Kytococcus schroeteri. J Clin Microbiol. 50:522–4. DOI: 10.1128/JCM.01245-11. PMID: 22162554. PMCID: PMC3264184.


8. Amaraneni A, Malik D, Jasra S, Chandana SR, Garg D. 2015; Kytococcus schroeteri bacteremia in a patient with hairy cell leukemia: a case report and review of the literature. Case Rep Infect Dis. 2015:217307. DOI: 10.1155/2015/217307. PMID: 26064718. PMCID: PMC4439477.
9. Ha J, Kim KH, Kim JO, Hong JS, Jeong SH, Lee K. 2015; Bacteraemia caused by Kytococcus schroeteri in a pneumonia patient. J Med Microbiol Diagn. 4:1000199. DOI: 10.4172/2161-0703.1000199.
10. Clinical and Laboratory Standards Institute. 2015. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria. 3rd ed. Clinical and Laboratory Standards Institute;Wayne, PA:
11. Clinical and Laboratory Standards Institute. 2019. Performance standards for antimicrobial susceptibility testing. CLSI supplement M100. 29th ed. Clinical and Laboratory Standards Institute;Wayne, PA:
12. Stackebrandt E, Koch C, Gvozdiak O, Schumann P. 1995; Taxonomic dissection of the genus Micrococcus: Kocuria gen. nov., Nesterenkonia gen. nov., Kytococcus gen. nov., Dermacoccus gen. nov., and Micrococcus Cohn 1872 gen. emend. Int J Syst Bacteriol. 45:682–92. DOI: 10.1099/00207713-45-4-682. PMID: 7547287.

13. Kämpfer P, Martin K, Schäfer J, Schumann P. 2009; Kytococcus aerolatus sp. nov., isolated from indoor air in a room colonized with moulds. Syst Appl Microbiol. 32:301–5. DOI: 10.1016/j.syapm.2009.05.004. PMID: 19541443.

14. Shah AS, Vijayvargiya P, Jung S, Wilson JW. 2019; Postoperative hardware-related infection from Kytococcus schroeteri: its association with prosthetic material and hematological malignancies-A report of a case and review of existing literature. Case Rep Infect Dis. 2019:6936472. DOI: 10.1155/2019/6936472. PMID: 31019817. PMCID: PMC6451804.
15. Li JS, Sexton DJ, Mick N, Nettles R, Fowler VG Jr, Ryan T, et al. 2000; Proposed modiÿcations to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis. 30:633–8. DOI: 10.1086/313753. PMID: 10770721.

16. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015; 2015 ESC Guidelines for the management of infective endocarditis: The task force for the management of infective endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 36:3075–128. DOI: 10.1093/eurheartj/ehv319. PMID: 26320109.

17. Clark AE, Kaleta EJ, Arora A, Wolk DM. 2013; Matrix-assisted laser desorption ionization-time of flight mass spectrometry: a fundamental shift in the routine practice of clinical microbiology. Clin Microbiol Rev. 26:547–603. DOI: 10.1128/CMR.00072-12. PMID: 23824373. PMCID: PMC3719498.


18. Clinical and Laboratory Standards Institute. 2018. Interpretive criteria for identification of bacteria and fungi by targeted DNA sequencing. CLSI guideline MM18. 2nd ed. Clinical and Laboratory Standards Institute;Wayne, PA:
19. Vincent LL, Otto CM. 2018; Infective endocarditis: update on epidemiology, outcomes, and management. Curr Cardiol Rep. 20:86. DOI: 10.1007/s11886-018-1043-2. PMID: 30117004.

20. Slipczuk L, Codolosa JN, Davila CD, Romero-Corral A, Yun J, Pressman GS, et al. 2013; Infective endocarditis epidemiology over five decades: a systematic review. PLoS One. 8:e82665. DOI: 10.1371/journal.pone.0082665. PMID: 24349331. PMCID: PMC3857279.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download