Abstract
As bacteria are pathogens that often cause healthcare-associated infections, it is important to understand their characteristics, in order to carry out proper infection control activities. Differences in virulence and site of colonization cause differences in the distribution of major causative pathogens, and thus in the types of infection. Antimicrobial-resistant bacteria are particularly important in healthcare-associated infections because they erode the efficacy of antibiotics and lead to treatment failure. To prevent the spread of antimicrobial-resistant bacteria within healthcare facilities, infection control activities, including encouraging hand hygiene and application of contact precaution for infected patients are necessary.
Go to : 
의료관련감염(Healthcare-associated infection)은 의료기관에서 시행하는 여러가지 의료행위와 연관된 모든 감염을 일컫는 말로, 사망률, 재원기간, 의료비 등을 포함한 환자의 예후에 치명적인 악영향을 미칠 수 있기 때문에 의료환경에서 발생을 최대한 예방해야 하는 대상으로 간주되고 있다[1]. 또한, 의료 기술이 발전함에 따라 과거에 비해 침습적 시술이 증가하고, 면역이 저하된 환자와 항생제 내성균이 증가하여 그 어느때보다 의료관련감염이 중요한 문제로 부각되고 있는 상황이다[2].
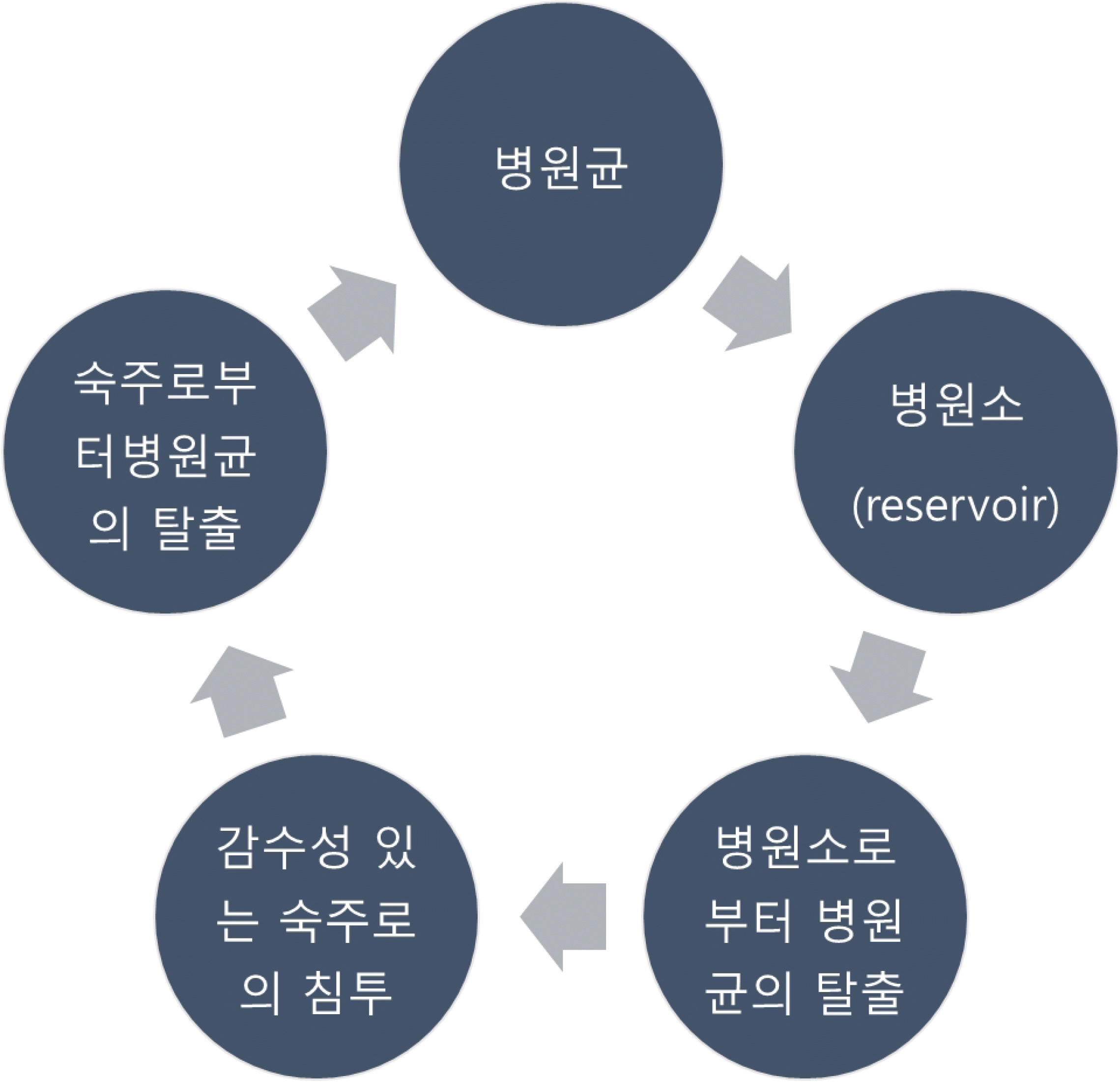
일반적인 감염증과 마찬가지로 의료관련감염은 세균(bacteria), 진균(fungi), 바이러스(viruses), 기생충(parasites) 등을 포함한 미생물(microorganisms)에 의하여 발생하게 된다. 인체나 환경 등에 존재하는 미생물이 인체 내부에 침투하여 손상을 입히게 되어 여러가지 임상 증상이 나타나는 현상을 감염증(infection)이라고 하며, 이러한 감염증을 유발할 수 있는 미생물을 병원성 미생물(pathogen)이라고 한다. 병원성 미생물은 서식지인 저장소(reservoir)에서 성장과 증식을 하게 되고, 저장소는 병원성 미생물의 종류에 따라 차이가 있다. 가령 황색 포도알균(Staphylococcus aureus)는 사람의 비강에서 주로 서식하는 반면, 결핵균(Mycobacterium tuberculosis)은 사람의 폐에서 주로 서식한다. 저장소에 따라 대변, 소변, 비말(침방울) 등으로 병원균이 빠져나가게 되고, 이를 통하여 감수성이 있는 숙주에게 전파되어 새로운 감염증을 유발한다. 의료관련감염을 일으키는 병원성 미생물은 주로 공기, 비말, 접촉이라는 경로를 통해 전파된다. 이러한 일련의 과정을 ‘감염고리(chain of infection)’이라고 하며 감염관리는 이 과정 중 일부(특히 병원성 미생물의 전파 경로)를 차단하여 의료기관 내 환자간, 환자와 직원간, 직원간 감염의 전파를 방지하는데 중점을 둔다(Fig. 1) [3].
세균은 단단한 세포벽을 가진 단세포 유기체로 인체 밖에서도 생존할 수 있으며 숙주 세포의 도움이 없이도 스스로 증식할 수 있는 능력을 가지고 있는 생명체로 대표적인 의료관련감염인 요로감염, 창상감염, 폐렴, 혈류감염 등을 유발한다. 과거에 비해 늘어난 병원 내 항생제 내성균은 의료관련감염 환자에게 효과적인 항생제 치료를 어렵게 만들고 결과적으로 치료 경과에 심각한 악영향을 미치고 있다[4]. 특히, 의료기관 내 요로감염, 폐렴 등을 유발하는 Acinetobacer baumanii는 국내 의료기관에서 주요 항생제에 내성을 나타내는 비율이 급속히 증가한 결과 현재는 imipenem에 90% 내외의 내성률을 나타내고 있어 임상적으로 큰 문제가 된다[5,6]. 본 연제에서는 의료관련감염을 유발하는 원인 병원성 미생물인 세균의 특성에 대해서 논의하고자 한다.
Go to : 
세균은 스스로 증식할 수 있는 가장 작은 단위의 단세포 원핵생물(prokaryotes)로 증식에 필요한 핵산, 단백질, 지질 및 당질을 보유하고 있다. 크기는 대개 1 마이크로미터 내외로 육안으로 관찰되지 않으며, 현미경을 사용하였을 때 100배-1000배의 배율로 관찰이 가능하다.
기본적으로 세균은 염색이 되는 패턴에 따라 구분할 수 있다. 이 중 그람 염색법(Gram stain)은 임상에서 가장 흔하게 사용되는 염색법이다. 그람 염색은 다음과 같은 순서로 진행된다. 1) 임상 검체(예: 고름, 소변 등) 혹은 배양된 세균을 슬라이드 글라스에 떨어뜨리고 넓게 펴서 알코올 램프를 이용하여 건조시킨다. 2) 군청색을 띠는 크리스탈 바이올렛(crystal violet)을 떨어뜨려 염색한다. 3) 요오드 용액을 이용하여 색소를 고착시킨다. 이 과정에서 크리스탈 바이올렛과 요오드가 반응하여 자주색을 띠는 복합체(CV-I)를 형성한다. 4) 95% 에탄올을 이용하여 착색된 복합제(CV-I)를 용해시킨다. 5) 붉은색의 색소인 사프라닌(safranin)으로 대비염색을 진행한다. 95% 에탄올을 이용한 탈색 과정 시 그람양성균의 경우 세포벽을 구성하는 펩티도글리칸층이 두껍기 때문에 착색된 복합물이 세포내에 그대로 남아있고, 상대적으로 펩티도글리칸층이 얇은 그람음성균의 경우 탈색된다. 그 결과 그람양성균은 보라색, 그람음성균은 무색으로 보인다. 이후 시행하는 대비염색 과정을 통해 그람음성균은 붉은색으로 염색되어 최종적으로 그람양성균은 보라색, 그람음성균은 붉은색으로 관찰된다.
현미경에서 관찰되는 형태에 따라 세균을 구분하기도 하는데 구형인 알균(cocci), 길고 가느다란 형태를 가지는 막대균(bacilli), 그리고 나선형인 나선균(spirillum)의 세가지 형태로 분류할 수 있다. 또한, 일부 균종의 경우 세균 분열 형태에 따라 고유한 형태의 집락을 형성한다. 예를 들면, 포도알균(Staphylococcus)의 경우 포도송이 모양으로 덩어리진 형태로 집락되어 있는 반면, 사슬알균(Streptococcus)의 경우 사슬형태로 연결된 형태로 집락하는 특성을 가진다.
세균의 염색 패턴과 형태에 따른 분류는 원인균의 추측과 이의 치료를 위한 항생제 선택에 중요한 정보를 줄 수 있다. 비교적 검사 소요시간이 짧아서 검체 채취 후 수시간 내에 검사 결과를 확인할 수 있다는 장점이 있지만 정확한 균주와 이의 항생제 감수성을 알기 위해서는 추가적인 배양검사와 항생제 감수성 검사가 필요하다. 세균 염색 패턴과 형태에 따른 분류의 예시는 Table 1과 같다.
Classification of bacteria according to staining pattern
세균의 생존과 증식에 산소가 필요한지 여부에 따라 산소성균(생존을 위해 산소 요구도가 높음)과 무산소성균(산소가 없는 환경에서 생존), 그리고 조건 무산소성균(산소가 있는 환경과 없는 환경에서 모두 생존 가능)으로 분류하기도 한다. 무산소성균의 경우 인체에서는 구강과 위장관에 상재균(normal flora)로 존재하며 Peptostreptococcus spp., Bacteroides fragilis 등이 대표적인 균주이다. 산소가 있는 환경에서 쉽게 사멸하기 때문에 검체를 잘 다루지 못할 경우 배양 결과를 얻을 수 없는 경우가 흔하다. 구강내의 무산소성균은 주로 그람 양성균이며 대부분의 그람 양성균을 타겟으로 하는 항생제에 감수성이 있으나, 위장관에 존재하는 그람 음성 무산소성균은 항생제 내성을 나타내는 경우가 흔하다. 가장 흔한 그람 음성 무산소성균인 B. fragilis에 효과적인 것으로 알려져 있는 대표적인 항생제 계열은 metronidazole, carbapenem, beta-lactam/beta-lactamase inhibitor이다[7,8]. 세균의 염색 패턴과 산소요구도에 따른 분류는 Table 2와 같다.
Classification of bacteria according to oxygen requirement
Go to : 
모든 세균은 단단한 외층인 세포벽(cell wall), 그 내부에 존재하는 얇은 세포질막(cytoplasmic membrane), 그리고 세포질막에 둘러싸인 세포질(cytoplasm)로 구성되어 있다.
세포벽에는 작은 통로인 포린(porin)이 존재하는데 이를 통하여 외부 환경과 세균 내부 사이에 물질 이동을 가능하게 한다. 일부 세균에는 세포벽으로부터 돌출된 섬모(pili)나 편모(flagella)가 존재하는데, 섬모는 세균이 숙주 세포에 부착하는 데 도움을 주고, 편모는 세균의 이동시키는 역할을 한다.
펩티도글리칸 성분의 함량이 그람양성균에 현저히 높기 때문에 그람양성균의 세포벽은 그람음성균보다 두껍다. 그람음성균의 세포벽은 그람양성균보다 복잡한데 특히, 그람양성균에 존재하지 않는 외막(outer membrane)이 존재하는 것이 특징적이다. 외막의 바깥쪽 면은 일부 지질이 내독소(endotoxin)로 작용하는 지질다당류(lipopolysaccharide, LPS) 복합체를 포함하는데 이는 인체 순환계에서 독성 반응을 일으켜 패혈증을 유발하는 중요한 요소로 작용할 수 있다. 많은 항생제들이 세포벽을 파괴하면서 항균력을 발휘하기 때문에 그람양성균과 그람음성균의 세포벽 구성 차이는 치료에 주로 사용하는 항생제의 차이로 이어진다. 가령 페니실린은 그람양성세포벽의 주 성분인 펩티도글리칸의 결합을 저해시키는데 펩티도글리칸 벽이 얇은 그람음성균에 대해서는 별 효과를 발휘하지 못한다[9].
일부 세균은 세포벽의 외측에 주로 다당류로 구성된 협막(capsule)을 가지고 있기도 한다. 협막은 숙주에 부착하여 영양분의 흡수를 원활하게 하도록 도울 뿐 아니라 숙주 내부의 방어인자들에 의한 식균작용(phagocytosis)에 저항하는 기능을 한다. 따라서 협막이 있는 세균은 대개 독력(virulence)이 강하다. 협막을 보유하는 주요 세균에는 폐렴사슬알균(Streptococcus pneumoniae), 폐렴막대균(Klebsiella pneumoniae), 수막알균(Neisseria meningitidis), 헤모필루스 인플루엔자(Haemophilus influenzae) 등이 있다. 이러한 협막이 있는 세균들의 포식작용을 담당하는 중요한 기관이 비장(spleen)인데 비장이 제거되거나 기능이 저하되는 상황에서 협막이 있는 세균들에 대한 멸균 작용이 저하되며 결과적으로 이들 균주에 의한 감염에 취약해진다. 현재 폐렴알균(pneumococcus) 백신, 수막알균(meningococcus) 백신, B형 헤모필루스 인플루엔자(Haemophilus influenzae type B) 백신이 개발되어 있기 때문에 비장이 제거되거나 기능이 떨어진 혹은 제거할 예정인 환자들에게 투여하는 것이 추천된다[10].
그람양성 막대균 중 바실루스 균 속(Bacillus spp.)이나 클로스트리디움 속(Clostridium spp.)의 경우 아포(spore)를 형성하는 세균으로 잘 알려져 있다. 이들 아포형성균은 영양소가 고갈되는 열악한 환경에서 대사가 중지되고 세포 성분이 휴지기에 진입한 아포로 변형한다는 특성이 있다. 이러한 습성으로 인해 오랜 기간(수개월-수년) 환경에서 생존할 수 있으며 주변 환경이 좋아질 경우 다시 생명활동을 시작하게 된다. 아포는 그 주위에 두꺼운 껍질을 만들기 때문에 건조, 고열, 산과 염기, 소독약 등에 매우 저항력이 강하며 따라서 이들 세균에 오염된 의료기구는 아포를 사멸시킬 수 있는 멸균을 적용해야 하며, 오염된 환경은 아포를 제거할 수 있는 염소계 소독제(염소 5,000 ppm: 락스 원액 농도에 따라 1:8 또는 1:10)를 사용해야 한다[11]. 아포형성균을 보유하고 있는 환자와 접촉했을 경우에는 손소독제를 이용한 손위생만으로는 아포를 사멸시킬 수 없기 때문에 물과 비누를 이용한 손씻기가 필요하다[2].
세균의 세포질 내부에는 유전자 정보를 담고 있는 DNA가 모여서 이루는 염색체(chromosome)가 존재하는데 핵막을 가지고 있지 않아 경계가 뚜렷치 않다는 점에서 진균과 같은 진핵세포(eukaryotes)와 차이점이 있다. 세균에는 주 염색체 외에 플라스미드(plasmid)라는 작은 원형의 부수적인 DNA가 염색체와 별개로 세포질 내부에 존재한다. 플라스미드는 세균의 생존을 위해서 반드시 필요한 것은 아니며, 자율적으로 복제될 수 있고, 동종 또는 이종 세균간에 접합(conjugation)을 통하여 교환될 수 있다. 플라스미드에 항생제 내성 유전자 포함되는 경우가 종종 있는데 접합을 통하여 다른 세균에게 옮겨가게 되어 항생제 내성균이 증가할 수 있다. 이는 카바페넴 분해효소 생성 장내세균속균종(Carbapenemase-producing Enterobacteriales, CPE)을 포함한 항생제 내성균 확산의 중요한 기전 중 하나로 알려져 있다[12].
염색체와 플라스미드 외에도 단백질 합성에 관여하는 리보솜(ribosome)이 세포질 내에 다수의 균일한 입자 형태로 존재한다. 일부 항생제의 경우 리보솜을 타겟으로 하여 세균을 사멸시킨다. Streptomycin을 포함한 aminoglycoside 계통 항생제는 30s 리보솜, erythromycin을 포함한 macrolide 계통 항생제나 doxycycline을 포함한 tetracycline 계통 항생제는 50s 리보솜과 특이적으로 결합하여 세균의 단백질 합성을 저해한다[13].
Go to : 
세균이 인체에 침입한다고 하여 모두 감염으로 진행되는 것은 아니다. 인체에 침입하고 증식하지만 조직에 손상을 입히지 않고, 따라서 임상 증상도 나타나지 않는 현상을 집락화(colonization) 혹은 불현성 감염(inapparent infection)이라고 한다. 숙주의 면역력이 저하되거나 병원체의 양이 증가되는 등 미생물과 숙주간 상호작용에 불균형이 발생할 때 현성 감염(apparent infection)이 발생하게 된다.
세균이 인체에 침입하고 독소를 생성하는 능력, 즉, 감염증을 일으킬 수 있는 능력을 독력(virulence)이라고 부르며 이는 세균 종류에 따라 다소간의 차이가 있다. 의료관련감염을 흔히 유발하는 Staphylococcus aureus, 혹은 Klebsiella pneumoniae를 포함한 그람음성 장내세균은 비교적 높은 독력을 가지고 있는 세균이기 때문에 현성 감염을 유발하는 비율이 높고 치명적인 감염증을 유발할 확률도 비교적 높은 반면, Enterococcus spp., Coagulase-negative staphylococci는 이들에 비해 낮은 독력을 가지고 있으므로 정상 면역을 가진 숙주에 침투하더라도 현성 감염으로 진행할 확률이 비교적 낮으며 주로 인공삽입물이나 중심정맥관과 연관된 감염증의 원인균으로 작용한다[14,15]. 독력과 별개로 침투하는 세균의 수가 많을수록 현성 감염이 발생할 확률이 높아지고 숙주의 반응도 심하게 나타나게 된다[16].
세균이 인체에 침입되어 감염증으로 발현되는 것을 방지하기 위하여 여러가지 방어 시스템이 존재한다. 방어의 첫 단계는 물리적 장벽으로 피부, 호흡기 상피 세포의 섬모와 점액, 위산 등이 여기에 해당한다. 이러한 물리적 장벽에 손상을 입게 되면 감염증에 취약해진다. 가령, 화상이나 찰과상 등으로 피부가 손상될 경우 피부에 상재하고 있는 그람양성균이 침투하여 연조직염(cellulitis) 등이 발생할 수 있고, 인플루엔자 감염이나 흡연으로 인하여 호흡기 상피세포의 섬모가 손상될 경우 비인두에 집락되어 있던 폐렴구균 등에 의하여 세균성 폐렴이 발생할 수 있다. 세균이 물리적 방어막을 통과하고 체내로 침투하면 인체는 이를 방어하기 위해 면역(immunity)체계를 가동시킨다. 면역은 개체가 태어날 때부터 가지고 있는 선천성 면역(innate immunity)과 감염원으로의 노출 등의 요인에 의해 후천적으로 획득되는 후천성 면역(adaptive immunity)으로 구성된다. 선천성 면역은 보체(complements), 호중구(neutrophil), 대식세포(macrophage) 등으로 구성되며 병원체가 침투하는 초기에 주로 가동된다. 선천성 면역 체계는 병원체를 빠른 시간에 제거함과 동시에 병원체에 대한 중요한 정보를 전달하여 후천성 면역이 작동할 수 있도록 돕는다. 후천성 면역은 B 세포와 T 세포로 구성되며 선천 면역 발현 후 일정 시간 이후에 유발되며, 선천성 면역에서 충분히 제거되지 않은 병원체를 제거하는 데 관여한다. 후천성 면역 발현의 과정에서 B 세포 가운데 일부가 형질 세포(plasma cell)로 변환되고, 형질 세포는 다시 기억 세포(memory B cell)로 분화되어 감염증이 종료된 후에도 오랜 기간 체내에 남는다. 체내에 남아있는 기억 세포는 동일한 병원체가 침투하였을 때 빠른 속도로 후천성 면역체계를 가동시키는 역할을 하며 이를 통해 다량의 항체를 신속히 생성함으로써 효율적인 병원체 제거에 기여한다. T 세포 역시 일부가 남아 기억 세포(memory T cell)로서 작용하여 재침입한 병원체에 빠르게 대응한다. 이러한 면역 체계의 특성을 이용하여 감염증이 노출되기 이전 혹은 직후에 병원체의 일부 혹은 전부를 투여하여 기억 세포 생성을 유도하는 과정이 바로 백신(vaccination)이다. 현재 세균에 대해 개발되어 사용 가능한 백신에는 폐렴알균(pneumococcus) 백신, 수막알균(meningococcus) 백신, B형 헤모필루스 인플루엔자(Haemophilus influenzae type B) 백신 정도가 있다.
Go to : 
세균 종류별로 고유한 특성에 따라 항생제에 내성을 나타내는 것을 자연 내성이라고 하는데 그람음성 막대균이 vancomycin에 내성을 나타내거나 그람양성 구균이 colistin에 내성을 나타내는 것이 자연 내성의 대표적인 예라고 할 수 있겠다. 반면, 세균 유전자의 변화에 따라 구조가 변화되어 원래 감수성이 있는 항생제에 내성을 나타내는 것을 획득 내성이라고 하며 이렇게 내성을 획득한 균에 의한 감염이 발생할 경우 감염증 발생 초기에 효과적인 항생제가 투여될 확률이 낮아지게 되고 치료 실패로 이어지게 될 확률이 높아진다[17]. 결과적으로 사망률, 재원기간, 의료비용의 상승이 유발되기 때문에 항생제 내성은 반드시 해결해야 하는 중요한 공중보건학적 문제이다[18].
개별 세균 차원에서 항생제에 내성을 획득하는 기전은 크게 세가지다: 1) 항생제가 표적부위에 도달하지 못하게 함(efflux pump 생성, porin 소실), 2) 항생제를 무력화시킴(효소를 통한 가수분해), 3) 항생제가 표적부위에 부착하는 것을 막음(표적 변화, 표적 숨김 등). 항생제 내성 획득은 항생제 사용과 밀접한 연관성이 있다[19]. 항생제를 사용하는 과정에서 인체 내부에 존재하는 균 집락 중 감수성을 가지고 있는 균주가 사멸되고, 해당 항생제에 내성을 획득한 균주가 생존하고 증식하는 ‘적자생존의 법칙’이 적용된다. 따라서 항생제 내성균 발현을 줄이기 위해서는 항생제 오남용을 줄여야 하는데, 이를 위해 의료기관 차원에서 수행되는 활동이 바로 ‘항생제 스튜어드십 프로그램(Antimicrobial stewardship program)’이다[20].
내성을 획득한 세균은 증식 과정에서 다음 세대의 세균에게 내성 유전자를 전달하고(수직 전파, vertical transmission) 플라스미드에 포함된 내성 유전자(e.g. blaKPC
, blaNDM
, blaOXA
, blaCTX-M
, blaTEM
등)를 세균간 접합을 통하여 다른 세균으로 전파시키는 방법을 통해(수평전파, transverse transmission) 숙주의 안팎에서 내성균의 증폭이 일어난다[21]. 항생제 내성균에 감염되었거나 집락된 환자를 직접적으로 접촉하거나 항생제 내성균으로 오염된 환자 주변 환경을 접촉하게 되면 항생제 내성균이 다른 사람에게 전파될 수 있다[22]. 환자를 진단하고 치료하는 과정에서 항생제 내성균에 오염된 의료진의 손을 통해 다른 환자에게 2차적으로 전파될 수 있으므로 항생제 내성균 전파 방지를 위해 의료진의 손위생 준수를 강조하는 것은 아무리 강조해도 지나치지 않다[23]. 이렇게 전파된 항생제 내성균은 환자를 감염시켜 환자의 예후에 악영향을 미칠 수 있고, 환자에게 손상을 입히지는 않지만 환자 체내, 혹은 체외에 집락되고 증식하여 다른 환자에게 다시 전파될 수 있다. 따라서 의료기관 내에서 항생제 내성균이 전파되는 것을 최대한 저지해야 하며 이는 감염관리 분야에 있어 중요한 활동 중 하나이다.
의료기관 내의 항생제 내성균 관리를 위해서 항생제 내성균에 감염되거나 집락된 환자에게 손위생, 안전주사실무 지침 준수 등 모든 환자를 대상으로 하는 감염관리 원칙인 표준주의를 강조하는 것에 더하여 접촉주의를 수행한다[11]. 접촉주의는 환자의 격리, 환자 및 주변 환경 접촉 시 장갑과 가운을 착용, 환자 전용 물품 사용, 환자의 병실 밖 이동 제한, 그리고 환경관리로 구성된다[23]. 의료기관마다 병실이나 인력 등의 구조에 다소간의 차이가 있기 때문에 접촉주의를 적용하는 항생제 내성균의 종류는 의료기관마다 다소 차이가 있지만 2급 법정 감염병에 해당되는 카바페넴 내성 장내세균속균종(carbapenem-resistant Enterobacteriales, CRE), 그리고 비교적 낮은 빈도로 관찰되는 반코마이신 내성 또는 중등도 내성 황색포도알균(vancomycin-resistant S. aureus/vancomycin-intermediate S. aureus, VRSA/VISA)의 경우 다른 항생제 내성균에 우선하여 접촉주의를 적용하는 것과 이들 세균에 감염 혹은 집락된 환자는 가급적 1인실에 격리하는 것이 권고된다[2]. 이 외에도 가능하다면 4급 감염병에 해당되는 메티실린 내성 황색 포도알균(methicillin-resistant S. aureus, MRSA), 반코마이신 내성 장알균(vancomycin-resistant Enterococci, VRE), 다제내성 녹농균(multidrug-resistant Pseudomonas aeruginosa, MRPA), 그리고 다제내성 아시네토박터 바우마니균(multidrug-resistant Acinetobacter baumanii)에 대해서도 접촉 주의를 적용하는 것이 권고된다.
Go to : 
정상 상재균(normal flora)은 인체에 정착하여 살아가는 세균의 집합체로 생체와 밀접한 관계를 유지한다. 이들은 엽산, 비타민 K 등의 인체에 이로운 물질을 합성하고, 영양물의 소화나 흡수를 보조하고, 외부 미생물로부터의 감염을 방어하는 작용을 하는 등 인체의 생존에 필요한 작용을 하지만 숙주의 면역이 저하되거나 물리적 장벽에 손상이 발생하는 경우 정상 상재균이 감염을 일으킬 수 있다[24].
장기별로 주로 집락되어 있는 상재균은 다소 차이가 있다. 피부에는 주로 그람양성 세균인 Staphylococcus epidermidis, Microccus spp., Corynebacterium spp., Streptococcus spp. 등이 존재한다. 피부가 손상될 경우 상재균의 침투에 의한 감염증인 연조직염(cellulitis)이나 얕은연조직염(erysipelas) 등이 발생할 수 있고 치료를 위해서는 그람양성 세균에 효과적인 항생제인 1세대 세팔로스포린이나 페니실린 계통의 항생제를 사용하는 것이 권고된다. 어떤 사람의 겨드랑이나 회음부, 혹은 비강 내부에는 높은 독성을 가지는 Staphylococcus aureus가 존재하기도 하며 이를 보유하고 있는 사람의 경우 Staphylococcus aureus에 의한 감염증이 발생할 확률이 높아진다. 혈액 배양 검사를 위한 혈액 검체 채취 시 피부를 철저히 소독하지 않는다면 피부 상재균에 검체가 오염되어 배양될 수 있어 결과 해석에 주의를 요한다[25].
위장관계에는 주로 그람음성균이 존재하는데 대표적으로 산소성 또는 조건 무산소성 세균인 Escherichia coli, Klebsiella pneumoniae, Serratia spp., Proteus spp., Enterobacter spp.와 무산소성 세균인 Bacteroides fragilis, Prevotella spp. 등이 존재한다. 산도가 높은 위산으로 인하여 위와 상부소장 부위에 서식하는 세균은 그리 많지 않고 앞서 언급한 세균은 대부분 하부 위장부위에 서식한다. 이들 균은 게실염, 담도염, 간농양 등 복강내 감염의 원인균으로 작용할 뿐 아니라 회음부에 집락되었다가 요도를 침입할 경우 요로감염을 유발할 수도 있다. 따라서 복강내 감염, 요로 감염이 발생하였을 경우 이들 균주에 효과적인 3세대 세팔로스포린, 퀴놀론, 카바페넴 계통의 항생제를 사용하는 경우가 많다.
구강과 상기도에는 산소성 세균인 Streptococcus spp., Neisseria spp., Haemophilus spp.와 무산소성 세균인 Fusobacterium spp., Actinomyces spp. 등이 존재하게 되며 이들 균이 흡인될 때 폐렴이 발생하므로 세균성 폐렴의 치료에는 3세대 세팔로스포린이나 퀴놀론 계통의 항생제가 권고된다. 의료관련감염에서 중요한 그람음성균인 Pseudomonas aeruginosa나 Acinetobacter baumanii의 경우 일반적으로 체내에 상재균으로 존재하지 않고 환경에 존재하게 되며 주로 의료장비 사용을 통해 전파와 감염증이 발생한다.
일부 환자에는 항생제 내성을 획득한 정상 상재균이 체내에 존재하는데 이러한 환자에서 감염이 발생할 경우 초기 항생제 선택에 어려움을 겪을 수 있다. 또한 항생제 내성균을 보유한 환자는 의료기관 내 항생제 내성균 전파의 원인이 되기도 한다. 일부 기관에서는 항생제 내성균에 의한 감염 전파를 방지하기 위해 중환자실 등 특정 부서의 환자들을 대상으로 클로르헥시딘(chlorohexidine) 목욕을 시키기도 하는데 이는 피부에 주로 상재하는 메티실린 내성 황색 포도알균(methicillin-resistant S. aureus, MRSA)에 의한 감염전파 예방에는 효과가 입증된 반면, 위장관에 주로 상재하는 카바페넴 내성 장내세균속균종(carbapenem-resistant Enterobacteriaceae, CRE)을 포함한 그람음성균에 의한 감염전파 예방에는 아직 효과가 불명확하다[26,27].
Go to : 
세균은 의료관련감염을 흔히 유발하는 미생물이기 때문에 감염관리 업무를 이해하고 수행함에 있어 앞서 소개한 특성들을 이해하는 것이 중요하다. 세균별로 독력과 주로 상재하는 부위가 다르다는 점을 이해하고 배양 검사 결과를 적절하게 해석을 할 수 있다면 중환자실 내 기구관련 의료관련감염률 감시를 비롯한 기관 내 감염 감시 활동 수행을 보다 효율적으로 할 수 있을 것이다. 또한, 항생제 내성균의 발생 기전과 전파 경로를 이해함으로써 각 기관에서 항생제 내성균 전파를 방지하기 위해 수행하고 있는 표준주의와 접촉주의의 구성 요소에 대해 보다 명확히 파악할 수 있고, 타 의료진을 교육하는 데에도 도움이 될 것으로 예상한다.
Go to : 
REFERENCES
1. Yoo JH. 2018; Principle and perspective of healthcare-associated infection control. J Korean Med Assoc. 61:5–12. DOI: 10.5124/jkma.2018.61.1.5.

2. Korea Centers for Disease Control and Prevention (KCDC). 2017. Guidelines for prevention and control of Healthcare associated infections. KCDC;Cheongju: p. 1–292.
3. Centers for Disease Control and Prevention. Principles of epidemiology in public health practice: an introduction to applied epidemiology and biostatistics. Principles of epidemiology in public health practice: an introduction to applied epidemiology and biostatistics.
https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section10.html
. Updated on May 18 2012.
4. Kang CI. 2015; Antimicrobial therapy for infections caused by multidrug-resistant Gram-negative bacteria. Korean J Med. 88:502–8. DOI: 10.3904/kjm.2015.88.5.502.

5. Kim EJ, Kwak YG, Kim TH, Lee MS, Lee SO, Kim SR, et al. 2019; Korean National Healthcare-associated Infections Surveillance System, intensive care unit module report: summary of data from July 2017 through June 2018. Korean J Healthc Assoc Infect Control Prev. 24:69–80. DOI: 10.14192/kjicp.2019.24.2.69.

6. Kwak YG, Choi JY, Yoo H, Lee SO, Kim HB, Han SH, et al. 2016; Korean National Healthcare-associated Infections Surveillance System, intensive care unit module report: summary of data from July 2014 through June 2015. Korean J Healthc Assoc Infect Control Prev. 21:37–49. DOI: 10.14192/kjhaicp.2016.21.2.37.

7. Snydman DR, Jacobus NV, McDermott LA, Golan Y, Goldstein EJ, Harrell L, et al. 2011; Update on resistance of Bacteroides fragilis group and related species with special attention to carbapenems 2006-2009. Anaerobe. 17:147–51. DOI: 10.1016/j.anaerobe.2011.05.014. PMID: 21664469.

8. Edwards R, Hawkyard CV, Garvey MT, Greenwood D. 1999; Prevalence and degree of expression of the carbapenemase gene (cfiA) among clinical isolates of Bacteroides fragilis in Nottingham, UK. J Antimicrob Chemother. 43:273–6. DOI: 10.1093/jac/43.2.273. PMID: 11252334.

9. Beveridge TJ. 1999; Structures of gram-negative cell walls and their derived membrane vesicles. J Bacteriol. 181:4725–33. DOI: 10.1128/JB.181.16.4725-4733.1999. PMID: 10438737. PMCID: PMC93954.

10. Ryu M, Kwon N, Kim YB, Park J, Lee S. 2013; Prophylactic antibiotics therapy after splenectomy. Clin Pediatr Hematol Oncol. 20:95–101.
11. Korea Centers for Disease Control and Prevention (KCDC). 2014. Guideline for disinfection and sterilization in healthcare facilities. KCDC;Cheongju: p. 1–64.
12. Yigit H, Queenan AM, Anderson GJ, Domenech-Sanchez A, Biddle JW, Steward CD, et al. 2001; Novel carbapenem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae. Antimicrob Agents Chemother. 45:1151–61. DOI: 10.1128/AAC.45.4.1151-1161.2001. PMID: 11257029. PMCID: PMC90438.
13. Wilson DN. 2014; Ribosome-targeting antibiotics and mechanisms of bacterial resistance. Nat Rev Microbiol. 12:35–48. DOI: 10.1038/nrmicro3155. PMID: 24336183.

14. Boyle KK, Wood S, Tarity TD. 2018; Low-virulence organisms and periprosthetic joint infection-biofilm considerations of these organisms. Curr Rev Musculoskelet Med. 11:409–19. DOI: 10.1007/s12178-018-9503-2. PMID: 29961193. PMCID: PMC6105490.

15. Buetti N, Lo Priore E, Atkinson A, Widmer AF, Kronenberg A, Marschall J. 2018; Catheter-related infections: does the spectrum of microbial causes change over time? A nationwide surveillance study. BMJ Open. 8:e023824. DOI: 10.1136/bmjopen-2018-023824. PMID: 30580270. PMCID: PMC6307612.

16. Sibbald RG, Woo K, Ayello EA. 2006; Increased bacterial burden and infection: the story of NERDS and STONES. Adv Skin Wound Care. 19:447–61. quiz 461-3. DOI: 10.1097/00129334-200610000-00012. PMID: 17008815.
17. Livermore DM. 2012; Current epidemiology and growing resistance of gram-negative pathogens. Korean J Intern Med. 27:128–42. DOI: 10.3904/kjim.2012.27.2.128. PMID: 22707882. PMCID: PMC3372794.

18. Spellberg B, Guidos R, Gilbert D, Bradley J, Boucher HW, Scheld WM, et al. 2008; The epidemic of antibiotic-resistant infections: a call to action for the medical community from the Infectious Diseases Society of America. Clin Infect Dis. 46:155–64. DOI: 10.1086/524891. PMID: 18171244.

19. Kim B, Kim Y, Hwang H, Kim J, Kim SW, Bae IG, et al. 2018; Trends and correlation between antibiotic usage and resistance pattern among hospitalized patients at university hospitals in Korea, 2004 to 2012: a nationwide multicenter study. Medicine (Baltimore). 97:e13719. DOI: 10.1097/MD.0000000000013719. PMID: 30572507. PMCID: PMC6320075.
20. Kim B, Lee MJ, Moon SM, Park SY, Song KH, Lee H, et al. 2020; Current status of antimicrobial stewardship programmes in Korean hospitals: results of a 2018 nationwide survey. J Hosp Infect. 104:172–80. DOI: 10.1016/j.jhin.2019.09.003. PMID: 31513880.

21. Sanseverino I, Navarro Cuenca A, Loos R, Marinov D, Lettieri T. 2018. State of the art on the contribution of water to antimicrobial resistance. Luxembourg;European Union: p. 1–89.
22. Siegel JD, Rhinehart E, Jackson M, Chiarello L. 2007; Management of multidrug-resistant organisms in health care settings, 2006. Am J Infect Control. 35(10 Suppl 2):S165–93. DOI: 10.1016/j.ajic.2007.10.006. PMID: 18068814.

23. Park SH. 2018; Management of multi-drug resistant organisms in healthcare settings. J Korean Med Assoc. 61:26–35. DOI: 10.5124/jkma.2018.61.1.26.

24. Canny GO, McCormick BA. 2008; Bacteria in the intestine, helpful residents or enemies from within? Infect Immun. 76:3360–73. DOI: 10.1128/IAI.00187-08. PMID: 18474643. PMCID: PMC2493210.

25. Kim BN. 2007; Blood cultures: principles and practices. Infect Chemother. 39:111–6.
26. Patel A, Parikh P, Dunn AN, Otter JA, Thota P, Fraser TG, et al. 2019; Effectiveness of daily chlorhexidine bathing for reducing gram-negative infections: a meta-analysis. Infect Control Hosp Epidemiol. 40:392–9. DOI: 10.1017/ice.2019.20. PMID: 30803462.

27. Huang SS, Singh R, McKinnell JA, Park S, Gombosev A, Eells SJ, et al. 2019; Decolonization to reduce postdischarge infection risk among MRSA carriers. N Engl J Med. 380:638–50. DOI: 10.1056/NEJMoa1716771. PMID: 30763195. PMCID: PMC6475519.
Go to : 




 Citation
Citation Print
Print



 XML Download
XML Download