Abstract
Antithrombotic agents, including antiplatelet agents and anticoagulants, are increasingly used in South Korea. The management of patients using antithrombotic agents and requiring gastrointestinal endoscopy is an important clinical challenge. Although clinical practice guidelines (CPGs) for the management of patients receiving antithrombotic agents and undergoing gastrointestinal endoscopy have been developed in the Unites States, Europe, and Asia Pacific region, it is uncertain whether these guidelines can be adopted in South Korea. After reviewing current CPGs, we identified unmet needs and recognized significant discrepancies in the clinical practice among regions. This is the first CPG in Korea providing information that may assist endoscopists in the management of patients on antithrombotic agents who require diagnostic or elective therapeutic endoscopy. This guideline was developed through the adaptation process as an evidence-based method, with four guidelines retrieved by systematic review. Eligible guidelines were evaluated according to the Appraisal of Guidelines for Research and Evaluation II process, and 13 statements were established using a grading system. This guideline was reviewed by external experts before an official. It will be revised as necessary to cover changes in technology, evidence, or other aspects of clinical practice.
Go to : 
항혈소판제 (antiplatelet agent) 와 항응고제 (anticoagulant)를 포함하는 항혈전제(antithrombotic agent) 는 심뇌혈관 질환에 대한 일차 및 이차 예방 목적으로 임상에서 활발히 사용되고 있다.1-4 현재까지 다양한 종류의 항혈소판제와 항응고제가 개발되어 사용중이고, 비타민 K 비의존성 경구 항응고제 (non-vitamin K antagonist oral anticoagulant, NOAC) 와 같이 새로운 약제들도 지속적으로 개발 출시되고 있다. 인구 고령화로 심뇌혈관 질환 유병률은 증가하고 있으며, 이로 인해 임상에서 항혈전제를 복용 중인 환자를 흔히 접하게 되었다.
내시경 기기 및 기술의 빠른 발전으로 다양한 종류의 진단 및 치료 내시경 시술이 가능하게 되었다. 국내에서 발생률이 가장 높은 암 중의 하나인 위암의 경우 국가 암 검진 사업 도입으로 조기 위암 단계에서 발견되는 경우가 70% 이상이며, 이 중에서 약 반수가 내시경 절제술로 치료되고 있다.5-7 일반적으로 조직 검사를 포함하는 진단 내시경 검사와 연관된 합병증 위험은 낮다. 그러나 치료 내시경 시술은 진단 내시경 검사와 비교하여 출혈을 비롯한 합병증 발생 위험이 높으며 항혈전제 복용은 이러한 합병증 위험을 더욱 증가시킬 수 있다. 따라서 내시경 검사 또는 시술이 예정된 환자가 항혈전 제를 복용하고 있는 경우 시술 전후 항혈전제 중단 여부 및 중단 기간을 결정하기 위해서는 내시경 시술과 연관된 출혈 등의 합병증 발생 위험을 고려해야 하며, 항혈전제 중단으로 인한 혈전색전증 (thromboembolism) 위험도 함께 고려해야 한다.8,9
지역과 인종에 따라 임상에서 이용 가능한 내시경 기구 및 실제 시술 방법, 내시경 시술과 연관된 합병증 발생 위험은 다를 수 있다. 항혈전제 복용 중단으로 인한 혈전색전증 발생 위험도 지역과 인종에 따라 차이가 있다. 따라서 각 지역별 의료 현실을 반영하는 내시경 시술 전후 항혈전제 사용에 관한 임상진료지침이 개발되어 이용되고 있다.10-13 하지만 아직까지 국내 임상진료지침은 개발되어 있지 않아 내시경 시술을 시행하는 국내 의사들은 국외 임상진료지침을 참고하거나, 국내외에서 이뤄진 개별 연구들을 직접 검토하여 진료에 활용해야 하는 어려움이 있었다. 이 임상진료지침에서 항혈전제를 복용하고 있는 환자에서 내시경 시술과 연관된 합병증 및 혈전색전증 발생 위험에 대한 국내외 연구 및 임상진료지침들을 종합적으로 검토하고, 국내의 역학적 특성, 임상 진료 양상 및 의료 환경을 반영한 내시경 시술 전후 항혈전제 사용에 관한 권고안을 제시하고자 하였다.
Go to : 
이 임상진료지침은 항혈전제를 복용하는 환자에서 내시경 시술과 연관된 출혈 및 혈전색전증 발생에 대하여 현재까지 제시된 근거 및 임상진료지침을 바탕으로 내시경 시술 전후 항혈전제 사용에 관한 임상적 결정이 필요할 때 참고할 수 있는 정보를 제공하고자 하였다. 이 임상진료지침은 심뇌혈관 질환의 일차 또는 이차 예방 목적으로 항혈전제를 복용하고 있으면서 내시경 지혈술과 같은 응급 내시경 시술을 제외한 진단 내시경 또는 계획된 치료 내시경 시술 (elective therapeutic endoscopic procedure) 이 계획된 성인 남녀 환자를 대상 인구집단으로 한다. 이 임상진료지침의 사용 대상자는 1차, 2차, 3차 의료기관에서 소화기 내시경 검사 및 시술을 시행하는 의사로, 내시경 시술 전후 항혈전제 사용과 관련된 의사결정을 하는 데 있어 도움을 주고자 하였다. 또한 전공의를 비롯한 병원 근무 인력이 진료의 길잡이로 활용할 수 있으며, 환자와 일반인도 참고할 수 있는 의학정보를 제공하고자 하였다.
임상진료지침 운영위원회는 대한소화기내시경학회 전훈재 이사장, 이수택 회장, 김호각 회장 및 임원진을 중심으로 2017년 11월에 구성되어 임상진료지침 개발 전략을 수립하고 관련 위원장을 선임하였으며, 사업 관련 예산을 검토하고 승인하였다. 또한 임상진료지침의 개발에 관하여 이해당사자의 참여 및 편집의 독립성이 적절히 유지되고 있는지를 감독하고, 제안된 권고안을 검토하였다. 최종 임상진료지침의 출판은 2020년 3월 대한소화기내시경학회 조주영 이사장, 박찬국 회장 및 임원진으로 이루어진 임상진료지침 운영위원회에서 승인하였다.
임상진료지침 운영위원회는 대한소화기내시경학회 진료 지침 개발위원회 (KSGE Task Force on Clinical Practice Guideline)를 구성하였으며, 대한소화기내시경학회 소속 소화기내과 전문의 변정식을 위원장으로 하여 소화기내과 전문의 5인(강승주, 공은정, 민병훈, 신철민, 임현)이 위원으로 참여하였다. 또한 한국보건의료연구원 소속 임상진료지침 개발 방법론 전문가 1인(최미영)에게 문헌 검색 및 개발 과정에 대한 자문을 구하였다. 대한소화기내시경학회 진료지침 개발위 원회는 임상진료지침의 핵심 질문 선정, 문헌 검색, 권고안 도출, 임상진료지침 초고 작성과 수정 등 임상진료지침 개발 과정을 총괄하였다.
대한소화기내시경학회 진료지침 개발위원회는 2017년 12월 22일부터 총 4회의 임상진료지침 개발위원회 회의를 진행하였으며, 총 2회의 워크숍을 통해 임상진료지침 개발 방법론과 개발 과정을 검토하고 근거 수준 평가, 권고 등급 결정, 권고문 합의 도출 방법에 관한 교육을 병행하였다 (2018년 3월 12일, 2018년 11월 10일). 대한소화기내시경학회 진료지침 개발위 원회는 이 임상진료지침의 권고안을 수용 개작(adaptation) 방식으로 개발하기로 결정하였고, 여러 차례의 온라인 및 대면 회의를 통해 임상진료지침 개발을 진행하였다.
임상진료지침에 포함할 핵심 질문을 도출하기 위하여 PICO 원칙에 따라 선정기준을 정하고 조사표를 설계하였다. P (population)는 항혈전제를 복용하고 있으면서 진단 내시경 또는 계획된 치료 내시경 시술을 받은 환자, I (intervention) 는 내시경 시술 전후 항혈전제를 중단하거나 대체하는 중재, C (comparison) 는 내시경 시술 전후 항혈전제를 중단하지 않고 계속 사용하는 비교군, O (outcome) 는 내시경 시술과 연 관된 출혈 등의 합병증 및 혈전색전증 발생 위험성이다. 핵심 질문 초안을 요약한 조사표를 취합하여 대한소화기내시경학회 진료지침 개발위원회 위원 간 토의로 우선순위를 정하는 방식으로 임상진료지침에 포함할 핵심 질문을 선정하였다.
2018년 5월 Ovid MEDLINE, KoreaMed, KoMGI, National Guideline Clearinghouse 및 Guidelines International Network를 이용하여 임상진료지침 및 핵심 질문에 따른 문헌 검색을 시행하였다. 검색은 내시경 시술과 관련된 색인 단어 (“endoscopy” OR “esophagogastroduodenoscopy” OR “colonoscopy” OR “endosonography” OR “endoscopic retrograde cholangiopancreatography” OR “enteroscopy” OR “biopsy” OR “stent” OR “argon plasma coagulation” OR “papillary balloon dilation” OR “sphincterotomy” OR “fine needle aspiration” OR ”percutaneous endoscopic gastrostomy” OR “ampullectomy” OR “cystgastrostomy” OR “pneumatic dilation” OR “polypectomy” OR “endoscopic mucosal resection” OR “endoscopic submucosal dissection”), 항혈전제와 관련된 색인 단어 (“antiplatelet” OR "platelet aggregation inhibitor" OR “aspirin” OR "acetylsalicylic acid" OR “thienopyridine” OR “clopidogrel” OR “prasugrel” OR “ticagrelor” OR “ticlopidine” OR “cilostazol” OR “triflusal” OR “anticoagulants” OR “warfarin” OR “coumadin” OR “heparin” OR “low molecular weight heparin” OR “enoxaparin” OR “dalteparin” OR “nadroparin” OR “non-vitamin K antagonist oral anticoagulant” OR "novel oral anticoagulant" OR "direct oral anticoagulant" OR “dabigatran” OR “apixaban” OR “rivaroxaban” OR “enoxaban” OR “bridge therapy” OR “antithrombin”), 임상진료지침과 관련된 색인 단어 (“guideline” OR “recommendation” OR “practice guideline”)를 조합하여 진행하였다.
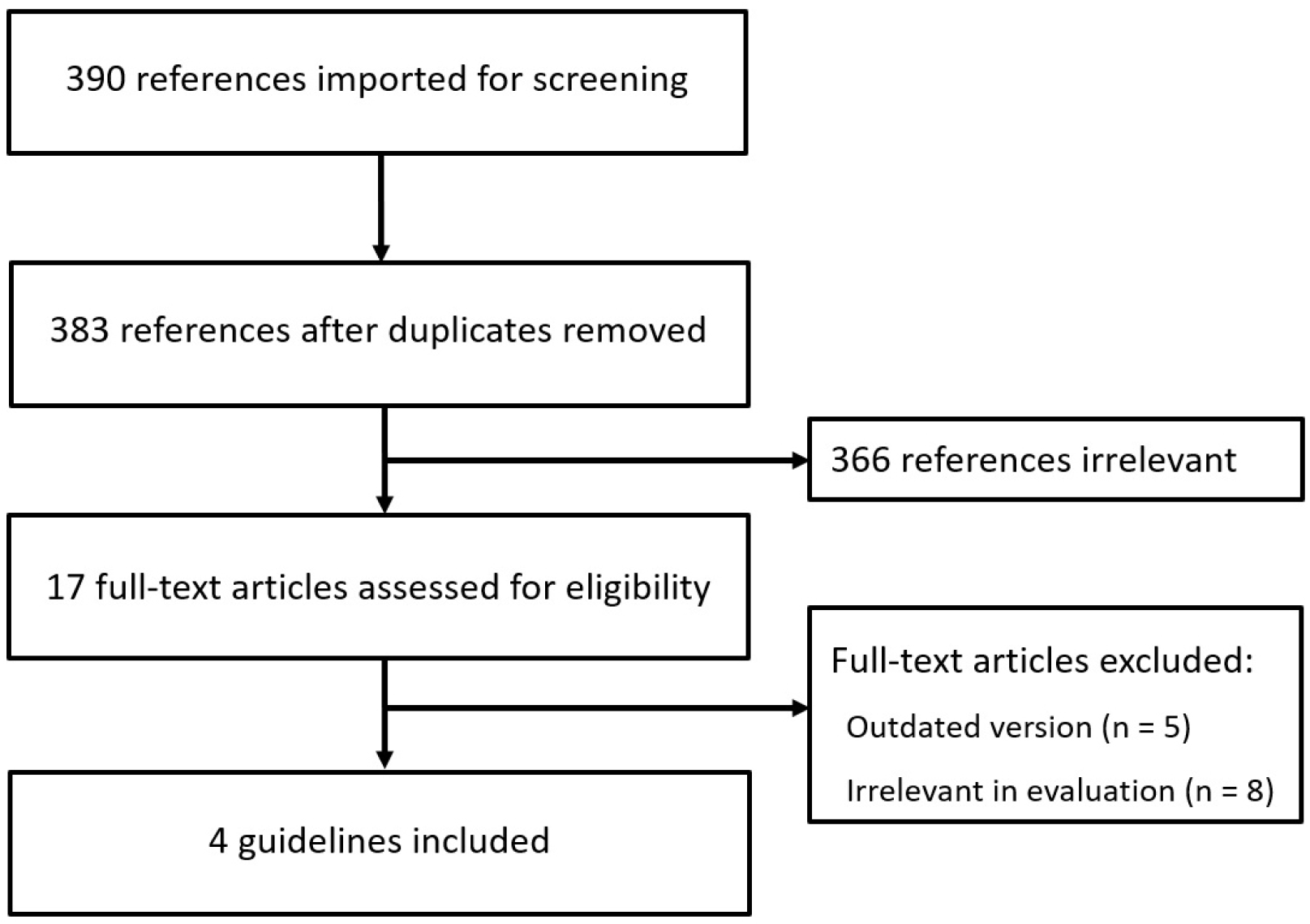
수용 개작을 위한 기존 임상진료지침 선정 기준은 1) 근거 중심의 임상진료지침일 것, 2) 한국어 또는 영어로 출판된 임 상진료지침일 것, 3) 2000년부터 2018년 5월 사이에 발표된 임상진료지침일 것, 4) 19세 이상의 성인을 대상으로 한 임상 진료지침일 것, 5) 개정판이 있는 경우에는 최신판을 기준으로 할것, 6) 외부 검토가 이루어진 전문가 합의 (consensus) 권고안을 포함할 것의 여섯 가지이다. 제외 기준은 1) 권고안 및 권고안를 지지하는 근거가 확실히 표기되지 않은 임상진료 지침, 2) 개정판의 발행으로 구판이 된 임상진료지침, 3) 수용 개작의 방법으로 개발된 임상진료지침이다. 임상진료지침 평가 및 개발을 위하여 최종적으로 4개의 진료지침이 선정되었다(Fig. 1).10-13
최신 문헌 선정을 위해 핵심 질문에 따라 검색 색인 단어를 조정 및 조합하여 2016년 이후 문헌을 MEDLINE 과 KoreaMed를 이용하여 추가로 검색하였다. 문헌 검색은 한국보건의료연구원 최미영 연구원이 시행하였으며, 핵심 질문별로 두 명의 개발 위원을 배정하여 선정 기준과 제외 기준에 맞추어 독립적으로 문헌을 선택하였다. 일차적으로는 문헌의 제목과 초록을 보고 임상진료지침 개발에 적합하지 않은 문헌을 배제하였다. 제목과 초록으로 배제되지 않은 문헌은 전문을 검토한 후 최종적으로 문헌 선택 또는 배제 여부를 결정하였다. 두 위원 간 의견이 일치하지 않은 경우에는 의견 조율을 통해 문헌 선택 여부를 결정하였고, 조율이 되지 않은 경우 개발위원회 위원장이 최종 결정하였다. 제외 기준으로는 1) 사람을 대상으로 한 연구가 아닌 경우, 2) 핵심 질문의 관심 환자를 대상으로 하지 않은 연구, 3) 핵심 질문 관련 중재 및 비교 중재가 시행되지 않은 연구, 4) 종설, 증례 또는 초록으로만 발표된 연구, 5) 한국어 또는 영어로 출판되지 않은 연구, 6) 원문을 구할 수 없는 연구를 포함하였다. 개별연구 간대상집단이 중복되는 경우에는 더 작은 규모의 연구를 배제하였다.
수용 개작의 대상이 되는 임상진료지침의 질 평가를 위하여 The Appraisal of Guidelines for Research & Evaluation (AGREE) II를 이용하였다. AGREE II는 6개의 영역으로 구분 되며 세부적으로는 23개의 구조화된 핵심 항목과 2개의 전반 적인 평가를 위한 항목으로 이루어져 있으며, 각각 7점 척도 (1: 전혀 동의 안함, 7: 매우 동의함 )로 점수화 된다.14 선정된 각각의 임상진료지침을 3인의 평가자가 평가하였고, 평가자 간의 편차를 최소화하기 위하여 임상진료지침 개발 방법론 전 문가(최미영)가 AGREE II의 이해에 대한 강의와 실습을 포함 한 워크샵을 실시하였다. 영역별 표준화 점수를 산출하고 분포도를 작성한 후 각 영역의 점수를 비교하여 4개의 지침을 선정하였다.10-13
근거에 사용될 자료로 선정된 최신 문헌에 대한 타당성 평가를 위해 체계적이고 일관된 평가 방법을 사용하였다. 무작위 배정 비교 연구는 코크란의 risk of bias법을 이용하여 평가하였고,15 비무작위 연구의 평가에는 RoBANS 2.016을, 체계적 문헌 고찰의 평가는 AMSTAR을 이용하였다.17 근거 요약과 근거 수준 평가에는 GRADE 방법을 이용하였다.18 문헌의 연구 유형에 따라 무작위 배정 비교 연구는 높은 근거 수준을, 관찰 연구는 낮은 근거 수준을 부여함을 기본으로 하되, 연구의 질에 영향을 주는 요소를 고려하여 해당 연구의 근거 수준을 상향 조정하거나 하향 조정하여 최종적으로는 근거 수준을 높음 (high), 중등도 (moderate), 낮음(low), 매우 낮음 (very low)의 네 단계로 구분하였다.
권고 등급은 바람직한 효과와 바람직하지 못한 효과의 균형, 근거의 질, 가치와 선호 등의 측면을 고려하여 강한 권고 (strong recommendation) 와 약한 권고(weak recommendation) 로 구분하였다. 강한 권고는 특정 중재에 대해 권고를 따를 경우 바람직한 효과가 바람직하지 않은 효과보다 크고 근거의 질이 높으며, 다른 중재와 비교하여 가치와 선호도가 우수하기 때문에 대부분의 환자에서 시행할 것을 권하는 등급이다. 약한 권고란, 효과 크기가 상대적으로 작거나 근거가 다소 약하지만 바람직한 효과가 있어 다수의 환자에서 시행되는 것이 좋을 것으로 판단되는 등급이다. 약한 권고 등급에서는 일부 환자에서 혹은 의료진의 가치나 선호도에 따라 다른 중재를 선택할 수 있다. 권고안 및 권고 등급, 근거 수준은 Table 1에 요약하여 정리하였다.
Summary and Strength of Recommendations
감수위원회는 대한소화기내시경학회 임원 34명과 보험정 책위원회 위원 14명으로 구성되었으며, 개방형 질문을 이용하여 초안 평가를 실시하였다. 임상진료지침의 미비한 부분은 대한소화기내시경학회 진료지침 개발위원회에서 수정 후 감수위원회의 재평가를 받아 임상진료지침의 균형성과 완결성을 높이고자 하였다. 외부 검토를 위하여 2019년 11월 16일 전국의 내시경 의사 및 간호사가 참여하는 KSGE days 2019에서 공청회를 개최하여 공개적으로 의견을 들었으며, 논의 사항을 최종 임상진료지침에 반영하였다.
임상진료지침의 보급과 확산을 위하여 임상진료지침을 Clinical Endoscopy 와 대한소화기학회지에 공동 게재하며 대한소화기내시경학회 홈페이지에 게시하고, 임상진료지침정 보센터에 등록하고자 한다. 데이터베이스 등록을 통한 임상진료지침의 수동적 확산은 일선에서 환자를 진료하는 의료인에 게 빠르게 보급되기에는 제한이 있을 것으로 예상되며, 이러한 장애요인을 극복하기 위해 주관 학회인 대한소화기내시경 학회에서 임상진료지침을 전자 우편 등 다양한 형식으로 무료 배포하고, 향후 다양한 소화기 관련 학술대회, 세미나, 워크숍 등을 통해 적극적으로 홍보할 예정이다. 임상진료지침은 개발을 진행하는 시점에서의 권고안으로, 향후 권고안을 변경할 만한 중요한 연구 결과 또는 근거가 새로이 축적되어 임상진료지침 개정이 필요하다고 판단되면 개정을 시행할 예정이다.
이 임상진료지침의 가장 중요한 한계점은 국내 근거 자료가 충분하지 않다는 점이다. 국내 근거가 부족한 경우에는 국외 자료를 이용할 수밖에 없는데, 국외 자료는 우리 나라와 내시경 기구, 실제 시술 방법, 내시경 시술과 연관된 합병증 위험 및 항혈전제 중단으로 인한 혈전색전증 위험 등이다르기 때문에 근거를 그대로 수용하기 어려운 경우가 있다. 또한 이 임상진료지침은 실제 임상에서 의료진이 환자를 진료할 때 절대적인 진료 기준을 제시하고자 함이 아니라, 현재까지 밝혀진 과학적 근거를 바탕으로 일선에서 진단 및 치료 내시경 시행을 담당하는 의사가 임상적 판단을 하는 데 도움이 되는 정보를 제공하기 위한 것이다. 따라서 각각의 환자에 대한 진료 행위는 담당 의사가 환자 및 시술과 관련된 여러 요인을 고려하여 최종적으로 결정해야 한다. 이 임상진료지침은 실제 진료를 담당하는 의사의 의료행위를 제한하는 목적이나 건강 보험 심사의 기준으로 사용되어서는 안되고, 또한 특정 환자에게 시행된 진료 행위에 대한 법률적 판단을 위해 이용되어서도 안된다.
이 임상진료지침은 대한소화기내시경학회 주관 사업으로 선정되어 대한소화기내시경학회로부터 재정 지원을 받았으나 재정 지원자가 지침을 개발하는 과정에 영향을 주지 않았고, 임상진료지침 개발과정에 참여한 모든 구성원은 지침 개발과 관련하여 이해 관계나 잠재적인 이해 상충이 없었다.
Go to : 
이 임상진료지침에서는 항혈전제를 복용하지 않는 환자에서 보고된 내시경 시술과 연관된 출혈 발생 위험에 따라 내시경 시술을 저위험(low risk), 고위험 (high risk), 초고위험 (ultra-high risk) 시술로 분류하였다 (Table 2). 저위험 내시경 시술은 출혈 발생 위험이 1% 미만으로 예상되는 시술로 정의하였으며 조직 검사 (mucosal biopsy)를 포함한 진단 내시경과 점막을 절개하지 않고 시행하는 치료 내시경 시술을 포함하였다. 고위험 내시경 시술은 출혈 발생 위험이 1% 이상으로 예상되는 시술로 정의하였다. 고위험 내시경 시술 중 다른 고위험 내시경 시술과 비교하여 출혈 발생 위험이 특히 높은 내시경 점막하박 리술(endoscopic submucosal dissection) 과 2 cm 이상 대장 용종에 대한 내시경 점막절제술 (endoscopic mucosal resection)은 2018년도 아시아태평양소화기학회 (Asian Pacific Association of Gastroenterology, APAGE)/ 아시아태평양 소화기내시경학회 (Asian Pacific Society for Digestive Endoscopy, APSDE) 임상진료지침과 같이 초고위험 내시경 시술로 분류하였다.13
Risk Stratification of Endoscopic Procedures Based on the Risk of Bleeding
1) 항혈소판제
관상동맥 스텐트 삽입술을 받은 환자는 스텐트 혈전증 (stent thrombosis) 예방을 위해 아스피린, P2Y12 수용체 억제제와 같은 항혈소판제 복용이 필요하다. 관상동맥 스텐트 삽입술을 받은 환자에서 고위험 내시경 시술 시기와 항혈소판제 복용 중단 결정은 시술과 연관된 출혈 위험, 스텐트 혈전증, 시술 지연 시 발생할 수 있는 문제점 등을 종합적으로 고려해야 한다. 그러나 관상동맥 스텐트 삽입술 후 내시경 시술 및 항혈전 제 중단과 연관된 주요 심장 관계 사건 (major adverse cardiac events) 발생 위험성에 대한 직접적인 자료는 부족하다. 2013년 도 대한심혈관중재학회의 급성 관동맥증후군 임상진료지침에서는 계획된 비심장 수술 (elective non-cardiac surgery) 전 P2Y12 수용체 억제제 중단이 필요한 경우 심장 전문의에게 협진을 의뢰하도록 권고하고 있다.19 또한 불안정성 협심증/비 ST분절상승 심근경색증에 대해 약물 방출 스텐트 (drug-eluting stent)를 삽입하고 12개월이 경과되지 않은 경우에는 수술을 연기하도록 권고하고 있다.19
2016 년도 미국심장학회 (the American College of Cardiology)/미국심장협회 (the American Heart Association)에서 개발한 관상동맥 질환 환자에서 이중 항혈소판 치료(dual antiplatelet therapy)에 대한 임상진료지침에서는 비약물 금속 스텐트 (bare metal stent) 삽입 후 30일, 약물 방출 스텐트 삽입 후 6개월이 경과되지 않은 경우는 수술을 연기하도록 권고하였다.20 관상동맥 스텐트 삽입술을 받은 환자를 대상으로 한 대규모 환자-대조군 연구에서 관상동맥 스텐트 삽입 후 4-6주 이내에 수술을 시행 받은 경우 주요 심장 관계 사건이 7.2-11.6%의 높은 빈도로 발생하였다.21-23 이 중 9,391 명의 환자를 대상으로 한 환자-대조군 연구에서 스텐트 종류는 주요 심장 관계 사건의 위험과 관련이 없었다.23 이러한 연구 결과에 근거하여 2017년도 유럽심장학회 (European Society of Cardiology)에서 개발한 관상동맥 질환 환자에서 이중 항혈소판 치료에 대한 임상진 료지침에서는 관상동맥 스텐트의 종류와 상관없이 스텐트 삽입 후 4주 이내에는 수술을 연기하고, 4주-6개월 이내에는 가능하면 수술을 연기하되 환자와 관련된 위험인자 및 수술의 이익과 위험을 고려하여 수술 진행 여부를 결정할 것을 권고하였다.24 이 임상진료지침에서는 기존 임상진료지침들과 최근 연구 결과들에 근거하여 관상동맥 스텐트 삽입술 후 고위험 내시경 시술 시행 시기를 Table 3에 정리하였다.
Appropriate Timing of High-risk Procedures in Patients with Acute Coronary Syndrome
2) 항응고제
내시경 시술이 계획된 환자에서 항응고제 중단 여부와 기간에 대한 결정에는 내시경 시술과 연관된 출혈 및 항응고제 중단에 따른 혈전색전증 위험을 모두 고려해야 한다. 항응고제 중단으로 발생할 수 있는 혈전색전증 위험은 부정맥, 뇌졸중 등 항응고 치료의 적응이 되는 기저 질환과 밀접한 관련이 있으며, 항응고제를 4-7일간 중단하였을 때 혈전색전증의 절대 위험도는 약 1% 증가하는 것으로 알려져 있다.25,26 하지만 내시경 시술 전후 항응고제 사용에 대한 연구는 대부분 관찰 연구로 근거 수준이 낮고, 관련된 임상진료지침 및 권고안 또한 전문가 의견 또는 합의에 기반하고 있다. 영국소화기학회 (British Society of Gastroenterology, BSG)/유럽소화기내시경학회 (European Society of Gastrointestinal Endoscopy, ESGE) 임상진료지침에서는 항응고제 중단 중에 발생할 수 있는 혈전 색전증 위험에 따라 환자를 저위험군과 고위험군으로 분류하였다.11 미국소화기내시경학회 (American Society for Gastrointestinal Endoscopy, ASGE) 임상진료지침에서는 혈전색전 증 위험에 따라 환자를 저위험군 (<5%), 중등도 위험군 (5-10%), 고위험군 (>10%)으로 분류하였고, 고위험군에서는 헤파린 가교 요법(heparin bridging therapy)을 권고하고 있다.12 이 임상진료지침에서는 기존 개발된 임상진료지침과 최근 연구 결과 들을 근거로 하여 항응고제를 중단하는 경우 혈전색전증 발생 위험이 높아 헤파린 가교 요법이 필요한 고위험군을 Table 4에 제시하였다.
Go to : 
진단 내시경과 연관된 출혈 발생 위험은 조직 검사를 시행 하는 경우에도 0.1% 미만으로 보고되고 있다.27-33 아스피린과 clopidogrel 등의 항혈소판제를 복용하고 있는 경우에도 진단 내시경과 연관된 출혈 위험은 낮은 것으로 알려져 있다.34-37 항혈소판제를 중단하지 않고 조직 검사를 포함한 상부위장관 내시경 검사를 시행하였을 때 출혈 위험을 조사한 미국의 전향 연구에서 아스피린 단독 복용군과 clopidogrel 단독 복용군의 출혈률은 각각 0.4%와 0%로 보고되었다.35 항혈소판제를 복용하는 환자를 대상으로 한 일본의 전향 연구에서도 조직 검사를 포함한 내시경 검사 후 출혈은 관찰되지 않았다.34 유두부 풍선 확장술 (endoscopic papillary balloon dilatation without sphincterotomy)을 받은 환자를 대상으로 항혈소판 제 복용이 시술 후 출혈에 미치는 영향을 조사한 후향 연구에서 출혈의 빈도는 0.8%였으며 시술 전 항혈소판제를 중단한 군과 중단하지 않은 군을 비교하였을 때 항혈소판제 복용을 중단하지 않은 군에서 출혈률 증가는 관찰되지 않았다.38 이러한 연구 결과들은 저위험 내시경 시술 시 항혈소판제를 중단 하지 않는 권고를 뒷받침한다.
고위험 내시경 시술 중 하나인 대장 용종절제술과 연관된 출혈률은 0.6-2.2%로 보고되고 있다.31,33,39-45 대장 용종절제술을 받은 환자들을 대상으로 한 환자-대조군 연구들에서 출혈군과 비출혈군 간에 아스피린 사용 빈도의 차이는 없는 것으로 보고되었다.37,46-48 국내 환자-대조군 연구에서도 출혈군 92명과 비출혈군 276명을 비교하였을 때 아스피린 사용 빈도는 두 군 간에 차이가 없었으며, 이 연구에서 대장 용종절제술 후 출혈률은 1.1%였다.49 대장 용종절제술과 연관된 출혈 발생 위험을 조사한 최근의 메타분석에서도 시술 전 아스피린 복용은 대장 용종절제술과 연관된 출혈 발생 위험을 증가시키 지 않는 것으로 보고되었다 (OR 1.5, 95% CI 0.9-2.2).50 따라서 이 임상진료지침에서는 아스피린을 단독 복용하고 있는 환자에서 대장 용종절제술을 시행하는 경우 아스피린을 중단하지 않고 시행하는 것을 권고한다. 단, 일차 예방 목적으로 아 스피린을 복용하고 있는 경우에는 시술 전 아스피린 복용 중단을 고려할 수 있다.
용종의 크기는 대장 용종절제술 후 지연성 출혈의 위험인 자로 잘 알려져 있으며, 용종 크기가 1 mm 증가할 때마다 지연성 출혈의 위험은 9%씩 증가하는 것으로 알려져 있다.51 특히 2 cm 이상 대장 용종에 대한 내시경 점막절제술 후에는 출혈 발생 위험이 높고, 아스피린 복용은 출혈 위험 증가와 관련이 있다.52-54 호주의 한 연구에서 2 cm 이상의 대장 용종에 대한 내시경 점막절제술 시행 후 출혈률은 7%였고 시술 7일 이내의 아스피린 복용은 출혈 발생 위험을 증가시키는 것으로 보고되었다.54 따라서 크기가 2 cm 이상인 대장 용종에 대한 내시경 점막절제술을 시행하는 경우 시술 전 아스피린 중단을 고려할 수 있으나, 시술과 연관된 출혈 및 아스피린 중단에 따른 혈전색전증 위험에 대한 평가가 반드시 이루어져야 한다.
내시경 점막하박리술은 내시경 점막절제술과 비교하여 출혈 위험이 높다(OR 2.20, 95% CI 1.58-3.07).55 위 병변과 대장 병변에 대한 내시경 점막하박리술 후 출혈률은 각각 3.6-6.9%, 0.5-9.5%로 보고되고 있다.56-64 아스피린 복용에 따른 내시경 점막하박리술 후 출혈 위험에 대한 연구 결과는 일관되지 않으며, 일부 연구에서는 시술 전 아스피린을 중단하지 않은 경우 시술과 연관된 출혈 발생 위험이 증가되는 것으로 보고하였으나 다른 연구에서는 아스피린을 계속 복용하더라도 출혈 발생 위험이 증가되지 않는 것으로 보고하였다.56-64 위 병변을 대상으로 한 국내 연구에서 시술 전 아스피린 복용을 지속한 군과 중단한 군의 출혈률은 각각 11.6%와 5.9%였으나 통계적 유의성은 확인되지 않아 아스피린 복용이 내시경 점막하박리술과 연관된 출혈 발생 위험을 증가시키지 않는 것으로 보고하였다.61 그러나 국내 다른 연구에서는 시술 전 아스피린 복용을 지속한 군과 중단한 군의 출혈률이 각각 21.1% 와 3.6% 로 유의한 차이를 보여 아스피린 복용이 내시경 점막하박리술과 연관된 출혈 발생 위험을 증가시키는 것으로 보고하였다.56 국외 임상진료지침에서도 내시경 점막하박리술과 연관된 권고는 일치되지 않으며, BSG/ESGE와 APAGE/APSDE 임상진료지 침에서는 내시경 점막하박리술을 출혈 고위험 시술로 분류하여 시술 전 아스피린을 포함한 항혈전제 중단을 권고하나 ASGE 임상진료지침에서는 모든 시술에 대해 아스피린을 유지하도록 권고하고 있다.11-13 이와 같이 근거가 제한적이나 내시경 점막하박리술과 연관된 출혈 위험을 고려하여 일부 환자에서 아스피린을 중단할 수 있으며, 시술 전 아스피린 중단은 혈전색전증 발생 위험을 증가시킬 수 있으므로65-67 순환기내과 또는 신경과 의료진과 협의 후 출혈 및 혈전색전증 발생 위험 정도에 기반하여 시술 전 아스피린 중단 여부를 결정하는 것이 바람직하다.
유두부 괄약근 절개술 (sphincterotomy) 과 연관된 출혈률은 1-5%로 보고되고 있으며 대부분 연구에서 시술 전 아스피 린을 포함한 항혈소판제 복용을 지속하여도 출혈률이 증가하지 않았다.38,68-74 총담관결석으로 유두부 괄약근 절개술을 받은 환자를 대상으로 항혈소판제 복용이 출혈률에 미치는 영향을 조사한 일본의 후향 연구에서 시술 전 아스피린 복용을 지속한 군과 중단한 군의 출혈률은 두 군 모두 0.8%로 차이가 없었다.38 미국의 후향 연구에서도 유두부 괄약근 절개술 시행 7일 이내 아스피린 복용은 시술과 연관된 출혈 발생 위험을 증가시키지 않는 것으로 보고되었다.73
항혈소판제로 P2Y12 수용체 억제제를 단독 복용하는 경우 대장 용종절제술을 포함한 고위험 내시경 시술과 연관된 출혈 발생 위험이 증가할 수 있다. 대장 용종절제술을 시행 받은 환자를 대상으로 한 미국의 전향 연구에서 시술 전 clopidogrel 또는 prasugrel 복용을 지속한 군에서 출혈률은 2.4%로 항혈전제를 복용하지 않았던 군에서 출혈이 발생하지 않은 것과 비교하여 유의한 차이를 보였다.75 메타분석을 포함한 최근 연구들에서도 시술 전 clopidogrel 복용은 대장 용종절제술과 연관된 출혈률을 증가시키는 것으로 보고되었다 (OR 4.7, 95% CI 2.4-9.2).50,75-77 따라서 대장 용종절제술 시행 5-7일 전 P2Y12 수용체 억제제를 중단할 것을 권고한다. BSG/ESGE 와 APAGE/APSDE 임상진료지침에서는 P2Y12 수용체 억제제 중단시 혈전색전증 발생 위험이 높을 것으로 예상되는 환자의 경우 순환기내과 또는 신경과 의료진과 협의 후에 항혈 소판제를 일시적으로 아스피린으로 교체하여 사용할 것을 권고하고 있다.12,13
P2Y12 수용체 억제제를 중단한 환자에서 고위험 내시경 시술 후 약제 복용을 언제 다시 시작해야 하는지에 대한 연구는 현재까지 없다. 따라서 순환기내과 또는 신경과 의료진과 약제 중단 기간 및 복용 재개 시점에 대하여 협의하는 것이 도움이 될 수 있다. P2Y12 수용체 억제제는 복용 재개 후 효 과가 나타날 때까지 3-5일이 소요되므로 시술 시 지혈술이 적절히 시행되고 시술 후 출혈의 증거가 없는 경우 P2Y12 수용체 억제제 복용을 가능한 빨리 재개하는 것을 권고한다.80 그러나 고위험 내시경 시술 후 P2Y12 수용체 억제제 복용은 지연성 출혈을 포함한 합병증 위험성을 증가시킬 수 있으므로 이에 대한 환자 교육과 의료진의 면밀한 감시가 필요하다.
이중 항혈소판 치료를 받는 환자에서 조직 검사를 포함한 저위험 내시경 시술과 연관된 출혈 발생 위험에 대한 연구는 많지 않다. 조직 검사가 포함된 48건의 상부위장관 내시경과 12건의 대장 내시경 검사를 대상으로 출혈 발생 위험을 분석한 일본의 전향 연구에서 총 101 건의 조직 검사 시행 후 2주 간 관찰하였을 때 의미 있는 출혈은 확인되지 않았다 (0/101, 95% CI 0-3.6%).34 또한 이 연구에서 조직 검사 후에 육안적으로 출혈이 멈출 때까지 걸리는 시간을 측정하였는데, 단일 항혈소판제를 복용하고 있는 경우 2.4±1.4분, 이중 항혈소판 치료 중인 경우 2.1±2.1 분이 소요되어 두 군 간에 유의한 차이는 없었다. 그러나 이 연구는 적은 수의 환자를 대상으로 시행되었고 각각의 환자에서 몇 개의 조직 검사가 시행되었는 지에 대한 기술이 없었으며 프로톤 펌프 억제제나 히스타민-2 수용체 억제제와 같은 위산 분비 억제제 사용 여부에 관한 정보 또한 제공되지 않아 결과 해석에 제한이 있다.
이중 항혈소판 치료를 받는 환자에서 항혈소판제 중단 여부와 기간을 결정하기 위해서는 혈전색전증 및 시술과 연관된 출혈 발생 위험을 동시에 고려해야 한다. 항혈소판제 중단 후 스텐트 혈전증이 발생한 161명의 환자를 분석한 메타분석에서 아스피린 중단 없이 P2Y12 수용체 억제제만 중단한 경우 스텐트 혈전증 발생까지의 기간 중간값은 122 일이었다. 그러나 아스피린과 P2Y12 수용체 억제제를 모두 중단한 경우 스텐트 혈전증 발생까지의 기간이 7일에 불과해 이중 항혈소판 치료를 받는 환자에서 두 가지 항혈소판제를 모두 중단하는 것은 스텐트 혈전증의 위험성을 현저히 증가시키는 것으로 보고하였다.80 대장 용종절제술을 시행 받은 1,385명의 환자를 대상으로 한 미국의 후향 연구에서 아스피린 단독 복용군과 이중 항혈소판 치료군의 출혈률은 각각 1.0%와 3.5%였으며 (p<0.02) 아스피린과 clopidogrel 동시 복용은 지연성 출혈 위험을 증가시켰다 (OR 3.7, 95% CI 1.6-8.5).77 최근의 메타분 석에서도 아스피린과 clopidogrel을 동시에 사용하는 경우 대장 용종절제술 후 출혈 위험이 유의하게 증가되는 것으로 보고되었다 (OR 3.4, 95% CI 1.3-8.8).50 따라서 이중 항혈소판 치료를 받는 환자에서 대장 용종절제술을 시행하는 경우 P2Y12 수용체 억제제는 시술 5-7일 전 중단하고 아스피린은 유지할 것을 권고한다.
내시경 점막하박리술과 2 cm 이상 대장 용종에 대한 내시경 점막절제술과 같은 초고위험 내시경 시술을 시행하는 경우 아스피린 단독 복용도 시술과 연관된 출혈 위험을 증가시킬 수 있다.52-54,56 한편, 관상동맥 질환으로 약물 방출 스텐트 삽입술을 받은 2,179 명의 환자를 대상으로 국내에서 시행된 대규모 환자-대조군 연구에서는 두 가지 항혈전제를 모두 중단한 기간이 7일 이내인 경우에 아스피린 단독 유지군과 비교하여 주요 심장 관계 사건 발생 위험은 유의하게 증가하지 않았다.81 이중 항혈소판 치료를 받는 환자에서 아스피린을 포함한 모든 항혈전제를 중단해야 하는지와 관련된 국외 임상진료지침의 권고는 일관되지 않으며, BSG/ESGE 와 APAGE/APSDE 임 상진료지침에서는 초고위험 시술 전 아스피린을 포함한 모든 항혈전제를 중단하도록 권고하나 ASGE 임상진료지침에서는 아스피린을 유지하도록 권고하고 있다.11-13 따라서 아스피린과 P2Y12 수용체 억제제를 함께 복용하고 있는 환자에서 초고위험 내시경 시술을 시행하는 경우 단기간 아스피린을 포함한 모든 항혈소판제 중단을 고려할 수 있으나 근거가 제한적이며, 순환기내과 또는 신경과 의료진과 협의 후 출혈 및 혈전색전증 발생 위험 정도에 따라 항혈소판제 중단 여부와 기간을 결정하는 것이 바람직하다.
이중 항혈소판 치료 중 P2Y12 수용체 억제제를 중단한 환자에서 고위험 내시경 시술 후 약제 복용을 언제 다시 시작해야 하는지에 대한 연구는 없다. 관상동맥 스텐트 삽입술을 받은 환자 또는 혈전색전증 발생 고위험 환자에서는 약제 중단 기간이 길어질 경우 혈전색전증 발생 위험이 증가할 수 있다. 따라서 시술 시 지혈술이 적절히 시행되고 시술 후 출혈의 증거가 없다면 P2Y12 수용체 억제제 복용을 가능한 빨리 재개하는 것을 권고한다. 그러나 P2Y12 수용체 억제제 중단 기 간과 재시작 시점은 환자에 따라 개별화해야 하고, 순환기내과 또는 신경과 의료진과 협의하는 것이 도움이 될 수 있다. 시술 후 P2Y12 수용체 억제제 복용 재개는 지연성 출혈을 포함한 합병증 위험을 증가시킬 수 있으므로 이에 대한 환자 교육과 의료진의 감시가 필요하다.
와파린을 복용하는 환자에서 저위험 내시경 시술과 연관된 출혈 위험에 대한 연구는 많지 않다. 일반적으로 조직 검사와 관련된 출혈 발생 위험은 매우 낮으며, 항응고제를 복용하는 중에도 비교적 안전하게 조직 검사를 시행할 수 있는 것으로 알려져 있다.31 항응고제를 복용하는 환자를 대상으로 한 일본의 전향 연구에서 조직 검사 후 유의한 출혈은 관찰되지 않았으며, 조직 검사 후 육안적으로 출혈이 멈출 때까지의 시간 또한 와파린 복용군과 비복용군에서 유의한 차이는 없었다.34 그러나 국제표준화비율 (International normalized ratio, INR) 이 치료 범위 (therapeutic range)를 벗어나는 경우 출혈 위험이 증가하므로 시술 전후 INR 이 치료 범위를 벗어나지 않는지 확인해야 한다.82 저위험 내시경 시술 전 요구되는 INR 수준에 대한 지침은 권고안에 따라 차이가 있으며, APAGE/APSDE 임상진료지침에서는 시술 전 INR 이 3.5를 초과한다면 시술을 연기하도록 권고하고 있다.13
항응고제를 복용하는 환자에서 고위험 내시경 시술과 연관된 출혈 발생 위험에 대한 연구는 부족하며 내시경 시술 전후 항응고제 사용에 대한 대부분의 임상진료지침은 전문가 의견에 기반하고 있다. 이전 관찰 연구들에서 항응고제를 복용하고 있는 환자는 항응고제를 복용하지 않는 환자와 비교하여 고위험 내시경 시술과 연관된 출혈 발생 위험이 높은 것으로 나타났다.46,83,84 대장 용종절제술을 받은 환자 1,657 명을 대상으로 한 후향적 연구에서도 시술 전 와파린 복용은 출혈 발생과 연관된 독립적인 위험인자로 확인되었다.46 혈전색전증 발생 가능성이 높아 와파린을 중단할 수 없는 경우 시술과 연관된 출혈 위험을 줄일 수 있는 시술 방법에 대한 연구도 시행되었다. 시술 전 와파린을 중단하지 않은 상태로 1 cm 미만의 대장 용종에 대해 용종절제술을 시행한 일본의 전향 연구에서 저온 올가미 용종절제술 (cold snare polypectomy) 과 고식적 용종절제술 (hot snare polypectomy) 후 출혈률은 각각 0% (0/35), 14% (5/35) 로 1 cm 미만의 대장 용종에 대해서는 저온 올가미 용종절제술 방법으로 항응고제 복용 중에도 비교적 안전하게 시술을 시행할 수 있음을 보여주었다.85
와파린 중단 후 24-36 시간에 걸쳐 INR이 감소하며 INR이 치료 범위 내에 있었다면 와파린 중단 약 3-5일 이후에는 대부분 환자에서 INR 1.5 이하에 도달하게 된다.86,87 일반적으로 INR이 1.5 이하일 때는 시술과 연관된 출혈 발생 위험이 증가되지 않는 것으로 알려져 있다. 따라서 고위험 내시경 시술이 예정된 경우 시술 3-5일 전 와파린 복용을 중단하고 시술 전후 INR을 측정해야 한다. 고위험 내시경 시술 전 요구되는 INR 수준에 대한 지침은 권고안에 따라 차이가 있으며, APAGE/APSDE 임상진료지침에서는 시술 전 INR이 2.0 이하일 때, BSG/ESGE 임상진료지침에서는 INR이 1.5 이하일 때 시술을 진행하도록 권고하고 있다.12,13
내시경 시술 전 와파린을 중단하였을 때 혈전색전증 발생 위험이 높을 것으로 예상되는 경우 헤파린 가교 요법이 필요하다. 헤파린 가교 요법의 목적은 와파린 복용 중단 기간 동안 저분자량 헤파린 (low molecular weight heparin) 이나 통상적인 헤파린 (unfractionated heparin)을 투여하여 내시경 시술 전후 항응고요법이 중단되는 기간을 최소화함으로써 혈전 색전증 발생 위험을 줄이는 데에 있다. APAGE/APSDE, ASGE, BSG/ESGE 임상진료지침에서는 헤파린 가교 요법이 필요한 환자의 적응증을 각각 제시하고 있다.11-13 한편, 대한 부정맥학회에서 2018년 발표한 비판막성 심방세동 환자의 뇌졸중 예방 지침에서는 인공 판막 (prosthetic valve)을 가지고 있는 환자들에서만 헤파린 가교 요법을 권고하고 있는데,88 이는 1,884명의 심방세동 환자를 대상으로 한 대규모 무작위 배정 연구에서 헤파린 가교 요법을 시행한 군과 시행하지 않은 군을 비교하였을 때 혈전색전증 발생률은 0.3%, 0.4%로 두 군 간에 차이가 없었던 반면, 주요 출혈 위험은 헤파린 가교 요법을 시행한 군(3.2%)에서 시행하지 않은 군(1.3%)에 비해 유의하게 높았다는 결과에 근거하고 있다.89 그러나 이 연구는 혈전색전증 발생 위험성이 높은 승모판 협착증 환자(≤ 2%)와 CHA2DS2 점수 5 또는 6 환자(≤3.4%)가 연구 대상군에서 차지하는 비율이 낮았고, 혈전색전증 고위험군에 대한 하위 집단 (subgroup) 분석 또한 이루어지지 않아 연구 결과를 일반화하기에는 무리가 있다. 이 임상진료지침에서는 최근 연구 결과와 기존 개발된 임상진료지침에 근거하여 헤파린 가교 요법의 혈전색전증 예방 효과가 출혈 발생 위험보다 더 클 것으로 예상되는 환자군을 선별하여 헤파린 가교 요법의 적응증으로 제시하였다 (Table 4).
와파린을 중단한 환자에서 고위험 내시경 시술 후 와파린 복용 재개 시기는 혈전색전증과 출혈 발생 위험을 동시에 고려하여 결정해야 하며, 이와 연관된 연구는 많지 않다. 1 cm 미만의 대장 용종에 대한 용종절제술 123 예를 분석한 연구에서 시술 다음 날 와파린 복용을 재개하였을 때 수혈을 필요로 하는 출혈은 1예(0.8%)에서만 발생하였다.90 고온 생검 (hot biopsy) 과 올가미 용종절제술을 포함한 109건의 대장 내시경 검사를 대상으로 한 다른 연구에서도 시술 다음 날 와파린 복용을 재개하였을 때 시술과 연관된 출혈률은 0.9%로 나타났다.91 한편, 대장 용종절제술을 시행 받은 173명의 환자를 대상으로 한 다른 연구에서는 시술 일주일 이내에 와파린 복용을 재개하였을 때 출혈의 위험이 약 5배 증가하였다.51
NOAC을 복용하고 있는 환자에서 저위험 내시경 시술 전 NOAC을 중단해야 하는지에 대해서는 현재까지 명확한 근거가 없다. 일반적으로 조직 검사와 관련된 출혈 위험은 매우 낮으며 항응고제를 복용하는 중에도 비교적 안전하게 조직 검사를 시행할 수 있는 것으로 알려져 있다.31,92 따라서 APAGE/APSDE 와 ASGE 임상진료지침에서는 저위험 내시경 시술 전 NOAC을 중단하지 않도록 권고하고 있으며, 이는 시술 전 항응고제 중단으로 인한 혈전색전증의 위험을 최소화 하기 위한 것이다.11,13 2017년 일본 소화기내시경학회 (Japan Gastroenterological Endoscopy Society) 임상진료지침에서도 저위험 내시경 시술 전 NOAC을 중단하지 않도록 권고 하고 있으나, NOAC의 혈중 농도가 최고치가 되는 시간대를 피하여 시술을 시행하도록 권고하고 있다.93 또한 조직 검사의 개수를 최소화하고, 지혈이 될 때까지 내시경을 회수하지 않고 관찰하며, 자연적으로 지혈이 되지 않는 경우 내시경 지혈 술을 시행하도록 권고하고 있다. 한편, BSG/ESGE 임상진료 지침에서는 저위험 내시경 시술 당일에 NOAC을 복용하지 않을 것을 권고한다.12 이와 같이 임상진료지침마다 권고 내용에 차이가 있으며 권고안을 뒷받침하는 근거 또한 제한적이다. 이 임상진료지침에서는 저위험 내시경 시술과 연관된 출혈 위험은 높지 않은 반면 NOAC 중단 시 혈전색전증 발생 위험이 증가할 수 있다는 점을 고려하여 저위험 내시경 시술 전에는 NOAC을 중단하지 않을 것을 권고한다.
현재 국내에서 사용되고 있는 NOAC 제제는 dabigatran (thrombin inhibitor), apixaban, rivaroxaban, edoxaban (factor Xa inhibitor)이 있다. 고위험 내시경 시술 전 NOAC 중단이 필요한지는 현재까지 명확한 근거가 없다. 2018년 대 한부정맥학회에서 발표한 심방세동 환자에서 NOAC 사용에 관한 임상진료지침에서는 NOAC을 복용하는 환자에서 출혈 발생 위험이 높은 침습적 시술을 시행하는 경우 시술 전 48시간 이상 NOAC을 중단하도록 권고하고 있으며 94 APAGE/APSDE 와 BSG/ESGE 임상진료지침에서도 고위험 시술 전 NOAC 중단을 권고한다.12,13 NOAC은 빠른 작용 시간(1-4 시간) 및 빠른 작용 소실 시간 (~24 시간)을 특징으로 하며, NOAC의 반감기는 약 12시간으로 48시간 후에는 체내에 거의 남아 있지 않을 것으로 예측할 수 있다. NOAC의 대사 및 배설에는 신기능이 중요하며, 특히 dabigatran의 경우 80%가 신장을 통해 배설되므로 신기능 저하 시 가장 큰 영향을 받을 수 있다.95 따라서 NOAC을 복용하는 환자에서 고위험 시술이 예정된 경우 시술 전 신기능을 평가해야 하며, 신기능이 저하된 경우 약제 사용에 각별한 주의가 필요하다.96 신기능이 정상인 환자에서는 고위험 내시경 시술 시행 2일 전부터 약제를 중단하 며, dabigatran은 크레아티닌 청소율(creatinine clearance, CrCl) 이 50-80 mL/min 인 경우 시술 3일 전부터, CrCl이 30-50 mL/min 인 경우에는 시술 4일 전부터 중단하는 것이 권고된다.97
혈전색전증 발생 위험이 높은 환자에서 내시경 시술 전 NOAC을 중단하였을 때 헤파린 가교 요법이 필요한지에 대해서는 현재까지 명확한 근거가 없다. ASGE 임상진료지침에서는 내시경 시술 후 24시간 이내에 NOAC 복용을 재개할 수 없는 경우에는 헤파린 가교 요법을 시행하도록 권고하고 있다.11 반면 APAGE/APSDE 와 BSG/ESGE 임상진료지침에서는 NOAC의 빠른 작용 시간을 근거로 NOAC 중단 기간 동안 헤파린 가교 요법을 권고하지 않는다.12,13 2018년 대한 부정맥학회 임상진료지침에서도 NOAC의 항응고 효과 예측이 가능하다는 점을 근거로 하여 단기간 약제 복용을 중지할 경우에는 헤파린 가교 요법을 권고하지 않았다.94
NOAC을 중단한 환자에서 고위험 내시경 시술 후 약제 복용을 언제 다시 시작해야 하는지에 대한 연구는 현재까지 없다. 따라서 약제 중단 기간 및 복용 재개 시점에 대하여 순환 기내과 또는 신경과 의료진과 협의하는 것이 도움이 될 수 있다. APAGE/APSDE 임상진료지침에서는 항응고제 중단으로 인한 혈전색전증의 발생 위험을 최소화하기 위해 지혈이 확인되고 재출혈의 증거가 거의 없는 경우 NOAC 복용을 조기에 재개하도록 권고하고 있다.13 반면 BSG/ESGE 임상진료 지침에서는 NOAC의 빠른 작용 시간을 고려하여 고위험 내시경 시술 후 24-48 시간 내에 NOAC을 재개하도록 권고하고 있다.12 이 임상진료지침에서는 NOAC 중단 기간이 길어질 경우 혈전색전증 발생 위험이 증가할 수 있다는 점을 고려하여 시술 시 지혈이 적절히 시행되고 시술 후 출혈의 증거가 없는 경우 NOAC 복용을 조기에 재개하는 것을 권고한다.
Go to : 
인구 고령화로 심뇌혈관 질환 유병률이 증가함에 따라 항 혈전제를 복용하는 환자의 수 또한 증가하고 있다. 내시경 시술과 연관된 출혈 발생 위험은 시술의 종류에 따라 다르며, 항혈전제 복용은 출혈 위험을 더욱 증가시킬 수 있다. 그러나 항혈전제를 중단하는 경우 혈전색전증 위험이 증가하므로, 항 혈전제를 복용하는 환자에서 내시경 시술 전 항혈전제 중단 여부 및 기간을 결정하기 위해서는 내시경 시술과 연관된 출혈과 항혈전제 중단으로 인한 혈전색전증 발생 위험을 동시에 고려해야 한다. 이 임상진료지침은 내시경 시술을 시행하는 의료진에게 내시경 시술 전후 항혈전제 사용과 관련된 근거와 임상 정보를 제공하고 적정 진료를 위한 의사결정을 하는 데 있어 도움을 주고자 개발되었다. 이 임상진료지침을 통해 항 혈전제를 사용하는 환자에서 내시경 시술과 연관된 출혈 및 혈전색전증 합병증 발생을 최소화함으로써 보다 효과적이고 안전하게 내시경 시술을 시행할 수 있을 것으로 기대한다.
Go to : 
REFERENCES
1. Antithrombotic Trialists' Collaboration. 2002; Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 324:71–86. DOI: 10.1136/bmj.324.7329.71. PMID: 11786451. PMCID: PMC64503.

2. Baigent C, Blackwell L, et al. Antithrombotic Trialists' (ATT) Collaboration. 2009; Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 373:1849–1860. DOI: 10.1016/S0140-6736(09)60503-1.
3. Singer DE, Hughes RA, et al. Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators. 1990; The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation. N Engl J Med. 323:1505–1511. DOI: 10.1056/NEJM199011293232201. PMID: 2233931.

4. van Walraven C, Hart RG, Singer DE, et al. 2002; Oral anticoagulants vs aspirin in nonvalvular atrial fibrillation: an individual patient meta-analysis. JAMA. 288:2441–2448. DOI: 10.1001/jama.288.19.2441. PMID: 12435257.
5. Choi KS, Jung HY, Choi KD, et al. 2011; EMR versus gastrectomy for intramucosal gastric cancer: comparison of long-term outcomes. Gastrointest Endosc. 73:942–948. DOI: 10.1016/j.gie.2010.12.032. PMID: 21392757.

6. Pyo JH, Lee H, Min BH, et al. 2016; Long-term outcome of endoscopic resection vs. surgery for early gastric cancer: a non-inferioritymatched cohort study. Am J Gastroenterol. 111:240–249. DOI: 10.1038/ajg.2015.427. PMID: 26782817.
7. Kim YG, Kong SH, Oh SY, et al. 2014; Effects of screening on gastric cancer management: comparative analysis of the results in 2006 and in 2011. J Gastric Cancer. 14:129–134. DOI: 10.5230/jgc.2014.14.2.129. PMID: 25061541. PMCID: PMC4105378.

8. Holbrook A, Schulman S, Witt DM, et al. 2012; Evidence-based management of anticoagulant therapy: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 141(Suppl 2):e152S–e184S. DOI: 10.1378/chest.141.4.1129b. PMCID: PMC3620915.
9. Becker RC, Scheiman J, Dauerman HL, et al. 2009; Management of platelet-directed pharmacotherapy in patients with atherosclerotic coronary artery disease undergoing elective endoscopic gastrointestinal procedures. J Am Coll Cardiol. 54:2261–2276. DOI: 10.1016/j.jacc.2009.09.012. PMID: 19942393.

10. Fujimoto K, Fujishiro M, Kato M, et al. 2014; Guidelines for gastroenterological endoscopy in patients undergoing antithrombotic treatment. Dig Endosc. 26:1–14. DOI: 10.1111/den.12183. PMID: 24215155.

11. Acosta RD, Abraham NS, et al. ASGE Standards of Practice Committee. 2016; The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc. 83:3–16. DOI: 10.1016/j.gie.2015.09.035. PMID: 26621548.

12. Veitch AM, Vanbiervliet G, Gershlick AH, et al. 2016; Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines. Gut. 65:374–389. DOI: 10.1136/gutjnl-2015-311110. PMID: 26873868. PMCID: PMC4789831.

13. Chan FKL, Goh KL, Reddy N, et al. 2018; Management of patients on antithrombotic agents undergoing emergency and elective endoscopy: joint Asian Pacific Association of Gastroenterology (APAGE) and Asian Pacific Society for Digestive Endoscopy (APSDE) practice guidelines. Gut. 67:405–417. DOI: 10.1136/gutjnl-2017-315131. PMID: 29331946. PMCID: PMC5868286.

14. Brouwers MC, Kho ME, Browman GP, et al. 2010; AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 182:E839–E842. DOI: 10.1503/cmaj.090449. PMID: 20603348. PMCID: PMC3001530.

15. Higgins JPT, Altman DG, Sterne JAC. Higgins JPT, Green S, editors. c2011. Chapter 8: assessing risk of bias in included studies. Cochrane handbook for systematic reviews of interventions. Version 5.1.0 [Internet]. Cochrane;London: Available from: http://handbook-5-1.cochrane.org/. updated 2011 Mar.
16. Sterne JA, Hernán MA, Reeves BC, et al. 2016; ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 355:i4919. DOI: 10.1136/bmj.i4919. PMID: 27733354. PMCID: PMC5062054.

17. Shea BJ, Grimshaw JM, Wells GA, et al. 2007; Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 7:10. DOI: 10.1186/1471-2288-7-10. PMID: 17302989. PMCID: PMC1810543.

18. Guyatt GH, Oxman AD, Kunz R, et al. 2008; Incorporating considerations of resources use into grading recommendations. BMJ. 336:1170–1173. DOI: 10.1136/bmj.39504.506319.80. PMID: 18497416. PMCID: PMC2394579.

19. Ischemic Heart Disease Clinical Research Center. c2013. Recommendation for standard treatment for acute coronary syndrome [Internet]. Korean Society of Cardiology;Seoul: Available from: https://www.circulation.or.kr:4443/bbs/index.php?.code=m_info&category=&gubun=&page=1&number=263&-mode=view&keyfield=&key=. updated 2013 Mar 12; cited 2020 Jul 15.
20. Levine GN, Bates ER, Bittl JA, et al. 2016; 2016 ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines: an update of the 2011 ACCF/AHA/SCAI guideline for percutaneous coronary intervention, 2011 ACCF/AHA guideline for coronary artery bypass graft surgery, 2012 ACC/AHA/ACP/AATS/PCNA/SCAI/STS guideline for the diagnosis and management of patients with stable ischemic heart disease, 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction, 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes, and 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery. Circulation. 134:e123–e155. DOI: 10.1161/CIR.0000000000000452.

21. Egholm G, Kristensen SD, Thim T, et al. 2016; Risk associated with surgery within 12 months after coronary drug-eluting stent implantation. J Am Coll Cardiol. 68:2622–2632. DOI: 10.1016/j.jacc.2016.09.967. PMID: 27978946.
22. Hawn MT, Graham LA, Richman JS, Itani KM, Henderson WG, Maddox TM. 2013; Risk of major adverse cardiac events following noncardiacsurgery in patients with coronary stents. JAMA. 310:1462–1472. DOI: 10.1001/jama.2013.278787. PMID: 24101118.
23. Holcomb CN, Graham LA, Richman JS, Itani KM, Maddox TM, Hawn MT. 2016; The incremental risk of coronary stents on postoperative adverse events: a matched cohort study. Ann Surg. 263:924–930. DOI: 10.1097/SLA.0000000000001246. PMID: 25894416.
24. Valgimigli M, Bueno H, Byrne RA, et al. 2018; 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual anti-platelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 39:213–260. DOI: 10.1093/eurheartj/ehx419. PMID: 28886622.
25. Garcia DA, Regan S, Henault LE, et al. 2008; Risk of thromboembolism with short-term interruption of warfarin therapy. Arch Intern Med. 168:63–69. DOI: 10.1001/archinternmed.2007.23. PMID: 18195197.

26. Blacker DJ, Wijdicks EF, McClelland RL. 2003; Stroke risk in anti-coagulated patients with atrial fibrillation undergoing endoscopy. Neurology. 61:964–968. DOI: 10.1212/01.WNL.0000086817.54076.EB. PMID: 14557569.

27. Cappell MS, Abdullah M. 2000; Management of gastrointestinal bleeding induced by gastrointestinal endoscopy. Gastroenterol Clin North Am. 29:125–167. vi–vii. DOI: 10.1016/S0889-8553(05)70110-2.

28. Macrae FA, Tan KG, Williams CB. 1983; Towards safer colonoscopy: a report on the complications of 5000 diagnostic or therapeutic colonoscopies. Gut. 24:376–383. DOI: 10.1136/gut.24.5.376. PMID: 6601604. PMCID: PMC1419999.

29. Rogers BH, Silvis SE, Nebel OT, Sugawa C, Mandelstam P. 1975; Complications of flexible fiberoptic colonoscopy and polypectomy. Gastrointest Endosc. 22:73–77. DOI: 10.1016/S0016-5107(75)73705-7.
30. Vu CK, Korman MG, Bejer I, Davis S. 1998; Gastrointestinal bleeding after cold biopsy. Am J Gastroenterol. 93:1141–1143. DOI: 10.1111/j.1572-0241.1998.346_e.x. PMID: 9672346.

31. Wexner SD, Garbus JE, Singh JJ. 2001; A prospective analysis of 13,580 colonoscopies. Reevaluation of credentialing guidelines. Surg Endosc. 15:251–261. DOI: 10.1007/s004640080147. PMID: 11344424.
32. Parra-Blanco A, Kaminaga N, Kojima T, et al. 2000; Hemoclipping for postpolypectomy and postbiopsy colonic bleeding. Gastrointest Endosc. 51:37–41. DOI: 10.1016/S0016-5107(00)70384-1.

33. Sieg A, Hachmoeller-Eisenbach U, Eisenbach T. 2001; Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists. Gastrointest Endosc. 53:620–627. DOI: 10.1067/mge.2001.114422. PMID: 11323588.

34. Ono S, Fujishiro M, Kodashima S, et al. 2012; Evaluation of safety of endoscopic biopsy without cessation of antithrombotic agents in Japan. J Gastroenterol. 47:770–774. DOI: 10.1007/s00535-012-0538-7. PMID: 22350697.

35. Whitson MJ, Dikman AE, von Althann C, et al. 2011; Is gastroduodenal biopsy safe in patients receiving aspirin and clopidogrel?: a prospective, randomized study involving 630 biopsies. J Clin Gastroenterol. 45:228–233. DOI: 10.1097/MCG.0b013e3181eb5efd. PMID: 20717045.
36. Ono S, Fujishiro M, Hirano K, et al. 2009; Retrospective analysis on the management of anticoagulants and antiplatelet agents for scheduled endoscopy. J Gastroenterol. 44:1185–1189. DOI: 10.1007/s00535-009-0127-6. PMID: 19763388.

37. Shiffman ML, Farrel MT, Yee YS. 1994; Risk of bleeding after endoscopic biopsy or polypectomy in patients taking aspirin or other NSAIDS. Gastrointest Endosc. 40:458–462. DOI: 10.1016/S0016-5107(94)70210-1.

38. Hamada T, Yasunaga H, Nakai Y, et al. 2015; Bleeding after endoscopic sphincterotomy or papillary balloon dilation among users of antithrombotic agents. Endoscopy. 47:997–1004. DOI: 10.1055/s-0034-1392408. PMID: 26126160.

39. Bowles CJ, Leicester R, Romaya C, Swarbrick E, Williams CB, Epstein O. 2004; A prospective study of colonoscopy practice in the UK today: are we adequately prepared for national colorectal cancer screening tomorrow? Gut. 53:277–283. DOI: 10.1136/gut.2003.016436. PMID: 14724164. PMCID: PMC1774946.

40. Gavin DR, Valori RM, Anderson JT, Donnelly MT, Williams JG, Swarbrick ET. 2013; The national colonoscopy audit: a nationwide assessment of the quality and safety of colonoscopy in the UK. Gut. 62:242–249. DOI: 10.1136/gutjnl-2011-301848. PMID: 22661458.

41. Choung BS, Kim SH, Ahn DS, et al. 2014; Incidence and risk factors of delayed postpolypectomy bleeding: a retrospective cohort study. J Clin Gastroenterol. 48:784–789. DOI: 10.1097/MCG.0000000000000027. PMID: 24231934.
42. Kim JH, Lee HJ, Ahn JW, et al. 2013; Risk factors for delayed post-polypectomy hemorrhage: a case-control study. J Gastroenterol Hepatol. 28:645–649. DOI: 10.1111/jgh.12132. PMID: 23369027.

43. Manocha D, Singh M, Mehta N, Murthy UK. 2012; Bleeding risk after invasive procedures in aspirin/NSAID users: polypectomy study in veterans. Am J Med. 125:1222–1227. DOI: 10.1016/j.amjmed.2012.05.030. PMID: 23164486.

44. Repici A, Hassan C, Vitetta E, et al. 2012; Safety of cold polypectomy for <10mm polyps at colonoscopy: a prospective multicenter study. Endoscopy. 44:27–31. DOI: 10.1055/s-0031-1291387. PMID: 22125197.
45. Rutter MD, Nickerson C, Rees CJ, Patnick J, Blanks RG. 2014; Risk factors for adverse events related to polypectomy in the English bowel cancer screening programme. Endoscopy. 46:90–97. DOI: 10.1055/s-0033-1344987. PMID: 24477363.

46. Hui AJ, Wong RM, Ching JY, Hung LC, Chung SC, Sung JJ. 2004; Risk of colonoscopic polypectomy bleeding with anticoagulants and antiplatelet agents: analysis of 1657 cases. Gastrointest Endosc. 59:44–48. DOI: 10.1016/S0016-5107(03)02307-1.

47. Yousfi M, Gostout CJ, Baron TH, et al. 2004; Postpolypectomy lower gastrointestinal bleeding: potential role of aspirin. Am J Gastroenterol. 99:1785–1789. DOI: 10.1111/j.1572-0241.2004.30368.x. PMID: 15330919.

48. Lee SH, Shin SJ, Park DI, et al. 2012; Korean guideline for colonoscopic polypectomy. Clin Endosc. 45:11–24. DOI: 10.5946/ce.2012.45.1.11. PMID: 22741130. PMCID: PMC3363129.

49. Moon HS, Park SW, Kim DH, Kang SH, Sung JK, Jeong HY. 2014; Only the size of resected polyps is an independent risk factor for delayed postpolypectomy hemorrhage: a 10-year single-center case-control study. Ann Coloproctol. 30:182–185. DOI: 10.3393/ac.2014.30.4.182. PMID: 25210687. PMCID: PMC4155137.

50. Shalman D, Gerson LB. 2015; Systematic review with meta-analysis: the risk of gastrointestinal haemorrhage post-polypectomy in patients receiving anti-platelet, anti-coagulant and/or thienopyridine medications. Aliment Pharmacol Ther. 42:949–956. DOI: 10.1111/apt.13367. PMID: 26290157.

51. Sawhney MS, Salfiti N, Nelson DB, Lederle FA, Bond JH. 2008; Risk factors for severe delayed postpolypectomy bleeding. Endoscopy. 40:115–119. DOI: 10.1055/s-2007-966959. PMID: 18253906.

52. Bahin FF, Naidoo M, Williams SJ, et al. 2015; Prophylactic endoscopic coagulation to prevent bleeding after wide-field endoscopic mucosal resection of large sessile colon polyps. Clin Gastroenterol Hepatol. 13:724–730. e1-e2. DOI: 10.1016/j.cgh.2014.07.063. PMID: 25151254.

53. Burgess NG, Metz AJ, Williams SJ, et al. 2014; Risk factors for intra-procedural and clinically significant delayed bleeding after wide-field endoscopic mucosal resection of large colonic lesions. Clin Gastroenterol Hepatol. 12:651–661. e1-e3. DOI: 10.1016/j.cgh.2013.09.049. PMID: 24090728.

54. Metz AJ, Bourke MJ, Moss A, Williams SJ, Swan MP, Byth K. 2011; Factors that predict bleeding following endoscopic mucosal resection of large colonic lesions. Endoscopy. 43:506–511. DOI: 10.1055/s-0030-1256346. PMID: 21618150.

55. Cao Y, Liao C, Tan A, Gao Y, Mo Z, Gao F. 2009; Meta-analysis of endoscopic submucosal dissection versus endoscopic mucosal resection for tumors of the gastrointestinal tract. Endoscopy. 41:751–757. DOI: 10.1055/s-0029-1215053. PMID: 19693750.

56. Cho SJ, Choi IJ, Kim CG, et al. 2012; Aspirin use and bleeding risk after endoscopic submucosal dissection in patients with gastric neoplasms. Endoscopy. 44:114–121. DOI: 10.1055/s-0031-1291459. PMID: 22271021.

57. Dong J, Wei K, Deng J, et al. 2017; Effects of antithrombotic therapy on bleeding after endoscopic submucosal dissection. Gastrointest Endosc. 86:807–816. DOI: 10.1016/j.gie.2017.07.017. PMID: 28732709.

58. Koh R, Hirasawa K, Yahara S, et al. 2013; Antithrombotic drugs are risk factors for delayed postoperative bleeding after endoscopic submucosal dissection for gastric neoplasms. Gastrointest Endosc. 78:476–483. DOI: 10.1016/j.gie.2013.03.008. PMID: 23622974.

59. Kono Y, Obayashi Y, Baba Y, et al. 2018; Postoperative bleeding risk after gastric endoscopic submucosal dissection during antithrombotic drug therapy. J Gastroenterol Hepatol. 33:453–460. DOI: 10.1111/jgh.13872. PMID: 28696019.

60. Libânio D, Costa MN, Pimentel-Nunes P, Dinis-Ribeiro M. 2016; Risk factors for bleeding after gastric endoscopic submucosal dissection: a systematic review and meta-analysis. Gastrointest Endosc. 84:572–586. DOI: 10.1016/j.gie.2016.06.033. PMID: 27345132.

61. Lim JH, Kim SG, Kim JW, et al. 2012; Do antiplatelets increase the risk of bleeding after endoscopic submucosal dissection of gastric neoplasms? Gastrointest Endosc. 75:719–727. DOI: 10.1016/j.gie.2011.11.034. PMID: 22317881.

62. Sanomura Y, Oka S, Tanaka S, et al. 2014; Continued use of low-dose aspirin does not increase the risk of bleeding during or after endoscopic submucosal dissection for early gastric cancer. Gastric Cancer. 17:489–496. DOI: 10.1007/s10120-013-0305-3. PMID: 24142107. PMCID: PMC4072060.

63. Arimoto J, Higurashi T, Chiba H, et al. 2018; Continued use of a single antiplatelet agent does not increase the risk of delayed bleeding after colorectal endoscopic submucosal dissection. Dig Dis Sci. 63:218–227. DOI: 10.1007/s10620-017-4843-0. PMID: 29177848. PMCID: PMC5760603.

64. Ninomiya Y, Oka S, Tanaka S, et al. 2015; Risk of bleeding after endoscopic submucosal dissection for colorectal tumors in patients with continued use of low-dose aspirin. J Gastroenterol. 50:1041–1046. DOI: 10.1007/s00535-015-1053-4. PMID: 25682173.

65. Biondi-Zoccai GG, Lotrionte M, Agostoni P, et al. 2006; A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50,279 patients at risk for coronary artery disease. Eur Heart J. 27:2667–2674. DOI: 10.1093/eurheartj/ehl334. PMID: 17053008.
66. Maulaz AB, Bezerra DC, Michel P, Bogousslavsky J. 2005; Effect of discontinuing aspirin therapy on the risk of brain ischemic stroke. Arch Neurol. 62:1217–1220. DOI: 10.1001/archneur.62.8.1217. PMID: 16087761.

67. Oscarsson A, Gupta A, Fredrikson M, et al. 2010; To continue or discontinue aspirin in the perioperative period: a randomized, controlled clinical trial. Br J Anaesth. 104:305–312. DOI: 10.1093/bja/aeq003. PMID: 20150346.

68. Cotton PB, Lehman G, Vennes J, et al. 1991; Endoscopic sphincterotomy complications and their management: an attempt at consensus. Gastrointest Endosc. 37:383–393. DOI: 10.1016/S0016-5107(91)70740-2.

69. Freeman ML, Nelson DB, Sherman S, et al. 1996; Complications of endoscopic biliary sphincterotomy. N Engl J Med. 335:909–918. DOI: 10.1056/NEJM199609263351301. PMID: 8782497.

70. Hui CK, Lai KC, Yuen MF, Wong WM, Lam SK, Lai CL. 2002; Does withholding aspirin for one week reduce the risk of post-sphincterotomy bleeding? Aliment Pharmacol Ther. 16:929–936. DOI: 10.1046/j.1365-2036.2002.01251.x. PMID: 11966501.
71. Hussain N, Alsulaiman R, Burtin P, et al. 2007; The safety of endoscopic sphincterotomy in patients receiving antiplatelet agents: a case-control study. Aliment Pharmacol Ther. 25:579–584. DOI: 10.1111/j.1365-2036.2006.03225.x. PMID: 17305758.
72. Onal IK, Parlak E, Akdogan M, et al. 2013; Do aspirin and non-steroidal anti-inflammatory drugs increase the risk of post-sphincterotomy hemorrhage--a case-control study. Clin Res Hepatol Gastroenterol. 37:171–176. DOI: 10.1016/j.clinre.2012.04.010. PMID: 22677232.
73. Nelson DB, Freeman ML. 1994; Major hemorrhage from endoscopic sphincterotomy: risk factor analysis. J Clin Gastroenterol. 19:283–287. DOI: 10.1097/00004836-199412000-00004. PMID: 7876506.

74. Hwang JH, Kang DH, Kim HW, Choi CW, Park SB. 2011; The safety of endoscopic sphincterotomy in patients taking aspirin. Korean J Med. 81:193–198.
75. Feagins LA, Iqbal R, Harford WV, et al. 2013; Low rate of postpolypectomy bleeding among patients who continue thienopyridine therapy during colonoscopy. Clin Gastroenterol Hepatol. 11:1325–1332. DOI: 10.1016/j.cgh.2013.02.003. PMID: 23403011.

76. Gandhi S, Narula N, Mosleh W, Marshall JK, Farkouh M. 2013; Meta-analysis: colonoscopic post-polypectomy bleeding in patients on continued clopidogrel therapy. Aliment Pharmacol Ther. 37:947–952. DOI: 10.1111/apt.12292. PMID: 23530880.

77. Singh M, Mehta N, Murthy UK, Kaul V, Arif A, Newman N. 2010; Postpolypectomy bleeding in patients undergoing colonoscopy on uninterrupted clopidogrel therapy. Gastrointest Endosc. 71:998–1005. DOI: 10.1016/j.gie.2009.11.022. PMID: 20226452.

78. Lee MG, Kim J, Lee SH, et al. 2014; Effect of sustained use of platelet aggregation inhibitors on post-endoscopic sphincterotomy bleeding. Dig Endosc. 26:737–744. DOI: 10.1111/den.12271. PMID: 24673356.

79. Oh S, Kim SG, Kim J, et al. 2018; Continuous use of thienopyridine may be as safe as low-dose aspirin in endoscopic resection of gastric tumors. Gut Liver. 12:393–401. DOI: 10.5009/gnl17384. PMID: 29429155. PMCID: PMC6027827.

80. Eisenberg MJ, Richard PR, Libersan D, Filion KB. 2009; Safety of short-term discontinuation of antiplatelet therapy in patients with drug-eluting stents. Circulation. 119:1634–1642. DOI: 10.1161/CIRCULATIONAHA.108.813667. PMID: 19289638.

81. Hong SJ, Kim MJ, Kim JS, et al. 2019; Effect of perioperative antiplatelet therapy on outcomes in patients with drug-eluting stents undergoing elective noncardiac surgery. Am J Cardiol. 123:1414–1421. DOI: 10.1016/j.amjcard.2019.02.004. PMID: 30770090.

82. Choudari CP, Rajgopal C, Palmer KR. 1994; Acute gastrointestinal haemorrhage in anticoagulated patients: diagnoses and response to endoscopic treatment. Gut. 35:464–466. DOI: 10.1136/gut.35.4.464. PMID: 8174982. PMCID: PMC1374792.

83. Igarashi K, Takizawa K, Kakushima N, et al. 2017; Should antithrombotic therapy be stopped in patients undergoing gastric endoscopic submucosal dissection? Surg Endosc. 31:1746–1753. DOI: 10.1007/s00464-016-5167-4. PMID: 27530896.

84. Witt DM, Delate T, McCool KH, et al. 2009; Incidence and predictors of bleeding or thrombosis after polypectomy in patients receiving and not receiving anticoagulation therapy. J Thromb Haemost. 7:1982–1989. DOI: 10.1111/j.1538-7836.2009.03598.x. PMID: 19719825.

85. White RH, McKittrick T, Hutchinson R, Twitchell J. 1995; Temporary discontinuation of warfarin therapy: changes in the international normalized ratio. Ann Intern Med. 122:40–42. DOI: 10.7326/0003-4819-122-1-199501010-00006. PMID: 7985894.

86. Schulman S, Elbazi R, Zondag M, O'Donnell M. 2008; Clinical factors influencing normalization of prothrombin time after stopping warfarin: a retrospective cohort study. Thromb J. 6:15. DOI: 10.1186/1477-9560-6-15. PMID: 18925967. PMCID: PMC2586623.

87. Horiuchi A, Nakayama Y, Kajiyama M, Tanaka N, Sano K, Graham DY. 2014; Removal of small colorectal polyps in anticoagulated patients: a prospective randomized comparison of cold snare and conventional polypectomy. Gastrointest Endosc. 79:417–423. DOI: 10.1016/j.gie.2013.08.040. PMID: 24125514.
88. Joung B, Lee JM, Lee KH, et al. 2018; 2018 Korean guideline of atrial fibrillation management. Korean Circ J. 48:1033–1080. DOI: 10.4070/kcj.2018.0339. PMID: 30403013. PMCID: PMC6221873.

89. Douketis JD, Spyropoulos AC, Kaatz S, et al. 2015; Perioperative bridging anticoagulation in patients with strial fibrillation. N Engl J Med. 373:823–833. DOI: 10.1056/NEJMoa1501035. PMID: 26095867. PMCID: PMC4931686.
90. Friedland S, Sedehi D, Soetikno R. 2009; Colonoscopic polypectomy in anticoagulated patients. World J Gastroenterol. 15:1973–1976. DOI: 10.3748/wjg.15.1973. PMID: 19399929. PMCID: PMC2675087.

91. Timothy SK, Hicks TC, Opelka FG, Timmcke AE, Beck DE. 2001; Colonoscopy in the patient requiring anticoagulation. Dis Colon Rectum. 44:1845–1848. discussion, 1848-1849. DOI: 10.1007/BF02234465. PMID: 11742172.

92. Ara N, Iijima K, Maejima R, et al. 2015; Prospective analysis of risk for bleeding after endoscopic biopsy without cessation of antithrombotics in Japan. Dig Endosc. 27:458–464. DOI: 10.1111/den.12407. PMID: 25425518.
93. Kato M, Uedo N, Hokimoto S, et al. 2018; Guidelines for gastroenterological endoscopy in patients undergoing antithrombotic treatment: 2017 appendix on anticoagulants including direct oral anticoagulants. Dig Endosc. 30:433–440. DOI: 10.1111/den.13184. PMID: 29733468.
94. Lee JH, Lim HE, Lim WH, et al. 2019; The 2018 Korean heart rhythm society practical guidelines on the use of non-vitamin K-antagonist oral anticoagulants: bleeding control and perioperative management. Korean J Med. 94:40–56. DOI: 10.3904/kjm.2019.94.1.40.

95. Trociz IF, Tillmann C, Liesenfeld KH, Schäfer HG, Stangier J. 2007; Population pharmacokinetic analysis of the new oral thrombin inhibitor dabigatran etexilate (BIBR 1048) in patients undergoing primary elective total hip replacement surgery. J Clin Pharmacol. 47:371–382. DOI: 10.1177/0091270006297228. PMID: 17322149.
96. Heidbuchel H, Verhamme P, Alings M, et al. 2017; Updated European Heart Rhythm Association practical guide on the use of non-vitamin-K antagonist anticoagulants in patients with non-valvular atrial fibrillation: executive summary. Eur Heart J. 38:2137–2149. DOI: 10.1093/eurheartj/ehw058. PMID: 27282612. PMCID: PMC5837231.

97. Dunn A. 2006; Perioperative management of oral anticoagulation: when and how to bridge. J Thromb Thrombolysis. 21:85–89. DOI: 10.1007/s11239-006-5582-9. PMID: 16475048.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download