1. Wood K, Vini L, Harmer C. 2004; Metastases to the thyroid gland: the Royal Marsden experience. Eur J Surg Oncol. 30(6):583–8. DOI:
10.1016/j.ejso.2004.03.012. PMID:
15256229.

3. Barczynski M, Jamski J, Cichon S, Barczynski M, Sulowicz W. 2000; Diagnosis, treatment and prognosis in cases of renal clear cell carcinoma metastases into the thyroid gland. Przegl Lek. 57(3):157–9. PMID:
10909286.
4. Chung AY, Tran TB, Brumund KT, Weisman RA, Bouvet M. 2012; Metastases to the thyroid: a review of the literature from the last decade. Thyroid. 22(3):258–68. DOI:
10.1089/thy.2010.0154. PMID:
22313412.

5. Lam KY, Lo CY. 1998; Metastatic tumors of the thyroid gland: a study of 79 cases in Chinese patients. Arch Pathol Lab Med. 122(1):37–41. PMID:
9448014.
6. Liu Y. 2009; Clinical significance of thyroid uptake on F18-fluorodeoxyglucose positron emission tomography. Ann Nucl Med. 23(1):17–23. DOI:
10.1007/s12149-008-0198-0. PMID:
19205834.

7. Ho TY, Liou MJ, Lin KJ, Yen TC. 2011; Prevalence and significance of thyroid uptake detected by
18F-FDG PET. Endocrine. 40(2):297–302. DOI:
10.1007/s12020-011-9470-5. PMID:
21505891.
10. Caturegli P, De Remigis A, Rose NR. 2014; Hashimoto thyroiditis: clinical and diagnostic criteria. Autoimmun Rev. 13(4-5):391–7. DOI:
10.1016/j.autrev.2014.01.007. PMID:
24434360.

11. Czepczynski R. 2012; Nuclear medicine in the diagnosis of benign thyroid diseases. Nucl Med Rev Cent East Eur. 15(2):113–9. PMID:
22936504.
12. Bertagna F, Treglia G, Piccardo A, Giubbini R. 2012; Diagnostic and clinical significance of F-18-FDG-PET/CT thyroid incidentalomas. J Clin Endocrinol Metab. 97(11):3866–75. DOI:
10.1210/jc.2012-2390. PMID:
22904176.

13. Chen W, Parsons M, Torigian DA, Zhuang H, Alavi A. 2009; Evaluation of thyroid FDG uptake incidentally identified on FDG-PET/CT imaging. Nucl Med Commun. 30(3):240–4. DOI:
10.1097/MNM.0b013e328324b431. PMID:
19262287.

14. Kurata S, Ishibashi M, Hiromatsu Y, Kaida H, Miyake I, Uchida M, et al. 2007; Diffuse and diffuse-plus-focal uptake in the thyroid gland identified by using FDG-PET: prevalence of thyroid cancer and Hashimoto's thyroiditis. Ann Nucl Med. 21(6):325–30. DOI:
10.1007/s12149-007-0030-2. PMID:
17705011.

15. Bae JS, Chae BJ, Park WC, Kim JS, Kim SH, Jung SS, et al. 2009; Incidental thyroid lesions detected by FDG-PET/CT: prevalence and risk of thyroid cancer. World J Surg Oncol. 7:63. DOI:
10.1186/1477-7819-7-63. PMID:
19664272. PMCID:
PMC2732624.

16. Bonabi S, Schmidt F, Broglie MA, Haile SR, Stoeckli SJ. 2012; Thyroid incidentalomas in FDG-PET/CT: prevalence and clinical impact. Eur Arch Otorhinolaryngol. 269(12):2555–60. DOI:
10.1007/s00405-012-1941-7. PMID:
22298251.

17. Are C, Hsu JF, Schoder H, Shah JP, Larson SM, Shaha AR. 2007; FDG-PET detected thyroid incidentalomas: need for further investigation? Ann Surg Oncol. 14(1):239–47. DOI:
10.1245/s10434-006-9181-y. PMID:
17024553.

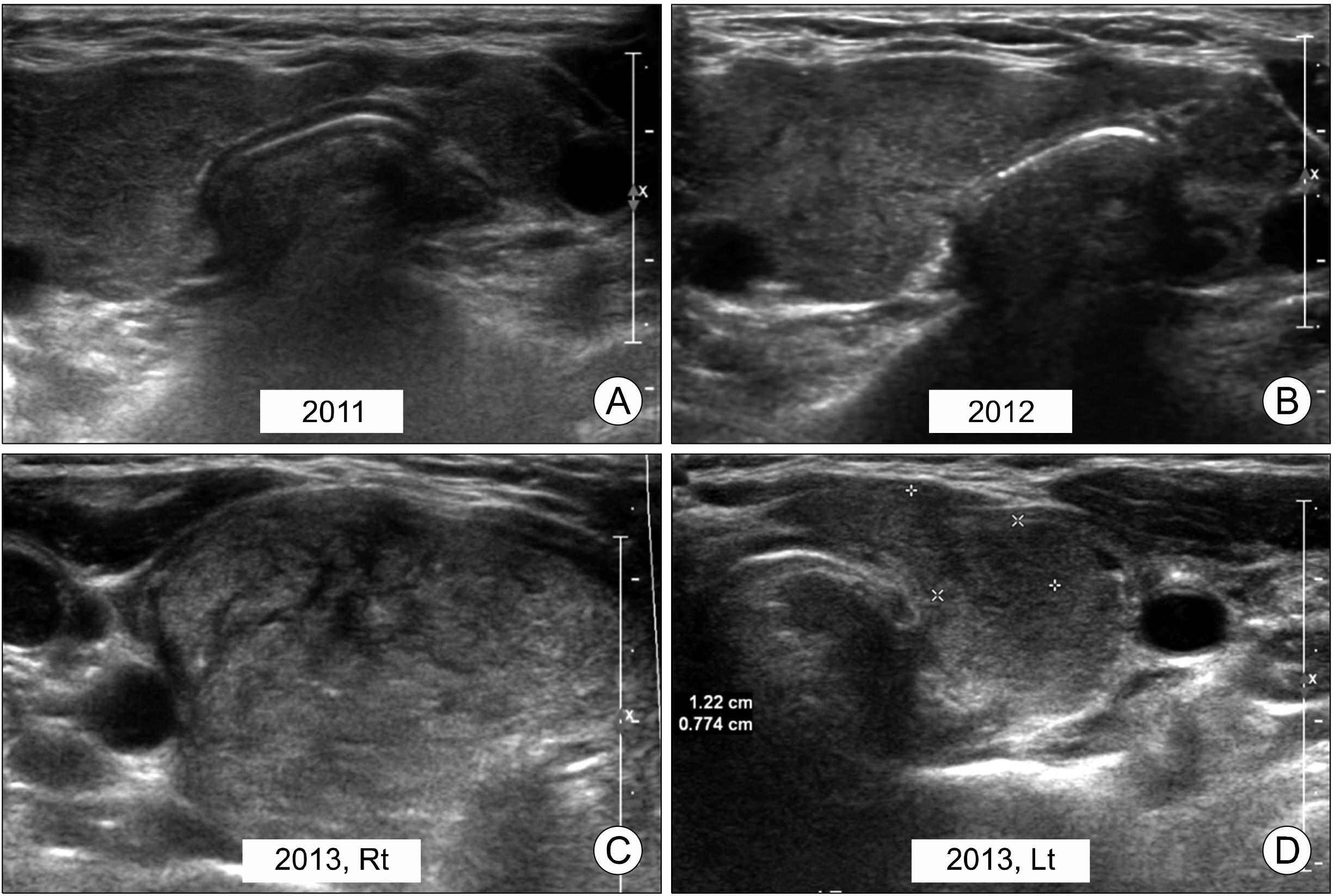
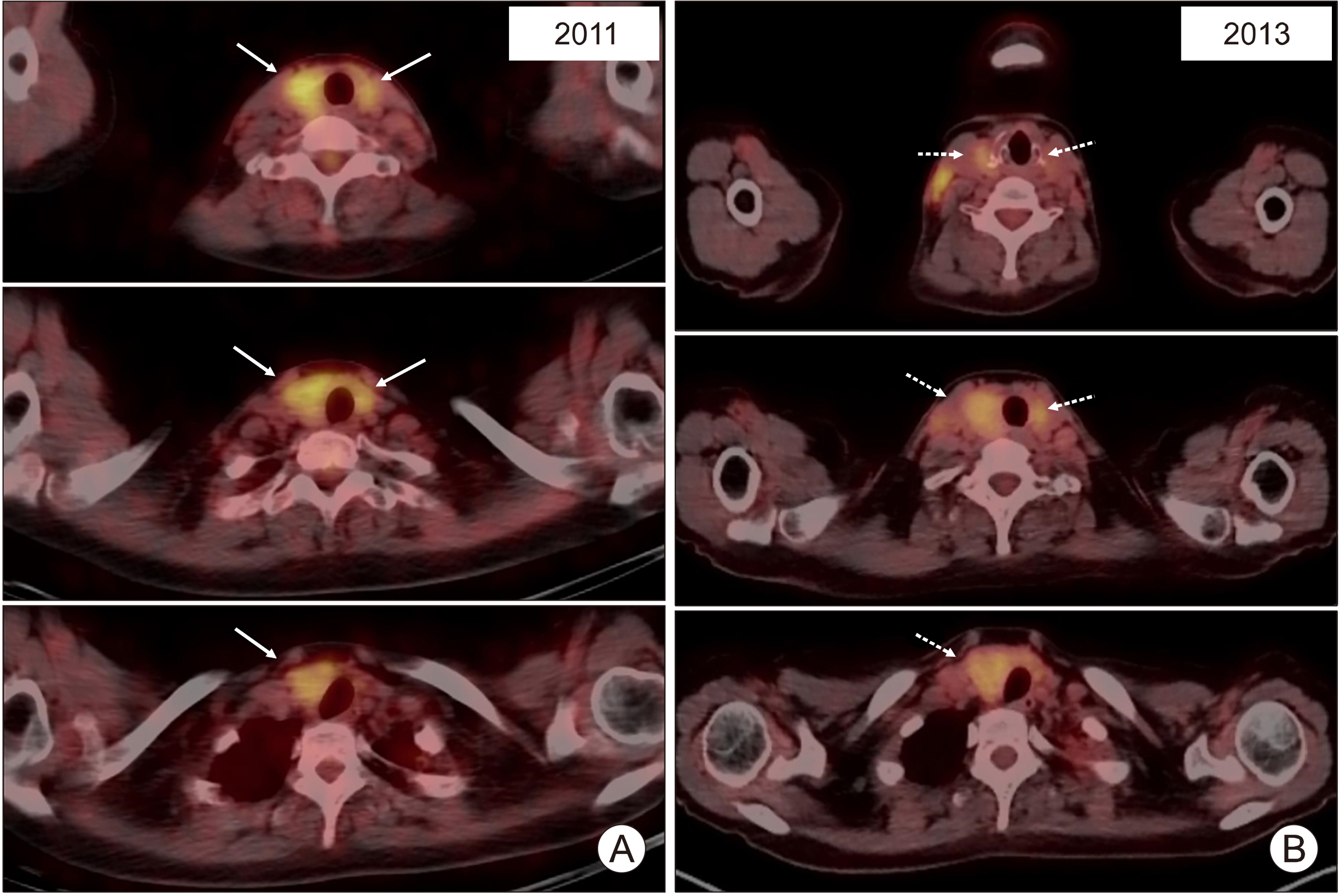
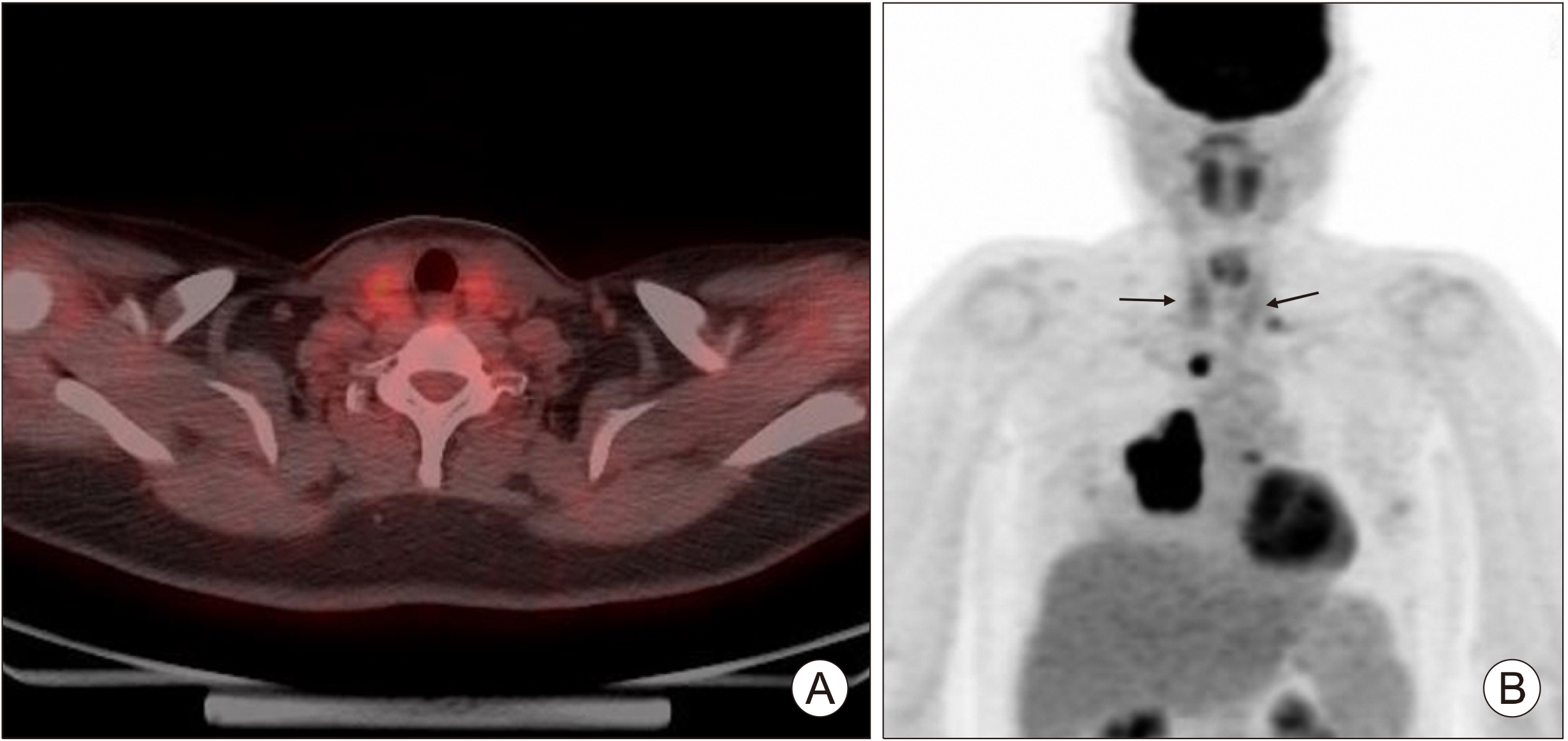




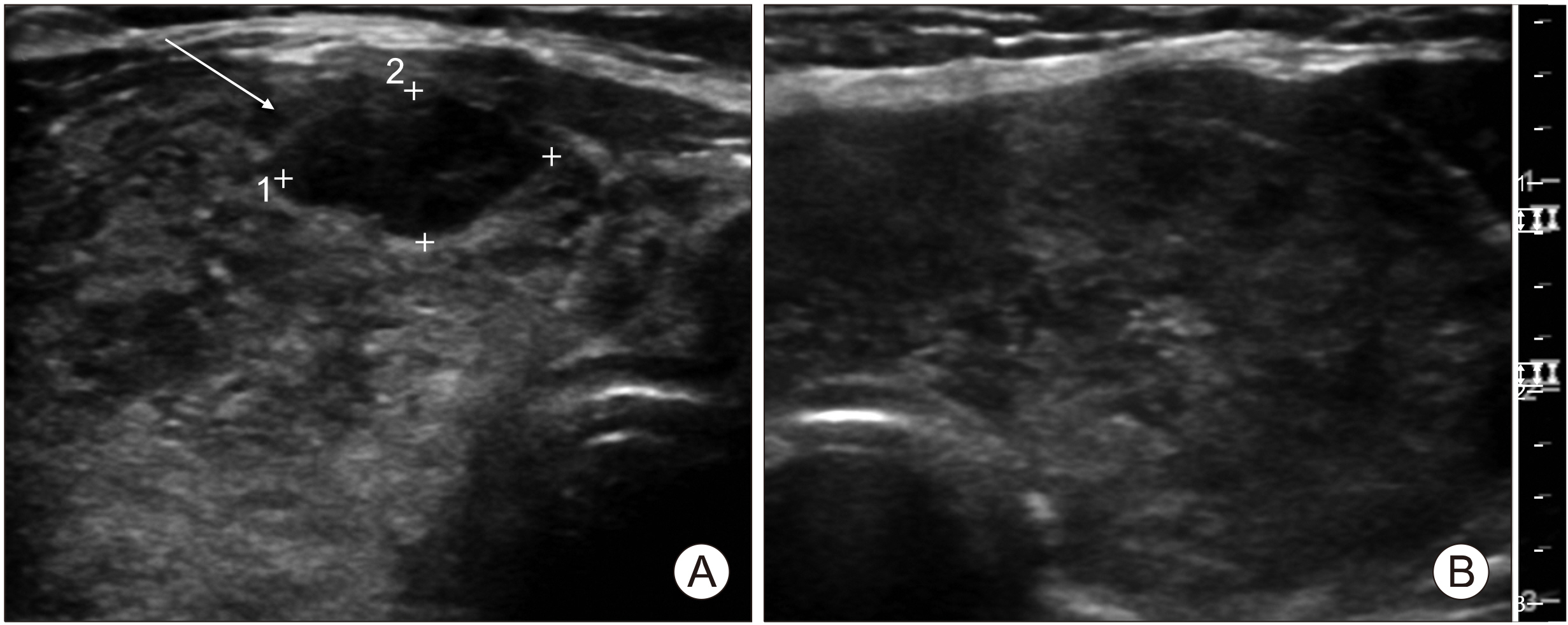
 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download