Abstract
Background and Objectives
This study was planned to investigate the relationship between iodine intake and thyroid peroxidase antibody in Korean population.
Materials and Methods
We used the data of the 6th Korea National Health and Nutrition Examination Survey from 2013 to 2015. A total of 6564 subjects who had the data of thyroid function test were included. We analyzed urinary iodine concentration and thyroid peroxidase antibody using the complex sample method. Univariate and multivariate analysis were performed according to clinical factors and thyroid function tests.
Results
In the multivariate analysis, the thyroid peroxidase antibody positivity was not related to urinary iodine concentration in the total group (p=0.102), male group (p=0.245) and female group (p=0.098). The urinary iodine concentration was associated with thyroid stimulating hormone (TSH) (p=0.001) and free T4 (p=0.001) but not associated with thyroid peroxidase antibody (p=0.218). When high TSH group was divided into the positive and negative thyroid peroxidase antibody, high TSH group with negative thyroid peroxidase antibody increased according to increasing urinary iodine concentration (p<0.001). But there was no difference in the high TSH group with positive thyroid peroxidase antibody (p=0.826).
Conclusion
This study did not show a statistically significant relationship between urinary iodine concentration and thyroid peroxidase antibody. As urinary iodine concentration increased, thyroid function was decreased only in the negative thyroid peroxidase antibody group. This confirmed that the increased urinary iodine concentration caused hypothyroidism which was not associated with thyroid peroxidase antibody.
요오드는 갑상선호르몬 생성에 필수 물질이지만 부족할 경우뿐만 아니라 과잉 섭취도 갑상선질환을 유발한다. 한국은 예전부터 김, 미역, 다시마 등 해조류 섭취가 많고, 천일염을 흔히 사용한다. 요오드 세계 네트워크(iodine global network)의 2020년 평가표1)에 따르면 한국 청소년의 평균 소변 내 요오드 농도는 449 μg/L이며, 한국은 요오드 섭취 과잉 국가로 분류되어 있다. 반면 중국이나 유럽 등 요오드 섭취 부족 지역에서는 강제적인 요오드화 소금(iodized salt) 사용 과정에서 일시적으로 요오드 섭취 과잉 상태가 보고되었다.
자가면역 갑상선질환은 유전 및 환경적 요인과 연관이 있으며, 요오드 섭취는 자가면역 갑상선질환의 중요한 환경적 요인 중 하나이다. 일반적으로 요오드 과잉 상태는 하시모토 갑상선염과 같은 자가면역성 갑상선 질환을 증가시키고, 이로 인하여 갑상선기능저하가 발생한다고 알려져 있다.2) 유사하게 요오드 섭취 부족 지역에서 요오드화 시행 이후 자가면역 갑상선질환과 갑상선기능저하가 증가한다고 알려져 있다.2)
갑상선 과산화효소 항체(thyroid peroxidase antibody, TPOAb)는 성별, 연령, 인종 및 검사방법에 따라 차이를 나타내지만, 자가면역 갑상선질환의 진단 지표로 사용되고 있다.3) 일반적으로 요오드 부족 지역에서는 요오드화로 인한 요오드 섭취 증가가 TPOAb 증가를 유발한다고 알려져 있지만, 일부 연구에서는 TPOAb의 변화가 없거나 오히려 감소한다고 알려져 있다.2) 이러한 상반된 결과와 함께, 우리나라와 같은 요오드 섭취가 충분한 국가에서의 요오드 섭취와 TPOAb의 상관관계에 대한 연구는 드물다. 이에 우리나라 인구집단을 대상으로 요오드 섭취와 TPOAb의 상관관계를 알아보고자 본 연구를 계획하였다.
본 연구는 국민건강영양조사의 원시자료를 이용하여 분석하였다. 1998년부터 질병관리본부에서 시행된 국민건강영양조사는 국민의 건강 상태를 파악하기 위하여 전 국민을 모집단으로 층화집락표본추출방법(stratified clustered probability sampling method)을 이용하여 시행되었으며, 건강 설문조사, 검진조사, 영양조사 등으로 구성되어 있다.4)
2013년부터 2015년까지 3년간 실시한 제6기 국민건강영양조사에 참여한 총 22,948명 중 갑상선자극호르몬(thyroid stimulating hormone, TSH), 유리티록신(free T4, fT4), TPOAb 및 요중 요오드 농도(urinary iodine concentration, UIC) 검사를 시행한 6564명을 대상으로 하였다.
국민건강영양조사는 질병관리본부의 연구윤리심의위원회의 심의(2013-07CON-03-4C, 2013-12EXP-03-5C)를 거쳤으며, 모든 대상자의 동의를 구한 후 자료수집이 시행되었다. 원시자료는 국민건강영양조사 홈페이지(https://knhanes.cdc.go.kr)에서 자료 이용에 대한 동의 후 제공받았다.
연령, 성별, 갑상선질환 진단, 갑상선암 진단, 체질량지수, 흡연, 음주, TSH, fT4, TPOAb 및 UIC를 조사하였고, 여성에서는 현재 임신과 출산 경험을 추가 조사하였다. 연령은 10세에서 80세까지 10세 단위로 분석하였다. 체질량지수 18.5 kg/m2 미만을 저체중, 18.5 kg/m2 이상 25 kg/m2 미만을 정상, 25 kg/m2 이상을 비만으로 정의하였다. 흡연은 평생 5갑(100개비) 이상 피웠고, 현재 담배를 피우는 경우로 정의하였고, 음주는 최근 1년 동안 월 1회 이상 음주하는 경우로 정의하였다.
TSH, fT4, TPOAb 및 UIC는 이전 논문5)과 동일한 방법으로 검사하였다. TSH, fT4, TPOAb는 각각 독일 Roche사의 E-TSH, E-Free T4, E-Anti-TPO 시약을 사용하였고, 동일 회사의 Cobas8000 E-602 측정기기를 이용하여 측정하였다. UIC는 미국 PerkinElmer사의 ICP-MS를 이용하였고, 시약은 미국의 Inorganic venture사의 Iodine standard를 이용하였다. TSH의 참고치는 0.35-5.50 mIU/L, fT4의 참고치는 0.89-1.76 ng/mL로 정의하였고, TPOAb 양성은 34.0 IU/mL 이상으로 정하였다. UIC는 WHO6)의 기준에 따라 100 μg/L 미만, 100-199, 200-299, 300 μg/L 이상으로 나누었으며, 대상군의 50% 이상이 300 μg/L 이상이었기 때문에 300 μg/L 이상의 군을 다시 300-599, 600-999, 1000 μg/L 이상으로 나누어서, 총 6개 군으로 나누어 분석하였다.
국민건강영양조사 자료는 각 표본마다 특정 가중치를 가지고 있기 때문에 복합표본 설계 방법으로 분석하였다. 단변량분석은 복합표본 교차분석을 시행하였다. 종속변수가 2개 군인 TPOAb 양성률의 분석에는 복합표본 로지스틱 회귀분석을 시행하였고, 종속변수가 6개 군인 UIC의 분석에는 복합표본 순서 회귀분석을 시행하였다. 승산비(odd ratio)는 95% 신뢰구간을 함께 표시하였고, p값이 0.05 이하인 경우 통계적으로 유의하다 정의하였다. 모든 통계 분석은 SPSS 버전 22 (IBM Corp., Chicago, IL, USA)를 이용하였다.
TPOAb 양성에 영향을 미치는 인자를 단변량분석하여 Table 1에 정리하였다. 전체 TPOAb 양성률은 7.3%이었고, 여성은 10.6%로 남성의 4.3%보다 유의하게 높았다. 나이가 증가함에 따라 TPOAb의 양성률은 점차 증가하여 50대에서 11.7%로 가장 높았으며, 이후 감소하는 경향을 나타냈다. 전체군에서 TPOAb에 영향을 미치는 유의한 인자는 성별, 연령, 갑상선질환, 흡연, 음주, TSH, fT4, UIC였다. 남녀군으로 나누었을 때, 남성(Table 2)과 여성(Table 3) 모두에서 TPOAb 양성률에 영향을 미치는 인자는 연령, 갑상선질환, TSH, fT4이었다. 추가적으로 여성에서는 출산 경험이 있는 경우의 TPOAb 양성률은 12.6%로 없는 경우의 5.7%보다 유의하게 높았다. 남녀군으로 나누었을 때 TPOAb 양성률과 UIC는 통계적 유의성이 없었다.
Table 4에 전체 및 남녀군에서 TPOAb 양성률에 영향을 미치는 인자에 대한 다변량분석을 정리하였다. 전체군에서 TPOAb 양성률에 유의한 인자는 성별, 연령, 갑상선질환, TSH, fT4이었다. 남성군에서 TPOAb 양성에 유의한 인자는 연령, 갑상선질환, TSH, fT4였고, 여성군에서는 연령, 갑상선질환 및 TSH가 유의한 인자였다. 출산력은 단변량분석에서 유의하였지만 다변량분석에서는 승산비 1.12 (95% 신뢰구간 0.64-1.95)로 통계적으로 유의성이 없었다. UIC는 남녀군 및 전체군에서 모두 TPOAb와 유의한 상관관계가 없었다.
UIC를 6개 군으로 나누어 연관이 있는 인자를 다변량분석하였을 때, 체질량지수, TSH, fT4가 유의한 인자였다(Table 5). UIC가 증가할수록 체질량지수는 감소하고, TSH는 증가하며, fT4는 감소하는 경향을 나타냈다. TPOAb 양성률은 UIC와 통계적 유의한 상관관계가 없었다.
UIC와 TPOAb 양성률의 관계를 Fig. 1에 정리하였다. 앞에서의 기술과 같이, 단변량분석에서는 전체군에서 UIC가 증가할수록 TPOAb가 감소하다가 증가하는 U자형 경향이 있었지만(p=0.02), 남녀군으로 나누었을 때는 유의성이 없었고(p=0.079, p=0.155), 다변량분석에서도 전체 및 남녀군 모두에서 유의성이 없었다(p=0.102, p=0.245, p=0.098).
UIC와 참고치보다 높은 TSH를 가지는 갑상선기능저하군과의 관계를 Fig. 2에 정리하였다. 앞에서 기술과 같이 UIC가 증가할수록 갑상선기능저하군이 많았다(p< 0.001). 갑상선기능저하군을 각각 TPOAb 양성군과 음성군으로 나누었을 때, TPOAb 양성 기능저하군의 빈도는 차이가 없는 반면(p=0.826), TPOAb 음성 기능저하군은 UIC가 증가함에 따라 함께 증가하였다(p<0.001).
TPOAb는 하시모토 갑상선염 및 일부 그레이브스병 같은 자가면역 갑상선질환에서 증가된다. 자가면역 갑상선질환은 여성에서 많으며, 출산력과 연관이 있고, 갑상선자극호르몬수용체(TSH receptor), 갑상선글로불린(thyroglobulin), 인간 백혈구항원(human leukocyte antigen) 등과 같은 유전자 변이 및 흡연, 음주, 비타민, 스트레스 및 약물 등 환경적 원인으로 발생하기 때문에, TPOAb도 성별, 유전 및 환경적 요인에 영향을 받는다.
본 연구에서 TPOAb 양성률은 외국의 결과7-9)와 유사하게 연령이 증가함에 따라 증가하였고, 남성보다 여성에서 높았다. 기존 국민건강영양조사를 이용한 우리나라 연구5)와 비교하면 연령별 TPOAb 양성률에 약간의 차이가 있었는데, 이는 연령군을 나누는 기준의 차이 때문으로 생각된다. 검사 방법 및 정상 참고치가 다르기 때문에 직접적인 비교는 어렵지만, 미국의 제3기 국민건강영양조사(NHANES III)에서 TPOAb 양성률은 남성 8.7%, 여성 17.0%였으며,7) 중국의 연구에서는 남성 6.3%, 여성 14.2%였고,10) 일본의 연구에서는 남성 7.2%, 여성 15.0%였다.11) 이와 비교하면 본 연구의 TPOAb 양성률인 남성 4.3%, 여성 10.6%는 외국에 비해 상대적으로 낮음을 알 수 있다.
UIC는 요오드 섭취 정도를 측정하는 효율적이며 쉬운 지표로 인정되고 있다.6) 요오드 섭취가 부족한 나라에서 요오드화 소금 사용 이후 TPOAb가 증가한다는 다수의 종단 연구(longitudinal study) 보고가 있었다. 요오드 섭취 부족 국가인 덴마크에서 5년간의 요오드화 이후 TPOAb 양성률은 14%에서 24%로 증가하였고, 항갑상선글로불린항체(anti-thyroglobulin antibody, TgAb) 양성률은 14%에서 20%로 증가하였다.12) 이는 이탈리아,13) 슬로베니아,14) 폴란드,15) 그리스16) 등의 보고와 유사하였다. 반면에 호주 태즈메이니아에서는 요오드화 전후 TPOAb의 변화가 없어 상반된 결과를 보고하였다.17) 중국은 요오드 부족 국가로 분류되었으나, 1996년부터 약 20년간 모든 소금에 요오드를 첨가하기 시작하였다. 요오드 섭취 정도가 서로 다른 중국의 세 지역을 대상으로 1999년과 2004년을 비교한 연구에서는 요오드 섭취가 증가함에 따라 5년간 TgAb 양성률은 증가하는 반면, TPOAb 양성률에는 차이가 없다고 보고하였다.18) 1999년과 2011년을 비교한 연구에서는 1999년의 평균 UIC가 306 μg/L에서 2011년 평균 UIC 205 μg/L로 감소한 반면, TPOAb 양성률은 9.8%에서 11.5%로 증가하는 상반된 결과를 나타내었다.19)
요오드 섭취와 TPOAb의 상관관계에 대한 횡단면 연구(cross-sectional study)에서도 다양한 결과가 보고되었다. 요오드 섭취에 따라 두 지역으로 나누어 비교한 일본 연구에서는 요오드 섭취에 따른 TgAb나 TPOAb 양성률에 차이가 없었다.20) 2007년 중국의 평균 UIC가 각각 145 μg/L 및 261 μg/L인 두 지역을 비교한 연구에서 TPOAb 양성률은 8.4% 및 10.6%로 평균 UIC가 높은 지역의 TPOAb 양성률이 유의하게 높았다.21) 유사하게 2011년 평균 UIC 100-199 μg/L인 중국의 6개 도시와 평균 UIC 200-299 μg/L인 중국의 4개 도시를 비교한 연구에서도 각각 TPOAb 양성률은 10.9% 및 12.4%로 UIC가 높은 지역의 TPOAb 양성률이 유의하게 높았다.19) 반면 2015년에서 2017년 사이 중국 31개 지역을 평균 UIC 100 μg/L 미만, 100-199 μg/L, 200-299 μg/L, 300 μg/L 이상의 네 군으로 나눈 연구에서는 UIC가 증가함에 따라 TPOAb 양성률이 감소하여 200-299 μg/L에서 가장 낮았으며, 300 μg/L에서 다시 증가하는 양상을 나타내었다.10) 중국의 수돗물 요오드 함량에 따라 요오드 부족, 적정, 과잉의 세 지역으로 나눈 연구에서 TPOAb 양성률은 각각 11.0%, 7.7%, 10.9%, 자가면역성 갑상선염은 각각 21.8%, 12.2%, 14.4%로 요오드 함량이 적정할 경우 TPOAb 양성률이 낮고, 자가면역성 갑상선염이 적었다.22) 이렇게 다양한 결과를 나타내는 이유로는 인종 등의 유전적 차이, 평소 요오드 부족 정도 및 요오드화 정도의 차이 때문으로 생각된다.
본 연구에서는 UIC와 TPOAb 양성률과의 통계적 연관성을 찾을 수는 없었지만, Fig. 1과 같이 전체군과 남성군에서 U자형 경향을 나타내어 남성군에서는 300-599 μg/L에서 TPOAb가 가장 낮았으며, 여성군에서는 200-299 μg/L에서 가장 낮았다. 이는 최근 중국의 연구10,22)와 유사한 경향을 나타냈다. 중국은 요오드화 이후 1996년부터 2001년까지 약 6년간 평균 UIC가 300 μg/L 이상의 요오드 과잉 상태였고, 이후 2002년부터 2011년까지 약 10년간 평균 UIC 200-299 μg/L를 유지하였으며, 2012년부터는 평균 UIC 100-199 μg/L를 유지하였다.10) 중국의 횡단면 연구를 정리하면 요오드화 초기에는 UIC가 증가함에 따라 TPOAb가 증가하는 경향을 나타냈으나, 요오드화가 진행되어 안정화된 이후에는 적정 UIC에서 가장 낮은 TPOAb를 나타내고, 따라서 적정 UIC에서 자가면역 갑상선질환이 감소한다고 유추할 수 있다. 요오드 섭취 증가로 인한 자가 항체의 변화는 요오드 섭취의 기저 상태와 변화 정도에 영향을 받는데, 요오드 부족 상태에서 갑작스러운 요오드 섭취 증가는 갑상선 조직의 손상을 유발하여 TPOAb 및 TgAb와 같은 자가항체 생성을 증가시키며, 반면에 요오드 섭취 증가 속도가 느리거나 이전부터 높은 요오드 섭취 상태가 유지되었을 경우 자가항체 생성은 낮을 것으로 가정하고 있다.12) 우리나라의 UIC의 중앙값(median)은 약 300 μg/L로 세계보건기구 기준에 따르면 적정 수준보다 높은 상태를 큰 변화 없이 유지하고 있어서, 상대적으로 낮은 TPOAb 양성률을 안정적으로 유지하고 있다고 생각된다.23)
UIC와 갑상선기능에 대한 이전 연구에서, UIC가 높을수록 갑상선기능이 저하되는 결과를 보고하였다.23,24) 본 연구에서도 동일한 결과를 확인하였고, 이에 추가하여 Fig. 2에서와 같이 TPOAb 음성군에서만 갑상선기능저하와 연관이 있고, TPOAb 양성군에서는 연관이 없음을 확인하였다. 이는 최근 중국 연구에서도 동일한 결과이며,10) 요오드 섭취 증가로 인한 갑상선기능저하는 자가면역 기전과 연관이 없이 직접적으로 갑상선기능에 영향을 주어 발생한다고 생각된다.
현재까지 갑상선기능에 대한 많은 연구가 국민건강영양조사 자료를 이용하여 보고되었지만, UIC와 TPOAb의 연관성에 관한 연구는 찾을 수 없어서 본 연구가 해당 주제에 관련된 첫 연구로 생각된다. 본 연구의 제한점으로는 횡단면 연구이기 때문에 코호트 연구와 달리 인과관계를 확인하기 어렵고, TPOAb에 영향을 주는 환경적 요인만을 조사하여 유전적 요인에 대한 고려가 없다는 점이다. 또한 임상적 특성을 설문조사에만 의존하여 회상 비뚤림(recall bias)이 발생할 가능성이 있다.
이상에서 국민건강영양조사 자료를 이용하여 UIC와 TPOAb 양성률에 대한 상관관계를 조사하였을 때 통계적으로 유의한 연관성은 없었다. UIC가 증가할수록 유의하게 갑상선기능저하가 많았고, 이는 TPOAb 음성군에서만 관찰되어 UIC 증가에 따른 갑상선기능저하는 TPOAb와 연관이 없음을 확인하였다.
References
1. Iodine Global Network. 2020. Global scorecard of iodine nutrition in 2020. Iodine Global Network;Seattle: Available from URL: https://www.ign.org/cm_data/Global-Scorecard-2020-3-June-2020.pdf. cited September 4, 2020.
2. Farebrother J, Zimmermann MB, Andersson M. 2019; Excess iodine intake: sources, assessment, and effects on thyroid function. Ann N Y Acad Sci. 1446(1):44–65. DOI: 10.1111/nyas.14041. PMID: 30891786.

3. Dong YH, Fu DG. 2014; Autoimmune thyroid disease: mechanism, genetics and current knowledge. Eur Rev Med Pharmacol Sci. 18(23):3611–8. PMID: 25535130.
4. Kweon S, Kim Y, Jang MJ, Kim Y, Kim K, Choi S, et al. 2014; Data resource profile: the Korea National Health and Nutrition Examination Survey (KNHANES). Int J Epidemiol. 43(1):69–77. DOI: 10.1093/ije/dyt228. PMID: 24585853. PMCID: PMC3937975.

5. Kim WG, Kim WB, Woo G, Kim H, Cho Y, Kim TY, et al. 2017; Thyroid stimulating hormone reference range and prevalence of thyroid dysfunction in the Korean population: Korea National Health and Nutrition Examination Survey 2013 to 2015. Endocrinol Metab (Seoul). 32(1):106–14. DOI: 10.3803/EnM.2017.32.1.106. PMID: 28116874. PMCID: PMC5368108.

6. WHO. Urinary iodine concentrations for determining iodine status deficiency in populations. Vitamin and Mineral Nutrition Information System. World Health Organization;Geneva: Available from URL: http://www.who.int/vmnis/indicators/urinaryiodine. cited September 4, 2020.
7. Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, et al. 2002; Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab. 87(2):489–99. DOI: 10.1210/jcem.87.2.8182. PMID: 11836274.

8. Amouzegar A, Bakhtiyari M, Mansournia MA, Etemadi A, Mehran L, Tohidi M, et al. 2016; Sex- and age-specific reference values and cutoff points for TPOAb: Tehran Thyroid Study. Thyroid. 26(3):458–65. DOI: 10.1089/thy.2015.0276. PMID: 26650261.

9. Teng D, Yang W, Shi X, Li Y, Ba J, Chen B, et al. 2020; An inverse relationship between iodine intake and thyroid antibodies: a national cross-sectional survey in Mainland China. Thyroid. 30(11):1656–65. DOI: 10.1089/thy.2020.0037. PMID: 32586221.

10. Li Y, Teng D, Ba J, Chen B, Du J, He L, et al. 2020; Efficacy and safety of long-term universal salt iodization on thyroid disorders: epidemiological evidence from 31 provinces of Mainland China. Thyroid. 30(4):568–79. DOI: 10.1089/thy.2019.0067. PMID: 32075540.

11. Kasagi K, Takahashi N, Inoue G, Honda T, Kawachi Y, Izumi Y. 2009; Thyroid function in Japanese adults as assessed by a general health checkup system in relation with thyroid-related antibodies and other clinical parameters. Thyroid. 19(9):937–44. DOI: 10.1089/thy.2009.0205. PMID: 19678737.

12. Pedersen IB, Knudsen N, Carle A, Vejbjerg P, Jorgensen T, Perrild H, et al. 2011; A cautious iodization programme bringing iodine intake to a low recommended level is associated with an increase in the prevalence of thyroid autoantibodies in the population. Clin Endocrinol (Oxf). 75(1):120–6. DOI: 10.1111/j.1365-2265.2011.04008.x. PMID: 21521277.

13. Aghini Lombardi F, Fiore E, Tonacchera M, Antonangeli L, Rago T, Frigeri M, et al. 2013; The effect of voluntary iodine prophylaxis in a small rural community: the Pescopagano survey 15 years later. J Clin Endocrinol Metab. 98(3):1031–9. DOI: 10.1210/jc.2012-2960. PMID: 23436921.

14. Zaletel K, Gaberscek S, Pirnat E. 2011; Ten-year follow-up of thyroid epidemiology in Slovenia after increase in salt iodization. Croat Med J. 52(5):615–21. DOI: 10.3325/cmj.2011.52.615. PMID: 21990079. PMCID: PMC3195970.

15. Golkowski F, Buziak-Bereza M, Trofimiuk M, Baldys-Waligorska A, Szybinski Z, Huszno B. 2007; Increased prevalence of hyperthyroidism as an early and transient side-effect of im-plementing iodine prophylaxis. Public Health Nutr. 10(8):799–802. DOI: 10.1017/S1368980007585939. PMID: 17381939.
16. Fountoulakis S, Philippou G, Tsatsoulis A. 2007; The role of iodine in the evolution of thyroid disease in Greece: from endemic goiter to thyroid autoimmunity. Hormones (Athens). 6(1):25–35. PMID: 17324915.
17. Hong A, Stokes B, Otahal P, Owens D, Burgess JR. 2017; Temporal trends in thyroid-stimulating hormone (TSH) and thyroid peroxidase antibody (ATPO) testing across two phases of iodine fortification in Tasmania (1995-2013). Clin Endocrinol (Oxf). 87(4):386–93. DOI: 10.1111/cen.13371. PMID: 28500624.

18. Li Y, Teng D, Shan Z, Teng X, Guan H, Yu X, et al. 2008; Antithyroperoxidase and antithyroglobulin antibodies in a five-year follow-up survey of populations with different iodine intakes. J Clin Endocrinol Metab. 93(5):1751–7. DOI: 10.1210/jc.2007-2368. PMID: 18270254.

19. Shan Z, Chen L, Lian X, Liu C, Shi B, Shi L, et al. 2016; Iodine status and prevalence of thyroid disorders after introduction of mandatory universal salt iodization for 16 years in China: a cross-sectional study in 10 cities. Thyroid. 26(8):1125–30. DOI: 10.1089/thy.2015.0613. PMID: 27370068.

20. Nagata K, Takasu N, Akamine H, Ohshiro C, Komiya I, Murakami K, et al. 1998; Urinary iodine and thyroid antibodies in Okinawa, Yamagata, Hyogo, and Nagano, Japan: the differences in iodine intake do not affect thyroid antibody positivity. Endocr J. 45(6):797–803. DOI: 10.1507/endocrj.45.797. PMID: 10395237.

21. Teng X, Shan Z, Chen Y, Lai Y, Yu J, Shan L, et al. 2011; More than adequate iodine intake may increase subclinical hypothyroidism and autoimmune thyroiditis: a cross-sectional study based on two Chinese communities with different iodine intake levels. Eur J Endocrinol. 164(6):943–50. DOI: 10.1530/EJE-10-1041. PMID: 21444648.

22. Wan S, Qu M, Wu H, Ren B, Jiang W, Wang X, et al. 2020; Autoimmune thyroid diseases after 25 years of universal salt iodisation: an epidemiological study of Chinese adults in areas with different water iodine levels. Br J Nutr. 124(8):853–64. DOI: 10.1017/S0007114520001786. PMID: 32436480.

23. Kim HI, Oh HK, Park SY, Jang HW, Shin MH, Kim SW, et al. 2019; Urinary iodine concentration and thyroid hormones: Korea National Health and Nutrition Examination Survey 2013-2015. Eur J Nutr. 58(1):233–40. DOI: 10.1007/s00394-017-1587-8. PMID: 29188371.

24. Jeon MJ, Kim WG, Kwon H, Kim M, Park S, Oh HS, et al. 2017; Excessive iodine intake and thyrotropin reference interval: data from the Korean National Health and Nutrition Examination Survey. Thyroid. 27(7):967–72. DOI: 10.1089/thy.2017.0078. PMID: 28471294.

Fig. 1
Positive thyroid peroxidase antibody (TPOAb) rate according to the urinary iodine concentration (UIC). TPOAb rate showed U shape according to increasing UIC, but that was not statistically significant.
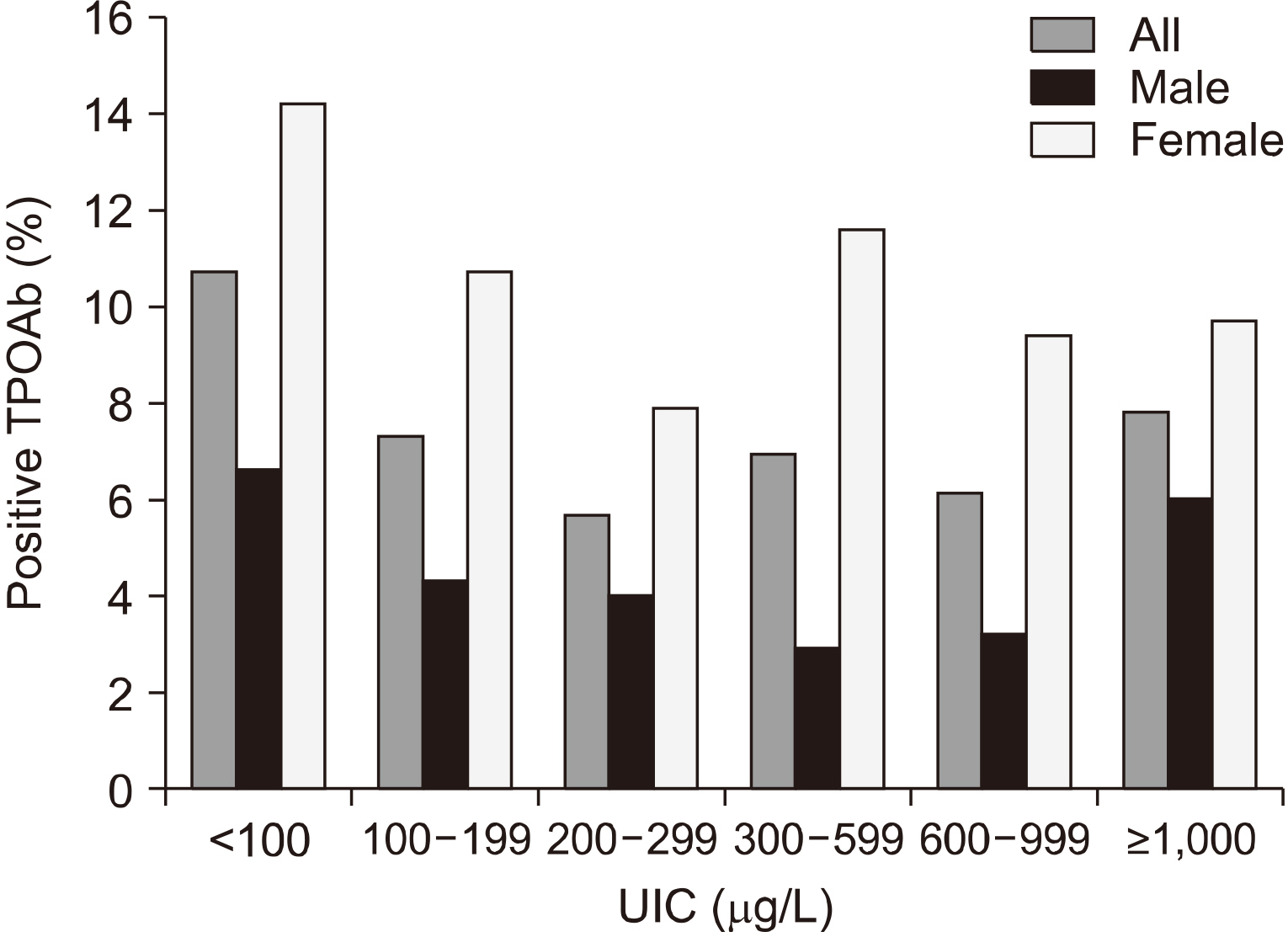
Fig. 2
Prevalence of high thyroid stimulating hormone (TSH) with negative and positive thyroid peroxidase antibody (TPOAb). High TSH group with negative thyroid peroxidase antibody increased according to increasing urinary iodine concentration (p<0.001). But there was no difference in the high TSH group with positive thyroid peroxidase antibody (p=0.826).
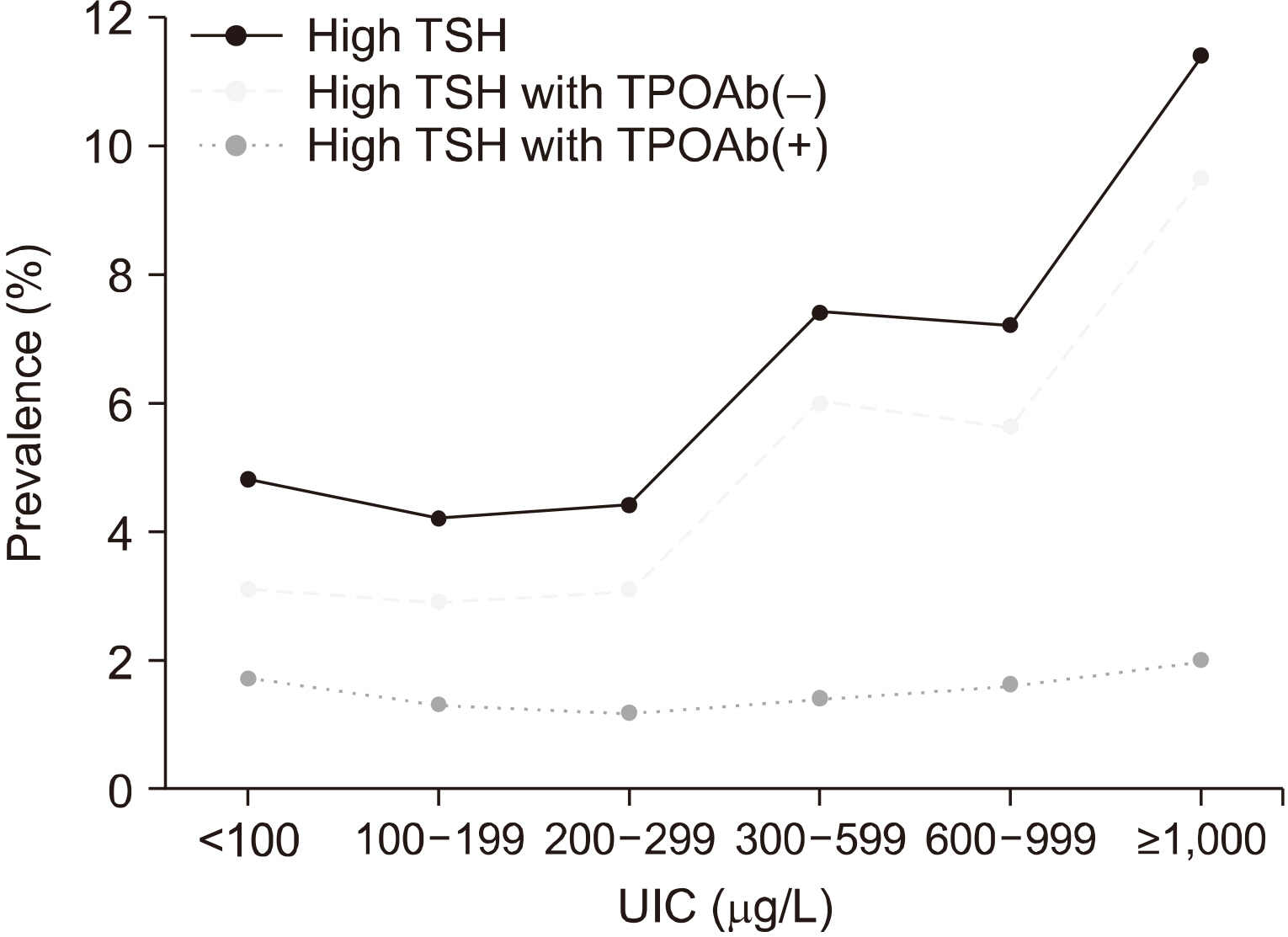
Table 1
Univariate analysis according to TPOAb positivity in all subjects
|
TPOAb negative 6084 (92.7%)* |
TPOAb positive 480 (7.3%) |
p value | |
|---|---|---|---|
| Sex | <0.001 | ||
| Male | 3233 (95.7%) | 145 (4.3%) | |
| Female | 2851 (89.4%) | 335 (10.6%) | |
| Age | <0.001 | ||
| 10-19 | 982 (97.3%) | 27 (2.7%) | |
| 20-29 | 960 (95.6%) | 46 (4.4%) | |
| 30-39 | 1022 (94.4%) | 62 (5.6%) | |
| 40-49 | 1009 (92.0%) | 92 (8.0%) | |
| 50-59 | 1059 (88.3%) | 137 (11.7%) | |
| 60-69 | 948 (90.0%) | 110 (10.0%) | |
| ≥70 | 104 (96.9%) | 6 (3.1%) | |
| Thyroid disease | <0.001 | ||
| No | 5657 (93.9%) | 365 (6.1%) | |
| Yes | 89 (54.5%) | 80 (45.5%) | |
| Thyroid cancer | 0.360 | ||
| No | 5708 (92.8%) | 441 (7.2%) | |
| Yes | 38 (87.3%) | 4 (12.7%) | |
| Body mass index | 0.894 | ||
| Underweight | 223 (92.5%) | 16 (7.5%) | |
| Normal | 3235 (92.3%) | 270 (7.7%) | |
| Obesity | 1725 (91.9%) | 166 (8.1%) | |
| Smoking | 0.009 | ||
| Never, past | 3822 (91.6%) | 365 (8.4%) | |
| Current | 1189 (94.2%) | 71 (5.8%) | |
| Alcohol | 0.002 | ||
| No | 2611 (91.3%) | 248 (8.7%) | |
| Yes | 3096 (93.7%) | 212 (6.3%) | |
| TSH (mIU/L) | <0.001 | ||
| <0.35 | 85 (73.9%) | 26 (26.1%) | |
| 0.35-5.5 | 5653 (94.2%) | 357 (5.8%) | |
| >5.5 | 346 (76.9%) | 97 (23.1%) | |
| fT4 (ng/mL) | <0.001 | ||
| <0.89 | 78 (69.2%) | 33 (30.8%) | |
| 0.89-1.76 | 5961 (93.3%) | 433 (6.7%) | |
| >1.76 | 45 (74.6%) | 14 (25.4%) | |
| UIC (μg/L) | 0.020 | ||
| <100 | 699 (89.3%) | 82 (10.7%) | |
| 100-199 | 1364 (92.7%) | 106 (7.3%) | |
| 200-299 | 973 (94.3%) | 56 (5.7%) | |
| 300-599 | 1258 (93.1%) | 100 (6.9%) | |
| 600-999 | 718 (93.9%) | 47 (6.1%) | |
| ≥1000 | 1072 (92.2%) | 89 (7.8%) |
Table 2
Univariate analysis according to TPOAb positivity in male subjects
|
TPOAb negative 3233 (95.7%)* |
TPOAb positive 145 (4.3%) |
p value | |
|---|---|---|---|
| Age | 0.001 | ||
| 10-19 | 559 (98.2%) | 10 (1.8%) | |
| 20-29 | 497 (96.4%) | 17 (3.6%) | |
| 30-39 | 540 (97.2%) | 16 (2.8%) | |
| 40-49 | 544 (95.8%) | 25 (4.2%) | |
| 50-59 | 552 (94.0%) | 32 (6.0%) | |
| 60-69 | 486 (92.2%) | 41 (7.8%) | |
| ≥70 | 55 (96.8%) | 4 (3.2%) | |
| Thyroid disease | <0.001 | ||
| No | 3014 (96.3%) | 112 (3.7%) | |
| Yes | 10 (36.4%) | 16 (63.6%) | |
| Thyroid cancer | 0.525 | ||
| No | 3017 (95.8%) | 128 (4.2%) | |
| Yes | 7 (100.0%) | 0 (0.0%) | |
| Body mass index | 0.343 | ||
| Underweight | 66 (97.9%) | 1 (2.1%) | |
| Normal | 1599 (95.8%) | 71 (4.2%) | |
| Obesity | 1058 (94.7%) | 62 (5.3%) | |
| Smoking | 0.834 | ||
| Never, past | 1549 (95.5%) | 75 (4.5%) | |
| Current | 1049 (95.3%) | 51 (4.7%) | |
| Alcohol | 0.418 | ||
| No | 982 (95.1%) | 52 (4.9%) | |
| Yes | 2018 (95.9%) | 82 (4.1%) | |
| TSH (mIU/L) | <0.001 | ||
| <0.35 | 31 (75.2%) | 8 (24.8%) | |
| 0.35-5.5 | 3056 (96.6%) | 108 (3.4%) | |
| >5.5 | 146 (82.6%) | 29 (17.4%) | |
| fT4 (ng/mL) | <0.001 | ||
| <0.89 | 20 (63.8%) | 10 (36.2%) | |
| 0.89-1.76 | 3188 (96.1%) | 131 (3.9%) | |
| >1.76 | 25 (84.9%) | 4 (15.1%) | |
| UIC (μg/L) | 0.079 | ||
| <100 | 332 (93.4%) | 23 (6.6%) | |
| 100-199 | 730 (95.7%) | 36 (4.3%) | |
| 200-299 | 554 (96.0%) | 21 (4.0%) | |
| 300-599 | 678 (97.1%) | 22 (2.9%) | |
| 600-999 | 383 (96.8%) | 13 (3.2%) | |
| ≥1000 | 556 (94.0%) | 30 (6.0%) |
Table 3
Univariate analysis according to TPOAb positivity in female subjects
|
TPOAb negative 2851 (89.4%)* |
TPOAb positive 335 (10.6%) |
p value | |
|---|---|---|---|
| Age | <0.001 | ||
| 10-19 | 423 (96.2%) | 17 (3.8%) | |
| 20-29 | 463 (94.7%) | 29 (5.3%) | |
| 30-39 | 482 (91.0%) | 46 (9.0%) | |
| 40-49 | 465 (87.4%) | 67 (12.6%) | |
| 50-59 | 507 (82.2%) | 105 (17.8%) | |
| 60-69 | 462 (88.2%) | 69 (11.8%) | |
| ≥70 | 49 (96.9%) | 2 (3.1%) | |
| Pregnant | 0.686 | ||
| No | 2837 (89.4%) | 333 (10.6%) | |
| Yes | 14 (85.3%) | 2 (14.7%) | |
| Parity | <0.001 | ||
| No | 959 (94.3%) | 58 (5.7%) | |
| Yes | 1757 (87.4%) | 258 (12.6%) | |
| Thyroid disease | <0.001 | ||
| No | 2643 (91.1%) | 253 (8.9%) | |
| Yes | 79 (57.9%) | 64 (42.1%) | |
| Thyroid cancer | 0.583 | ||
| No | 2691 (89.5%) | 313 (10.5%) | |
| Yes | 31 (85.5%) | 4 (14.5%) | |
| Body mass index | 0.669 | ||
| Underweight | 157 (90.2%) | 15 (9.8%) | |
| Normal | 1636 (88.9%) | 199 (11.1%) | |
| Obesity | 667 (87.8%) | 104 (12.2%) | |
| Smoking | 0.238 | ||
| Never, past | 2273 (89.0%) | 290 (11.0%) | |
| Current | 140 (85.2%) | 20 (14.8%) | |
| Alcohol | 0.730 | ||
| No | 1629 (89.1%) | 196 (10.9%) | |
| Yes | 1078 (89.5%) | 130 (10.5%) | |
| TSH (mIU/L) | <0.001 | ||
| <0.35 | 54 (73.2%) | 18 (26.8%) | |
| 0.35-5.5 | 2597 (91.4%) | 249 (8.6%) | |
| >5.5 | 200 (73.1%) | 68 (26.9%) | |
| fT4 (ng/mL) | <0.001 | ||
| <0.89 | 58 (71.2%) | 23 (28.8%) | |
| 0.89-1.76 | 2773 (90.2%) | 302 (9.8%) | |
| >1.76 | 20 (63.0%) | 10 (37.0%) | |
| UIC (μg/L) | 0.155 | ||
| <100 | 367 (85.8%) | 59 (14.2%) | |
| 100-199 | 634 (89.3%) | 70 (10.7%) | |
| 200-299 | 419 (92.1%) | 35 (7.9%) | |
| 300-599 | 580 (88.4%) | 78 (11.6%) | |
| 600-999 | 335 (90.6%) | 34 (9.4%) | |
| ≥1000 | 516 (90.3%) | 59 (9.7%) |
Table 4
Multivariate analysis according to TPOAb positivity in total and male, female subjects
Table 5
Multivariate analysis according to UIC
|
UIC Unweighted number* |
<100 781 |
100-199 1470 |
200-299 1029 |
300-599 1358 |
600-999 765 |
≥1000 1161 |
p value |
|---|---|---|---|---|---|---|---|
| Sex | 0.076 | ||||||
| Male | 355 (46.3%) | 766 (53.2%) | 575 (58.3%) | 700 (54.0%) | 396 (52.3%) | 586 (50.7%) | |
| Female | 426 (53.7%) | 704 (46.8%) | 454 (41.7%) | 658 (46.0%) | 369 (47.7%) | 575 (49.3%) | |
| Age | 45.99±0.65 | 42.37±0.46 | 41.18±0.53 | 40.40±0.50 | 40.99±0.71 | 42.62±0.57 | 0.100 |
| Body mass index | 23.71±0.15 | 23.67±0.10 | 23.52±0.11 | 23.58±0.10 | 23.35±0.14 | 23.11±0.11 | 0.005 |
| TSH | 2.51±0.09 | 2.51±0.07 | 2.57±0.07 | 2.95±0.15 | 2.81±0.10 | 3.36±0.14 | 0.001 |
| fT4 | 1.24±0.01 | 1.27±0.01 | 1.27±0.01 | 1.23±0.01 | 1.24±0.01 | 1.22±0.01 | 0.001 |
| TPOAb | 39.84±7.46 | 29.66±4.78 | 41.25±10.27 | 32.82±6.13 | 30.78±7.02 | 38.87±10.71 | 0.218 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download