Abstract
Nonsteroidal anti-inflammatory drugs (NSAID) are some of the most commonly prescribed medications in clinical practice. The long-term use of NSAIDs is one of the main causes of peptic ulcers and the increased risk of upper gastrointestinal tract complications, such as perforation and bleeding. Thus, the prevention of NSAID-induced peptic ulcers is an important clinical issue. Previous studies have evaluated various strategies for preventing ulcers in patients requiring prolonged NSAID use. The Korean clinical practice guidelines have been published recently based on the evidence of the currently available data. This review describes the strategies for the prevention of peptic ulcers due to NSAID. An assessment of the risk factors for peptic ulcers from NSAID is recommended to identify patients who should be considered for primary prophylaxis. The risk of NSAID-induced peptic ulcers can be reduced by the concomitant use of proton pump inhibitors (PPI), misoprostol, and histamine-2 receptor antagonists. Selective cyclooxygenase-2 inhibitors can be used with caution due to concerns regarding cardiovascular toxicity. Attempts should be made to use the lowest dose and shortest duration of the NSAID.
Go to : 
아스피린을 포함한 비스테로이드소염제(NSAID)는 위 및 십이지장 점막의 손상을 일으켜서 약제로 인한 유병률 및 사망률과 관련이 높은 것으로 알려져 있다.1 인구의 고령화가 진행되어 근골격계 질환 및 심뇌혈관 질환의 유병률이 높아지면서 NSAID의 투약은 증가하고 있다.2,3 이들 고령 환자에서는 위점막 방어 기전도 약해져서 NSAID로 인한 소화성궤양의 합병증 발생이 더 잘 일어난다.4 또 고령 환자의 경우 만성질환 및 통증으로 NSAID를 중단하기 어려운 경우가 많아서 지속적으로 궤양이 발생할 위험이 있다. NSAID에 의한 통증 경감 효과와 NSAID가 기존의 무통성궤양을 악화시키는 경우가 있어서 NSAID로 인한 소화성궤양은 무증상이면서 출혈 및 천공 등의 합병증이 동반되는 경우가 많다.5 서양에서는 Helicobacter pylori (H. pylori)에 의한 소화성궤양 및 합병증은 감소하고 있지만 아스피린을 포함한 NSAID에 의한 소화성궤양의 발생 및 합병증은 변화가 없거나 증가하고 있다.6,7 국내에서도 소화성궤양으로 진단받은 환자에서 H. pylori의 유병률은 지속적으로 감소하고 있으나 NSAID나 아스피린을 투약하는 환자는 증가하는 것으로 보고된다.4
외국의 가이드라인에서는 NSAID를 장기간 투약하는 환자에서 궤양 발생의 위험인자를 조사하여 고위험군, 중등위험군, 저위험군으로 분류하고 심뇌혈관의 위험도를 고위험군과 저위험군으로 분류하여 관리하도록 권고한다.8,9 그러나 국내에서는 외국과 비교하여 H. pylori의 유병률 및 위암의 유병률이 높고 또 내시경에 대한 접근성이 좋아서 외국의 진료지침을 국내에 적용하기에 제한점이 있었다. 최근에 국내의 약제 연관 소화성궤양의 임상진료지침이 발표되었는데,10 이번 임상진료지침은 총 9개의 권고문으로 구성되며 그중 NSAID와 관련된 권고문은 총 4개를 포함하고 있다. 본고에서는 NSAID와 관련된 소화성궤양 발생의 위험인자와 예방에 관련된 내용을 소개하려고 하며 이번에 발표된 국내 임상진료지침 내용 중 NSAID와 관련된 내용을 같이 소개하고자 한다.
Go to : 
NSAID를 투약하는 34,701명의 환자를 전향적으로 조사한 Laine 등11의 연구에서 소화성궤양 및 합병증의 위험인자를 65세 이상의 고령, 소화성궤양의 과거력, 아스피린의 병용 투여로 보고하였다. 그러나 국내 연구에서는 60세 이상을 NSAID 관련 소화성궤양의 위험인자로 보고하고 있어, 고위험군에 해당하는 구체적 연령에 대해서는 이견이 있다.12 미국 심장학회의 가이드라인에서는 NSAID를 투약하는 환자에서 소화성궤양 및 합병증의 위험인자로는 1) 소화성궤양의 과거력, 2) 이제 항혈소판제 요법(dual antiplatelet therapy), 3) 항응고제의 병용 투여, 4) 60세 이상, 5) 스테로이드의 병용 투여인 것으로 발표하였다.8 다른 미국의 가이드라인에서는 1) 소화성궤양의 과거력, 2) 65세 이상, 3) 고용량 NSAID 투약, 4) 아스피린, 스테 로이드, 항응고제의 병용 투여를 위험인자로 보고하였다.9 이와 같이 미국의 두 가이드라인에서도 고령의 정의가 다른 것을 확인할 수 있다. 이와 별도로 최근 메타분석에서 선택적 serotonin 재흡수 억제제(selective serotonin reuptake inhibitors)는 OR은 2.36 (95% CI 1.44-3.85)으로 위장관 출혈과 연관이 있으며 NSAID와 병용 투여 시 위장관 출혈의 OR은 6.33 (95% CI 3.40-11.8)으로 증가하는 것으로 보고하였다.13
국내 가이드라인에서는 고위험인자로 고령, 궤양의 과거력, 고용량의 NSAID 투약 및 아스피린, 항혈소판제, 항응고제 혹은 스테로이드의 병용 투약으로 정의하였다.10 NSAID와 관련된 소화성궤양 및 합병증의 고위험인자 중 고령의 정의에 대해서는 가이드라인 및 연구마다 조금씩 차이가 있어 구체적인 연령을 이번 가이드라인에서는 기술하지 않았다.
NSAID는 크게 비선택적 NSAID와 선택적 NSAID인 cyclooxygenase-2 (COX-2) 차단제(celecoxib)로 분류된다. NSAID는 종류와 상관없이 위장관 점막에 손상을 일으킬 수 있지만 그 종류에 따라서 손상의 정도에는 차이가 있다. 2013년 발표된 메타분석에서는 NSAID의 종류에 따른 위장관 합병증의 발생을 비교하였다.14 그 결과 위약과 비교하였을 때 diclofenac의 adjusted rate ratio는 1.89 (95% CI 1.2-3.1), ibuprofen은 3.97 (95% CI 2.2-7.1), naproxen은 4.2 (95% CI 2.7-6.6)인 것으로 나타났다. 또 다른 메타분석에서는 indomethacin의 RR은 2.25, naproxen 은 1.83, diclofenac은 1.73, piroxicand은 1.66, tenoxicam은 1.43, ibuprofen은 1.19, meloxican은 1.24였다.15 이 연구에서는 NSAID의 투약 기간이 길수록 소화성궤양 합병증이 잘 발생하는 것으로 보고하였다. 이들 연구를 종합하면 NSAID 중에서 aceclofenac, celecoxib, ibuprofen의 소화성궤양 발생 위험이 가장 낮으며 diclofenac, meloxicam, ketoprofen이 중간의 위험을 나타내며 prioxicam과 ketorolac의 소화성궤양 발생 위험이 가장 높다.16
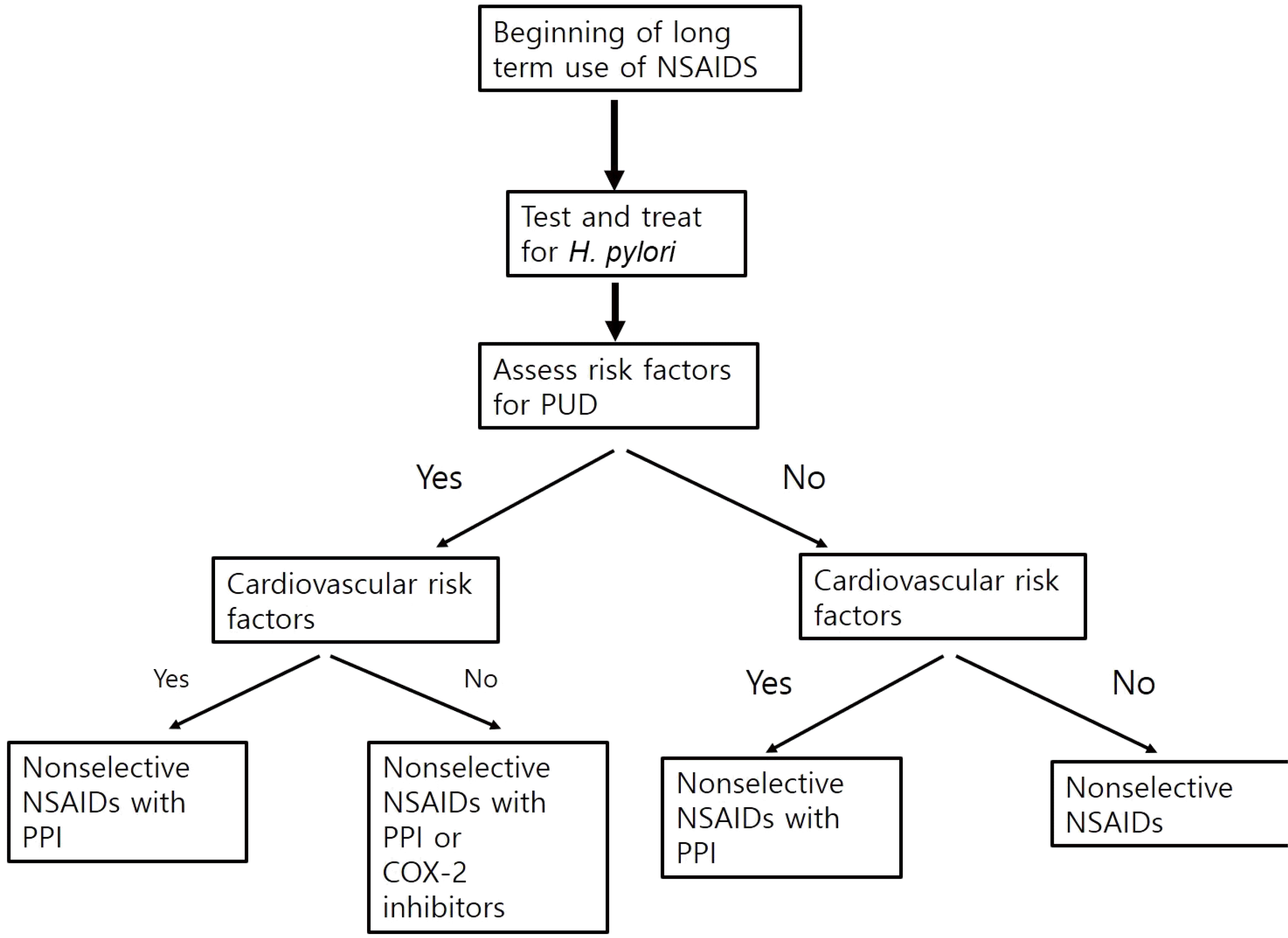
소화성궤양을 유발하는 대표적인 인자는 H. pylori 감염과 NSAID 투약이다. 이 두 인자가 동시에 있는 경우에는 소화성 궤양의 위험이 증가한다.17 NSAID 투약 환자에서 H. pylori 균 감염이 동반된 경우 소화성궤양의 합병률이 60배 정도 높고 출혈이 발생할 위험은 6배 높다.18 NSAID 투약자에서 H. pylori 균 감염이 있는 경우에 소화성궤양의 위험이 1.8배로 높다는 연구도 있다.17 그러나 제균 치료가 NSAID 장기 투약자에서 소화성궤양의 발생을 줄여주는지에 대해서는 논란이 있다. 여러 연구에서 NSAID를 처음 투약하는 환자에서 제균 치료가 효과적이나 이미 NSAID를 장기간 투약하는 환자에서는 제균 치료를 해도 여러 소화기 합병증의 발생을 줄여주지는 못하는 것으로 발표하였다.19-25 따라서 이런 연구를 토대로 이번 가이드라인에서는 NSAID 투약 전에 소화성궤양의 과거력이 있는 환자는 H. pylori 감염 검사 및 제균 치료를 하도록 권고하고 있다.10 사실 소화성궤양의 과거력이 있는 환자는 약물의 투약 여부와 상관없이 궤양 발생의 예방을 위해서 제균 치료가 권고된다. 그럼에도 NSAID 장기 투약이 예상되는 환자에게서 H. pylori 균 검사 및 치료의 중요성을 상기시키기 위해서 이번 권고문을 선정하게 되었다. 국내에서 NSAID를 투약하는 환자에서 제균 치료를 시행하는 것이 비용 효과면에서 더 효율적인 것으로 보고한 연구도 있어서 추후 비용 효과와 관련된 연구들이 더 필요할 것으로 생각된다.26
NSAID는 COX를 억제하여 arachidonic acid가 prostaglandin, prostacyclin, thromboxane으로 변환하는 것을 억제한다.27 COX는 COX-1과 COX-2로 구성되는데, COX-1은 위 및 십이지장의 방어 기전에 중요한 역할을 하며 COX-2는 항염증 작용에 관여한다.28 선택적 COX-2 차단제인 celecoxib는 COX-1을 억제하지 않아서 이론적으로는 COX-1과 COX-2를 모두 억제하는 비선택적 NSAID와 비교하여 소화성궤양의 발생이 적을 것으로 예상된다.14 아스피린을 투약하는 환자에서 celecoxib을 투약하는 군과 naproxen과 lansoprazole을 투약하는 군을 비교하였을 때 위 십이지장 궤양 발생에는 차이가 없는 것으로 나타났다.29 또 다른 연구에서는 4,484명의 환자에게 celecoxib을 투여한 군과 diclofenac과 omeprazole을 병용 투여한 군을 비교하였는데, 그 결과 celecoxib을 투여한 군에서 위장관 합병증의 발생이 더 적은 것으로 보고하였다.30 다른 연구에서는 celecoxib나 비선택적 NSAID를 투약하면서 상부위장관 합병증이 있는 1,382명의 환자를 나이와 성별을 조정한 22,957명의 대조군과 비교하였고,31 그 결과 proton pump inhibitor (PPI)나 misoprostol의 병용 투여와 celecoxib의 투여가 상부위장관 합병증을 감소시키는 데 도움이 되는 것으로 나타났다. 이 연구에서는 celecoxib와 PPI의 병용 투여가 비선택적 NSAID와 PPI의 병용 투여보다 더 효과적인 것으로 나타났다. 그러나 celecoxib은 심뇌혈관 고위험 환자에서는 사용에 주의가 필요하다. 한 메타분석에서 COX-2 차단제가 비선택적 NSAID에 비해서 심근경색의 위험도를 53% 올리며 심혈관 질환의 위험도를 올리는 경향을 보였다.32 국내 가이드라인에서도 심혈관계 질환 위험성이 낮은 경우 선택적 COX-2 차단제를 사용할 것을 권고한다(Fig. 1).10
NSAID를 투약하는 환자에서 소화성궤양이 발생한 경우에는 우선 NSAID의 투약을 중단할 것이 권고된다. 이와 함께 PPI와 histamine-2 receptor antagonist (H2RA)와 같이 표준적인 소화성궤양 치료를 시행한다. PPI는 산분비의 마지막 단계를 차단하므로 산분비억제작용이 H2RA에 비해 강력해 현재 궤양 치료에 있어서 첫 번째 약제로 고려된다.33,34 다른 소화성궤양 환자들과 마찬가지로 H. pylori 감염 여부를 조사하여 균 감염이 있다면 제균 치료를 시행한다.35 NSAID의 투약을 중단할 수 없어서 계속 투약하는 환자에게는 PPI를 투여하는 것이 H2RA, misoprostol, sucralfate를 투여하는 것보다 효과적이다.36-39
비선택적 NSAID를 투약하는 환자에서 소화성궤양을 예방하기 위해서는 우선적으로 PPI의 병용 투여를 고려할 수 있다. PPI는 비선택적 비스테로이드 소염제를 투약하는 환자에서 궤양의 새로운 발생 뿐만 아니라 궤양의 재발도 감소시키는 효과가 있다.40,41 최근 골관절염 또는 류마티스 관절염이 있는 환자에게 celecoxib, ibuprofen, naproxen과 함께 esomeprazole을 투여한 후 34개월간 추적 관찰을 하였다.42 그 결과 소화기 합병증의 발생은 각각 0.7%, 0.9%, 0.7%로 매우 낮은 것으로 나타나서 PPI의 병용 투여가 효과가 있음을 시사하였다. 다른 연구에서는 NSAID를 투약하는 환자 중에서 고령이거나 과거 궤양의 기왕력이 있는 고위험군에게 esomeprazole의 궤양 예방 효과를 조사하였다.41 1,429명의 환자에게 esomeprazole 20 mg 또는 40 mg 및 위약을 6개월간 투약한 후에 내시경으로 궤양의 발생을 조사한 결과 esomeprazole을 20 mg, 40 mg을 투약하는 군에서는 궤양의 발생이 5.2%, 4.6%로 감소하는 것으로 나타났다. NSAID를 투약하는 환자에서 prostaglandin E analog인 misoprostol을 투여하면 소화성궤양의 합병증을 감소시켜주는 것으로 알려져 있다.43 NSAID를 투약하는 8,843명의 환자에게 misoprostol 과 위약을 비교한 결과 misoprostol을 투약하는 군에서 출혈, 천공과 같은 소화기 합병증의 발생이 40% 감소하는 것으로 나타났다.44 그러나 이 연구에서 misoprostol을 투약하는 군에서 20%는 부작용으로 약 투약을 중단한 것으로 나타났다. Misoprostol과 PPI를 비교하면 misoprostol을 투약한 군의 7%에서 위십이지장 점막의 결손이 관찰되었으며 lansoprazole 15 mg, 30 mg을 투약한 환자에서는 20%, 18%에서 결손이 관찰되었다.45 그러나 misoprostol을 투약한 군에서 부 작용을 호소하는 경우가 더 많았다. 즉 misoprostol은 소화성 궤양의 예방 효과는 있지만 설사나 복통 등의 부작용이 많아서 장기간 투약이 어려운 경우가 많아서 PPI에 비해서 선호되지는 않는다. 이번 국내 가이드라인에서도 NSAID 장기 투약자에서 궤양 예방을 위해서 misoprostol을 투여할 수는 있지만 부작용에 주의해야 한다고 권고하고 있다.10
Go to : 
비스테로이드 소염제나 아스피린을 투약하는 환자에서 소화성궤양이 잘 발생하는 위험인자에는 환자의 소화성궤양의 과거력, H. pylori 감염 여부, NSAID의 종류와 용량, 환자의 나이와 병용 약물의 투여가 연관 있는 것으로 알려져 있다. 따라서 환자에게 이런 위험인자가 있다면 NSAID의 장기 투약을 시작하기 전에 H. pylori 균 감염을 확인하고 제균 치료를 시행하는 것이 중요하다. NSAID를 사용하는 경우에는 최소 용량으로 최단 기간 동안 사용하는 것이 권고된다. 장기간 복용이 필요한 환자에서는 소화성궤양 발생의 위험인자들이 있으면 PPI, misoprostol, H2RA와의 병용 요법을 고려한다. 또 고위험군에서는 심혈관 질환의 위험인자가 없다면 celecoxib의 투여를 고려해 볼 수 있으며 심혈관 질환의 위험인자가 있으면 비선택적 NSAID와 PPI의 병용 투여를 고려할 수 있다.
Go to : 
REFERENCES
1. Wallace JL. 1997; Nonsteroidal anti-inflammatory drugs and gastroenteropathy: the second hundred years. Gastroenterology. 112:1000–1016. DOI: 10.1053/gast.1997.v112.pm9041264. PMID: 9041264.

2. Abraham NS. 2014; Gastrointestinal bleeding in cardiac patients: epidemiology and evolving clinical paradigms. Curr Opin Gastroenterol. 30:609–614. DOI: 10.1097/MOG.0000000000000122. PMID: 25216111.
3. Wongrakpanich S, Wongrakpanich A, Melhado K, Rangaswami J. 2018; A comprehensive review of non-steroidal anti-inflammatory drug use in the elderly. Aging Dis. 9:143–150. DOI: 10.14336/AD.2017.0306. PMID: 29392089. PMCID: PMC5772852.

4. Shim YK, Kim N. 2016; Nonsteroidal anti-inflammatory drug and aspirin-induced peptic ulcer disease. Korean J Gastroenterol. 67:300–312. DOI: 10.4166/kjg.2016.67.6.300. PMID: 27312830.

5. Armstrong CP, Blower AL. 1987; Non-steroidal anti-inflammatory drugs and life threatening complications of peptic ulceration. Gut. 28:527–532. DOI: 10.1136/gut.28.5.527. PMID: 3596334. PMCID: PMC1432891.

6. Manuel D, Cutler A, Goldstein J, Fennerty MB, Brown K. 2007; Decreasing prevalence combined with increasing eradication of Helicobacter pylori infection in the United States has not resulted in fewer hospital admissions for peptic ulcer disease-related complications. Aliment Pharmacol Ther. 25:1423–1427. DOI: 10.1111/j.1365-2036.2007.03340.x. PMID: 17539981.

7. Post PN, Kuipers EJ, Meijer GA. 2006; Declining incidence of peptic ulcer but not of its complications: a nation-wide study in The Netherlands. Aliment Pharmacol Ther. 23:1587–1593. DOI: 10.1111/j.1365-2036.2006.02918.x. PMID: 16696807.

8. Bhatt DL, Scheiman J, Abraham NS, et al. 2008; ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 52:1502–1517. DOI: 10.1016/j.jacc.2008.08.002. PMID: 19017521.
9. Lanza FL, Chan FK, Quigley EM. Practice Parameters Committee of the American College of Gastroenterology. 2009; Guidelines for prevention of NSAID-related ulcer complications. Am J Gastroenterol. 104:728–738. DOI: 10.1038/ajg.2009.115. PMID: 19240698.

10. Joo MK, Park CH, Kim JS, et al. 2020; Clinical guidelines for drug-induced peptic ulcer, 2020 revised edition. Korean J Gastroenterol. 76:108–133. DOI: 10.4166/kjg.2020.76.3.108. PMID: 32969360.

11. Laine L, Curtis SP, Cryer B, Kaur A, Cannon CP. 2010; Risk factors for NSAID-associated upper GI clinical events in a long-term prospective study of 34 701 arthritis patients. Aliment Pharmacol Ther. 32:1240–1248. DOI: 10.1111/j.1365-2036.2010.04465.x. PMID: 20955443.
12. Lee HL, Han DS, Kim JB, et al. 2004; Importance of age and other risk factors in NSAID-induced gastropathy. Korean J Gastroenterol. 44:246–251. PMID: 15564803.
13. Loke YK, Trivedi AN, Singh S. 2008; Meta-analysis: gastrointestinal bleeding due to interaction between selective serotonin uptake inhibitors and non-steroidal anti-inflammatory drugs. Aliment Pharmacol Ther. 27:31–40. DOI: 10.1111/j.1365-2036.2007.03541.x. PMID: 17919277.

14. Bhala N, Emberson J, et al. Coxib and traditional NSAID Trialists' (CNT) Collaboration. 2013; Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet. 382:769–779. DOI: 10.1016/S0140-6736(13)60900-9. PMID: 23726390. PMCID: PMC3778977.
15. Richy F, Bruyere O, Ethgen O, et al. 2004; Time dependent risk of gastrointestinal complications induced by non-steroidal anti-inflammatory drug use: a consensus statement using a meta-analytic approach. Ann Rheum Dis. 63:759–766. DOI: 10.1136/ard.2003.015925. PMID: 15194568. PMCID: PMC1755051.

16. Henry D, Lim LL, Garcia Rodriguez LA, et al. 1996; Variability in risk of gastrointestinal complications with individual non-steroidal anti-inflammatory drugs: results of a collaborative meta-analysis. BMJ. 312:1563–1566. DOI: 10.1136/bmj.312.7046.1563. PMID: 8664664. PMCID: PMC2351326.

17. Papatheodoridis GV, Sougioultzis S, Archimandritis AJ. 2006; Effects of Helicobacter pylori and nonsteroidal anti-inflammatory drugs on peptic ulcer disease: a systematic review. Clin Gastroenterol Hepatol. 4:130–142. DOI: 10.1016/j.cgh.2005.10.006. PMID: 16469671.

18. Huang JQ, Sridhar S, Hunt RH. 2002; Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet. 359:14–22. DOI: 10.1016/S0140-6736(02)07273-2. PMID: 11809181.
19. Kiltz U, Zochling J, Schmidt WE, Braun J. 2008; Use of NSAIDs and infection with Helicobacter pylori--what does the rheumatologist need to know? Rheumatology (Oxford). 47:1342–1347. DOI: 10.1093/rheumatology/ken123. PMID: 18477642.

20. Chan FK, Sung JJ, Chung SC, et al. 1997; Randomised trial of eradication of Helicobacter pylori before non-steroidal anti-inflammatory drug therapy to prevent peptic ulcers. Lancet. 350:975–979. DOI: 10.1016/S0140-6736(97)04523-6. PMID: 9329511.

21. Chan FK, To KF, Wu JC, et al. 2002; Eradication of Helicobacter pylori and risk of peptic ulcers in patients starting long-term treatment with non-steroidal anti-inflammatory drugs: a randomised trial. Lancet. 359:9–13. DOI: 10.1016/S0140-6736(02)07272-0. PMID: 11809180.
22. Labenz J, Blum AL, Bolten WW, et al. 2002; Primary prevention of diclofenac associated ulcers and dyspepsia by omeprazole or triple therapy in Helicobacter pylori positive patients: a randomised, double blind, placebo controlled, clinical trial. Gut. 51:329–335. DOI: 10.1136/gut.51.3.329. PMID: 12171952. PMCID: PMC1773346.

23. Hawkey CJ, Tulassay Z, Szczepanski L, et al. 1998; Randomised controlled trial of Helicobacter pylori eradication in patients on non-steroidal anti-inflammatory drugs: HELP NSAIDs study. Helicobacter eradication for lesion prevention. Lancet. 352:1016–1021. DOI: 10.1016/S0140-6736(98)04206-8. PMID: 9759744.
24. Lai KC, Lau CS, Ip WY, et al. 2003; Effect of treatment of Helicobacter pylori on the prevention of gastroduodenal ulcers in patients receiving long-term NSAIDs: a double-blind, placebo-controlled trial. Aliment Pharmacol Ther. 17:799–805. DOI: 10.1046/j.1365-2036.2003.01528.x. PMID: 12641502.

25. de Leest HT, Steen KS, Lems WF, et al. 2007; Eradication of Helicobacter pylori does not reduce the incidence of gastroduodenal ulcers in patients on long-term NSAID treatment: double-blind, randomized, placebo-controlled trial. Helicobacter. 12:477–485. DOI: 10.1111/j.1523-5378.2007.00543.x. PMID: 17760715.

26. Song HJ, Kwon JW, Kim N, Park YS. 2013; Cost effectiveness associated with Helicobacter pylori screening and eradication in patients taking nonsteroidal anti-inflammatory drugs and/or aspirin. Gut Liver. 7:182–189. DOI: 10.5009/gnl.2013.7.2.182. PMID: 23560154. PMCID: PMC3607772.

27. Zidar N, Odar K, Glavac D, Jerse M, Zupanc T, Stajer D. 2009; Cyclooxygenase in normal human tissues--is COX-1 really a constitutive isoform, and COX-2 an inducible isoform? J Cell Mol Med. 13:3753–3763. DOI: 10.1111/j.1582-4934.2008.00430.x. PMID: 18657230. PMCID: PMC4516524.
28. Feldman M, McMahon AT. 2000; Do cyclooxygenase-2 inhibitors provide benefits similar to those of traditional nonsteroidal anti-inflammatory drugs, with less gastrointestinal toxicity? Ann Intern Med. 132:134–143. DOI: 10.7326/0003-4819-132-2-200001180-00008. PMID: 10644275.

29. Goldstein JL, Cryer B, Amer F, Hunt B. 2007; Celecoxib plus aspirin versus naproxen and lansoprazole plus aspirin: a randomized, double-blind, endoscopic trial. Clin Gastroenterol Hepatol. 5:1167–1174. DOI: 10.1016/j.cgh.2007.06.009. PMID: 17916545.

30. Laine L, Curtis SP, Cryer B, Kaur A, Cannon CP. MEDAL Steering Committee. 2007; Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the multinational etoricoxib and diclofenac arthritis long-term (MEDAL) programme: a randomised comparison. Lancet. 369:465–473. DOI: 10.1016/S0140-6736(07)60234-7. PMID: 17292766.

31. Targownik LE, Metge CJ, Leung S, Chateau DG. 2008; The relative efficacies of gastroprotective strategies in chronic users of nonsteroidal anti-inflammatory drugs. Gastroenterology. 134:937–944. DOI: 10.1053/j.gastro.2008.01.010. PMID: 18294634.

32. Farkouh ME, Greenberg BP. 2009; An evidence-based review of the cardiovascular risks of nonsteroidal anti-inflammatory drugs. Am J Cardiol. 103:1227–1237. DOI: 10.1016/j.amjcard.2009.01.014. PMID: 19406264.

33. Bhatt DL, Scheiman J, Abraham NS, et al. 2008; ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on clinical expert consensus documents. Circulation. 118:1894–1909. DOI: 10.1161/CIRCULATIONAHA.108.191087. PMID: 18836135.
34. Satoh K, Yoshino J, Akamatsu T, et al. 2016; Evidence-based clinical practice guidelines for peptic ulcer disease 2015. J Gastroenterol. 51:177–194. DOI: 10.1007/s00535-016-1166-4. PMID: 26879862.

35. Fallone CA, Chiba N, van Zanten SV, et al. 2016; The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology. 151:51–69.e14. DOI: 10.1053/j.gastro.2016.04.006. PMID: 27102658.

36. Yeomans ND, Tulassay Z, Juhász L, et al. 1998; A comparison of omeprazole with ranitidine for ulcers associated with nonsteroidal antiinflammatory drugs. Acid suppression trial: ranitidine versus omeprazole for NSAID-associated ulcer treatment (ASTRONAUT) study group. N Engl J Med. 338:719–726. DOI: 10.1056/NEJM199803123381104. PMID: 9494148.
37. Agrawal NM, Campbell DR, Safdi MA, Lukasik NL, Huang B, Haber MM. 2000; Superiority of lansoprazole vs ranitidine in healing nonsteroidal anti-inflammatory drug-associated gastric ulcers: results of a double-blind, randomized, multicenter study. NSAIDassociated gastric ulcer study group. Arch Intern Med. 160:1455–1461. DOI: 10.1001/archinte.160.10.1455. PMID: 10826458.
38. Hawkey CJ, Karrasch JA, Szczepañski L, et al. 1998; Omeprazole compared with misoprostol for ulcers associated with nonsteroidal antiinflammatory drugs. Omeprazole versus misoprostol for NSAID-induced ulcer management (OMNIUM) Study Group. N Engl J Med. 338:727–734. DOI: 10.1056/NEJM199803123381105. PMID: 9494149.
39. Bianchi Porro G, Lazzaroni M, Manzionna G, Petrillo M. 1998; Omeprazole and sucralfate in the treatment of NSAID-induced gastric and duodenal ulcer. Aliment Pharmacol Ther. 12:355–360. DOI: 10.1046/j.1365-2036.1998.00312.x. PMID: 9690725.
40. Kim JJ, Kim N, Lee BH, et al. 2010; Risk factors for development and recurrence of peptic ulcer disease. Korean J Gastroenterol. 56:220–228. DOI: 10.4166/kjg.2010.56.4.220. PMID: 20962557.

41. Scheiman JM, Yeomans ND, Talley NJ, et al. 2006; Prevention of ulcers by esomeprazole in at-risk patients using non-selective NSAIDs and COX-2 inhibitors. Am J Gastroenterol. 101:701–710. DOI: 10.1111/j.1572-0241.2006.00499.x. PMID: 16494585.

42. Yeomans ND, Graham DY, Husni ME, et al. 2018; Randomised clinical trial: gastrointestinal events in arthritis patients treated with celecoxib, ibuprofen or naproxen in the PRECISION trial. Aliment Pharmacol Ther. 47:1453–1463. DOI: 10.1111/apt.14610. PMID: 29667211.

43. Raskin JB, White RH, Jackson JE, et al. 1995; Misoprostol dosage in the prevention of nonsteroidal anti-inflammatory drug-induced gastric and duodenal ulcers: a comparison of three regimens. Ann Intern Med. 123:344–350. DOI: 10.7326/0003-4819-123-5-199509010-00004. PMID: 7625622.

44. Silverstein FE, Graham DY, Senior JR, et al. 1995; Misoprostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving nonsteroidal anti-inflammatory drugs. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 123:241–249. DOI: 10.7326/0003-4819-123-4-199508150-00001. PMID: 7611589.
45. Graham DY, Agrawal NM, Campbell DR, et al. 2002; Ulcer prevention in long-term users of nonsteroidal anti-inflammatory drugs: results of a double-blind, randomized, multicenter, active- and placebo-controlled study of misoprostol vs lansoprazole. Arch Intern Med. 162:169–175. DOI: 10.1001/archinte.162.2.169. PMID: 11802750.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download