증례: 47세 남자 환자가 검진 대장 내시경을 시행하였다. 환자는 평상 시 간헐적인 소화불량을 호소하였고 배변횟수가 하루 3-4회로 잦은 편이었다. 하루 2-3병, 주 3회의 음주력이 있었고 음주 시 배변횟수가 증가한다고 하였다. 대장암의 가족력은 없었으며 유전성 폴립증 증후군, 신경섬유종증(neurofibromatosis), Cowden 증후군, 염증성 장질환 등의 기왕력도 없었다.
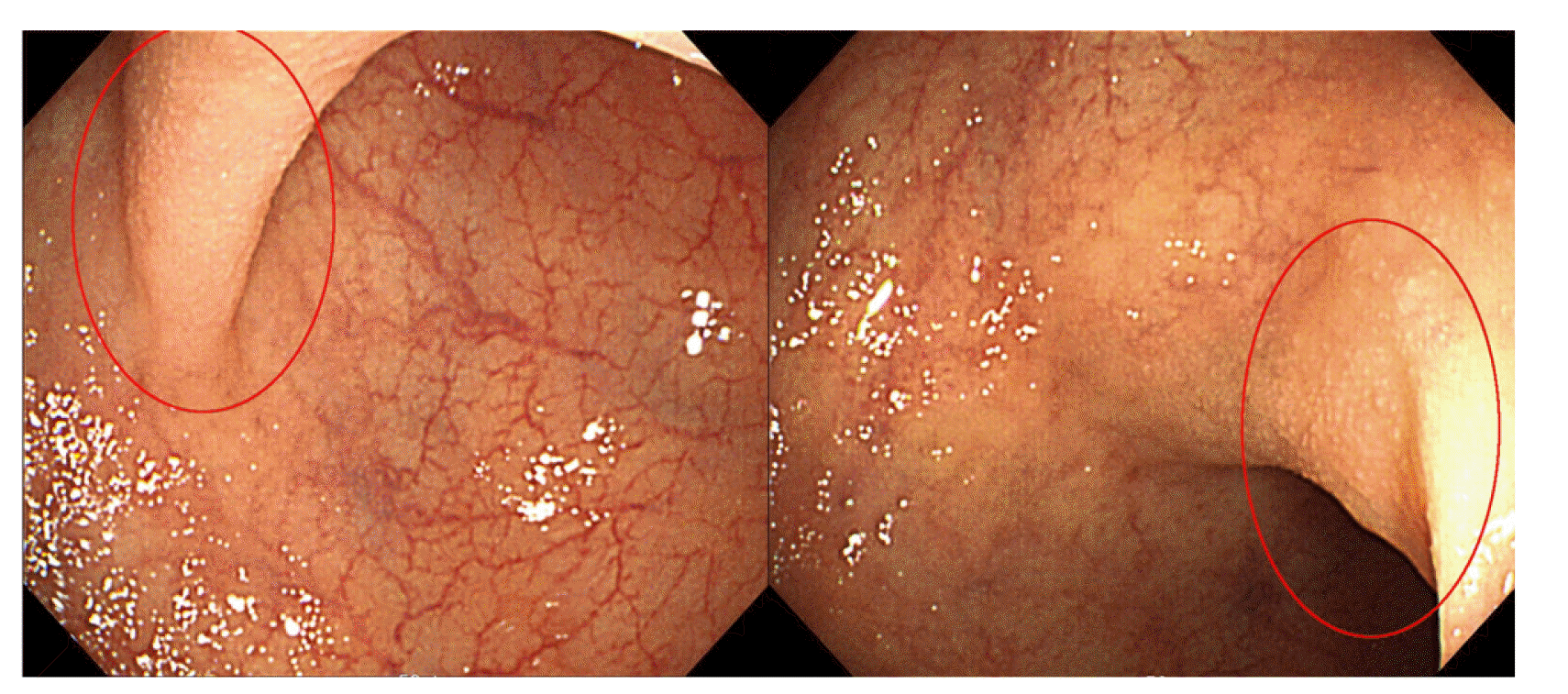
활력징후는 혈압 114/77 mmHg, 맥박수 78회/분, 호흡수 20회/분이었다. 말초혈액 검사에서 백혈구 5,900/μL, 혈색소 14.9 g/dL, 혈소판 281,000/μL였고, 생화학 검사에서 모두 정상 범위 내로 측정되었다. CEA는 1.01 ng/mL (정상 범위 0-3.8 ng/mL), CA 19-9는 0.6 U/mL (정상 범위 0-39 U/mL)였다. 시행한 대장 내시경에서 직장구불결장이행부에서 미만성 미세결절 소견(diffuse fine nodularities)이 관찰되어 조직 검사를 시행하였다(Fig. 1).
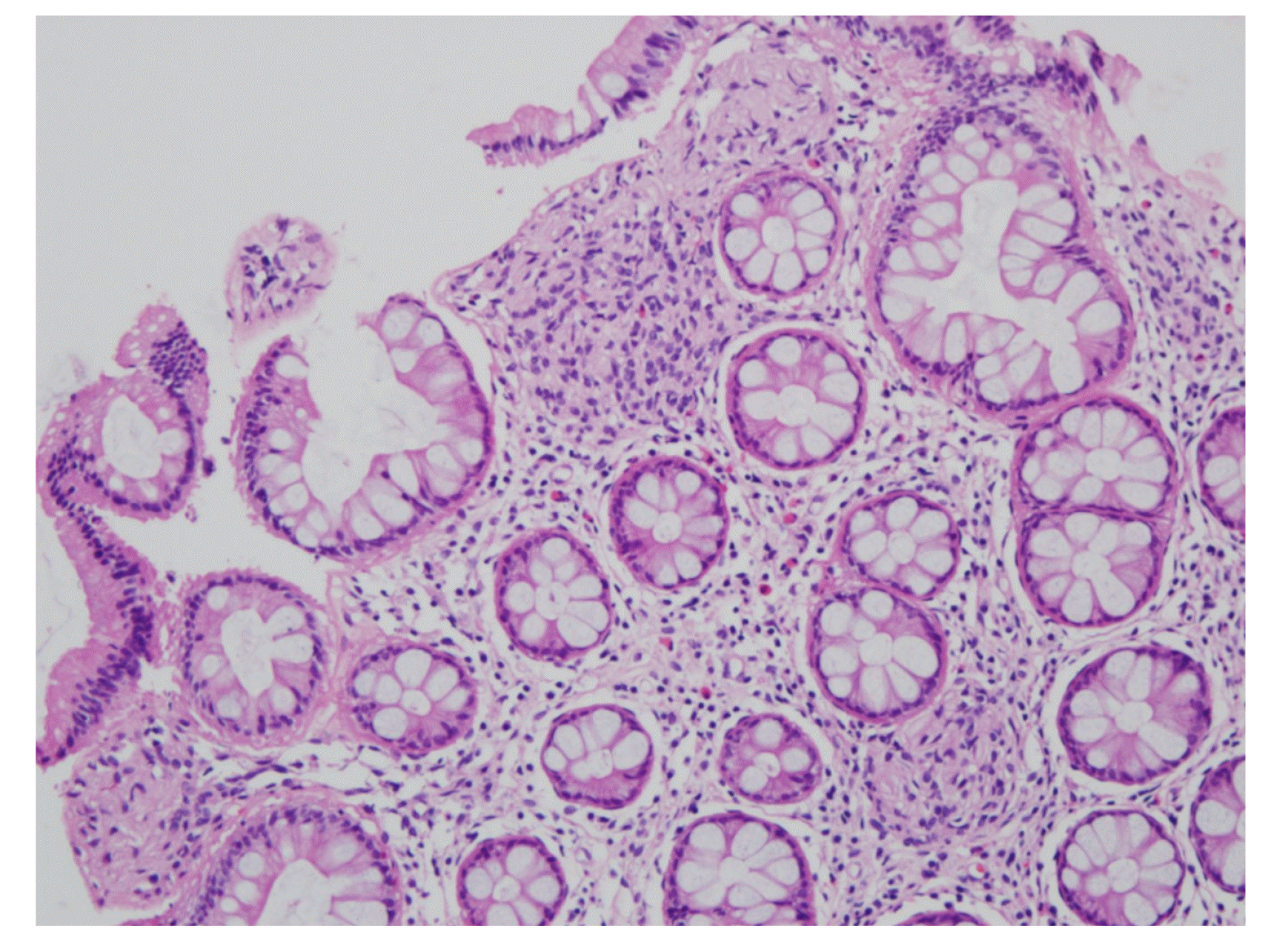
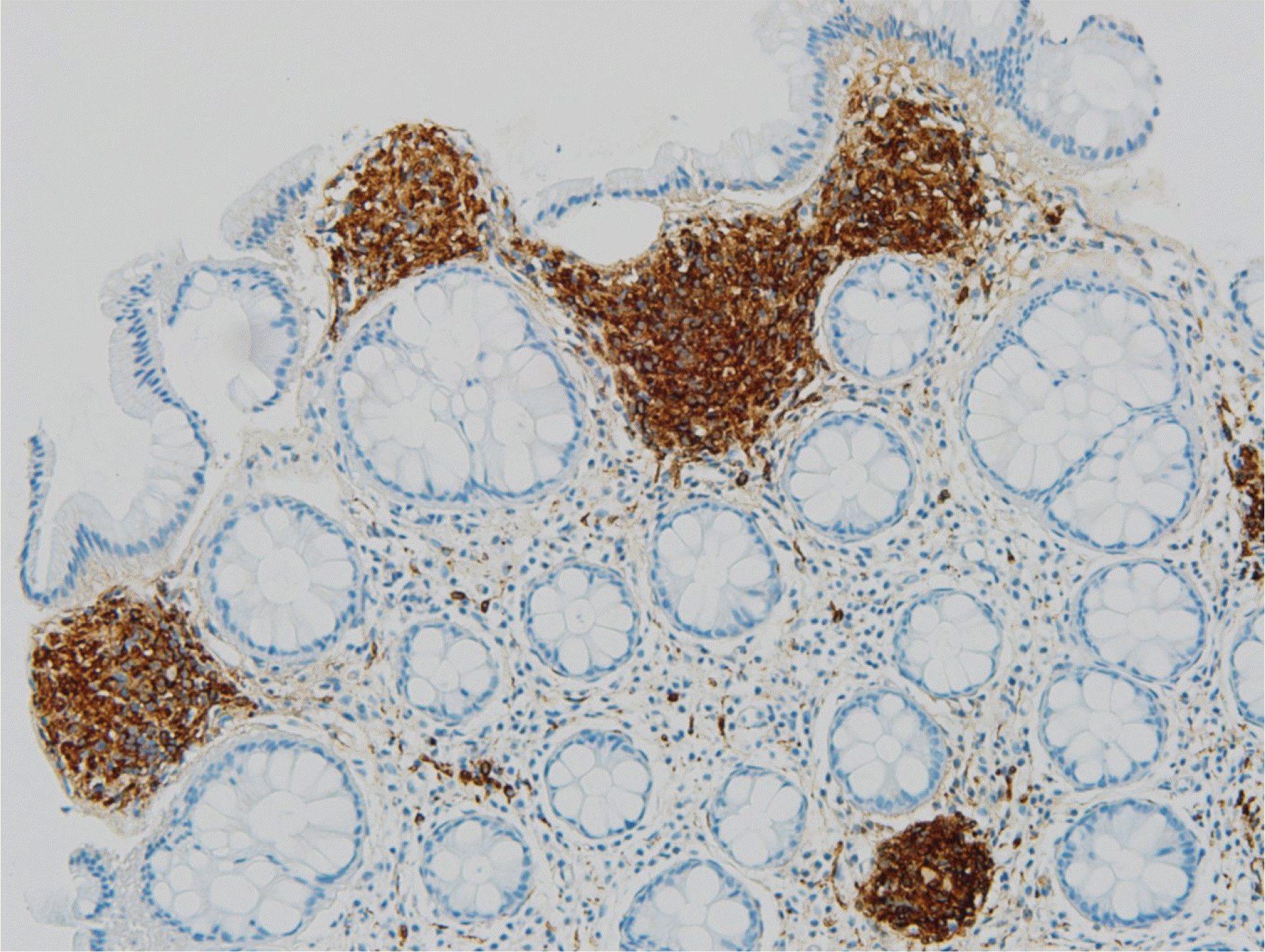
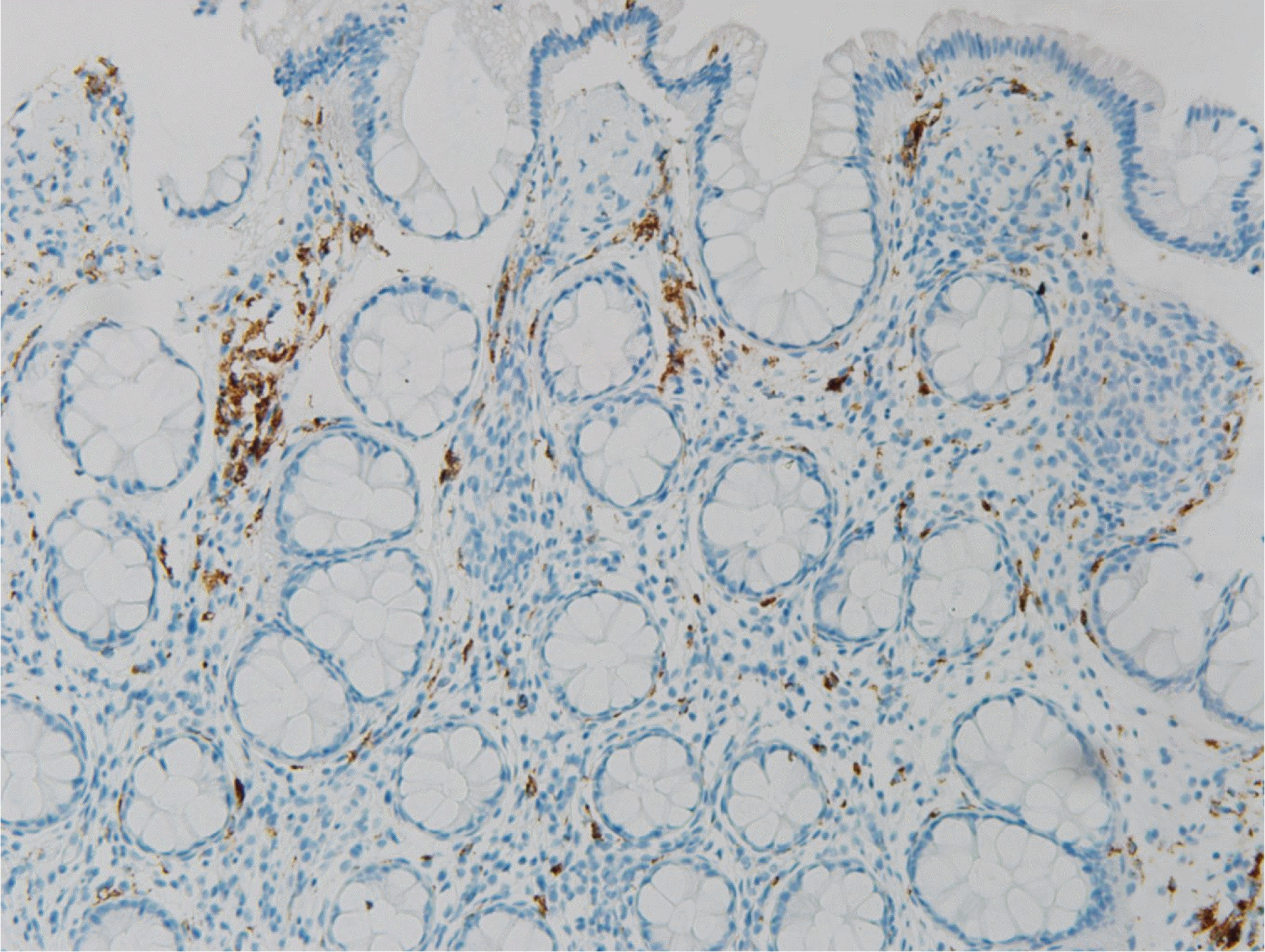
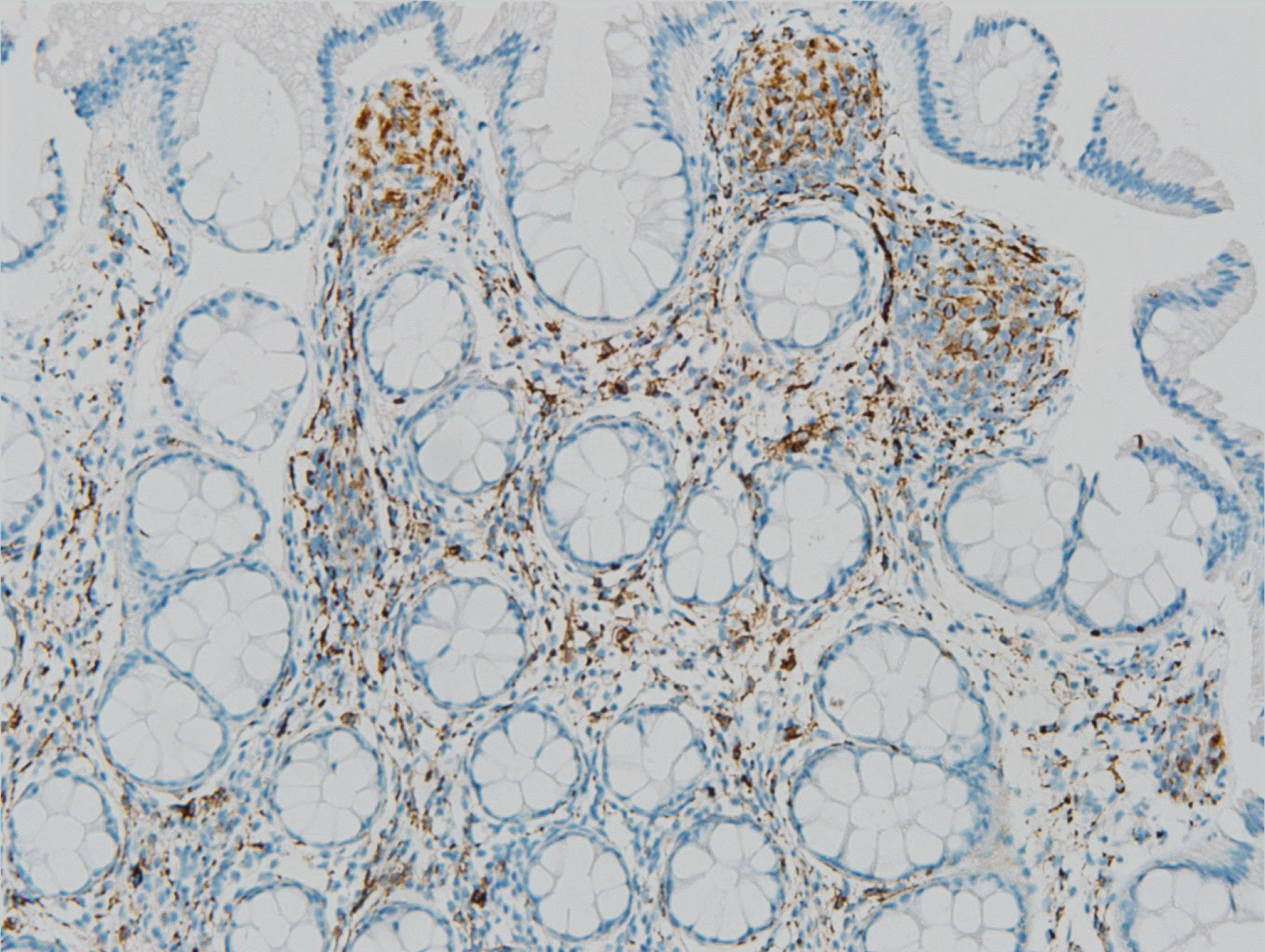
조직 검사상 방추세포(spindle cells)가 세포소(nest) 형성이 관찰되었고 이형성이나 악성을 시사하는 소견은 관찰되지 않았다(Fig. 2). 면역조직화학염색 검사에서는 S-100 양성, CD 56은 부분 양성, CD 68은 음성이 확인되었다(Figs. 3-5). 이를 바탕으로 점막슈반세포과오종(mucosal Schwann cell hamartoma, MSCH)으로 진단 내릴 수 있었으며 환자는 추가 검사나 치료 없이 경과 관찰 중이다.
진단: 미만성 미세 결절 형태로 나타난 MSCH
MSCH는 대장 고유판층의 S-100 양성을 보이는 슈반세포의 증식으로 이루어진 용종으로 1형 신경섬유종증 환자에서 나타나는 결장 신경섬유종(neurofibroma)과는 구별되며 Gibson과 Hornick1이 26개의 증례를 모아 2009년 처음 보고하였다. 이후 현재까지 16 증례가 추가로 보고되었고,2-13 우리나라에서도 Bae 등2,3과 Han 등4이 보고한 바 있다. 중년 여성에서 가장 빈도가 높게 나타났으며 대부분 무증상이지만 일부 위장관 출혈, 설사 등의 증상이 동반된 경우도 있었다.12 빈도가 매우 드물기 때문에 정확한 발생률과 유병률을 알기는 어렵다.
현재까지 보고된 MSCH의 내시경적 소견을 살펴보면 궤양이나 괴사가 동반되지 않은 1-8 mm 크기의 작은 무경성의 용종 형태로 주로 직장과 구불결장에서 나타는 것으로 알려져 있다.12 대부분 단일 용종 형태로 나타나지만 다발성 용종형 점막 병변,6 미만성의 작은 흰색 결절 형태14도 보고된 바 있다. 본고에서는 흔하게 나타나는 단일 용종 형태가 아닌 미만성 미세결절 소견이 확인되었다. 육안적 내시경 소견만으로는 판단이 어렵기 때문에 진단을 위해서는 조직 검사 및 면역조직화학염색 검사가 필수적이다.
조직학적으로 MSCH는 점막고유층 내의 방추세포의 증식이 관찰되며 세포형태는 이형성 소견 없이 비교적 균일하고 호산구성 세포질을 동반한다. 면역조직화학염색 검사상 S-100 양성을 보이며 CD34, KIT (CD117), 평활근 액틴(smooth muscle actin), 상피막항원(epithelial membrane antigen)에는 음성을 보인다.13 진단에 있어서 방추세포 증식을 보이거나 면역조직화학염색 검사에서 S-100 양성을 보이는 다른 질환들의 감별이 중요하다.
위장관기질종양은 위장관에서 나타나는 가장 흔한 방추세포 종양이다.10 면역조직화학염색 검사에서 KIT (CD117) 양성이 약 95%에서 나타나 이를 통해 MSCH와 감별할 수 있다. CD34는 60-80% 양성을 보이며 5%에서 S-100 양성이 나타난다.15
위장관 신경초종(gastrointestinal Schwannoma)은 소화기계 종양의 0.2%의 빈도를 차지하는 드문 종양16으로 조직학적으로 방추형 세포다발이 관찰되며, 경계가 비교적 명확하다. MSCH에서는 나타나지 않는 주변부의 두꺼운 림프구층10과 치밀한 세포구조가 있는 Antoni A 부위 및 세포가 적고 점액 기질로 구성된 Antoni B 부위를 확인할 수 있다.17
결장의 신경섬유종은 신경섬유종증 1형과 동반되어 나타나며 대부분 다발성이지만 드물게 피부 병변 없이 단발성으로 나타나는 경우도 있어9 MSCH와 감별이 필요하다. 비교적 균일하게 방추세포의 증식을 보여주는 MSCH와 다르게 신경섬유종은 슈반세포, 신경모세포, 말초신경세포, 축삭돌기 등 다양한 세포의 집합으로 나타나며 그 결과로 면역조직화학염색 검사에서도 S-100은 일부에서만 양성을 보이며 CD34, neurofilament 단백, 상피막항원(epithelial membrane antigen) 등에서도 양성이 나타난다.12
위장관 신경절신경종(ganglioneuroma)은 용종성 신경절신경종(polypoid ganglioneuroma), 신경절신경종성 용종증(ganglioneuromtous polyposis), 미만성 신경절신경종(diffuse ganglioneuromaosis)으로 나눌 수 있으며,18 용종성 신경절신경종은 전신 질환과 연관성이 없고 결장에 단발성으로 나타날 수 있어 MSCH와 감별이 필요하다. 조직학적으로 S-100 양성인 슈반세포와 섬유기질이 관찰되며 MSCH와는 다르게 neuron specific enolase 양성인 신경절세포가 관찰된다.9
현재까지 MSCH는 양성 종양으로 생각되며 악성을 보이거나 유전적 질환과 연관성은 보고된 바 없으며 특별한 치료를 요하지 않는다. 본고의 환자의 경우도 다른 검사나 치료 없이 경과 관찰 중에 있다. 다만 진단 과정에서 방추세포 증식을 보이거나 S-100 양성을 보이는 다른 질환의 감별이 중요한데, 위장관기질종양처럼 악성화 가능성이 있는 질환도 포함되므로 진단 과정이 그만큼 중요하다고 할 수 있겠다. 빈도가 매우 드물기에 추적 대장 내시경 검사 등에 대한 가이드라인은 현재까지 정립된 바 없으며 추가적인 연구가 필요할 것으로 보인다.
본고는 검진 내시경에서 확인된 MSCH 증례로 현재까지 보고된 대부분의 MSCH 증례들이 작은 크기의 용종 형태였던 것과 비교하여 미만성 미세결절 형태를 보인다는 점에서 이전의 증례들과는 차이를 보인다. 현재까지 미만성 결절 형태로 나타난 MSCH는 일본에서 1예 보고된 바 있으며 국내에서는 최초의 증례로 판단되어 간단한 문헌고찰과 함께 보고하는 바이다.
Go to : 
REFERENCES
1. Gibson JA, Hornick JL. 2009; Mucosal Schwann cell "hamartoma": clinicopathologic study of 26 neural colorectal polyps distinct from neurofibromas and mucosal neuromas. Am J Surg Pathol. 33:781–787. DOI: 10.1097/PAS.0b013e31818dd6ca. PMID: 19065103.
2. Bae MN, Lee JE, Bae SM, et al. 2013; Mucosal Schwann-cell hamartoma diagnosed by using an endoscopic snare polypectomy. Ann Coloproctol. 29:130–134. DOI: 10.3393/ac.2013.29.3.130. PMID: 23862132. PMCID: PMC3710775.

3. Bae JM, Lee JY, Cho J, Lim SA, Kang GH. 2015; Synchronous mucosal Schwann-cell hamartomas in a young adult suggestive of mucosal Schwann-cell harmatomatosis: a case report. BMC Gastroenterol. 15:128. DOI: 10.1186/s12876-015-0349-4. PMID: 26444007. PMCID: PMC4596299.

4. Han J, Chong Y, Kim TJ, Lee EJ, Kang CS. 2017; Mucosal Schwann cell hamartoma in colorectal mucosa: a rare benign lesion that resembles gastrointestinal neuroma. J Pathol Transl Med. 51:187–189. DOI: 10.4132/jptm.2016.07.02. PMID: 27560153. PMCID: PMC5357750.

5. Feng X, Xu H, Dela Cruz N. 2020; Mucosal Schwann cell hamartoma in sigmoid colon - a rare case report and review of literature. Human Pathology: Case Reports. 19:200337. DOI: 10.1016/j.ehpc.2019.200337.

6. Vaamonde-Lorenzo M, Elorriaga K, Montalvo I, Bujanda L. 2020; Colonic mucosal Schwann cell hamartoma. J Dig Dis. 21:475–477. DOI: 10.1111/1751-2980.12874. PMID: 32378790.

7. Chintanaboina J, Clarke K. 2018; Case of colonic mucosal Schwann cell hamartoma and review of literature on unusual colonic polyps. BMJ Case Rep. 2018:bcr2018224931. DOI: 10.1136/bcr-2018-224931. PMID: 30244220. PMCID: PMC6157549.

8. Pasquini P, Baiocchini A, Falasca L, et al. 2009; Mucosal Schwann cell "hamartoma": a new entity? World J Gastroenterol. 15:2287–2289. DOI: 10.3748/wjg.15.2287. PMID: 19437573. PMCID: PMC2682248.

9. Rocco EG, Iannuzzi F, Dell'Era A, et al. 2011; Schwann cell hamartoma: case report. BMC Gastroenterol. 11:68. DOI: 10.1186/1471-230X-11-68. PMID: 21663626. PMCID: PMC3123296.

10. Neis B, Hart P, Chandran V, Kane S. 2013; Mucosal Schwann cell hamartoma of the colon in a patient with ulcerative colitis. Gastroenterol Hepatol (N Y). 9:183–185. PMID: 23961270. PMCID: PMC3745209.
11. Kanar O, Nakshabendi R, Berry AC. 2015; Colonic mucosal Schwann cell hamartoma on incidental screening colonoscopy. J Gastrointestin Liver Dis. 24:411. DOI: 10.15403/jgld.2014.1121.244.scw. PMID: 26697564. PMCID: PMC6157549.

12. Gaspar R, Santos-Antunes J, Marques M, et al. 2017; Endoscopic submucosal dissection of a schwann cell hamartoma mimicking a lateral spreading tumor of the rectum. Acta Gastroenterol Belg. 80:429. PMID: 29560678.
13. Hashimoto H, Usui G, Sakai E, Ohata K, Morikawa T. 2019; Mucosal Schwann cell hamartoma of the rectosigmoid junction: a rare lesion mimicking mucosal prolapse syndrome and other neural lesions. Int J Surg Pathol. 27:515–517. DOI: 10.1177/1066896918818897. PMID: 30541360.

14. Sagami S, Fukumoto A, Amano M, et al. 2012; A case of mucosal Schwann cell hamartoma. Nihon Shokakibyo Gakkai Zasshi. 109:1776–1783. PMID: 23047636.
15. Kang YK, Koo DH. 2013; Diagnosis and treatment of gastrointestinal stromal tumor. Korean J Med. 85:341–353. DOI: 10.3904/kjm.2013.85.4.341. PMID: 32927508.

16. Jacobson BC, Hirsch MS, Lee JH, Van Dam J, Shoji B, Farraye FA. 2001; Multiple asymptomatic plexiform schwannomas of the sigmoid colon: a case report and review. Gastrointest Endosc. 53:801–804. DOI: 10.1067/mge.2001.115317. PMID: 11375596.

17. Moon SY, Chang YW, Lee CK, et al. 2007; A case of gastric Schwannoma in a male patient. Clin Endosc. 34:210–213.
18. Srinivasan R, Mayle JE. 1998; Polypoid ganglioneuroma of colon. Dig Dis Sci. 43:908–909. DOI: 10.1023/A:1018807307295. PMID: 9558052. PMCID: PMC7451080.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download