서 론
본 론
1. 담낭용종의 병리 및 분류
Table 1
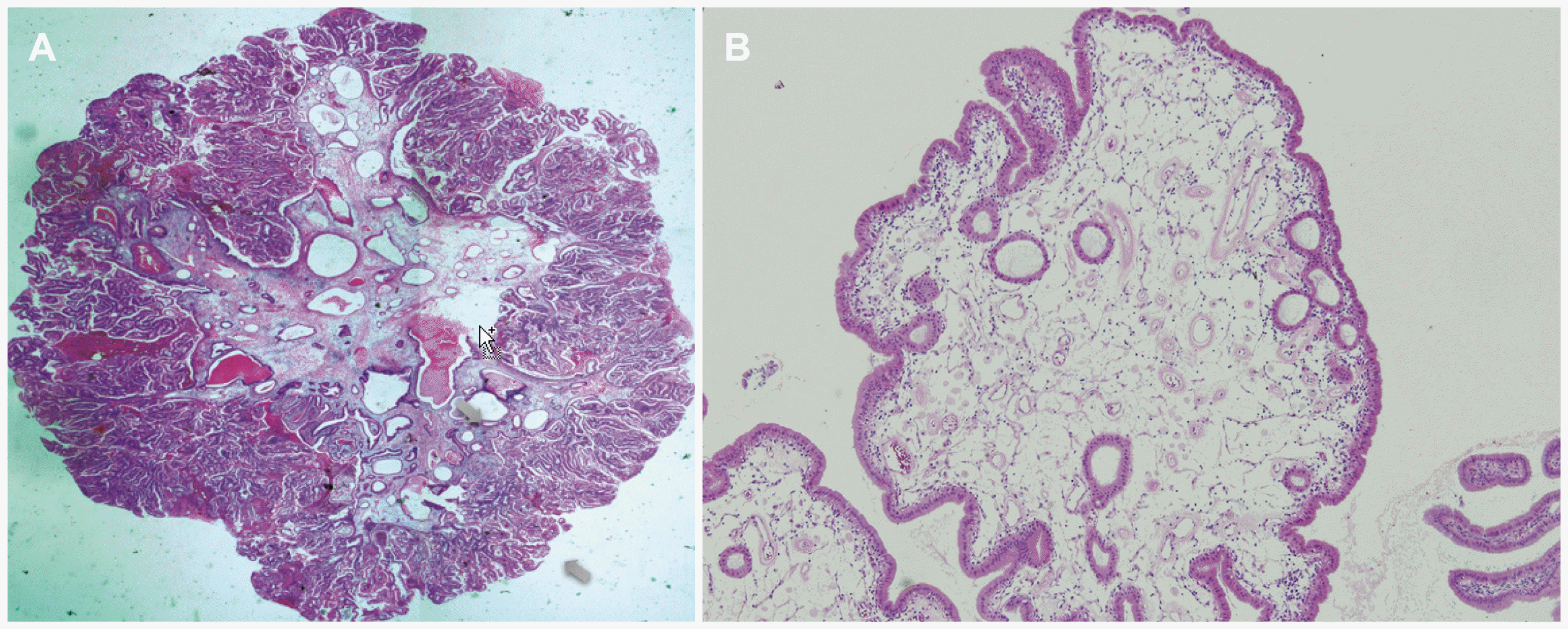 | Fig. 1(A) microscopic feature of an adenomatous polyp. The polyp was composed of a glandular structure with a tall columnar epithelium and stroma. In the center, a dilated gland and vessels surrounded by loose connective tissue were noted (H&E staining, ×40), (B) microscopic features of a cholesterol polyp. Lipid laden macrophage containing a polyp was observed (H&E staining, ×40). |
2. 담낭 신생물용종의 위험인자
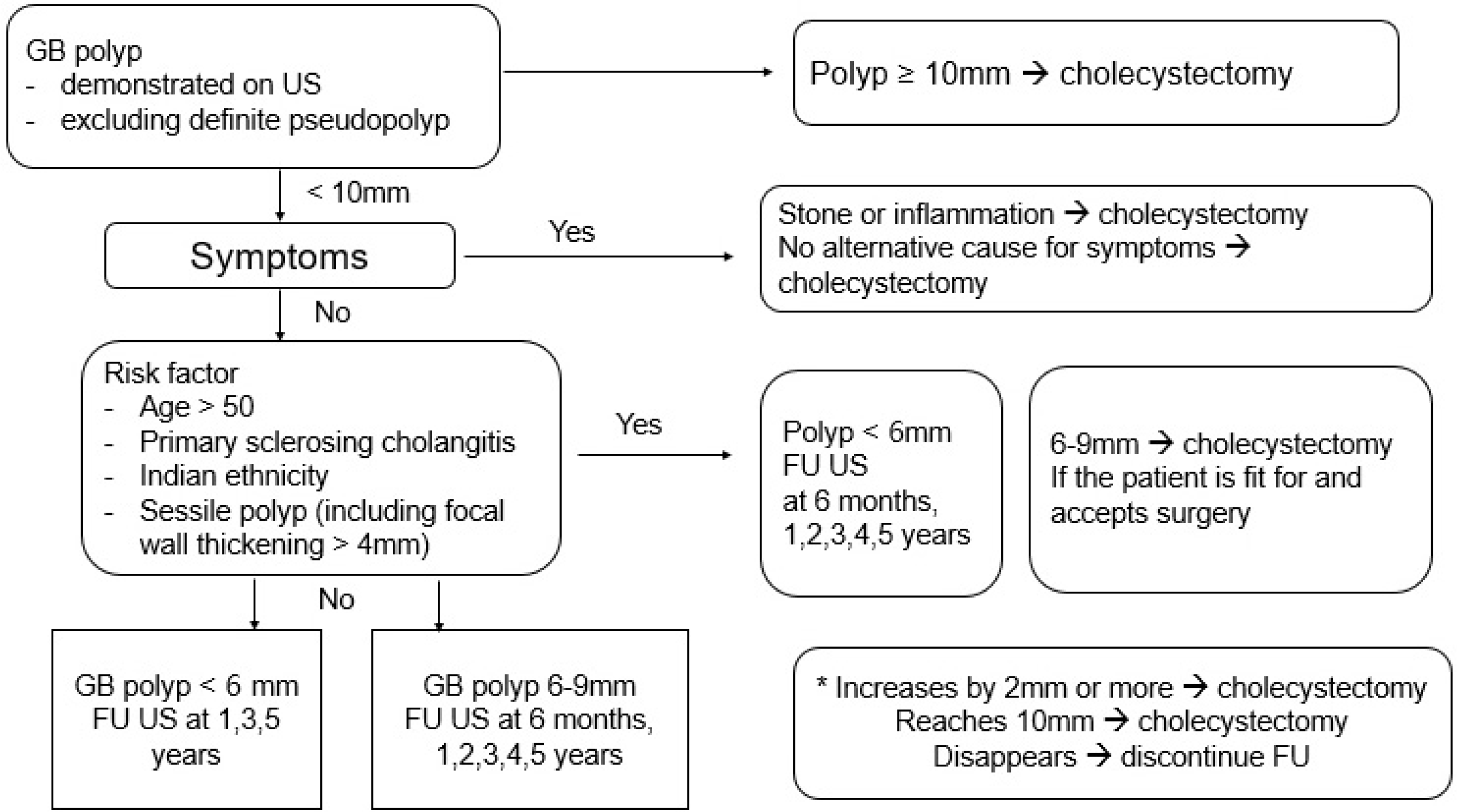
3. 담낭용종의 치료 전략
4. 추적 관찰 및 자연 경과
5. 새로운 시도와 발전 방향
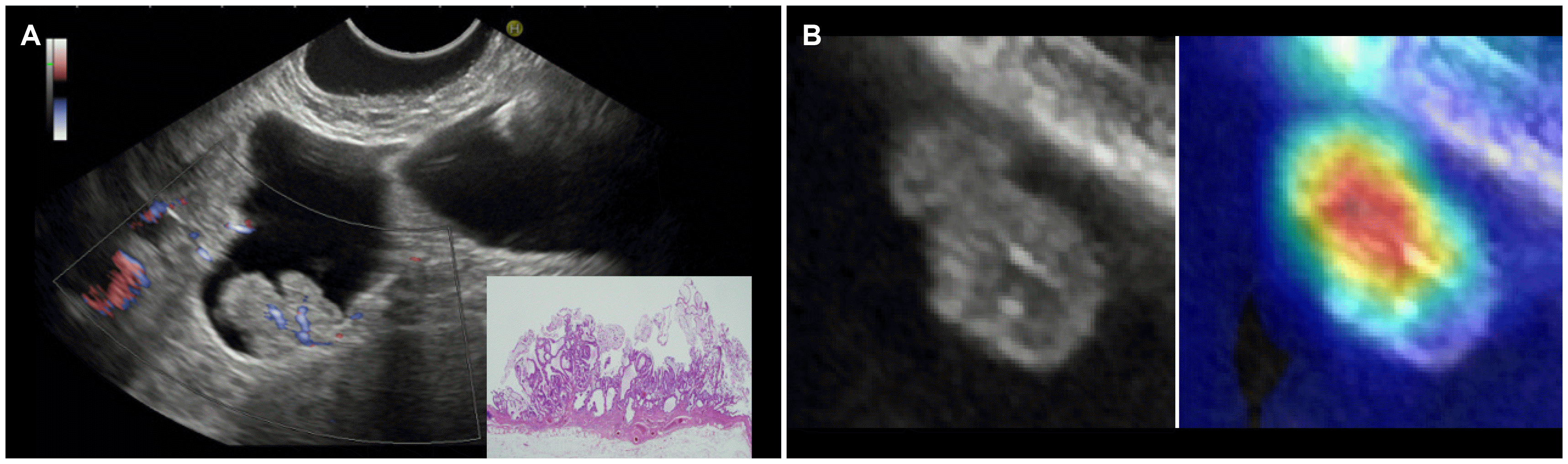 | Fig. 3(A) Color Doppler flow endoscopic ultrasonography image shows a strong continuous flow in an adenomatous polyp, which is compatible with prominent small feeding arterioles in gallbladder polyps. (B) Class activation map of a gallbladder polyp in the image classification through deep learning of the endoscopic ultrasonography-artificial intelligence system. |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download