Abstract
Alcoholic liver disease is a major cause of liver disease that results in significant morbidity and mortality in Korea. Abstinence is the most important strategy to prevent disease progression. Corticosteroids improve the one-month survival in patients with severe alcoholic hepatitis, but it was not effective on long-term survival. An N-acetylcysteine treatment combined with corticosteroids may provide a short-term survival benefit than corticosteroids alone. Pentoxifylline is unlikely to affect short-term survival. Hence, studies on new therapies, such as granulocyte colony-stimulating factor and fecal microbiota transplantation, are ongoing. This paper briefly reviews the current knowledge of the medical treatment of alcoholic liver disease.
Go to : 
알코올 간질환은 과도한 알코올 섭취로 인해 발생하는 간질환으로, 지방간, 알코올 지방간염, 간경변증 및 그에 따른 여러 합병증을 포함하는 질환군이다. 알코올 간질환은 우리나라에서 알코올 관련 질환 중 사망의 주요 원인을 차지하며, 만성 B형간염에 이어 간염의 원인 중 2위를 차지하고, 간세포암종의 원인 질환 중 3위를 차지한다.1 또한 만성 간질환을 가진 환자 중 급성 악화를 겪는 환자(acute-on-chronic liver failure)에서는 알코올이 가장 중요한 원인인자이다.2
알코올 간질환에서 가장 근간이 되는 치료는 금주이다. 금주는 알코올 간질환 환자에서 조직학적 소견을 개선시켜줄 뿐만 아니라, 질환의 진행을 늦춰 장기 예후를 개선시켜준다.3-5 알코올 간질환에서도 지속적인 음주로 인해 단기간에 발생한 황달과 복수 및 간성뇌증과 같은 합병증을 동반하는 중증 알코올 간염은 매우 예후가 나쁨에도 불구하고 최근 40여 년 동안 스테로이드 치료 외에 크게 바뀐 것이 없는 실정이다. 게다가 스테로이드 치료에 반응이 없는 환자에서는 치료가 매우 제한적이다. 하지만 최근 알코올 간염의 병태생리에 대한 연구가 많이 밝혀지면서 다양한 임상 연구가 진행되었고, 일부에서 의미 있는 결과를 보이기도 하였다. 따라서 본고에서는 알코올 간질환에서 금주 치료 외에 효과적으로 이용할 수 있는 치료에 대해 알아보고자 한다.
Go to : 
알코올 간질환 환자에서 영양불량 상태는 흔하게 나타나고, 간기능이 나쁠수록 영양불량의 빈도가 높아진다.6 알코올 간질환에서 영양불량을 유발하는 원인은 다양하다.7 알코올을 섭취하면서 균형 잡힌 식사가 이뤄지기 어렵고, 식욕이 저하되어 있는 경우가 많다. 또한 복수나 간성뇌증과 같은 합병증으로 인해 충분한 식사를 할 수 없는 경우도 있고, 저염식이 맞지 않아 식사를 충분히 하지 못하는 경우도 있다. 알코올 간질환에서 영양불량은 불량한 예후와 연관되기 때문에 적절한 영양공급은 중요하다.8-10
유럽 임상 영양 및 대사학회(European Society for Clinical Nutrition and Metabolism) 가이드라인은 중증 알코올 간염 환자에서 영양공급은 장관영양(enteral feeding)을 우선적으로 권장하며, 장관영양을 할 수 없는 환자 혹은 장관영양으로 충분한 영양공급을 하기 어려운 환자에서만 비경구 영양(parenteral feeding)을 할 것을 권장하고 있다.11 장관영양은 비경구 영양에 비해 감염의 위험성이 더 낮고,12 장점막의 통합성(mucosal integrity)의 유지 및 장내 미생물에 더 유리하기 때문이다.11 중증 알코올 간염 환자에서 영양요법의 효과를 분석한 2개의 메타 연구는 알코올 간염 환자에서 영양요법이 간성뇌증과 감염의 발생을 감소시키는 효과가 있음을 보였지만 생존율에서는 서로 다른 결과를 보여주었다.13,14 스테로이드 치료를 받는 알코올 간염 환자에서 집중영양 치료와 일반식을 비교한 최근의 무작위 다기관 연구에서 집중영양 치료는 일반식과 비교하여 6개월 사망률에 차이가 없었다(집중영양 치료 44.4% vs. 일반 식이 52.1%, p=0.406).15 하지만 집중영양 치료 여부와 관계없이 하루 21.5 kcal/kg의 열량을 섭취하지 못한 환자는 21.5 kcal/kg 이상의 열량을 섭취한 환자에 비해 사망률이 높음(65.8% vs. 33.1%, p<0.001)을 보여, 중증 알코올 간염환자에서 적절한 영양 섭취가 중요함을 알 수 있다. 그래서여러 가이드라인에서는 중증 알코올 간염 환자에서 하루 열량35-40 kcal/kg, 단백질 1.2-1.5 g/kg 이상 섭취를 권장하고있지만,16,17 실제 임상에서 달성하기 어려운 목표일 수 있어 환자 개인에 맞는 영양 상담이 필요하겠다.
알코올 간질환 환자에서는 부적절한 칼로리 섭취뿐만 아니라 수용성 및 지용성 비타민, 아연, 마그네슘 등과 같은 미량영양소의 결핍도 흔하다.7 알코올 간질환 증상과 관련이 없는 미량 영양소 부족 자체에 의한 증상도 나타날 수 있으므로 부족한 영양소에 대한 보충을 고려해야 한다.
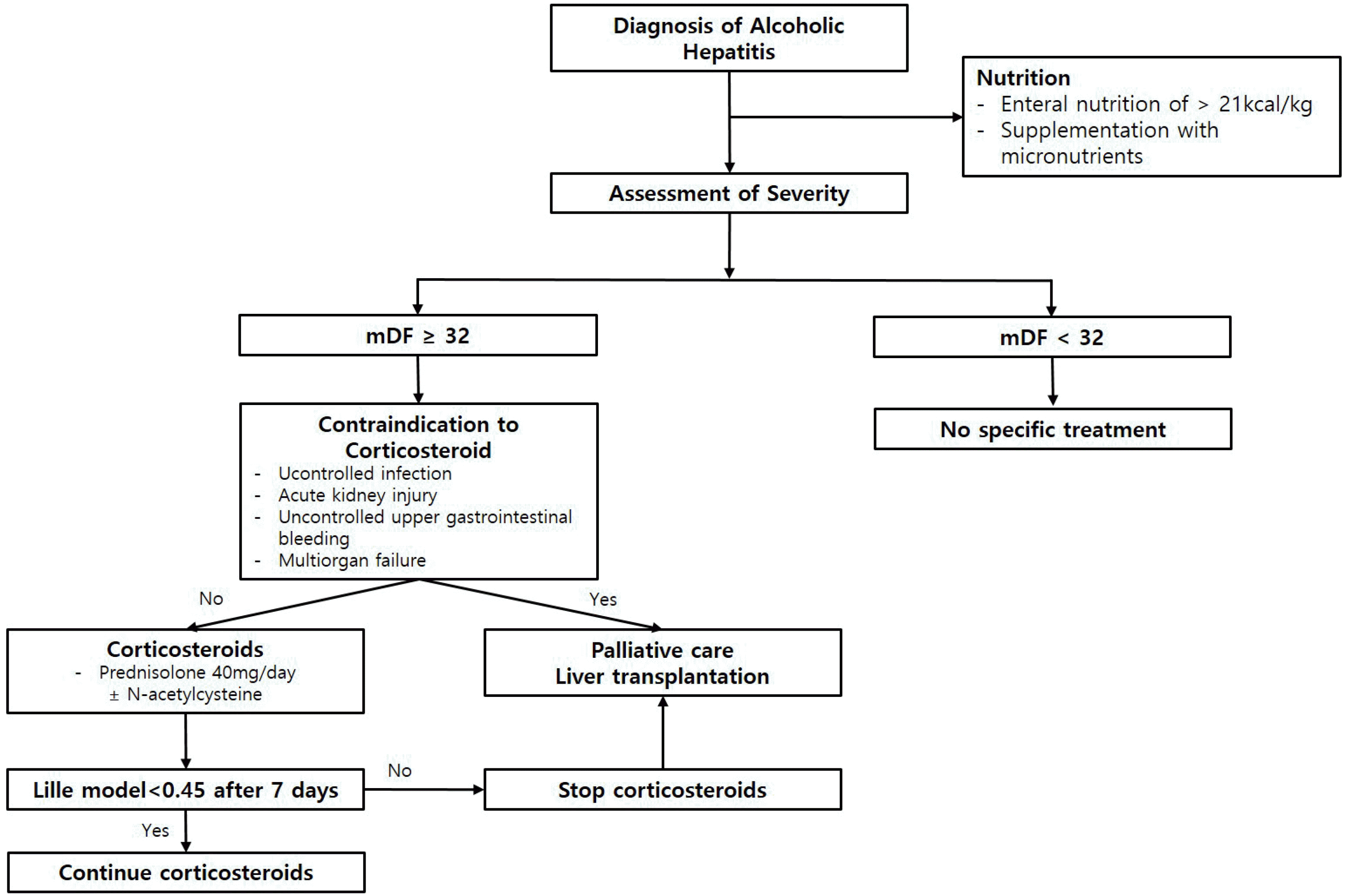
알코올 간질환의 약물 치료는 주로 중증 알코올 간염 환자에서 사용되어왔다. 중증 알코올 간염은 조직학적 혹은 임상적으로 알코올 간염이 진단되고, “빌리루빈+4.6×(환자의 프로트롬빈 시간-기관의 정상 프로트롬빈 시간)”으로 계산되는 Maddrey’s discriminant function (mDF)이 32점 이상일 경우로 정의한다.
스테로이드 치료는 중증 알코올 간염 환자의 치료에서 가장 많이 연구가 된 치료 방법이다. 중증 알코올 간염에서 스테로이드를 사용하기 시작한 것은 1971년부터이며, 지난 50년 동안 많은 무작위 임상 연구가 진행되어 왔다.17-21 하지만 중증 알코올 간염에서 스테로이드를 사용한 무작위 대조 연구들은 스테로이드의 효과에 대해 서로 다른 결과들을 보여왔는데, 이는 무작위 대조 연구들에 포함된 환자수가 적고, 연구 방법 및 환자군의 이질성, 스테로이드 치료 용량 및 기간의 다양성 등에 의한 것으로 보인다.22 Mathurin 등23은 중증 알코올 간염 환자에서 스테로이드 치료를 사용하였던 무작위 대조 연구들을 모아서 메타분석을 하였고, 스테로이드 치료가 28일 생존율을 유의하게 증가시키는 것을 보였다(79.97±2.8% vs. 65.7±3.4%, p=0.0005). 영국에서 진행된 steroids or pen-toxifylline for alcoholic hepatitis (STOPAH) 연구는 지금까지 진행된 무작위 대조 연구 중 가장 많은 환자가 등록된 연구(스테로이드 사용 543명)이며, 이 연구에서는 스테로이드 치료를 받은 중증 알코올 간염 환자는 대조군에 비해 28일 사망률이 낮은 경향성은 보였으나 통계적 유의성은 보이지 못하였고(14% vs. 18%, 교차비 0.72, p=0.06),24 다변량 분석에서 스테로이드 치료는 28일 사망의 유의한 예후 인자였다(교차비 0.61; p=0.02). 하지만, 90일 사망(교차비 1.00; p=0.98) 및 1년 사망(교차비 1.01; p=0.94)에는 통계적 유의성을 보이지 않아 스테로이드 치료가 한 달 정도의 단기 예후는 개선시켜주지만 한 달 이후의 예후 개선 효과는 없음을 보여주었다. STOPAH 연구 이후 발표되는 메타분석 연구들 역시 스테로이드 치료가 중증 알코올 간염 환자의 단기 생존율 개선 효과가 있음을 보였다.25,26
중증 알코올 간염 환자는 입원 당시 12-26%에서 감염을 동반한다.27 하지만 중증 알코올 간염 환자는 명확한 감염이 없이도 백혈구 증가증 및 발열과 같은 전신 염증 증상을 동반하는 경우가 흔해 실제 세균 감염증과 구분하기 어려운 경우가 있다. 입원 시점의 세균 감염은 적절한 항생제 치료가 동반된다면 스테로이드 치료가 사망률을 증가시키지 않는다.28,29따라서 스테로이드 치료를 하는 환자에서는 적극적으로 감염에 대한 검사를 진행하여 감염이 의심될 때는 적절한 항생제를 사용해야한다.17 뚜렷한 감염이 없는 중증 알코올 간염 환자에서 예방적 항생제 사용에 대해서는 아직 정해진 바가 없다. Vergis 등28은 혈중 세균 DNA 수치가 높은 환자에서 스테로이드 사용 후 감염 발생의 위험이 높았다는 연구 결과를발표하여 세균 감염 발생의 고위험군을 선별하는 데 도움이되겠고, 이러한 환자에서 선별적으로 예방적 항생제 사용을 고려해 볼 수가 있겠다. 현재 중증 알코올 간염에서 예방적 항생제의 효과에 대해서는 전향적 임상 연구가 진행 중에 있다(ClinicalTrial.gov: NCT02281929).
중증 알코올 간염에서 스테로이드 치료는 감염 발생의 위험인자이며, 치료 중 혹은 치료 후 감염 발생은 사망률을 증가시킨다.28,30 특히나 감염 발생 위험은 스테로이드에 치료 반응이 없는 환자(Lille 점수 >0.45)에서 증가되므로,28,30 스테로이드 치료에 따른 반응을 예측하고 치료 지속 여부를 판단하는것이 중요하다. Lille 점수는 입원 당시 환자의 나이, 알부민,빌리루빈, 크레아티닌, 프로트롬빈 시간과 치료 7일째 빌리루빈 값으로 계산된다. 프랑스의 Lille에 위치한 병원에서Louvet 등31이 중증 알코올 간염 환자 295명을 대상으로 진행한 연구에서는 Lille 점수 ≥0.45인 환자군은 0.45 미만인 환자군보다 6개월 생존율이 유의하게 낮아(25% vs. 85%, p<0.0001), Lille 점수 0.45 이상일 경우 무반응으로 정의하였다. 중증 알코올 간염 환자를 대상으로 한 메타분석에서는Lille 점수를 0.16 이하, 0.16-0.56, 0.56 이상의 3개 군으로분류하여 각각 완전반응군, 부분반응군, 무반응군으로 분류하였고, 무반응군은 28일 생존율이 53.3%에 불과해 스테로이드치료를 중단할 것을 주장하였다.23 또 다른 연구에서는 Lille점수와 model for end-stage liver disease 점수를 병용할경우 단독으로 사용하는 것보다 단기 예후 예측에 유리하다는 연구도 발표되었다.32 현재 미국 간학회 및 유럽 간학회 가이드라인에서는 모두 Lille 점수 0.45 이상인 경우 스테로이드 치료를 중단할 것을 권장하고 있다(Fig. 1).16,33
실제 임상에서는 프레드니솔론(prednisolone)을 4주간 하루 40 mg 경구 복용하며, 경구 복용이 어려운 경우 메틸프레드니솔론(methylprednisolone)을 4주간 하루 32 mg 정맥주사 치료한다. 스테로이드 치료를 시작하기 전에는 스테로이드치료의 금기증에 대한 검사들이 필요하다. 중증 알코올 간염환자에서 스테로이드 치료의 금기증으로는 1) 조절되지 않는감염, 2) 크레아티닌 2.5 mg/dL 이상의 급성 신손상, 3) 조절되지 않는 위장관 출혈, 4) 다장기 부전, 5) 항바이러스제 치료를 받지 않는 B형간염 혹은 결핵, 췌장염과 같은 동반 질환이있는 경우이다.17,33 이러한 금기증에 해당되는 질환이 있을 경우는 이식을 고려하거나 완화 치료(palliative treatment) 등을 고려하며, 금기증에 해당되는 상태가 해소될 경우 스테로이드 치료를 고려한다.
펜톡시필린은 종양괴사인자(tumor necrosis factor)의 생성을 억제하는 효과가 있어 알코올 간염 치료에 이용되었다. 펜톡시필린을 이용한 이중맹검 무작위 대조 연구에서는 중증 알코올 간염 환자에서 펜톡시필린을 사용한 군에서 사망률이 유의하게 낮았다(p=0.037).34 이 연구에서는 펜톡시필린을 사용한 군에서 간신증후군의 발생 위험이 대조군에 비해 유의하게 낮았고(8.2% vs. 34.6%, p=0.0015), 이러한 신기능 보호 역할이 사망률을 감소에 기여하였을 것으로 보인다. 하지만 이후에 펜톡시필린과 스테로이드 치료의 병합 혹은 스테로이드 치료 이후 구제요법으로의 펜톡시필린 치료는 스테로이드 단독 치료와 비교하여 효과가 없었고,35,36 STOPAH 연구에서도 펜톡시필린 치료는 28일 사망률을 개선시키는 효과가 없었다(교차비 1.07; p=0.69).24 또한, Singh 등의 네트워크 메타분석에서는 펜톡시필린이 생존율 개선 효과가 있었지만 증거수준이 낮았고,25 다른 메타분석에서도 펜톡시필린의 사망률 감소 효과가 없었다.26,37 반면에 국내 연구자에 의한 메타분석에서 펜톡시필린 치료는 신기능 악화 예방 효과가 있음을 보여,37 중증 알코올 간염에서 펜톡시필린의 역할에 대해서는 좀 더 연구가 필요할 것으로 생각된다.
알코올 간염 환자에서 산화 스트레스(oxidative stress)가 중요한 역할을 한다고 알려져 있다.38 중증 알코올 간염 환자에서 NAC, 비타민 E와 같은 항산화제 치료를 이용한 초기 연구에서는 항산화 치료가 중증 알코올 간염 환자의 예후 개선 효과가 없었다.39,40 이후 프랑스에서 진행된 다기관 연구에서 NAC와 스테로이드의 병합 요법은 스테로이드 단독 치료에 비해 3개월과 6개월 생존율에 차이를 보이지 못하였지만(p=0.06, p=0.07), 1개월 생존율의 개선 효과가 있었고(8% vs. 24%, p=0.006), 간신증후군 발생이 유의하게 낮았다(22% vs. 9%, p=0.02).41 또한, 네트워크 메타분석에서도 스테로이드와 NAC의 병합요법은 중등도의 증거 수준으로 1개월 생존율 개선 효과를 보여주었다.25 따라서 NAC는 중증 알코올 간염에서 스테로이드와 병합하여 생존율을 향상시킬 수 있는 치료로 기대가 되지만, 실제 진료에서 사용되기 위해서는 더 많은 연구가 필요하다.
과립구집락자극인자는 골수에서 CD34+ 줄기세포의 생성을 자극하고 혈액 내로 내보내 간 조직의 재생을 돕는다. Spahr 등42은 알코올 간염 환자를 대상으로 한 무작위 대조 연구에서 5일간의 과립구집락자극인자 피하주사가 혈액 내에 CD34+ 줄기세포 및 간세포 성장인자(hepatocyte growth factor)를 증가시킴을 보였다. 최근 인도에서 진행된 스테로이드 무반응 환자를 대상으로 한 무작위 대조 연구에서 과립구집락자극인자 치료는 대조군에 비해 90일 사망률(35.7% vs. 71.4%, p=0.004)과 감염 발생률(28% vs. 71%, p<0.001)을 유의하게 감소시켜주었다.43 스테로이드 무반응 중증 알코올 간염 환자에서 과립구집락자극인자를 이용한 치료는 국내에서도 다기관으로 임상 연구가 진행되고 있다.44 과립구집락자극인자 치료가 예후가 불량한 스테로이드 무반응 환자에서 구제 요법으로서의 가능성이 있음을 보여주었지만 폭넓게 사용되기 위해서는 더 많은 연구가 필요하다.
알코올 간염의 발생 및 진행에서 장내 미생물은 중요한 역할을 한다.45 중증 알코올 간염 환자는 간염이 없는 알코올 간질환 및 간염 소견이 적은 알코올 간염 환자와 비교하여 다른 장내 미생물 특성을 보이고 있었으며, 중증 알코올 간염 환자의 대변을 무균 마우스에 이식하였을 때 알코올 간염이 없는 환자의 대변을 이식한 마우스에 비해 훨씬 심한 알코올 간염 소견을 보였다.46 또 다른 동물 연구에서는 알코올 저항성을 보이는 마우스의 대변을 알코올에 취약한 마우스에 이식한 후 알코올을 섭취시키면 알코올 저항성을 보이는 마우스와 비슷한 장내 미생물 특성을 보이고, 알코올에 의한 간손상 역시 알코올 저항성을 보이는 마우스와 비슷한 정도로 적었다.47 스테로이드 치료의 적응증이 될 수 없는 환자들을 대상으로 인도에서 진행된 대변 미생물무리 이식의 예비 연구에서는, 대변 미생물무리 이식이 대조군에 비해 유의한 생존율 향상 효과가 있었다(p=0.018).48 또한 인도에서 후향적으로 중증 알코올 간염 환자에서 스테로이드, 영양요법, 펜톡시필린, 대변 미생물무리 이식을 비교한 연구에서는 대변 미생물무리 이식이 가장 높은 3개월 생존율을 보여주었다.49 이처럼, 중증 알코올 간염 환자에서 대변 미생물무리 이식은 스테로이드 치료의 대체 요법으로 고려될 수 있지만 아직 잘 고안된 무작위 대조 연구 결과가 없어 일반적으로 사용하기는 아직 어렵다.
Go to : 
금주 치료는 알코올 간질환에서 가장 근간이 되는 치료이며, 개별적인 영양 상담을 통한 충분한 영양 섭취를 통해 예후가 개선될 수 있다. 중증 알코올 간염의 약물 요법으로 스테로이드±N-acetylcysteine 치료는 단기(1개월) 사망률을 개선시키는 효과는 있지만 아직 장기 사망률 개선 효과는 없는 것으로 보인다. 스테로이드 치료가 어려운 환자에서 펜톡시필린치료가 사용되어 왔지만 생존율 개선 효과는 없고, 다만 신기능 보호 역할에 대해서는 좀 더 연구가 필요할 것으로 보인다.스테로이드 치료의 적응증이 안되거나 반응이 없는 환자에서과립구집락자극인자 혹은 대변 미생물무리 이식과 같은 치료가 생존율 개선 가능성을 보이기는 하였지만 아직 연구가 더필요한 실정이다. 최근 수 십 년간 알코올 간질환의 치료에서 스테로이드 외에 큰 발전이 없었지만, 알코올 간질환에 대한 병태생리에 대한 연구와 이를 바탕으로 새로운 치료의 개발 및 임상 연구를 통해 향후 알코올 간질환의 예후가 개선될 것으로 기대해본다.
Go to : 
REFERENCES
1. Jang JY, Kim DJ. 2018; Epidemiology of alcoholic liver disease in Korea. Clin Mol Hepatol. 24:93–99. DOI: 10.3350/cmh.2017.0079. PMID: 29544241. PMCID: PMC6038943.

2. Kim TY, Song DS, Kim HY, et al. 2016; Characteristics and discrepancies in acute-on-chronic liver failure: need for a unified definition. PLoS One. 11:e0146745. DOI: 10.1371/journal.pone.0146745. PMID: 26789409. PMCID: PMC4720429.

3. Galambos JT. 1972; Natural history of alcoholic hepatitis. 3. Histological changes. Gastroenterology. 63:1026–1035. DOI: 10.1016/S0016-5085(19)33180-4. PMID: 4639358.
4. Jepsen P, Ott P, Andersen PK, Sørensen HT, Vilstrup H. 2010; Clinical course of alcoholic liver cirrhosis: a Danish population-based cohort study. Hepatology. 51:1675–1682. DOI: 10.1002/hep.23500. PMID: 20186844.

5. Pessione F, Ramond MJ, Peters L, et al. 2003; Five-year survival predictive factors in patients with excessive alcohol intake and cirrhosis. Effect of alcoholic hepatitis, smoking and abstinence. Liver Int. 23:45–53. DOI: 10.1034/j.1600-0676.2003.01804.x. PMID: 12640727.

6. Stickel F, Hoehn B, Schuppan D, Seitz HK. 2003; Review article: nutritional therapy in alcoholic liver disease. Aliment Pharmacol Ther. 18:357–373. DOI: 10.1046/j.1365-2036.2003.01660.x. PMID: 12940921.
7. Stickel F, Datz C, Hampe J, Bataller R. 2017; Pathophysiology and management of alcoholic liver disease: update 2016. Gut Liver. 11:173–188. DOI: 10.5009/gnl16477. PMID: 28274107. PMCID: PMC5347641.

8. Mendenhall CL, Anderson S, Weesner RE, Goldberg SJ, Crolic KA. 1984; Protein-calorie malnutrition associated with alcoholic hepatitis. Veterans administration cooperative study group on alcoholic hepatitis. Am J Med. 76:211–222. DOI: 10.1016/0002-9343(84)90776-9. PMID: 6421159.
9. Mendenhall C, Bongiovanni G, Goldberg S, et al. 1985; VA Cooperative Study on Alcoholic Hepatitis. III: changes in protein-calorie malnutrition associated with 30 days of hospitalization with and without enteral nutritional therapy. JPEN J Parenter Enteral Nutr. 9:590–596. DOI: 10.1177/0148607185009005590. PMID: 3930765.

10. Mendenhall C, Roselle GA, Gartside P, Moritz T. 1995; Relationship of protein calorie malnutrition to alcoholic liver disease: a reexamination of data from two veterans administration cooperative studies. Alcohol Clin Exp Res. 19:635–641. DOI: 10.1111/j.1530-0277.1995.tb01560.x. PMID: 7573786.

11. Plauth M, Bernal W, Dasarathy S, et al. 2019; ESPEN guideline on clinical nutrition in liver disease. Clin Nutr. 38:485–521. DOI: 10.1016/j.clnu.2018.12.022. PMID: 30712783. PMCID: PMC6686849.

12. Koretz RL. 2014; The evidence for the use of nutritional support in liver disease. Curr Opin Gastroenterol. 30:208–214. DOI: 10.1097/MOG.0000000000000049. PMID: 24468804.

13. Antar R, Wong P, Ghali P. 2012; A meta-analysis of nutritional supplementation for management of hospitalized alcoholic hepatitis. Can J Gastroenterol. 26:463–467. DOI: 10.1155/2012/945707. PMID: 22803023. PMCID: PMC3395449.

14. Fialla AD, Israelsen M, Hamberg O, Krag A, Gluud LL. 2015; Nutritional therapy in cirrhosis or alcoholic hepatitis: a systematic review and meta-analysis. Liver Int. 35:2072–2078. DOI: 10.1111/liv.12798. PMID: 25645300.

15. Moreno C, Deltenre P, Senterre C, et al. 2016; Intensive enteral nutrition is ineffective for patients with severe alcoholic hepatitis treated with corticosteroids. Gastroenterology. 150:903–910.e8. DOI: 10.1053/j.gastro.2015.12.038. PMID: 26764182.

16. European Association for the Study of the Liver. 2018; EASL clinical practice guidelines: management of alcohol-related liver disease. J Hepatol. 69:154–181. DOI: 10.1016/j.jhep.2018.03.018. PMID: 29628280.
17. Singal AK, Bataller R, Ahn J, Kamath PS, Shah VH. 2018; ACG clinical guideline: alcoholic liver disease. Am J Gastroenterol. 113:175–194. DOI: 10.1038/ajg.2017.469. PMID: 29336434. PMCID: PMC6524956.

18. Porter HP, Simon FR, Pope CE 2nd, Volwiler W, Fenster LF. 1971; Corticosteroid therapy in severe alcoholic hepatitis. A doubleblind drug trial. N Engl J Med. 284:1350–1355. DOI: 10.1056/NEJM197106172842404. PMID: 4930603.
19. Campra JL, Hamlin EM Jr, Kirshbaum RJ, Olivier M, Redeker AG, Reynolds TB. 1973; Prednisone therapy of acute alcoholic hepatitis. Report of a controlled trial. Ann Intern Med. 79:625–631. DOI: 10.7326/0003-4819-79-5-625. PMID: 4751740.
20. Ramond MJ, Poynard T, Rueff B, et al. 1992; A randomized trial of prednisolone in patients with severe alcoholic hepatitis. N Engl J Med. 326:507–512. DOI: 10.1056/NEJM199202203260802. PMID: 1531090.

21. Mathurin P, Duchatelle V, Ramond MJ, et al. 1996; Survival and prognostic factors in patients with severe alcoholic hepatitis treated with prednisolone. Gastroenterology. 110:1847–1853. DOI: 10.1053/gast.1996.v110.pm8964410. PMID: 8964410.

22. Lieber SR, Rice JP, Lucey MR, Bataller R. 2018; Controversies in clinical trials for alcoholic hepatitis. J Hepatol. 68:586–592. DOI: 10.1016/j.jhep.2017.09.013. PMID: 28966126. PMCID: PMC6709528.

23. Mathurin P, O'Grady J, Carithers RL, et al. 2011; Corticosteroids improve short-term survival in patients with severe alcoholic hepatitis:meta-analysis of individual patient data. Gut. 60:255–260. DOI: 10.1136/gut.2010.224097. PMID: 20940288.
24. Thursz MR, Richardson P, Allison M, et al. 2015; Prednisolone or pentoxifylline for alcoholic hepatitis. N Engl J Med. 372:1619–1628. DOI: 10.1056/NEJMoa1412278. PMID: 25901427.

25. Singh S, Murad MH, Chandar AK, et al. 2015; Comparative effectiveness of pharmacological interventions for severe alcoholic hepatitis:a systematic review and network meta-analysis. Gastroenterology. 149:958–970.e12. DOI: 10.1053/j.gastro.2015.06.006. PMID: 26091937.
26. Louvet A, Thursz MR, Kim DJ, et al. 2018; Corticosteroids reduce risk of death within 28 days for patients with severe alcoholic hepatitis, compared with pentoxifylline or placebo-a meta-analysis of individual data from controlled trials. Gastroenterology. 155:458–468.e8. DOI: 10.1053/j.gastro.2018.05.011. PMID: 29738698.

27. Singal AK, Shah VH, Kamath PS. 2017; Infection in severe alcoholic hepatitis: yet another piece in the puzzle. Gastroenterology. 152:938–940. DOI: 10.1053/j.gastro.2017.02.030. PMID: 28259797.
28. Vergis N, Atkinson SR, Knapp S, et al. 2017; In patients with severe alcoholic hepatitis, prednisolone increases susceptibility to infection and infection-related mortality, and is associated with high circulating levels of bacterial dna. Gastroenterology. 152:1068–1077.e4. DOI: 10.1053/j.gastro.2016.12.019. PMID: 28043903. PMCID: PMC6381387.
29. Michelena J, Altamirano J, Abraldes JG, et al. 2015; Systemic inflammatory response and serum lipopolysaccharide levels predict multiple organ failure and death in alcoholic hepatitis. Hepatology. 62:762–772. DOI: 10.1002/hep.27779. PMID: 25761863. PMCID: PMC4549175.

30. Louvet A, Wartel F, Castel H, et al. 2009; Infection in patients with severe alcoholic hepatitis treated with steroids: early response to therapy is the key factor. Gastroenterology. 137:541–548. DOI: 10.1053/j.gastro.2009.04.062. PMID: 19445945.

31. Louvet A, Naveau S, Abdelnour M, et al. 2007; The Lille model: a new tool for therapeutic strategy in patients with severe alcoholic hepatitis treated with steroids. Hepatology. 45:1348–1354. DOI: 10.1002/hep.21607. PMID: 17518367.

32. Louvet A, Labreuche J, Artru F, et al. 2015; Combining data from liver disease scoring systems better predicts outcomes of patients with alcoholic hepatitis. Gastroenterology. 149:398–406.e8. quiz e16–e17. DOI: 10.1053/j.gastro.2015.04.044. PMID: 25935634.

33. Crabb DW, Im GY, Szabo G, Mellinger JL, Lucey MR. 2020; Diagnosis and treatment of alcohol-associated liver diseases: 2019 practice guidance from the American association for the study of liver diseases. Hepatology. 71:306–333. DOI: 10.1002/hep.30866. PMID: 31314133.

34. Akriviadis E, Botla R, Briggs W, Han S, Reynolds T, Shakil O. 2000; Pentoxifylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind, placebo-controlled trial. Gastroenterology. 119:1637–1648. DOI: 10.1053/gast.2000.20189. PMID: 11113085.

35. Louvet A, Diaz E, Dharancy S, et al. 2008; Early switch to pentoxifylline in patients with severe alcoholic hepatitis is inefficient in non-responders to corticosteroids. J Hepatol. 48:465–470. DOI: 10.1016/j.jhep.2007.10.010. PMID: 18164508.

36. Mathurin P, Louvet A, Duhamel A, et al. 2013; Prednisolone with vs without pentoxifylline and survival of patients with severe alcoholic hepatitis: a randomized clinical trial. JAMA. 310:1033–1041. DOI: 10.1001/jama.2013.276300. PMID: 24026598.
37. Lee YS, Kim HJ, Kim JH, et al. 2017; Treatment of severe alcoholic hepatitis with corticosteroid, pentoxifylline, or dual therapy: a systematic review and meta-analysis. J Clin Gastroenterol. 51:364–377. DOI: 10.1097/MCG.0000000000000674. PMID: 27636406.
38. Loguercio C, Federico A. 2003; Oxidative stress in viral and alcoholic hepatitis. Free Radic Biol Med. 34:1–10. DOI: 10.1016/S0891-5849(02)01167-X. PMID: 12498974.

39. Mezey E, Potter JJ, Rennie-Tankersley L, Caballeria J, Pares A. 2004; A randomized placebo controlled trial of vitamin E for alcoholic hepatitis. J Hepatol. 40:40–46. DOI: 10.1016/S0168-8278(03)00476-8. PMID: 14672612.

40. Stewart S, Prince M, Bassendine M, et al. 2007; A randomized trial of antioxidant therapy alone or with corticosteroids in acute alcoholic hepatitis. J Hepatol. 47:277–283. DOI: 10.1016/j.jhep.2007.03.027. PMID: 17532088.

41. Nguyen-Khac E, Thevenot T, Piquet MA, et al. 2011; Glucocorticoids plus N-acetylcysteine in severe alcoholic hepatitis. N Engl J Med. 365:1781–1789. DOI: 10.1056/NEJMoa1101214. PMID: 22070475.
42. Spahr L, Lambert JF, Rubbia-Brandt L, et al. 2008; Granulocyte-colony stimulating factor induces proliferation of hepatic progenitors in alcoholic steatohepatitis: a randomized trial. Hepatology. 48:221–229. DOI: 10.1002/hep.22317. PMID: 18537187.

43. Shasthry SM, Sharma MK, Shasthry V, Pande A, Sarin SK. 2019; Efficacy of granulocyte colony-stimulating factor in the management of steroid-nonresponsive severe alcoholic hepatitis: a double-blind randomized controlled trial. Hepatology. 70:802–811. DOI: 10.1002/hep.30516. PMID: 30664267.

44. Cho Y, Park YS, Kim HY, Kim W, Lee HJ, Kim DJ. 2018; Efficacy of granulocyte colony stimulating factor in patients with severe alcoholic hepatitis with partial or null response to steroid (GRACIAH trial):study protocol for a randomized controlled trial. Trials. 19:696. DOI: 10.1186/s13063-018-3092-7. PMID: 30577864. PMCID: PMC6303849.

45. Bajaj JS. 2019; Alcohol, liver disease and the gut microbiota. Nat Rev Gastroenterol Hepatol. 16:235–246. DOI: 10.1038/s41575-018-0099-1. PMID: 30643227.

46. Llopis M, Cassard AM, Wrzosek L, et al. 2016; Intestinal microbiota contributes to individual susceptibility to alcoholic liver disease. Gut. 65:830–839. DOI: 10.1136/gutjnl-2015-310585. PMID: 26642859.

47. Ferrere G, Wrzosek L, Cailleux F, et al. 2017; Fecal microbiota manipulation prevents dysbiosis and alcohol-induced liver injury in mice. J Hepatol. 66:806–815. DOI: 10.1016/j.jhep.2016.11.008. PMID: 27890791.

48. Philips CA, Pande A, Shasthry SM, et al. 2017; Healthy donor fecal microbiota transplantation in steroid-ineligible severe alcoholic hepatitis: a pilot study. Clin Gastroenterol Hepatol. 15:600–602. DOI: 10.1016/j.cgh.2016.10.029. PMID: 27816755.

49. Philips CA, Phadke N, Ganesan K, Ranade S, Augustine P. 2018; Corticosteroids, nutrition, pentoxifylline, or fecal microbiota transplantation for severe alcoholic hepatitis. Indian J Gastroenterol. 37:215–225. DOI: 10.1007/s12664-018-0859-4. PMID: 29931479.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download