76세 남자가 18년 전 만성 B형간염을 진단받고 정기적으로 상복부 초음파를 시행받던 중 간 우엽에 종괴가 발견되어 전원되었다. 본원에서 시행한 간 CT에서 간의 5, 6, 7번 분획에 9 cm 크기의 동맥기 조영 증가, 문맥기 및 지연기 조영 감소를 보이는 전형적인 간세포암종이 확인되었다(
Fig. 1). 환자는 B형간염 이외에 다른 과거력은 없었고, 하루 소주 1-2병을 약 30년간 섭취한 음주력이 있었다. 입원 당시 활력징후는 혈압 110/70 mmHg, 맥박 53회/분, 호흡수 19회/분, 체온 36.6℃였다. 신체검진에서 공막 황달은 없었고 간과 비장은 만져지지 않았으며, 우상복부 압통이나 반동압통도 없었다. 혈액 검사에서 백혈구 4,540/mm
3 (중성구 62%), 혈색소 15.7 g/dL, 혈소판 156,000/mm
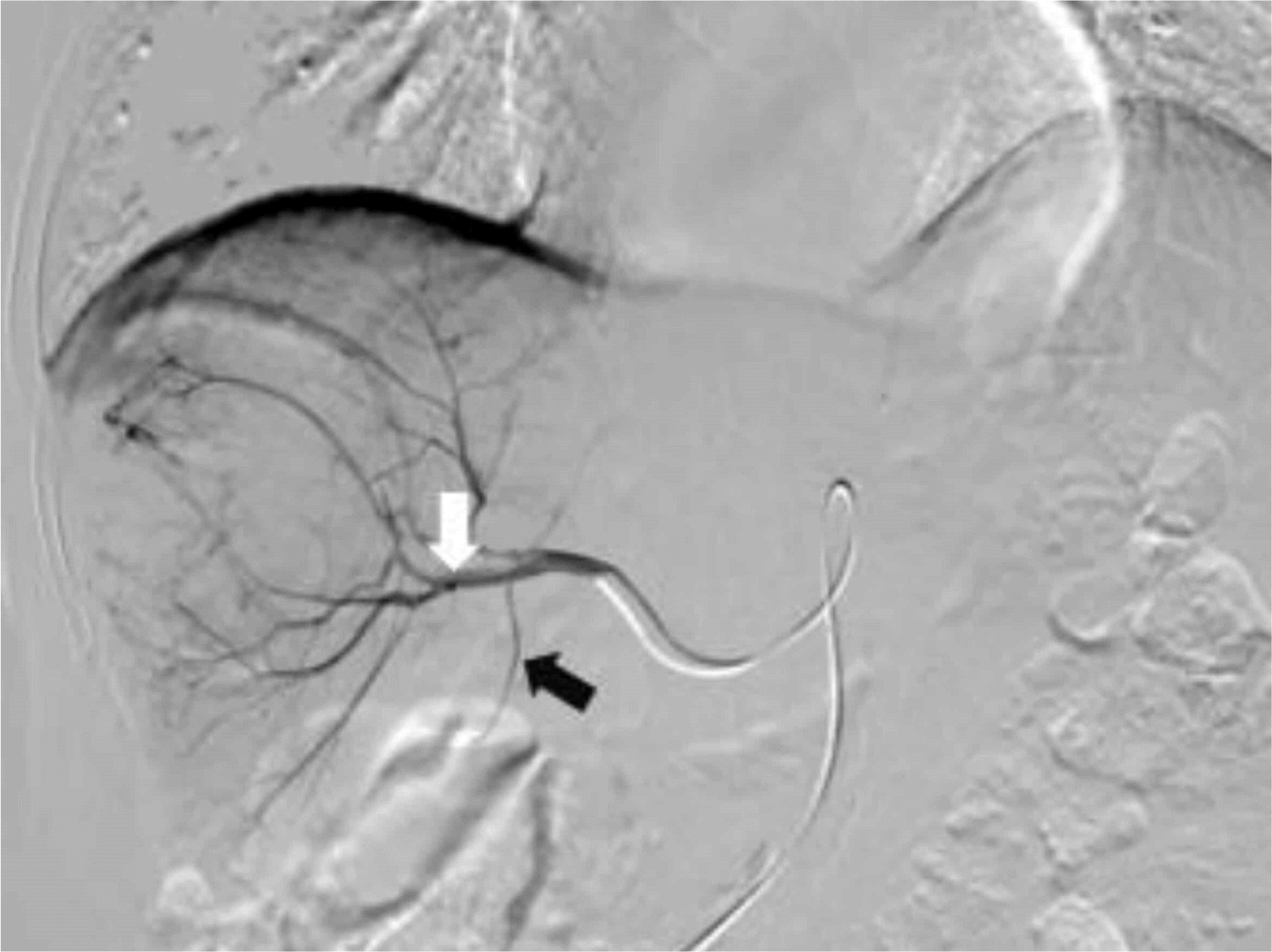
3, 프로트롬빈 시간 13.4초(INR 1.17), 요소질소 11.2 mg/dL, 크레아티닌 1.09 mg/dL, 총 단백 7.6 g/dL, 알부민 4.5 g/dL, 나트륨 137 mEq/L, 칼륨 4.3 mEq/L, 직접 빌리루빈은 0.36 mg/dL로 모두 정상이었으나 AST 73 U/L, ALT 50 U/L, 총 빌리루빈 1.33 mg/dL, AFP 11,364 ng/mL, protein induced by vitamin K absence or antagonist-ll 3,655 mAU/mL는 증가되어 있었다. Child-Turcotte-Pugh 점수는 5점으로 A등급이었고, Barcelona Clinic Liver Cancer 병기는 A, modified International Union Against Cancer 병기는 II였다. 환자 및 보호자와 치료에 대하여 상의하였으나 수술적 치료를 원하지 않아 경동맥화학색전술을 시행하였다. 우측 간혈관조영술을 통하여 우측 간동맥에서 분지된 영양동맥을 초선택하여 독소루비신 50 mg, 리피오돌 12 mL, 젤라틴 색전 물질을 이용하여 경동맥화학색전술을 시행하였다(
Fig. 2). 시술 후 1일째 환자는 우상복부 둔통을 호소하였고, 당시 체온은 36.5℃였다. 혈액 검사에서는 백혈구 11,630/mm
3 (호중구93%)로 증가하였고, 총 빌리루빈 1.27 mg/dL, 직접 빌리루빈 0.32 mg/dL로 입원 당시와 비슷하였으나 AST 231 U/L, ALT 169 U/L 그리고 CRP는 1.6 mg/dL로 증가되어 있었다. 시술 후 5일째 환자의 우상복부 둔통이 지속되고 신체검진에서 Murphy 징후는 없었으나 새롭게 압통이 있었다. 체온은 36.7℃였고, 혈액 검사에서 백혈구는 7,830/mm
3 (호중구 86%), AST 45 U/L, ALT 44 U/L로 떨어지며 호전 추세를 보였지만 총 빌리루빈 2.79 mg/dL, 직접 빌리루빈 1.63 mg/dL, CRP는 15 mg/dL로 증가 추세에 있었다. 또한 복부 방사선에서 우상복부 장마비가 확인되었다(
Fig. 3). 환자는 열은 없었으나 보존적인 치료를 시행하여도 장마비가 지속되어, 시술 후 7일째 복부 CT를 시행하였다. 복부 CT에서 담낭 기저부가 천공되어 담즙이 우측 주름 창자 고랑과 골반강 내에 있는 것이 확인되었다(
Fig. 4). 간담췌외과와 상의한 뒤, 정맥용 항생제를 투여하고 경피경간담낭배액술(percutaneous transhepatic gallbladder drainage)을 시행하여 간기능과 환자의 전신 상태가 회복된 다음에 담낭 절제술을 시행하기로 하였다. 내과적 치료 이후 우상복부 둔통과 장마비는 호전을 보였고, CRP 수치도 안정화되었다. 또한 이후 시행한 복부 CT에서도 담낭 허탈과 복강내 담즙 소실이 확인되었으며, 새롭게 경동맥화학색전술 이후 간세포암종의 크기가 줄어든 것이 확인되었다. Indocyanine Green-R15 검사 결과 8.9%로 간기능이 양호하고, MRI에서 간문맥 침범이나 림프절 비대, 전이 소견은 없어 환자 및 보호자와 치료 계획에 대하여 다시 상의한 후에 담낭 절제술과 우측 반간절제술(right hemihepatectomy)을 같이 시행하기로 하였다. 한 달 뒤 환자는 담낭 절제술과 우측반간 절제술을 같이 시행받았다. 수술 당시 병리 결과에서는 10.5×7.5×6.0 cm 크기의 팽창 결절형 간세포암종으로 확인되었고, 분화도는 Edmondson-Steiner 등급 IV로 분화도가 나빴다. 종괴 괴사 범위는 80%였고 피막 침습, 문맥 침습, 미세혈관 침습도 있었다. 간세포암종 주변 간 조직은 만성 B형간염, 2기 섬유화를 보였다. 환자는 수술 후 1개월 뒤 다발성 폐 전이가 확인되어 sorafenib 치료를 하였으나 5개월 뒤 간세포암종 재발과 다발성 폐 전이 악화가 확인되어 현재 외래에서 추적 관찰 및 대증 치료 중에 있다.
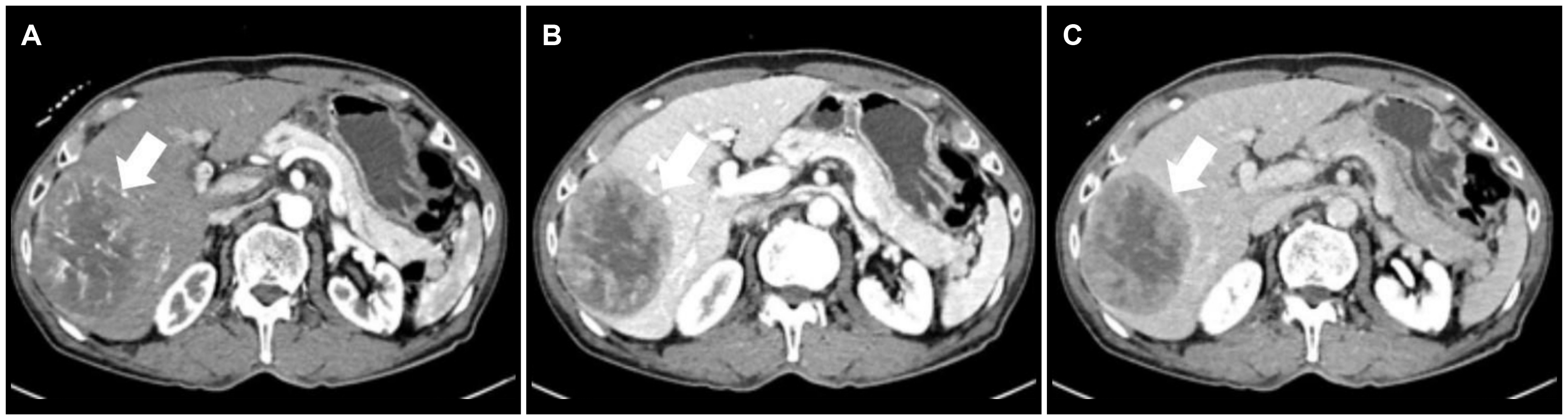 | Fig. 1Triple phase computed tomography of the liver at diagnosis. (A) A 9 cm sized heterogeneous enhancing mass of the right hepatic lobe at the arterial phase (white arrow). (B) The heterogeneous enhancing mass is washed out, showing low density at the portal and (C) delayed phase (white arrows). 
|
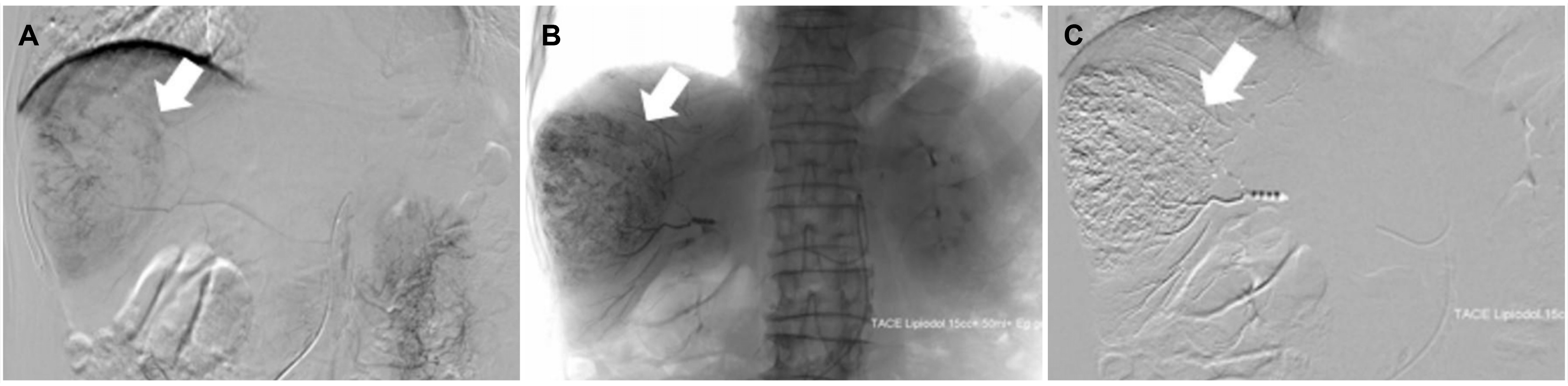 | Fig. 2Transarterial chemoembolization (TACE) of the hepatocellular carcinoma. Right hepatic angiography shows (A) huge hypervascular mass in the right hepatic lobe (white arrow), (B) super selection of supplying branches of the right hepatic artery by microcatheter (white arrow), and (C) complete embolization (white arrow). 
|
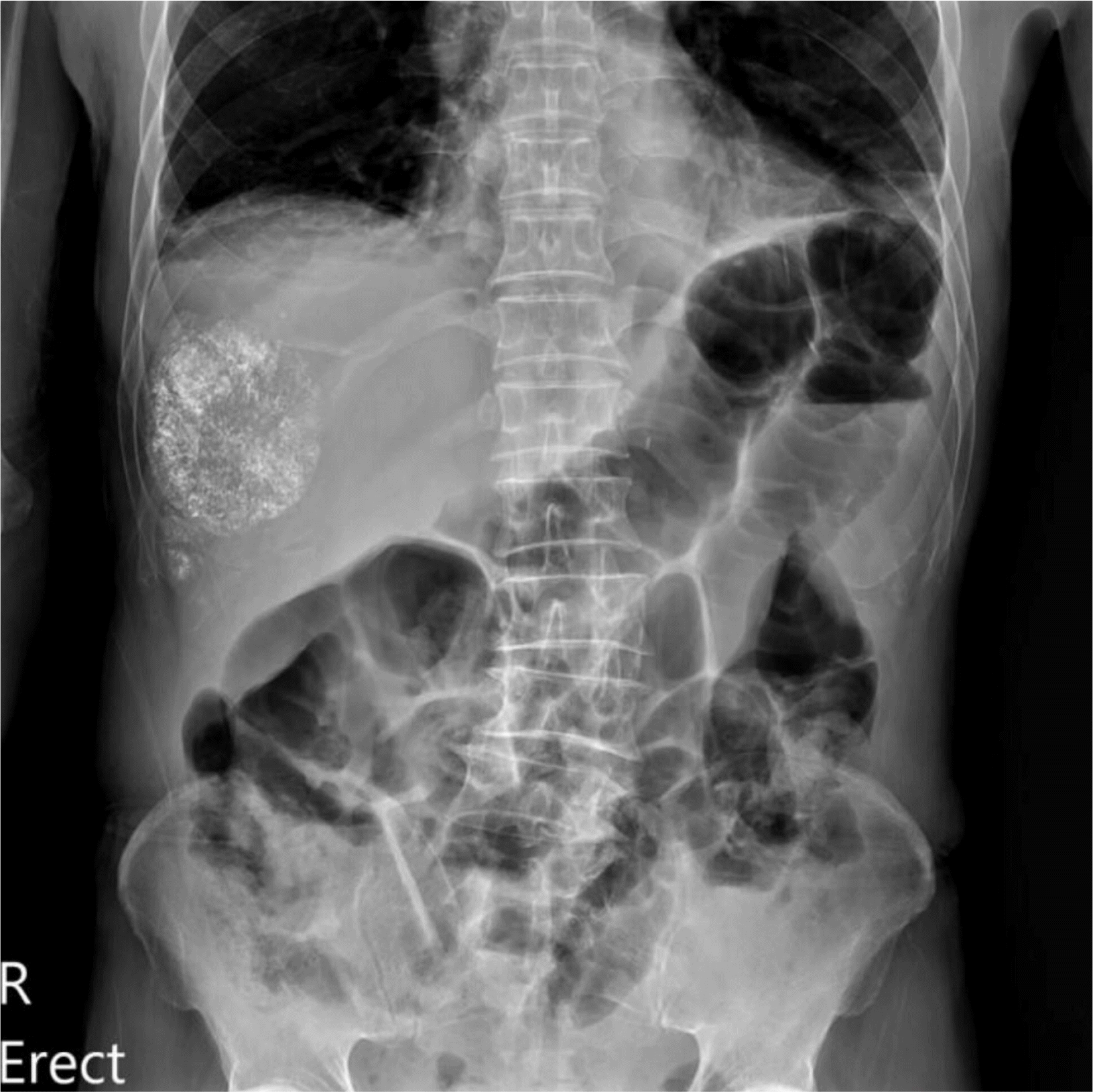 | Fig. 3X-ray of the abdomen at 5 days after the transarterial chemoembolization. X-ray findings show the generalized distension of small and large intestine. 
|
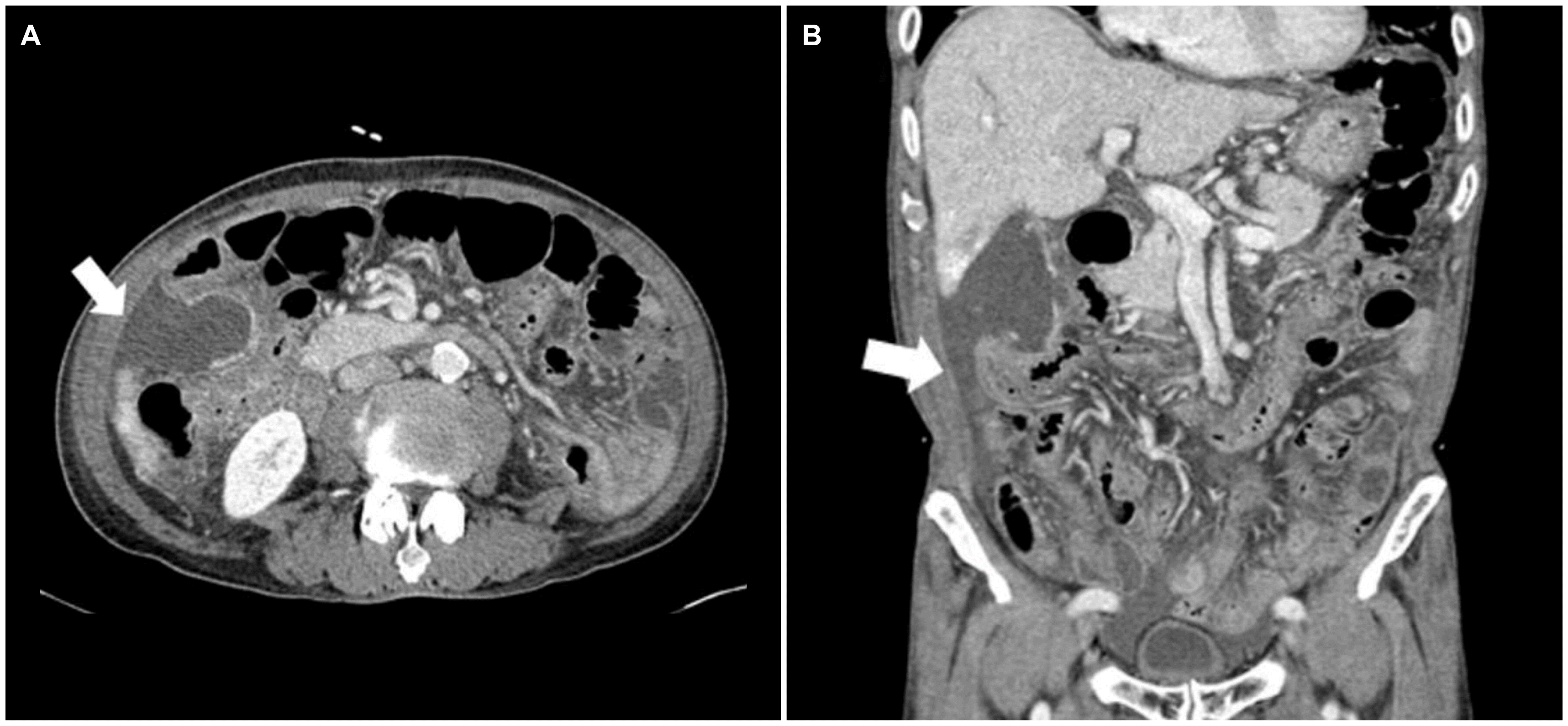 | Fig. 4Contrast-enhanced computed tomography (CT) at 7 days after the transarterial chemoembolization. (A) Axial and (B) coronal CT images show the perforation of the gallbladder with bile (white arrows) in the right paracolic gutter and pelvic cavity. 
|






 PDF
PDF Citation
Citation Print
Print





 XML Download
XML Download