Abstract
Dumping syndrome has long been associated with gastric surgery. The authors experienced an adult patient presenting with dumping syndrome after meningitis without any previous surgical procedures on the stomach and small bowel. Dysfunction of the autonomic nervous system after infective meningitis may originate from postinfectious sequelae or an immunologic mechanism. A comprehensive study and proper management of autonomic symptoms of patients with a central nervous system infection are needed.
Go to : 
덤핑 증후군은 식후 빠른 위배출로 인하여 악화되는 위장관 및 혈관 운동 증상의 집합이다.1 덤핑 증후군은 조기 혹은 후기 덤핑 증후군으로 분류되는데, 조기 덤핑 증후군은 식후 30분 이내 발생하며 장의 확장, 위장관 호르몬의 과분비, 자율신경 장애로 인하여 생긴다.2 후기 덤핑 증후군은 식후 1-3시간에 반응성 저혈당으로 인하여 발생한다.2 대부분의 덤핑 증후군은 조기 덤핑 증후군에 해당하며, 전신 증상으로 심계항진, 빈맥, 피로, 식후 누우려는 욕구, 안면 홍조 혹은 창백, 발한, 어지럼증, 저혈압, 실신, 두통 등이 있고, 복부 증상으로는 조기 충만감, 상복부 통증, 설사, 구역감, 복명 등이 있다.1 덤핑 증후군의 진단은 임상증상이 중요하며, Sigstad’s scoring system을 흔히 이용하고, 총점이 7점 이상일 때 진단할 수 있다(Table 1).3-5 성인에서 덤핑 증후군의 가장 흔한 원인은 위우회술로 약 75%에 달한다.6 드물게 수술과 무관하게 덤핑 증후군이 발생하기도 하는데, 최근에 발생한 당뇨와 연관되거나 특발성의 증례들이 보고된 바 있다.1
Sigstad’s Scoring System is Used to Diagnose Dumping Syndrome
Go to : 
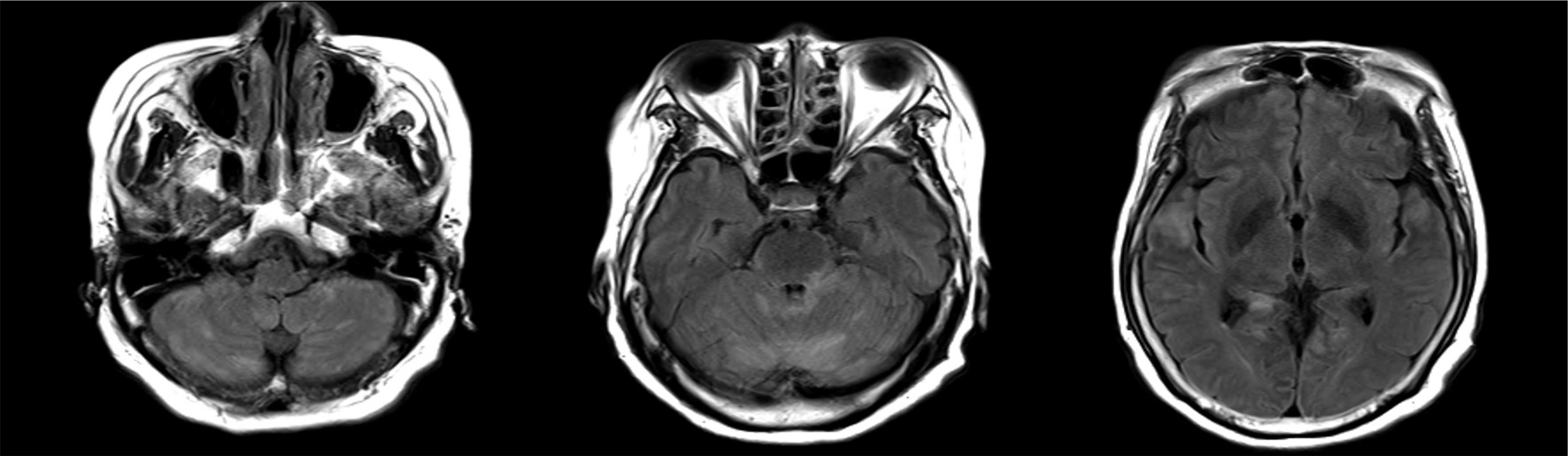
70세 여자가 3일 전부터 발생한 의식 저하로 본원으로 전원되었다. 약 일주일 전부터 식욕 저하를 호소하며 식사를 거의 하지 못하였다. 당뇨로 약 10년 전부터 약을 복용 중이었으며, 응급실 내원 당시 혈당은 229 mg/dL로 측정되었고, 당화혈색소 값은 8.7%였다. 활력징후는 안정적이었으나 의식은 혼미 상태였으며, 경부 경직 소견을 보였다. 내원 당일 실시한 뇌척수액 검사 결과 압력 150 mmH2O, 백혈구수 280/mm3 (단핵구 95%), 적혈구수 65/mm3, 단백질 1066.2 mg/dL, 당 146 mg/dL였고, 혈청의 혈당은 218 mg/dL였다. 결핵성 뇌수막염 및 바이러스 뇌염 의심하에 경험적으로 항결핵제 및 아시클로버를 사용하였다. 뇌 자기공명영상의 액체감쇠역전회복영상(fluid-attenuated inversion recovery image)에서 소뇌와 뇌줄기, 섬이랑을 포함하는 양측 대뇌의 피질 및 피질하 부위에 다발성의 고신호 강도가 관찰되었다(Fig. 1). 조영 증강 영상에서 뇌줄기와 양측 대뇌 주위로 전반적인 경질막 비후와 조영 증강 소견을 나타내 수막뇌염에 합당하였다. 이후 나온 검사 결과에서 아데노신탈아미노화효소는 10.6 IU/L였으며, 결핵균 핵산 증폭 검사 및 배양 검사, 각종 세균 및 곰팡이 관련 검사 결과는 모두 음성 소견이었다. 수두 대상포진바이러스 핵산 증폭 검사는 양성 소견이었고, 단순포진바이러스 1형과 2형은 음성 소견이었다. 그밖에 한탄바이러스, 렙토스피라, 일본뇌염, 진드기매개뇌염, 쯔쯔가무시에 대한 항체 검사도 음성 소견이었다. 아시클로버 2주간 정맥주사 및 항결핵제 치료를 지속하였으며, 입원 3일째부터 의식이기면 상태로 호전되었고, 약 10일째부터는 의식이 명료해져의사소통이 가능하였다. 입원 8일째 재시행한 뇌척수액 검사결과, 백혈구수 170/mm3 (단핵구 90%), 단백질 223.9 mg/dL,당 200 mg/dL, 혈청의 혈당은 244 mg/dL로 호전되었다. 지속되는 구역 증상 및 의식 저하로 금식을 지속하다 입원 2주째 아침부터 경구 식이를 시도하였다. 삼킴 장애는 없었으며,미음을 100 g 가량 섭취하고 30분 정도 경과 후 가슴이 답답하고 안절부절 하였으며, 앉아 있으면 불편하고 누우면 괜찮아진다고 하였다. 점심은 금식한 후 저녁에 다시 50 g 가량의미음을 섭취하였고, 특이 증상은 없었으나 다음날 오전 150 g의 미음을 섭취하고 20여 분 뒤 혈압이 80/62로 떨어져 누운자세, 수액 공급 등의 보존적 치료에 다시 정상화되었다. Sigstad’s scoring system의 항목 중 쇼크, 누우려는 경향,안절부절 못하는 모습, 어지럼증, 복부 팽만감 및 구역 증세를충족하였으며, 증상이 있을 당시 창백해지는 모습을 보여, 총점 19점으로 임상적으로 덤핑 증후군을 의심할 수 있었다. 이후 다시 금식하였으며, 덤핑 증후군 의심하에 3일 뒤부터 죽을 소량으로 나누어 섭취하며 식사 도중이나 직후에 물을 마시지 않게 하였다. 이후 전과 같은 혈압 저하는 없었으나 식후에 불안해하며, 가슴 답답함과 호흡곤란을 호소하는 증상이몇 차례 반복되었다. 심장 질환을 감별하기 위하여 경흉부 심초음파, 심근 단일양자방출전산화단층촬영, 24시간 활동 심전도 검사를 시행하였으나 특이 소견은 발견되지 않았고, 위 내시경에서도 위염 소견만 발견되었다. 수막뇌염이 발생하며 자율신경계 기능 이상으로 인한 증상일 가능성이 있어 자율신경계 기능 검사를 실시하였다. 교감 피부 반응 검사 결과 양측 손바닥, 발바닥에서 전기 자극에 대한 땀분비 반응을 전혀 보이지 않았고, 발살바 조작에 대한 심전도의 R-R 간격의 최소치 대비 최대치의 비율이 1.17로 비정상 소견을 보였다. 전신 쇠약을 호소하여 자율신경계 기능 검사의 다른 항목들에 대해서는 검사를 시행하지 못하였다. 식후에 발생하는 증상은 시일이 경과함에 따라 서서히 호전되었고, 약 3개월 뒤부터는 정상적인 식사에도 전과 같은 증상이 반복되지 않았다.
Go to : 
최근에 발생한 당뇨에서 Waller 변성과 조기 미주신경 손상에 의하여 덤핑 증후군이 발생할 수 있다고 하나 우리 환자는 10년 이상 전부터 당뇨를 진단받아 약을 복용 중이었다.1 또한 당뇨 환자에서 합병증으로 흔히 동반되는 위마비와 덤핑 증후군을 감별하는 것이 중요한데, 위마비의 경우 구토가 주요 증상이며 본 환자는 입원한 처음 며칠 동안 구토 증세가 있었으나 뇌수막염에 동반된 증상일 가능성이 높을 것으로 보이며, 덤핑 증후군의 증상을 보인 약 2주 뒤에는 구역감은 남아 있었으나 유의한 구토 증세는 보이지 않았고, 식후 30분이내에 반복적인 전신 증상과 한 차례의 유의한 혈압 저하를보였다.7 그러나 신티그래피를 통하여 급격한 위배출을 확인하지 못하였으며, 증상만으로 당뇨병성 위마비를 온전히 배제할 수 없어 본 증례의 제한점으로 들 수 있다. 덤핑 증후군의치료에 있어 우선적으로 고려되는 것은 식이 조절로, 소량씩자주 먹는 것을 권고하고 있다. 또한, 식사 후 1시간 이상 물등의 액체를 먹지 않는 것을 추천하며, 식후에 눕는 것이 좋고, 탄수화물 함량이 적은 음식이 권고되고 있다.1 본 환자 또한 소량씩 자주 먹으며, 식후 눕는 자세를 취하는 것만으로혈압 저하는 더 이상 발생하지 않았다. 음식을 섭취하면 소화를 위하여 내장성 정맥 혈액의 저류(splanchnic venous pooling)가 발생하는데, 이에 대한 정상적인 교감신경계의 보상 반응으로 맥박이 빨라지고, 혈관 수축이 일어나며, 혈압을비교적 일정하게 유지한다.8 본 환자에서는 수막뇌염과 연관되어 발생한 자율신경 장애로 식후 혈압 저하가 발생한 것으로 사료된다. 중추신경계 감염과 연관된 자율신경 장애에 대한 보고는 드물게 소아 환자에서 보고된 바 있다.9-11 그중 한증례는 본 증례와 유사하게 원인 미상의 뇌수막염 증상 발현2주 후 무한증, 변비, 배뇨 장애 및 체위 변화에 따른 전실신(presyncope) 등의 자율신경계 증상이 발생하였으며, 특별한치료없이 3개월여 만에 증상이 호전되었다.9 이 밖에도 헤르페스 수막뇌염 이후 반복되는 기립성 저혈압으로 발현된 자율신경계 장애가 보고된 바 있다.12 가장 흔하게는 진드기매개뇌염에서 보고되었고, 정상 대조군과 심박 변이도 비교를 통하 여 자율신경계 기능 저하를 밝힐 수 있었다.13 최근에는 장액성 수막염 성인 환자 64명을 대상으로 심박 변이도 분석을 통하여, 정상 대조군과 비교하여 장액성 수막염 환자의 유의한 교감신경 및 부교감신경계 기능 저하를 보고하였다.14 중추신경계 감염 이후 자율신경계 이상이 발생하는 원인에 대해서는 뚜렷하게 알려지지 않았으나 솔기핵, 청반을 포함하는 연수, 교뇌의 뇌줄기 혹은 대뇌의 섬이랑, 앞대상이랑, 편도핵 등의 자율신경계 기능에 밀접하게 연관되는 부위의 감염으로 인하거나15 감염 이후 약 2주까지 지연된 증상 발현은 감염 이후 후기 면역 반응으로 인하였을 가능성 또한 시사하고 있다. 본 증례는 중추신경계 감염과 관련된 자율신경계 기능 저하, 특히 이전에 보고된 바 없는 덤핑 증후군으로 발현된 증례로서 더욱 의미 있을 것이다. 중추신경계 감염 환자를 대함에 있어 자율신경계 기능 저하의 가능성을 염두에 두고 관련 증상에 더욱 관심을 기울이며, 교감신경 피부 반응 검사, 심박 변이도를 포함하는 자율신경계 기능 검사를 시행하는 것이 환자의 적절한 평가 및 치료에 도움이 되리라 사료된다.
Go to : 
REFERENCES
1. Berg P, McCallum R. 2016; Dumping syndrome: a review of the current concepts of pathophysiology, diagnosis, and treatment. Dig Dis Sci. 61:11–18. DOI: 10.1007/s10620-015-3839-x. PMID: 26396002.

2. Tack J, Arts J, Caenepeel P, De Wulf D, Bisschops R. 2009; Pathophysiology, diagnosis and management of postoperative dumping syndrome. Nat Rev Gastroenterol Hepatol. 6:583–590. DOI: 10.1038/nrgastro.2009.148. PMID: 19724252.

3. Sigstad H. 1970; A clinical diagnostic index in the diagnosis of the dumping syndrome. Changes in plasma volume and blood sugar after a test meal. Acta Med Scand. 188:479–486. DOI: 10.1111/j.0954-6820.1970.tb08072.x. PMID: 5507449.
4. Banerjee A, Ding Y, Mikami DJ, Needleman BJ. 2013; The role of dumping syndrome in weight loss after gastric bypass surgery. Surg Endosc. 27:1573–1578. DOI: 10.1007/s00464-012-2629-1. PMID: 23233009.

5. Tzovaras G, Papamargaritis D, Sioka E, et al. 2012; Symptoms suggestive of dumping syndrome after provocation in patients after laparoscopic sleeve gastrectomy. Obes Surg. 22:23–28. DOI: 10.1007/s11695-011-0461-7. PMID: 21647622.

6. Abell TL, Minocha A. 2006; Gastrointestinal complications of bariatric surgery: diagnosis and therapy. Am J Med Sci. 331:214–218. DOI: 10.1097/00000441-200604000-00008. PMID: 16617237.

7. Hejazi RA, Patil H, McCallum RW. 2010; Dumping syndrome: establishing criteria for diagnosis and identifying new etiologies. Dig Dis Sci. 55:117–123. DOI: 10.1007/s10620-009-0939-5. PMID: 19714467.

8. Heseltine D, Potter JF, Hartley G, Macdonald IA, James OF. 1990; Blood pressure, heart rate and neuroendocrine responses to a high carbohydrate and a high fat meal in healthy young subjects. Clin Sci (Lond). 79:517–522. DOI: 10.1042/cs0790517. PMID: 2174321.

9. Dune X, Lee WT, Shen YZ. 2002; Postmeningoencephalitic dysautonomia:report of one case. Pediatr Neurol. 26:161–163. DOI: 10.1016/S0887-8994(01)00366-6. PMID: 11897485.
10. Safadieh L, Sharara-Chami R, Dabbagh O. 2012; Paroxysmal autonomic instability with dystonia after pneumococcal meningoencephalitis. Case Rep Med. 2012:965932. DOI: 10.1155/2012/965932. PMID: 23093976. PMCID: PMC3475321.

11. Singh DK, Singh N. 2011; Paroxysmal autonomic instability with dystonia in a child: rare manifestation of an interpeduncular tuberculoma. Pediatr Neurosurg. 47:275–278. DOI: 10.1159/000334276. PMID: 22378546.

12. Tamura N, Shimazu K, Yamamoto T, Itokawa K, Hamaguchi K. 1996; A case of sympathotonic orthostatic hypotension following herpes simplex encephalitis. Rinsho Shinkeigaku. 36:1161–1165. PMID: 8997141.
13. Neumann B, Schulte-Mattler W, Brix S, et al. 2016; Autonomic and peripheral nervous system function in acute tick-borne encephalitis. Brain Behav. 6:e00485. DOI: 10.1002/brb3.485. PMID: 27247855. PMCID: PMC4864130.

14. Riabokon Y, Zadyraka D. 2019; Dynamics of the vegetative nervous system functional state in interaction with the changes in adrenocorticotropic and somatotropic hormones in patients with serous meningitis. Georgian Med News. (287):90–95.
15. Nagai M, Hoshide S, Kario K. 2010; The insular cortex and cardiovascular system: a new insight into the brain-heart axis. J Am Soc Hypertens. 4:174–182. DOI: 10.1016/j.jash.2010.05.001. PMID: 20655502.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download