1. European Association for the Study of the Liver. 2017; EASL clinical practice guidelines: the diagnosis and management of patients with primary biliary cholangitis. J Hepatol. 67:145–172. DOI:
10.1016/j.jhep.2017.03.022. PMID:
28427765.
2. Tanaka A. 2019; IgG4-related sclerosing cholangitis and primary sclerosing cholangitis. Gut Liver. 13:300–307. DOI:
10.5009/gnl18085. PMID:
30205418. PMCID:
PMC6529173.

4. Chapman MH, Thorburn D, Hirschfield GM, et al. 2019; British Society of Gastroenterology and UK-PSC guidelines for the diagnosis and management of primary sclerosing cholangitis. Gut. 68:1356–1378. DOI:
10.1136/gutjnl-2018-317993. PMID:
31154395. PMCID:
PMC6691863.

5. Karlsen TH, Folseraas T, Thorburn D, Vesterhus M. 2017; Primary sclerosing cholangitis - a comprehensive review. J Hepatol. 67:1298–1323. DOI:
10.1016/j.jhep.2017.07.022. PMID:
28802875.

6. Bergquist A, Montgomery SM, Bahmanyar S, et al. 2008; Increased risk of primary sclerosing cholangitis and ulcerative colitis in first-degree relatives of patients with primary sclerosing cholangitis. Clin Gastroenterol Hepatol. 6:939–943. DOI:
10.1016/j.cgh.2008.03.016. PMID:
18674735.

7. Lammert C, Juran BD, Schlicht E, et al. 2014; Reduced coffee consumption among individuals with primary sclerosing cholangitis but not primary biliary cirrhosis. Clin Gastroenterol Hepatol. 12:1562–1568. DOI:
10.1016/j.cgh.2013.12.036. PMID:
24440215. PMCID:
PMC4101072.

8. Eaton JE, Juran BD, Atkinson EJ, et al. 2015; A comprehensive assessment of environmental exposures among 1000 North American patients with primary sclerosing cholangitis, with and without inflammatory bowel disease. Aliment Pharmacol Ther. 41:980–990. DOI:
10.1111/apt.13154. PMID:
25783671. PMCID:
PMC4402146.

9. Isayama H, Tazuma S, Kokudo N, et al. 2018; Clinical guidelines for primary sclerosing cholangitis 2017. J Gastroenterol. 53:1006–1034. DOI:
10.1007/s00535-018-1484-9. PMID:
29951926.

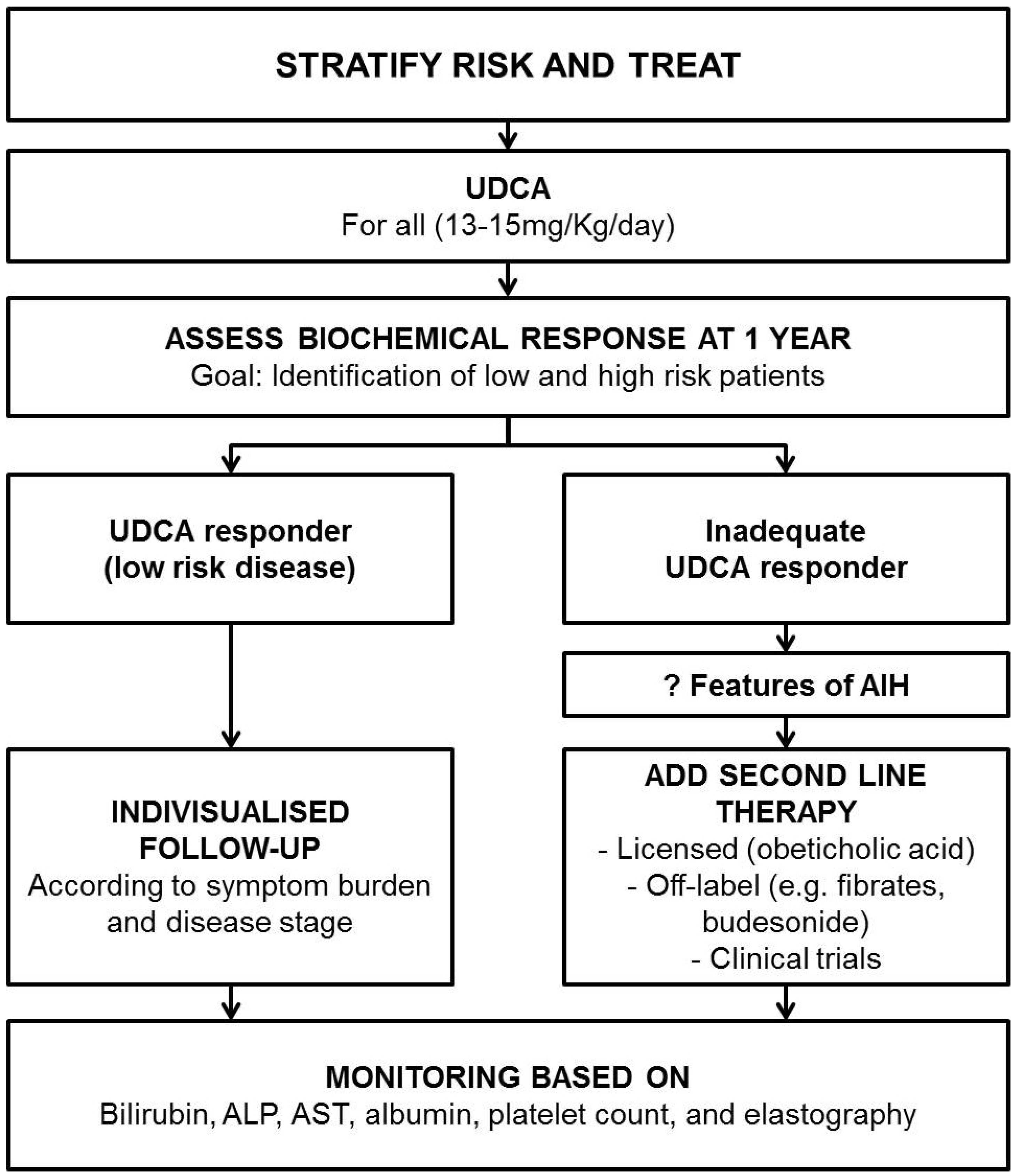
11. Angulo P, Peter JB, Gershwin ME, et al. 2000; Serum autoantibodies in patients with primary sclerosing cholangitis. J Hepatol. 32:182–187. DOI:
10.1016/S0168-8278(00)80061-6.

12. Boonstra K, Weersma RK, van Erpecum KJ, et al. 2013; Populationbased epidemiology, malignancy risk, and outcome of primary sclerosing cholangitis. Hepatology. 58:2045–2055. DOI:
10.1002/hep.26565. PMID:
23775876.

13. Tanaka A, Tazuma S, Nakazawa T, et al. 2017; No negative impact of serum IgG4 levels on clinical outcome in 435 patients with primary sclerosing cholangitis from Japan. J Hepatobiliary Pancreat Sci. 24:217–225. DOI:
10.1002/jhbp.432. PMID:
28103424.

14. Tischendorf JJ, Hecker H, Krüger M, Manns MP, Meier PN. 2007; Characterization, outcome, and prognosis in 273 patients with primary sclerosing cholangitis: a single center study. Am J Gastroenterol. 102:107–114. DOI:
10.1111/j.1572-0241.2006.00872.x. PMID:
17037993.

15. Mertz A, Nguyen NA, Katsanos KH, Kwok RM. 2019; Primary sclerosing cholangitis and inflammatory bowel disease comorbidity: an update of the evidence. Ann Gastroenterol. 32:124–133. DOI:
10.20524/aog.2019.0344. PMID:
30837784. PMCID:
PMC6394256.

16. Boonstra K, van Erpecum KJ, van Nieuwkerk KM, et al. 2012; Primary sclerosing cholangitis is associated with a distinct phenotype of inflammatory bowel disease. Inflamm Bowel Dis. 18:2270–2276. DOI:
10.1002/ibd.22938. PMID:
22407885.

17. Lewis JT, Talwalkar JA, Rosen CB, Smyrk TC, Abraham SC. 2007; Prevalence and risk factors for gallbladder neoplasia in patients with primary sclerosing cholangitis: evidence for a metaplasiadysplasia-carcinoma sequence. Am J Surg Pathol. 31:907–913. DOI:
10.1097/01.pas.0000213435.99492.8a. PMID:
17527079.

18. Chapman R, Fevery J, Kalloo A, et al. 2010; Diagnosis and management of primary sclerosing cholangitis. Hepatology. 51:660–678. DOI:
10.1002/hep.23294. PMID:
20101749.

19. Lindor KD, Kowdley KV, Harrison ME. American College of Gastroenterology. 2015; ACG clinical guideline: primary sclerosing cholangitis. Am J Gastroenterol. 110:646–659. DOI:
10.1038/ajg.2015.112. PMID:
25869391.

20. European Association for the Study of the Liver. 2009; EASL clinical practice guidelines: management of cholestatic liver diseases. J Hepatol. 51:237–267. DOI:
10.1016/j.jhep.2009.04.009. PMID:
19501929.
21. Aabakken L, Karlsen TH, Albert J, et al. 2017; Role of endoscopy in primary sclerosing cholangitis: European Society of Gastrointestinal Endoscopy (ESGE) and European Association for the Study of the Liver (EASL) clinical guideline. Endoscopy. 49:588–608. DOI:
10.1055/s-0043-107029. PMID:
28420030.

22. Muratori P, Muratori L, Ferrari R. 2003; Characterization and clinical impact of antinuclear antibodies in primary biliary cirrhosis. Am J Gastroenterol. 98:431–437. DOI:
10.1111/j.1572-0241.2003.07257.x. PMID:
12591064.

23. Chazouillères O, Wendum D, Serfaty L, Montembault S, Rosmorduc O, Poupon R. 1998; Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy. Hepatology. 28:296–301. DOI:
10.1002/hep.510280203. PMID:
9695990.

25. Hirschfield GM, Dyson JK, Alexander GJM. 2018; The British Society of Gastroenterology/UK-PBC primary biliary cholangitis treatment and management guidelines. Gut. 67:1568–1594. DOI:
10.1136/gutjnl-2017-315259. PMID:
29593060. PMCID:
PMC6109281.

27. Angulo P, Lindor KD, Therneau TM, et al. 1999; Utilization of the Mayo risk score in patients with primary biliary cirrhosis receiving ursodeoxycholic acid. Liver. 19:115–121. DOI:
10.1111/j.1478-3231.1999.tb00020.x. PMID:
10220741.

28. Parés A, Caballería L, Rodés J. 2006; Excellent long-term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic acid. Gastroenterology. 130:715–720. DOI:
10.1053/j.gastro.2005.12.029. PMID:
16530513.

29. Corpechot C, Abenavoli L, Rabahi N, et al. 2008; Biochemical response to ursodeoxycholic acid and long-term prognosis in primary biliary cirrhosis. Hepatology. 48:871–877. DOI:
10.1002/hep.22428. PMID:
18752324.

30. Kuiper EM, Hansen BE, de Vries RA, et al. 2009; Improved prognosis of patients with primary biliary cirrhosis that have a biochemical response to ursodeoxycholic acid. Gastroenterology. 136:1281–1287. DOI:
10.1053/j.gastro.2009.01.003. PMID:
19208346.

31. Kumagi T, Guindi M, Fischer SE, et al. 2010; Baseline ductopenia and treatment response predict long-term histological progression in primary biliary cirrhosis. Am J Gastroenterol. 105:2186–2194. DOI:
10.1038/ajg.2010.216. PMID:
20502446.

32. Corpechot C, Chazouillères O, Poupon R. 2011; Early primary biliary cirrhosis:biochemical response to treatment and prediction of long-term outcome. J Hepatol. 55:1361–1367. DOI:
10.1016/j.jhep.2011.02.031. PMID:
21703194.
33. Azemoto N, Abe M, Murata Y, et al. 2009; Early biochemical response to ursodeoxycholic acid predicts symptom development in patients with asymptomatic primary biliary cirrhosis. J Gastroenterol. 44:630–634. DOI:
10.1007/s00535-009-0051-9. PMID:
19370305.

34. Carbone M, Sharp SJ, Flack S, et al. 2016; The UK-PBC risk scores:derivation and validation of a scoring system for long-term prediction of end-stage liver disease in primary biliary cholangitis. Hepatology. 63:930–950. DOI:
10.1002/hep.28017. PMID:
26223498. PMCID:
PMC6984963.
35. Lammers WJ, Hirschfield GM, Corpechot C, et al. 2015; Development and validation of a scoring system to predict outcomes of patients with primary biliary cirrhosis receiving ursodeoxycholic acid therapy. Gastroenterology. 149:1804–1812.e4. DOI:
10.1053/j.gastro.2015.07.061. PMID:
26261009.

36. Poupon RE, Lindor KD, Cauch-Dudek K, Dickson ER, Poupon R, Heathcote EJ. 1997; Combined analysis of randomized controlled trials of ursodeoxycholic acid in primary biliary cirrhosis. Gastroenterology. 113:884–890. DOI:
10.1016/S0016-5085(97)70183-5.

37. Lammers WJ, van Buuren HR, Hirschfield GM, et al. 2014; Levels of alkaline phosphatase and bilirubin are surrogate end points of outcomes of patients with primary biliary cirrhosis: an international follow-up study. Gastroenterology. 147:1338–1349.e5. DOI:
10.1053/j.gastro.2014.10.032. PMID:
24954664.
38. Beuers U, Trauner M, Jansen P, Poupon R. 2015; New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond. J Hepatol. 62(1 Suppl):S25–S37. DOI:
10.1016/j.jhep.2015.02.023. PMID:
25920087.

39. Nevens F, Andreone P, Mazzella G, et al. 2016; A placebo-controlled trial of obeticholic acid in primary biliary cholangitis. N Engl J Med. 375:631–643. DOI:
10.1056/NEJMoa1509840. PMID:
27532829.
40. Corpechot C, Chazouillères O, Rousseau A, et al. 2018; A placebo-controlled trial of bezafibrate in primary biliary cholangitis. N Engl J Med. 378:2171–2181. DOI:
10.1056/NEJMoa1714519. PMID:
29874528.
41. Adam R, Karam V, Delvart V, et al. 2012; Evolution of indications and results of liver transplantation in Europe. A report from the European Liver Transplant Registry (ELTR). J Hepatol. 57:675–688. DOI:
10.1016/j.jhep.2012.04.015. PMID:
22609307.
42. Singal AK, Guturu P, Hmoud B, Kuo YF, Salameh H, Wiesner RH. 2013; Evolving frequency and outcomes of liver transplantation based on etiology of liver disease. Transplantation. 95:755–760. DOI:
10.1097/TP.0b013e31827afb3a. PMID:
23370710.

43. Carbone M, Neuberger JM. 2014; Autoimmune liver disease, autoimmunity and liver transplantation. J Hepatol. 60:210–223. DOI:
10.1016/j.jhep.2013.09.020. PMID:
24084655.

44. Sylvestre PB, Batts KP, Burgart LJ, Poterucha JJ, Wiesner RH. 2003; Recurrence of primary biliary cirrhosis after liver transplantation:histologic estimate of incidence and natural history. Liver Transpl. 9:1086–1093. DOI:
10.1053/jlts.2003.50213. PMID:
14526404.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download