Abstract
Type 1 autoimmune pancreatitis and IgG4-related sclerosing cholangitis (IgG4-SC) are the pancreatobiliary manifestations of IgG4-related disease. IgG4-related disease is a newly named fibroinflammatory condition that is characterized by tumefactive lesions that contain dense lymphoplasmacytic infiltrates rich in IgG4-positive cells and often by elevated serum IgG4 concentrations. IgG4-related pancreatobiliary disease is often disguised as pancreatobiliary malignancies owing to its tumefactive nature and clinical presentations, such as obstructive jaundice. The differentiation of IgG4-SC from primary sclerosing cholangitis is also essential because of the significant differences in treatment responses and prognosis. A timely diagnosis of IgG4-related pancreatobiliary disease can lead clinicians to prescribe adequate glucocorticoid treatment that can reverse the pancreatobiliary duct strictures and obstructive jaundice. On the other hand, the diagnosis of IgG4-related pancreatobiliary disease is sometimes challenging because there is no single diagnostic clinical test. The diagnosis of IgG4-related pancreatobiliary disease rests on fulfilling the diagnostic criteria, including imaging, serology, other organ involvement, histology, and response to steroids. Approximately 50% of patients with IgG4-related pancreatobiliary disease experience relapse, despite IgG4-related pancreatobiliary disease showings a favorable short-term prognosis after glucocorticoid therapy. To reduce the relapse, long maintenance treatment for 3 years may be necessary. The purposes of this review were to emphasize the clinical problem of diagnosing IgG4-related pancreatobiliary disease as well as to highlight the use of the published guidelines for the diagnosis and management of IgG4-related pancreatobiliary disease.
IgG4 연관 췌장담도 질환(IgG4-related pancreatobiliary disease)은 췌장 또는 담도에 IgG4 양성 형질세포(plasma cell)가 침윤하고 섬유화가 동반되는 질병으로 전신을 침범할 수 있는 IgG4 연관 질환(IgG4-related disease)의 일부분이다.1 여러 장기를 동시에 침범하기도 하지만 1-2개의 장기에 국한되어 나타날 수 있는데 이런 경우 종양과의 감별이 중요하다.2,3 IgG4 연관 질환이 침범하는 장기의 비율은 문헌마다 매우 다양하지만 2015년 한 보고에 따르면 췌장 60%, 침샘 34%, 눈물샘 23%, 신장 23%, 대동맥 20%, 담도 13%, 폐 13%, 안와 주위 4%, 후복막 4%였으며, 이 외에도 담낭, 간, 갑상선, 전립선, 위 등을 침범할 수 있다.4 이전의 문헌에서는 자가면역췌장염, 리델갑상선염, 미쿨리츠병 등과 같이 불리다가 최근에는 침범된 장기에 따라 제1형 자가면역췌장염(type 1 autoimmune pancreatitis or IgG4-related pancreatitis), IgG4 연관 경화성 담관염(IgG4-related sclerosing cholangitis), IgG4 연관 신장 질환(IgG4-related kidney disease), IgG4 연관 폐 질환(IgG4-related lung diseae), IgG4 연관 타액선염(IgG4-related sialadenitis) 등과 같이 명명하도록 권고하고 있다.5
IgG4 연관 췌장담도 질환은 종괴를 형성하기도 하지만 스테로이드 치료에 잘 반응하는 특징이 있다. 현재 IgG4 연관 췌장담도 질환은 췌장담도암의 중요한 감별 진단인데, 만약 췌장담도암이 IgG4 연관 췌장담도 질환으로 오인된다면 병이 진행하여 수술의 시기를 놓칠 수도 있다. 반대로 IgG4 연관 췌장담도 질환을 췌장담도암으로 오인한다면 불필요한 수술이 시행될 수 있으므로 이 질환의 특징을 올바르게 이해하는 것은 중요하다. 본고에서는 IgG4 연관 췌장담도 질환과 췌장담도암의 감별 진단 및 치료에 중점을 두어 IgG4 연관 췌장담도 질환의 최신 지견에 대하여 소개하고자 한다.
명확한 병태생리학적 기전은 알려져 있지 않으며, 유전적으로 민감한 사람이 어떠한 면역원(immunogen)에 반복적으로 노출되면서 IgG4 연관 질환의 면역 반응이 시작되는 것으로 설명한다.6 현재 제시되고 있는 면역원으로는 감염 물질, 자가항원, 직업환경적 면역원 등이 있다. 자가면역췌장염 환자에서 발견된 자가항체에는 anti-carbonic anhydrase II, anti-lactoferrin, anti-PRSS1, anti-PRSS2 등이 있다.6 유럽의 연구에 따르면 유해물질에 노출되는 육체 노동자에서 IgG4 연관 질환의 발생 위험이 높으므로, IgG4 연관 질환을 유발하는 면역원은 산업용 오일, 가스, 먼지, 용제 등이라고 제시하였다.7,8 이러한 가설은 IgG4 연관 질환이 고령의 남성에서 호발하는 이유를 설명할 수 있다. 유전적 요인으로 IgG4 연관 질환의 발생 비율을 높이거나 재발과 연관된 사람백혈구 항원(human leukocyte antigen, HLA)은 HLA-DRB1*04:05, HLA-DQB1*04:01, HLA-DQB1*03:02 등이 보고되었다.9
자가면역 또는 외부 항원에 의하여 IgG4 연관 질환의 면역 방아쇠(trigger)가 당겨지면 제2형 조력 T세포(T helper 2 cell)의 비율이 높아지고 B세포(B cell)가 활성화된다. 제2형 조력 T세포는 전환성장인자-베타(transforming growth factor-β)를 증가시켜 섬유모세포(fibroblast)를 활성화시키고 세포외기질(extracellular matrix)을 재형성(remodeling)하게 만들어 조직을 손상시킨다.10 B세포의 활성화는 형질모세포(plasmablast)를 확장(expansion)시키며 형질세포분화(plasma cell differentiation)를 유도하여 IgG 항체를 생성하게 되는데 IgG4 아형항체도 다수 생성된다.10 IgG4 항체는 항염증(anti-inflammatory)작용에 관여하는 것으로 생각되며, IgG4 이외의 다른 아형 IgG는 염증을 유도(proinflammatory)하는 작용에 관여한다. 이를 뒷받침할 수 있는 2016년 연구에 따르면, IgG4 연관 질환 환자의 혈청 IgG를 BALB/c 생쥐모델에 피하 주입하면 생쥐의 췌장과 침샘에 조직 손상을 일으키는데, 특히 IgG1을 주입할 때 조직 손상이 크고 IgG4가 IgG1과 동시에 투여되면 IgG1에 의한 조직 손상을 억제할 수 있었다.11
자가면역성 췌장염의 진단을 위하여 이전에는 일본, 미국, 우리나라 등에서 각각의 진단기준을 사용하였지만 2011년 세계췌장학회에서 자가면역성 췌장염에 대한 국제진단기준(international consensus diagnostic criteria)을 합의하여 발표하였으므로 국제진단기준을 사용하는 것을 추천한다.12 국제진단기준은 제1형 자가면역췌장염과 제2형 자가면역췌장염을 구분하였으며 제1형 자가면역췌장염이 IgG4 연관 췌장담도 질환에 속한다. 제1형 자가면역췌장염의 진단기준에는 (1) 췌장실질영상(췌장의 미만성 종대), (2) 췌관 영상(췌관의 긴 협착 및 상류췌관 확장 결핍), (3) 혈청 소견(IgG4 증가), (4) 췌장 외 장기 침범(e.g., 담관 및 후복막 침범), (5) 병리 소견(lymphoplamacytic sclerosing pancreatitis) 및 (6) 스테로이드 반응이 포함된다(Fig. 1). 임상에서 자가면역췌장염의 진단에서 가장 중요한 것은 췌장암과의 감별이다(Table 1).2,13
최근 발표된 메타분석 연구는 523명의 자가면역췌장염 환자와 771명의 췌장암 환자가 포함되었고, 혈청 IgG4가 자가면역췌장염과 췌장암의 감별을 위하여 93%의 높은 특이도와 72%의 민감도를 가진다고 보고하였다.14 새로운 검사실적 진단법으로 혈액 IgG4/IgG RNA 비율에 대한 연구가 시도되고 있다. IgG4 연관 췌장담도 질환 환자와 대조군(췌담도암, 원발성 경화성 담관염[(primary sclerosing cholangitis])에 대하여 정량중합연쇄반응(quantitative polymerase chain reaction)을 이용하여 혈액 IgG4/IgG RNA 비율(>0.05)을 측정하였더니 혈청 IgG4보다 높은 민감도(94%)와 특이도(99%)를 보고하였고 후속 연구가 기대된다.7
췌장의 침범이 없는 독립된 IgG4 연관 경화성 담관염은 매우 드물고, 대부분(약 72-92%)의 IgG4 연관 경화성 담관염은 자가면역췌장염과 동반되어 있거나 이전에 자가면역췌장염의 병력이 있다.15-18 IgG4 연관 경화성 담관염에 대한 국제진단 기준은 아직 발표되지 않았으므로 미국의 Mayo그룹에서 발표한 진단기준이나 일본의 진단기준을 이용할 수 있다.18,19
실제 임상에서 IgG4 연관 경화성 담관염의 진단을 위해서는 담관 협착의 부위와 특징에 따라서 담관암 또는 원발성 경화성 담관염과 감별이 필요하다(Table 2).20,21 IgG4 연관 경화성 담관염은 담관의 침범 범위에 따라서 제1형(원위부담관), 제2형(간내담관과 원위부담관; 2a intrahepatic segmental, 2b intrahepatic diffuse), 제3형(간문부와 원위부담관) 및 제4형(간문부담관)으로 나뉘게 된다.21 2017년 일본의 다기관 연구에 따르면 527명의 IgG4 연관 경화성 담관염 환자 중 제1형이 가장 많아 64% 정도이며, 제2형은 13% (2a 5%, 2b 8%), 제3형은 10%, 제4형은 10%이고, 분류 미상은 4%였다.15 제1형, 3형, 4형은 주로 췌장이나 담관의 악성 종양과의 감별이 필요하며 제2형은 원발성 경화성 담관염과의 감별이 필요한 경우가 많다(Table 3).16,21
내시경역행담췌관조영술을 통한 담도배액술은 폐쇄성 황달이 있는 경우 담도계 감염을 막고, 또한 담도의 악성 종양과의 감별을 위한 겸자생검/솔세포 검사 시행에 유용하다.21,22 최근의 연구에 의하면 일부 환자에서 담도배액술 없이 스테로이드 치료만으로 자가면역췌장염의 폐쇄성 황달을 치료할 수 있다는 보고가 있다.23 그러나 IgG4 연관 췌장담도 질환의 폐쇄성 황달을 담도배액술 없이 약물 치료를 할 때에는 (1) 자가면역췌장염/IgG4 연관 경화성 담관염의 진단이 스테로이드 치료 전에 확실하고, (2) 담관 협착에 대한 병리 검사가 필요하지 않고, (3) 황달이 심하지 않고, (4) 감염의 증거가 없는 경우에 시행할 수 있다.21
관해의 유도를 위하여 스테로이드가 가장 좋은 치료제이며 초기 스테로이드 치료는 프레드니손을 0.6-1.0 mg/kg/day의 고용량으로 2-4주 투약하고 감량하는 것을 권유한다.21,22 감량은 20 mg/day의 용량이 될 때까지는 1-2주 간격으로 5-10 mg/day씩 줄이고, 20 mg/day가 된 이후로는 2주 간격으로 5 mg/day씩 감량하게 된다. 이러한 초치료의 기간은 일반적으로 12주 정도 되며 4주 미만의 치료는 권고하지 않는다. 스테로이드 치료는 각 환자의 질병 활동도에 따라서 개별화하여 감량해야 한다. 서구에서는 Mayo그룹의 초치료 방법이 많이 사용되는데, 40 mg/day를 4주간 투약하고 이후 1주마다 5 mg/day씩 감량하여 끊는 것으로 총 11주간의 초치료 기간을 가지게 된다.3
제1형 자가면역췌장염의 재발률은 30-60% 정도로 알려져 있는데, 관해를 얻은 후 유지 요법을 시행하는 것이 재발률을 낮출 수 있고 유지 요법에 따른 합병증이 적다면 유지 요법을 시행하는 것이 좋을 것이다.24 일본과 우리나라에서는 임상 관해를 얻은 후 유지 요법을 시행하지만 Mayo그룹의 치료법에 따르면 초치료 군에서는 유지 요법을 시행하지 않고 재발한 환자에 대해서만 유지 요법을 시행한다. 2017년 국제합의에서는 유지 요법이 일부분의 환자에서 도움이 되며 대상 환자군은 제1형 자가면역췌장염 환자로 질병 활성도가 높거나 재발률이 높을 것으로 예측되는 환자라고 명시하였다.22 유지 요법의 방법으로는 2.5-7.5 mg/day의 저용량 스테로이드 또는 면역조절제를 제시하였다. 유지 요법의 근거인 자가면역췌장염 환자의 전향적 무작위 대조 시험에서 3년의 유지 요법을 시행한 군은 재발률이 23.3%였고, 6개월 이전에 스테로이드를 끊고 유지 요법을 시행하지 않은 군은 57.9%로 유의하게 높아 3년의 유지 요법을 추천한다.25 또 다른 일본의 대규모 연구에서 자가면역췌장염의 재발은 낮추면서 스테로이드의 합병증은 줄일 수 있는 유지 요법의 기간으로 2-3년을 제시하였다.26 2019년 일본의 임상 진료지침에서 IgG4 연관 경화성 담관염 환자는 3년의 유지 요법을 추천하였다.21
초기의 제1형 자가면역췌장염 연구들에서 재발률은 20-30% 정도라고 보고하였지만 최근의 연구들에서는 50-60%까지 보고하여 자가면역췌장염 환자의 추적 기간이 길어지면서 재발률도 같이 증가하고 있는 경향을 보인다.17,24,26-28 재발의 위험인자를 알게 된다면 스테로이드 치료의 용량 조절 및 유지 요법의 기간 결정에 도움을 줄 수 있을 것이다.
재발의 임상적 위험인자에 대해서는 연구들마다 다른 결과들을 보고하는데 이는 연구마다 (1) 치료 요법, (2) 관해와 재발의 정의, (3) 추적 기간에 차이가 있기 때문이다. 2019년 발표된 3,595명의 자가면역췌장염 환자가 포함된 메타분석에 따르면 의미 있는 재발의 위험인자는 스테로이드 유지 요법을 시행하지 않은 경우뿐이었다.28 재발의 위험인자가 아직 정립되지는 않았지만 재발의 위험인자로 (1) 4배 이상의 혈청 IgG4 증가, (2) 스테로이드 치료 후에도 지속적으로 증가된 혈청 IgG4, (3) 췌장의 미만성 종대, (4) 근위부 담관 침범, (5) 2개 이상의 다발성 장기 침범이 제시된다.22
질병 활성도를 감시하여 재발의 위험성을 예측할 수 있는 방법으로 2018년 유럽그룹에서 발표한 M-ANNHEIM-AiPActivity-Score가 있다.29 질병 활성도 스코어를 통증, 통증조절 방법, 외분비 기능 이상, 당뇨병, 영상, 합병증을 이용하여 계산하게 되며, 스코어가 60% 이상 감소하지 않는 군에서 재발 위험이 높았다.
IgG4 연관 췌장담도 질환은 염증 및 섬유화를 일으키고 때때로 종괴를 형성하기도 하는 질병으로 치료의 근간은 스테로이드이다. IgG4 연관 췌장담도 질환과 췌장담도암의 감별을 위해서는 자가면역췌장염 및 IgG4 연관 경화성 담관염의 진단기준을 숙지하고 있어야 하고 임상적 경험이 필요하다. 혈청 IgG4의 상승은 IgG4 연관 췌장담도 질환 환자의 72% 정도에서 관찰되지만 췌장암 환자의 7%에서도 관찰된다. 치료는 30-40 mg/day의 고용량 스테로이드를 사용하여 관해를 얻고 점차 감량한다. 스테로이드 유지 요법을 시행하지 않은 환자에서는 재발의 위험성이 높다. 이에, 향후 더 많은 연구와 지식의 축적에 의하여 더 간단하게 IgG4 연관 췌장담도 질환을 진단하고 적절한 치료를 통하여 재발을 줄일 수 있기를 기대한다.
REFERENCES
1. Kamisawa T, Zen Y, Nakazawa T, Okazaki K. 2018; Advances in IgG4-related pancreatobiliary diseases. Lancet Gastroenterol Hepatol. 3:575–585. DOI: 10.1016/S2468-1253(18)30121-3. PMID: 30047448.

2. Moon SH, Kim MH, Park DH, et al. 2008; Is a 2-week steroid trial after initial negative investigation for malignancy useful in differentiating autoimmune pancreatitis from pancreatic cancer? A prospective outcome study. Gut. 57:1704–1712. DOI: 10.1136/gut.2008.150979. PMID: 18583399.

3. Chari ST, Takahashi N, Levy MJ, et al. 2009; A diagnostic strategy to distinguish autoimmune pancreatitis from pancreatic cancer. Clin Gastroenterol Hepatol. 7:1097–1103. DOI: 10.1016/j.cgh.2009.04.020. PMID: 19410017.

4. Inoue D, Yoshida K, Yoneda N, et al. 2015; IgG4-related disease: dataset of 235 consecutive patients. Medicine (Baltimore). 94:e680. DOI: 10.1097/MD.0000000000000680. PMID: 25881845.
5. Stone JH, Khosroshahi A, Deshpande V, et al. 2012; Recommendations for the nomenclature of IgG4-related disease and its individual organ system manifestations. Arthritis Rheum. 64:3061–3067. DOI: 10.1002/art.34593. PMID: 22736240. PMCID: PMC5963880.
6. Hart PA, Zen Y, Chari ST. 2015; Recent advances in autoimmune pancreatitis. Gastroenterology. 149:39–51. DOI: 10.1053/j.gastro.2015.03.010. PMID: 25770706.

7. Doorenspleet ME, Hubers LM, Culver EL, et al. 2016; Immunoglobulin G4(+) B-cell receptor clones distinguish immunoglobulin G 4-related disease from primary sclerosing cholangitis and biliary/pancreatic malignancies. Hepatology. 64:501–507. DOI: 10.1002/hep.28568. PMID: 27015613.
8. de Buy Wenniger LJ, Culver EL, Beuers U. 2014; Exposure to occupational antigens might predispose to IgG4-related disease. Hepatology. 60:1453–1454. DOI: 10.1002/hep.26999. PMID: 24407836. PMCID: PMC4258085.

9. Ishikawa Y, Terao C. 2020; Genetic analysis of IgG4-related disease. Mod Rheumatol. 30:17–23. DOI: 10.1080/14397595.2019.1621000. PMID: 31104539.

10. Miyabe K, Zen Y, Cornell LD, et al. 2018; Gastrointestinal and extra-intestinal manifestations of IgG4-related disease. Gastroenterology. 155:990–1003.e1. DOI: 10.1053/j.gastro.2018.06.082. PMID: 30012334.

11. Shiokawa M, Kodama Y, Kuriyama K, et al. 2016; Pathogenicity of IgG in patients with IgG4-related disease. Gut. 65:1322–1332. DOI: 10.1136/gutjnl-2015-310336. PMID: 26964842.

12. Shimosegawa T, Chari ST, Frulloni L, et al. 2011; International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas. 40:352–358. DOI: 10.1097/MPA.0b013e3182142fd2. PMID: 21412117.

13. Gardner TB, Levy MJ, Takahashi N, Smyrk TC, Chari ST. 2009; Misdiagnosis of autoimmune pancreatitis: a caution to clinicians. Am J Gastroenterol. 104:1620–1623. DOI: 10.1038/ajg.2008.89. PMID: 19574965.

14. Dai C, Cao Q, Jiang M, Sun MJ. 2018; Serum immunoglobulin G4 in discriminating autoimmune pancreatitis from pancreatic cancer: a diagnostic meta-analysis. Pancreas. 47:280–284. DOI: 10.1097/MPA.0000000000000994. PMID: 29351121.
15. Tanaka A, Tazuma S, Okazaki K, et al. 2017; Clinical features, response to treatment, and outcomes of IgG4-related sclerosing cholangitis. Clin Gastroenterol Hepatol. 15:920–926.e3. DOI: 10.1016/j.cgh.2016.12.038. PMID: 28111336.
16. Moon SH, Kim MH, Lee JK, et al. 2017; Development of a scoring system for differentiating IgG4-related sclerosing cholangitis from primary sclerosing cholangitis. J Gastroenterol. 52:483–493. DOI: 10.1007/s00535-016-1246-5. PMID: 27470434.

17. Huggett MT, Culver EL, Kumar M, et al. 2014; Type 1 autoimmune pancreatitis and IgG4-related sclerosing cholangitis is associated with extrapancreatic organ failure, malignancy, and mortality in a prospective UK cohort. Am J Gastroenterol. 109:1675–1683. DOI: 10.1038/ajg.2014.223. PMID: 25155229.

18. Ghazale A, Chari ST, Zhang L, et al. 2008; Immunoglobulin G4-associated cholangitis: clinical profile and response to therapy. Gastroenterology. 134:706–715. DOI: 10.1053/j.gastro.2007.12.009. PMID: 18222442.

19. Ohara H, Okazaki K, Tsubouchi H, et al. 2012; Clinical diagnostic criteria of IgG4-related sclerosing cholangitis 2012. J Hepatobiliary Pancreat Sci. 19:536–542. DOI: 10.1007/s00534-012-0521-y. PMID: 22717980.
20. Culver EL, Chapman RW. 2016; IgG4-related hepatobiliary disease: an overview. Nat Rev Gastroenterol Hepatol. 13:601–612. DOI: 10.1038/nrgastro.2016.132. PMID: 27625195.

21. Kamisawa T, Nakazawa T, Tazuma S, et al. 2019; Clinical practice guidelines for IgG4-related sclerosing cholangitis. J Hepatobiliary Pancreat Sci. 26:9–42. DOI: 10.1002/jhbp.596. PMID: 30575336.

22. Okazaki K, Chari ST, Frulloni L, et al. 2017; International consensus for the treatment of autoimmune pancreatitis. Pancreatology. 17:1–6. DOI: 10.1016/j.pan.2016.12.003. PMID: 28027896.

23. Bi Y, Hart PA, Law R, et al. 2016; Obstructive jaundice in autoimmune pancreatitis can be safely treated with corticosteroids alone without biliary stenting. Pancreatology. 16:391–396. DOI: 10.1016/j.pan.2016.03.017. PMID: 27107633.

24. Lee HW, Moon SH, Kim MH, et al. 2018; Relapse rate and predictors of relapse in a large single center cohort of type 1 autoimmune pancreatitis:long-term follow-up results after steroid therapy with short-duration maintenance treatment. J Gastroenterol. 53:967–977. DOI: 10.1007/s00535-018-1434-6. PMID: 29362937.
25. Masamune A, Nishimori I, Kikuta K, et al. 2017; Randomised controlled trial of long-term maintenance corticosteroid therapy in patients with autoimmune pancreatitis. Gut. 66:487–494. DOI: 10.1136/gutjnl-2016-312049. PMID: 27543430.

26. Kubota K, Kamisawa T, Okazaki K, et al. 2017; Low-dose maintenance steroid treatment could reduce the relapse rate in patients with type 1 autoimmune pancreatitis: a long-term Japanese multicenter analysis of 510 patients. J Gastroenterol. 52:955–964. DOI: 10.1007/s00535-016-1302-1. PMID: 28062947.

27. Kamisawa T, Shimosegawa T, Okazaki K, et al. 2009; Standard steroid treatment for autoimmune pancreatitis. Gut. 58:1504–1507. DOI: 10.1136/gut.2008.172908. PMID: 19398440.

28. Tacelli M, Celsa C, Magro B, et al. 2019; Risk factors for rate of relapse and effects of steroid maintenance therapy in patients with autoimmune pancreatitis: systematic review and meta-analysis. Clin Gastroenterol Hepatol. 17:1061–1072.e8. DOI: 10.1016/j.cgh.2018.09.051. PMID: 30312787.

29. Hirth M, Vujasinovic M, Münch M, et al. 2018; Monitoring and predicting disease activity in autoimmune pancreatitis with the M-ANNHEIM-AiP-Activity-Score. Pancreatology. 18:29–38. DOI: 10.1016/j.pan.2017.10.005. PMID: 29158146.

30. Kamisawa T, Okazaki K, Kawa S, et al. 2014; Amendment of the Japanese consensus guidelines for autoimmune pancreatitis, 2013 III. Treatment and prognosis of autoimmune pancreatitis. J Gastroenterol. 49:961–970. DOI: 10.1007/s00535-014-0945-z. PMID: 24639058.
31. Hart PA, Topazian MD, Witzig TE, et al. 2013; Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab:the Mayo clinic experience. Gut. 62:1607–1615. DOI: 10.1136/gutjnl-2012-302886. PMID: 22936672.
FIGURE AND TABLES
Fig. 1
Imaging features of autoimmune pancreatitis, immunoglobulin G4-related sclerosing cholangitis, and other organ involvement. (A) Diffuse enlargement of pancreatic parenchyma with a capsule-like rim. (B) Multiple round or wedge-shaped lesions (arrows) in the kidney. (C) Retroperitoneal fibrosis (arrows) encasing the aorta. (D) Diffuse irregular narrowing (arrows) of the main pancreatic duct. (E) Bile duct wall thickening (arrows) with a preserved bile duct lumen. (F) Hilar bile duct stricture with an intrahepatic bile duct stricture.
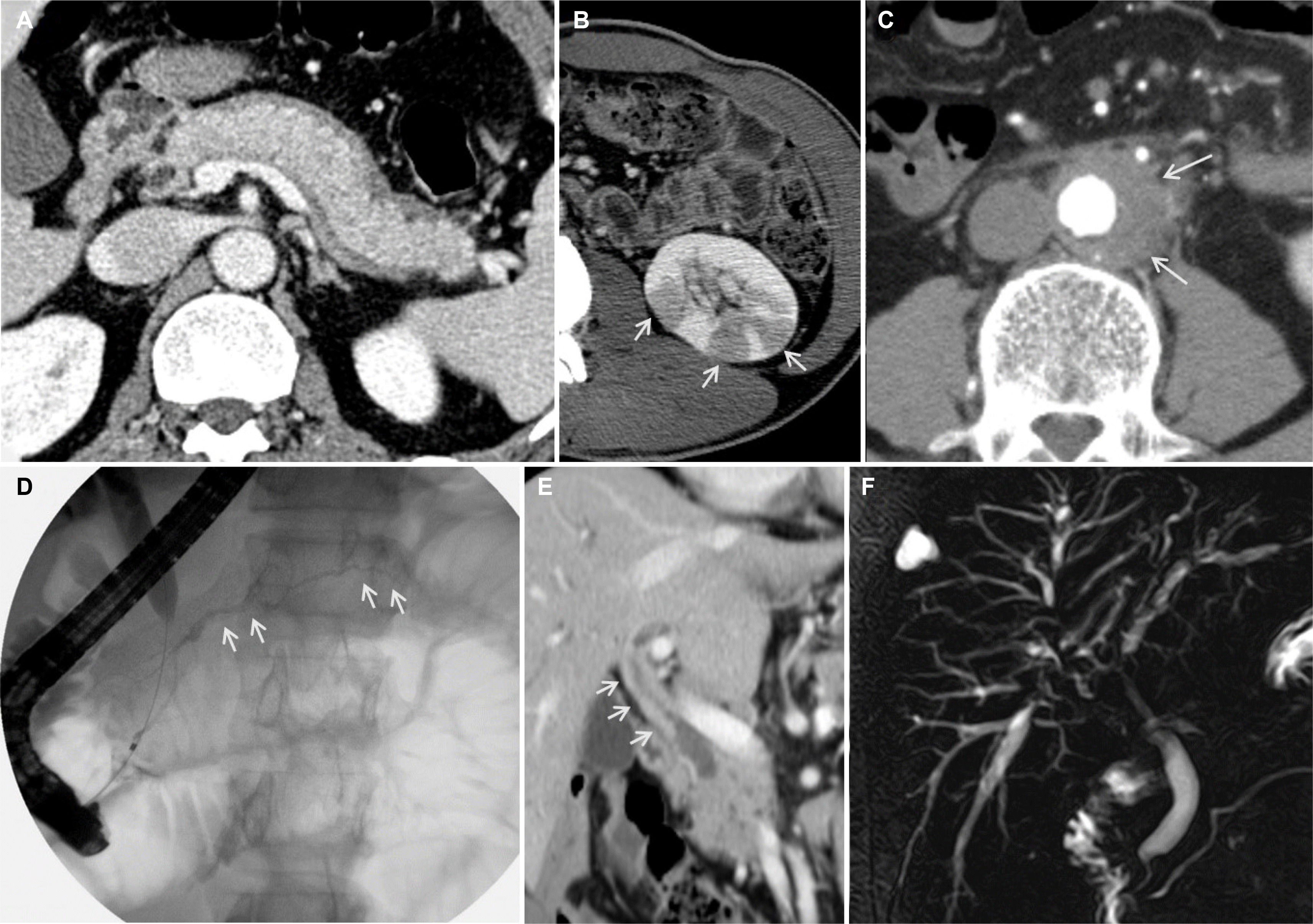
Table 1
Differentiation of Autoimmune Pancreatitis (AIP) from Pancreatic Cancer
| AIP | Pancreatic cancer | |
|---|---|---|
| Incidence | AIP is a rare disease thought to be much less common than pancreatic cancer | |
| Pancreatic parenchymal imaging | Diffuse pancreatic enlargement | Low-density mass |
| Capsule-like rim around pancreas | Distal pancreatic atrophy | |
| Atypical imaging: focal enlargement or mass | ||
| Pancreatic ductal imaging | Diffuse irregular narrowing of main pancreatic duct | Focal stricture with upstream duct dilatation |
| Lack of upstream dilatation | ||
| Multiple strictures | ||
| Elevated serum IgG4a | 72% | 7% |
| Other organ involvement | Hilar/intrahepatic bile duct wall thickening/stricture | Liver mass |
| Retroperitoneal fibrosis | ||
| Salivary gland enlargement | ||
| Kidney involvement | ||
| Tips for performing steroid trialb | 1. Utilize international consensus diagnostic criteria for AIP to help differentiate AIP from pancreatobiliary malignancies. | |
| 2. All pancreatic masses should be sampled prior to initiating glucocorticoids. | ||
| 3. The preferred objective markers for positive steroid responsiveness are marked improvement of the main pancreatic ductal narrowing and, if present, measurable reduction of the pancreatic mass as well. | ||
| 4. For differentiating AIP from pancreatic cancer, assessment of steroid responsiveness should be performed in 2 weeks after the initiation of glucocorticoids. | ||
| 5. Pancreatic enlargement (developed from obstructive pancreatitis) associated with pancreatic cancer may be relieved with glucocorticoids. | ||
| 6. Elevated serum IgG4 levels can decrease in patients with pancreatic cancer after administration of glucocorticoids. | ||
| 7. When serum CA 19-9 increases even after biliary decompression, pancreatobiliary malignancies should be differentiated by means of a meticulous re-biopsy. | ||
| 8. Glucocorticoids often cause subjective improvement in symptoms even in patients without AIP. | ||
Table 2
Differentiation of Immunoglobuling G4-related Sclerosing Cholangitis (IgG4-SC) Based on Cholangiogram
| Subtype of IgG4-SC | Area of bile duct stricturea |
|---|---|
| Type 1 | Lower bile duct |

|
Differential diagnosis: pancreatic cancer, cholangiocarcinoma, chronic pancreatitis |
| Type 2 | Intrahepatic and extrahepatic bile duct |

|
Differential diagnosis: primary sclerosing cholangitis, secondary sclerosing cholangitis |
| Type 3 | Hilar and lower bile duct |

|
Differential diagnosis: cholangiocarcinoma, gallbladder cancer |
| Type 4 | Hilar bile duct alone |

|
Differential diagnosis: cholangiocarcinoma, gallbladder cancer |
Table 3
Differentiation of Immunoglobuling G4-related Sclerosing Cholangitis (IgG4-SC) from Primary Sclerosing Cholangitis (PSC)
| IgG4-SC | PSC | |
|---|---|---|
| Prevalence | 0.25-1/100,000 | 0.95-16.2/100,000 |
| Age at diagnosis (median) | 60-70 years | 35-40 years |
| Male predominance | 4-8:1 | 1.5-2:1 |
| Cholangiogram | Confluent stricture with proximal duct dilatation | Beaded, prune tree, diverticulum-like outpouching |
| Extrabiliary manifestation | IgG4-related disease such as pancreas, salivary gland, kidney and retroperitoneum (90%) | Inflammatory bowel disease (30-50% in Asian,60-80% in Western population) |
| Elevated serum IgG4 | 74-90% | 9-26% |
| Positive tissue IgG4 | 50-90% | 5-23% |
| Response to steroids based on radiographya | Mostly | Nob |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download