초록
배경
장기이식 전에 공여자 선택을 위해 사전에 공여자 HLA에 대한 항체 유무를 확인하는 것이 중요하고, 이식 후의 급성 또는 만성 거부반응을 예측하기 위해서도 HLA 항체에 대한 주기적인 추적 검사가 필요하다. 본 연구에서는 보체 활성화를 유발하는 HLA 항체를 검출할 수 있는 Luminex 검사법 중 C3d 검사를 시행하여 기존의 SAB 검사법과 비교하였다.
방법
HLA 항체 검사를 위해 검사실로 의뢰된 검체 중 class II SAB 검사(Immucor Transplant Diagnostics, USA)에서 양성인 혈액 검체 중 최종적으로 DSA 양성인 66개의 검체를 대상으로 하였다. 각 검체를 SAB 검사법과 C3d 검사법(Immucor Transplant Diagnostics)으로 검사를 시행한 후 MATCH IT! Antibody v1.3.1.5 (Immucor Transplant Diagnostics) 프로그램으로 HLA 항체 종류, MFI 값, 양성여부를 파악한 후 두 검사의 상관관계를 분석하였다.
결과
SAB 검사의 항체수는 11-20개인 구간에서 24개(36.4%)로 가장 많았고, C3d 검사는 항체수가 2-5개인 구간에서 23개(34.8%)로 가장 많았다. SAB 검사에서 양성인 항체 중에서 MFI≤3,000인 항체 440개 중 28개(6.4%)만이 C3d 검사 양성이었고, MFI≥3,001인 항체 556개 중 341개(61.3%)가 C3d 검사 양성이었다. 반면, C3d 검사에서 양성인 442개의 항체 중에서는 MFI≤500, 1,001≤MFI≤10,000인 구간에서 각각 32개(7.2%), 41개(9.3%)를 제외하고는 모두 SAB 검사도 양성이었다. C3d 검사 양성 검체가 C3d 검사 음성 검체보다 SAB의 최대 MFI 값이 더 큰 것으로 나타났다.
Go to : 
Abstract
Background
Detection of anti-human leukocyte antigen (HLA) antibodies is important during the selection of an appropriate donor prior to organ transplantation and also for monitoring the patients after transplantation. In this study, we compared antibodies detected via C3d assays, which monitors C3d complement-binding activities of HLA antibodies with those detected via single antigen bead (SAB) assays.
Methods
A total of 66 serum samples were tested in parallel by SAB assays (Immucor Transplant Diagnostics, USA) and C3d assays (Immucor) for the detection of HLA class II antibodies. The relationship between these two methods was analyzed based on the types, numbers, median fluorescent intensity (MFI) values, and positivity of the antibodies using MATCH IT! Antibody (Immucor) program.
Results
The number of antibodies obtained based on SAB and C3d assays was the highest with 24 samples (36.4%) in the 11–20 range and 23 (34.8%) in the 2–5 range detected via each assay. Among the SAB-positive antibodies, only 28 (6.4%) of the 440 antibodies with MFI ≤3,000 were C3d-positive, and 341 (61.3%) of the 556 antibodies with MFI ≥3,001 were C3d-positive. Whereas, among the 442 C3d-positive antibodies, SAB assays were positive except for 32 (7.2%) and 41 (9.3%) antibodies in the sections of MFI ≤500 and 1,001 ≤MFI ≤10,000, respectively. C3d-positive samples had higher maximum MFI values based on SAB assays, compared with C3d-negative samples.
Go to : 
임신, 수혈 및 장기이식 등을 통해 타인의 사람백혈구항원(human leukocyte antigen, HLA)에 노출되는 경우 동종면역 반응에 의해 HLA 항체가 생성될 수 있고, 이는 고형 장기이식 수혜자에게 항체매개성 거부반응(antibody-mediated rejection)을 유발할 수 있다[1, 2]. HLA는 그 종류가 매우 다양하므로 정확한 HLA 항체의 검출, 특히 공여자 특이 HLA와 반응하는 HLA 항체 검출은 이식 전 공여자의 선택뿐 아니라 이후 성공적인 장기 생착에도 필수적이다[3, 4]
패널반응항체(panel reactive antibody, PRA) 검사는 환자가 속해있는 인종 또는 집단의 HLA 빈도를 고려한 항원 패널을 이용하여 혈청 내의 HLA 항체를 검출 및 동정하는 검사이다. 그 중 solid phase-based PRA 방법은 추출 혹은 재조합 HLA 항원을 이용하므로 비 HLA 항체에 의한 위양성을 배제할 수 있어 기존 림프구를 이용한 방법에 비해 민감도가 높은 장점을 가진다[5, 6]. 그 중 Luminex-PRA는 높은 민감도를 보이며, 특히 각 비드마다 한 종류의 재조합 HLA 항원이 코팅된 비드를 이용한 단일항원비드(single antigen bead, SAB) 검사법은 직접 항체특이성을 확인할 수 있어 임상적으로 중요한 공여자특이항체(donor-specific antibody, DSA) 동정에 도움이 된다.
하지만, solid phase-based 방법으로 검출된 DSA가 이식 후 거부반응 또는 생존율과 큰 상관성을 보이지 않는다는 보고들이 있었는데, 이를 면역반응에서 보체 활성화를 유발하지 않는 HLA 항체까지 검출하기 때문으로 설명을 하였다[7, 8]. 최근 이를 보완하여 보체 활성화를 유발시키는 항체인지를 규명하는 검사법들이 개발되었고[9, 10], One Lambda사(One Lambda, Inc., Canoga Park, CA, USA)의 C1q screen과 Immucor사(Immucor Transplant Diagnostics, Norcross, GA, USA)의 C3d detection이 사용되고 있다.
보체를 이용한 새로운 검사법들은 이미 수 차례 기존 검사법들과 비교평가가 이루어져 왔고, 일부 임상 경과의 상관성에 대한 연구도 보고된 바 있다[11-16]. 하지만, 현재까지 다량의 검체를 대상으로 class II 항원을 이용한 C3d 검사법의 비교평가에 대한 연구는 없었다. 이에 본 연구에서는 SAB 검사법에서 class II HLA 항체가 검출된 환자들을 대상으로 C3d 검사를 시행하여 SAB 검사법과 C3d 검사법을 비교하고자 하였다.
Go to : 
계명대학교 동산병원에서 2015년 4월부터 2018년 9월까지 HLA항체 검사를 위해 검사실로 의뢰된 검체 중 class II SAB 검사(LIFECODES LSA Single Antigen, Immucor Transplant Diagnostics)에서 양성인 총 80개의 혈액 검체를 선별하였다. 선별된 검체 중 DSA가 확인되지 않은 14개는 제외하고 DSA 양성인 66개의 검체를 대상으로 하였다. 그 중 SAB 검사에서 양성을 보인 994개, C3d 검사에서 양성을 보인 442개의 항체를 분석하였다.
정규 검사 후 –80˚C 냉동고에 보관되어 있던 66개의 검체를 대상으로 class II C3d 검사(C3d detection kit, Immucor Transplant Diagnostics)를 시행하여 평행 검사를 진행하였다. 이 연구와 관련된 자료 수집 및 분석은 계명대학교 동산병원 기관윤리심의위원회(Institutional Review Board, IRB No. DSMC 2019-03-002)의 승인 하에 시행되었다.
본 연구에서는 Luminex-PRA 검사법 중 재조합된 HLA 항원이코팅된 비드를 이용하여 HLA 항체를 검출하는 방법을 SAB 검사법으로 지칭하였고, SAB를 환자 혈청과 반응시킬 때 C3d 보체를 첨가하여 C3d가 결합하는 HLA 항체를 검출하는 검사법을 C3d 검사법으로 지칭하였다.
Plate의 각 well에 40 μL의 LSA 비드를 첨가한 후, 10 μL의 환자혈청과 대조혈청을 분주하고 혼합하였다. Adhesive plastic cover로 plate를 덮고 호일 또는 상자를 이용하여 빛을 차단한 후 실온에서 30분간 배양하였다. 이후 cover를 제거하고 각 well에 100 μL의 wash buffer를 첨가하여 비드를 재부유시키기 위해 혼합하고 plate를 부드럽게 흡인하는 과정을 3회 반복하였다. 각 well에 50 μL의 diluted conjugate를 첨가하고 빛을 차단한 후 실온에서 30분간 배양하였다. 150 μL의 wash buffer를 각 well에 분주 후 비드를 재부유시키기 위해 혼합하였다. Luminex 장비(Luminex® 200™, Luminex Corp., Austin, TX, USA)를 이용해서 각 비드의 신호 강도를 측정하여 MATCH IT! Antibody v1.3.1.5 (Immucor Transplant Diagnostics)로 분석하였다. 각각의 비드별로 얻어진 median fluorescence intensity (MFI) 값을 이용하여 보정값을 구했다. 다음 3개의 보정값 중에서 두 개 이상의 adjusted (ADJ) MFI 값이 “Suggested Cutoff”보다 높은 경우 양성으로 판정하였다: 1) ADJ1=raw MFI 값에서 background (BG) MFI 값을 뺀 값; 2) ADJ2=ADJ1 값을 locus “1”에서 가장 낮게 반응한 비드의 raw MFI 값으로 나눈 값; 3) ADJ3 =ADJ2 값을 항원 밀도의 상대량으로 나눈 값. 이때 대조혈청은 검사키트에 포함된 LSA class II 대조혈청을 사용하였다.
40 μL의 LSA 비드와 1 μL의 양성대조 비드를 혼합한 후 plate의각 well에 40 μL의 mix와 10 μL의 혈청을 분주하였다. Adhesive plastic cover로 plate를 덮고 호일 또는 상자를 이용하여 빛을 차단한 후 실온에서 30분간 배양하였다. 이후 cover를 제거하고 각 well에 30 μL의 C3d 보체 혈청을 분주하였다. 다시 cover로 plate를 덮고 빛을 차단한 후 실온에서 30분간 배양하였다. 배양이 끝나면 각 well에 100 μL의 washing buffer를 분주하고 섞은 다음 부드럽게 흡인하는 과정을 4회 반복하였다. 각 well에 C3d conjugate를 50 μL씩 분주하고, 빛을 차단한 후 실온에서 30분간 배양하였다. 그 후 각 well에 100 μL의 washing buffer를 분주하고 혼합한 다음 흡인하고, 다시 분주하여 혼합하였다. Luminex 장비를 이용해서 각 비드의 신호 강도를 측정하여 MATCH IT! Antibody 프로그램으로 분석하였다. 다음 3개의 보정값 중에서 하나 이상에서 양성수치를 보이는 경우 양성으로 판정하였다: 1) BG Adjusted MFI=얻어진 MFI 값에서 음성대조혈청 MFI 값을 뺀 값; 2) BCR-Neg=BG Adjusted MFI를 해당 locus의 가장 낮게 반응한 bead의 raw MFI 값으로 나눈 값; 3) R-Strength=BG Adjusted MFI를 항원의 raw MFI 값으로 나눈 값. 이때 대조혈청은 검사키트에 포함된 LSA class II 대조혈청을 사용하였다.
MATCH IT! Antibody 프로그램을 통해 각 검체를 SAB 검사법과 C3d 검사법으로 분석한 HLA 항체 종류, MFI 값, 양성여부를 수집하였다. SAB 검사법은 raw MFI 값에서 BG MFI 값을 뺀 BG corrected MFI 값을 기준으로 하였고, C3d 검사법은 raw MFI 값에서 음성대조혈청의 MFI 값을 뺀 BG Adjusted MFI 값을 기준으로 하였다. 대한진단면역학회에서 제시한 HLA 보고서 표준안에 따라 MFI≤1,000, 1,001≤MFI≤3,000, 3,001≤MFI≤10,000, MFI≥ 10,000로 구분하였고, 세부적인 분석을 위해 MFI 500, 20,000, 30,000을 기준으로 하여 추가적으로 구간을 나누었다[17].
통계처리는 Microsoft Office Excel 2016 (Microsoft Co., Redmond, WA, USA)을 이용하였고, Analyse-it software v5.20 (Analyse-it Soft-ware, Ltd., Leeds, UK)을 이용하여 상관분석을 시행하였다.
Go to : 
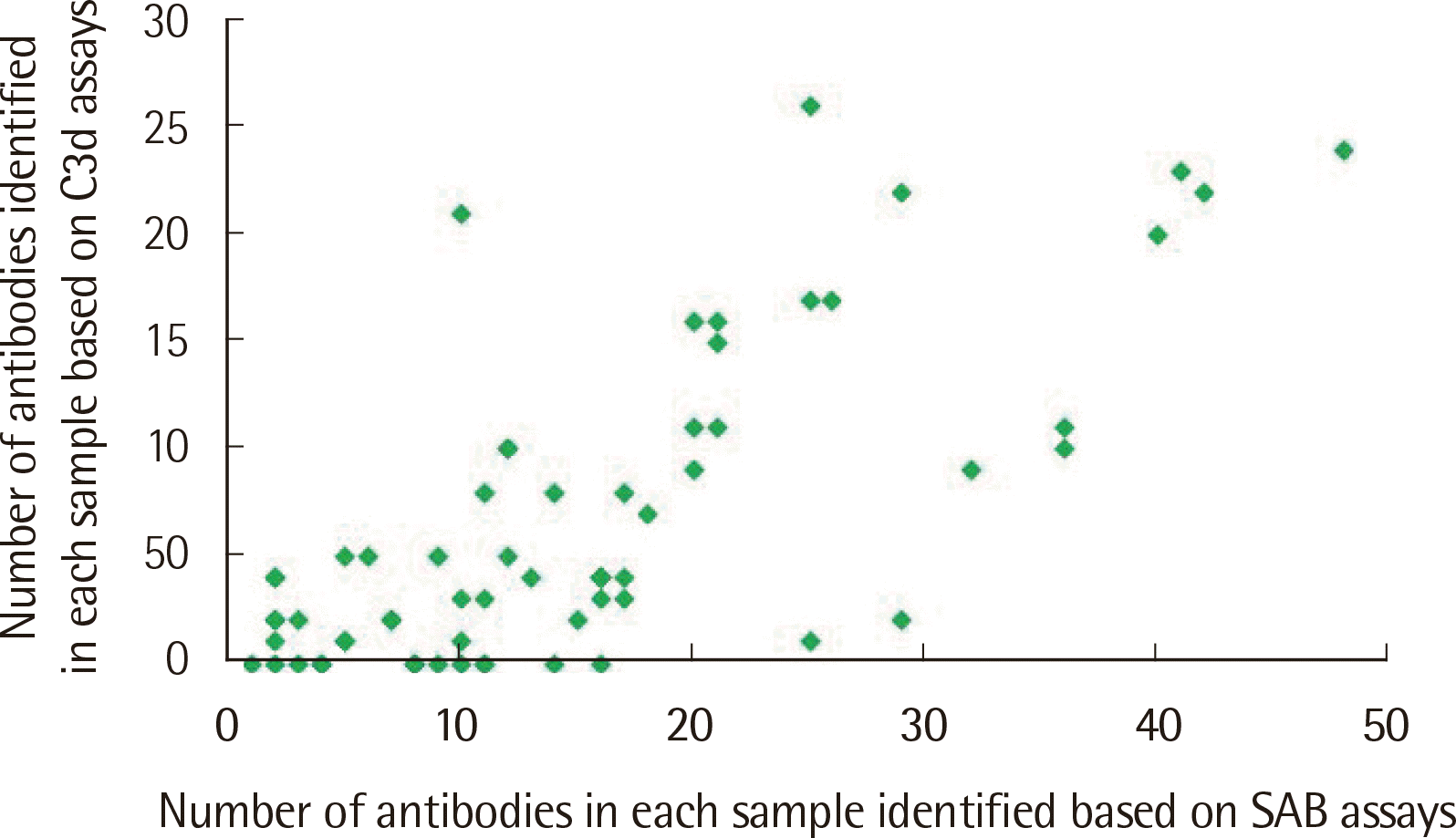
전체 검체 중 DSA 양성인 검체는 66예였고, 각 검체는 1개에서48개의 항체를 가지고 있었고 중간값은 12.5개였다. 그 중 52예가 C3d 검사 양성이었고 1개에서 26개의 항체를 가지며 중간값은 4개였다. SAB 검사와 C3d 검사에서 각각 996개와 442개의 항체가 양성이었다. SAB 검사와 C3d 검사에서 확인된 항체수의 피어슨 상관계수는 0.735로 양의 상관관계를 나타냈다(Fig. 1). 각 검사별 항체 수는 SAB 검사에서 항체수가 11-20개인 구간에서 24개(36.4%)로 가장 많았고, C3d 검사에서는 항체수가 2-5개인 구간에서 23개(34.8%)로 가장 많았다.
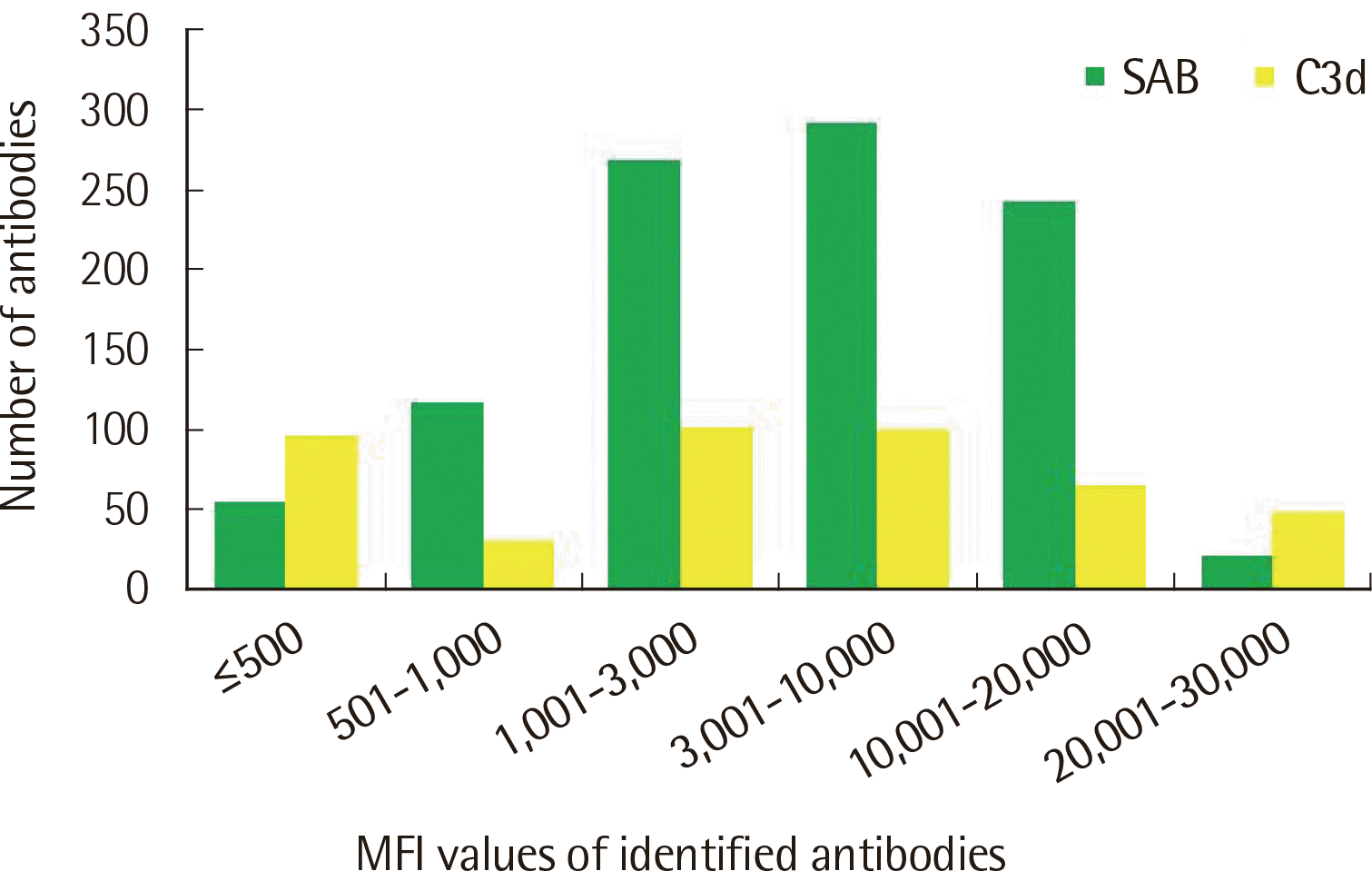
SAB 검사의 항체는 MFI 값이 1,001≤MFI≤20,000인 구간에 802개(80.7%)가 속한 반면, C3d 검사는 MFI≤500인 구간과 1,001 ≤MFI≤10,000인 구간에 299개(67.6%)의 항체가 속했다(Fig. 2).
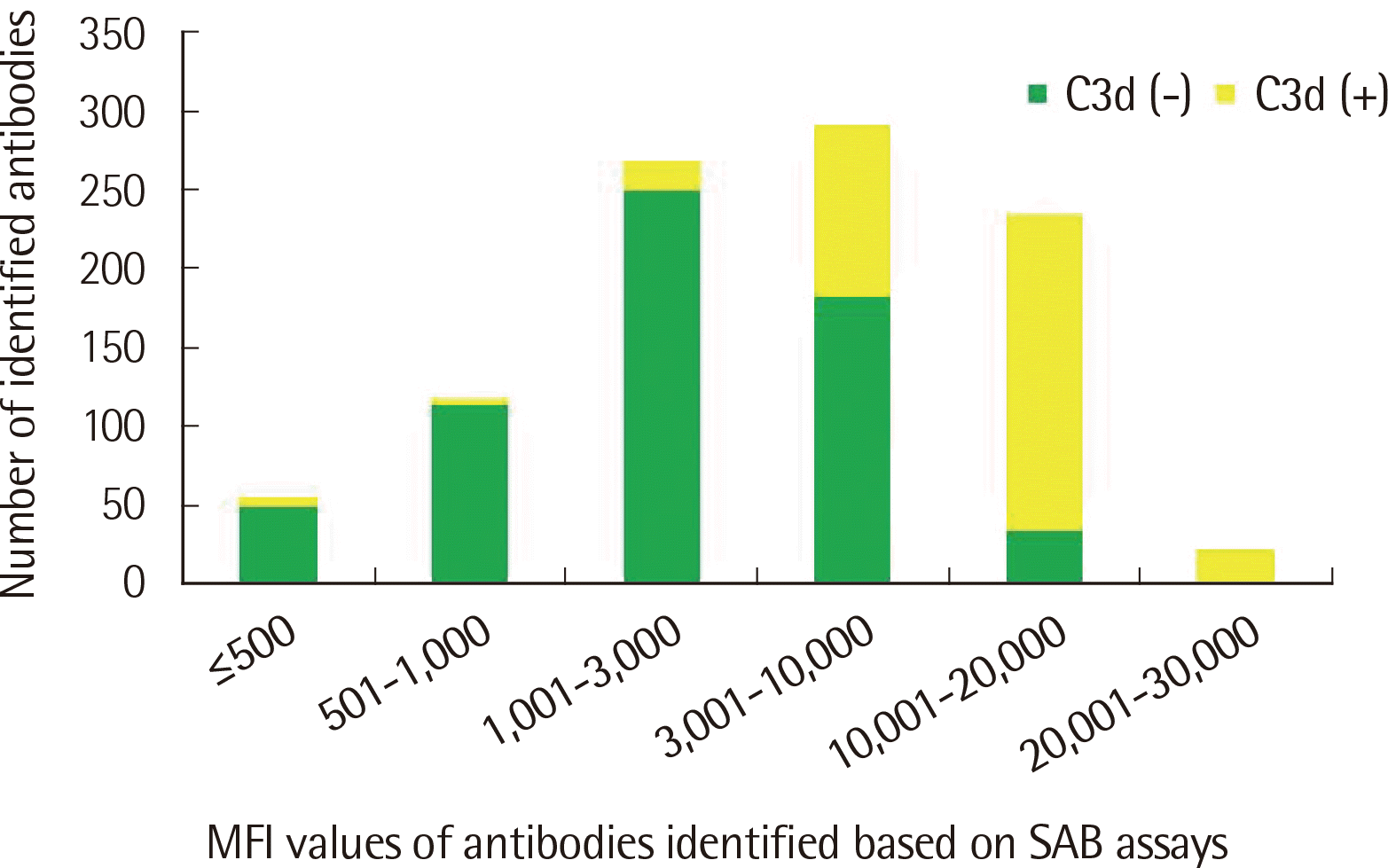
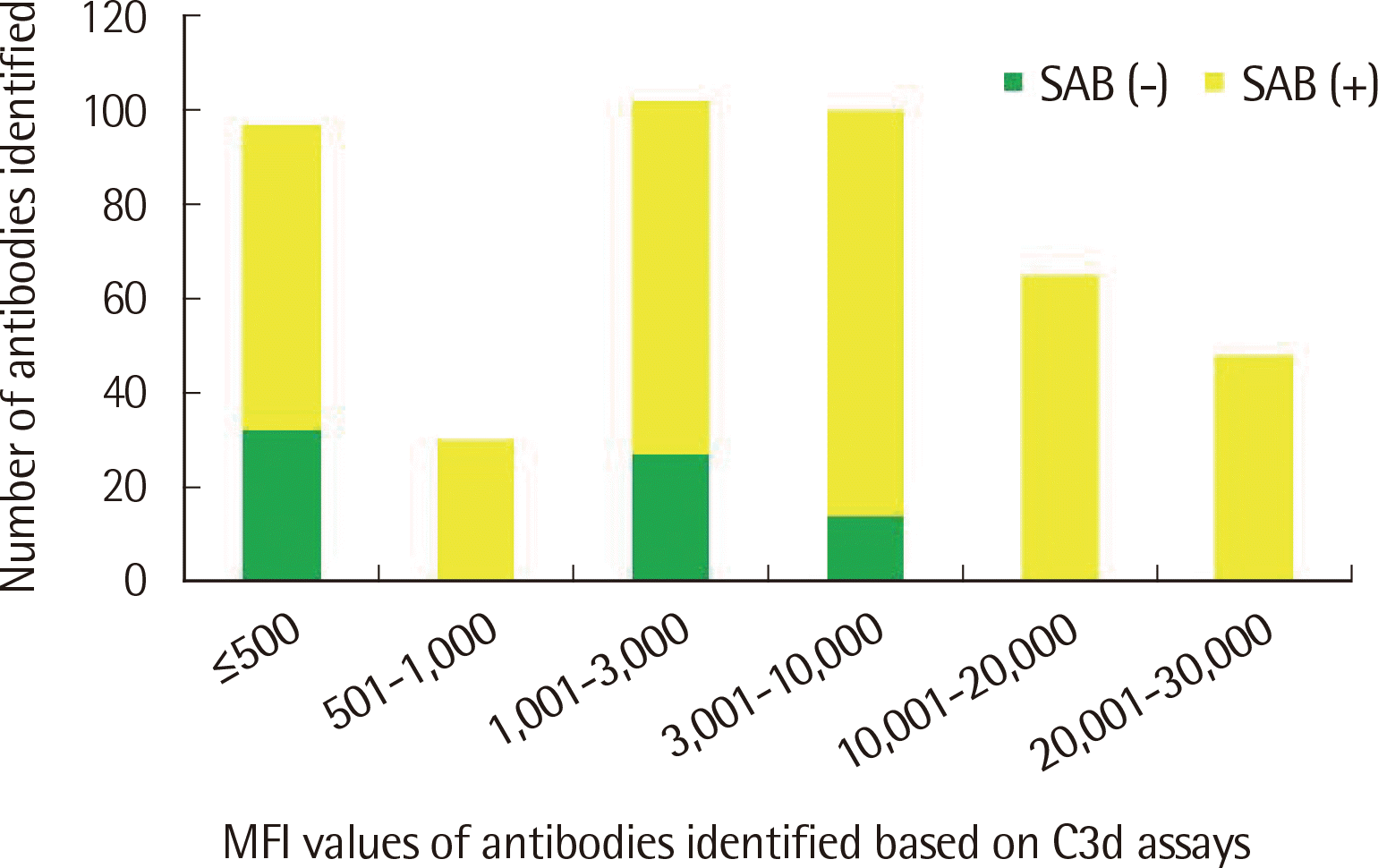
SAB 검사에서 양성인 항체 중에서 MFI≤3,000인 항체 440개 중28개(6.4%)만이 C3d 검사 양성이었고, MFI≥3,001인 항체 556개 중 341개(61.3%)가 C3d 검사 양성이었다(Fig. 3). 반면, C3d 검사에서 양성인 442개의 항체 중에서는 MFI≤500, 1,001≤MFI≤10,000인 구간에서 각각 32개(7.2%), 41개(9.3%)를 제외하고는 모두 SAB 검사도 양성이었다(Fig. 4). 한편, SAB 검사에서 음성이었으나 C3d 검사 양성인 항체는 26종, 총 73개였다. 이들의 MFI 값은 98부터 9,710까지였으며 평균값은 2,062, 중간값은 1,817이었다. 반대로, SAB 양성이나 C3d 검사 음성인 항체는 총 92종, 627개로 63.1%를 차지했다. 이들의 MFI 값은 86부터 14,888까지였으며 평균값은 3,207, 중간값은 1,935였다. DSA만을 대상으로 했을 때 SAB 검사 양성이나 C3d 검사 음성인 항체는 총 42종, 103개로 56.9%를 차지했다. 이들의 MFI 값은 206부터 8,505까지였으며 평균값은 2,488, 중간값은 1,591이었다.
Go to : 
DSA의 임상적 중요성이 거론되면서 항체의 강도, 항체의 종류, 항원결정기, 대립유전자, 염기서열 분석 및 새로운 검사법과 검사법 간 비교 등에 대한 많은 연구들이 이루어지고 있다[13, 16, 18-21]. 그 중 총 IgG SAB 검사와 C1q, C3d 보체를 이용한 SAB 검사를 CDC PRA 검사법으로 동정된 항체와 비교한 한 연구에서는 IgG SAB 검사가 가장 높은 일치도를 보였다. 또한 IgG SAB 검사의 MFI 값이 10,000보다 클 경우에 C1q와 C3d 보체 검사의 정확도가 높은 것으로 나타났다[13]. HLA class I 항체를 대상으로 SAB 검사법과 C3d 검사법을 비교한 한 연구에 의하면 C3d 검사 양성 검체가 C3d 검사 음성 검체보다 SAB 검사의 최대 MFI 값이 큰 것으로 나타났고 SAB 검사의 MFI 값은 C3d의 양성여부와 양의 상관관계를 보였다[19].
본 연구는 SAB 검사법과 C3d 검사법에서 HLA class II 항체를 비교한 것으로, 단일 기관에서 시행된 66예의 검체를 분석하였다. 그 결과 HLA class I 항체를 대상으로 한 앞선 연구와 동일한 양상을 보였다. 이는 MFI 값이 C3d 검사 양성여부의 강력한 예측인자라는 기존의 보고와 일치한다[20].
하지만 SAB 검사와 C3d의 양성여부 또는 MFI 값의 강도는 상관관계를 보이지 않는 경우도 있었다. 특히 SAB 검사에서 양성이지만 C3d 검사에서 음성인 항체가 63.1%였다. SAB 검사에서 DSA로 확인된 181개의 항체만을 대상으로 분석해봤을 때에도 동일하게 SAB 검사에서 양성이지만 C3d 검사에서 음성인 항체는 56.9%로 상당수가 존재했다. C3d 검사법은 면역반응에서 활성화되는 보체를 이용한 검사법이므로 실제 보체의존성면역반응에 관여하는 HLA 항체만을 검출한다[23]. 따라서 이전에 SAB 검사에서 실제로 보체의존성면역반응에 관여하지 않지만 양성으로 검출되었던 항체들이 음성으로 나왔을 것이라 예측해볼 수 있었다.
반대로 SAB 검사에서 음성이지만 C3d 검사에서 양성으로 검출된 항체는 보체경로를 활성화하는 항체 자체의 특성 때문에 기존 방법으로 찾아내지 못했던 항체를 찾을 수 있어서 유용하다고 생각하였으나 이에 대한 정확한 원인은 아직 알려지지 않았다. 흔히 면역검사법에서 위음성을 나타낼 수 있는 요인으로는 프로존 효과(prozone effect) 등이 있으나 본 연구에서는 명확하게 프로존 효과를 보이는 것으로 생각되는 항체들이 관찰되지 않았다[24].
DSA가 환자의 치료와 임상 결과에 미치는 영향이 크기 때문에 이식 후의 거부반응이나 환자의 임상양상과의 연관성도 함께 연구되어야 하지만 이번 연구에서는 이식 이후 환자의 임상양상을 포함하여 분석하지 못했다. 그러므로 C3d 검사 결과가 환자의 생존율에 어떠한 영향을 미쳤는지는 확인하지 못하였다는 제한점을 가진다. 이에 대해 이전에 보고된 바에 따르면 MFI 값과 무관하게 C3d 양성 DSA가 존재할 경우 C3d 음성인 경우보다 장기 생존율이 낮다는 연구결과가 있으며[16], DSA가 C1q와 C3d에 결합하는경우 이식 후 예후가 좋지 않다는 보고도 있다[14]. 추가적으로, 항체매개성 거부반응 진단 시 C4d 침착을 확인하기 위한 조직검사는 침습적인 반면 DSA 검출은 말초혈액 채혈로 가능하기 때문에훨씬 용이하다는 이점을 가진다. 또한 조직검사 결과가 항체매개성 거부반응 진단기준에 만족하지 못하더라도 C3d에 결합하는DSA가 존재할 때 조직 손상을 시사하는 미세혈관 염증 소견이 보이는 경우도 있으므로[15], DSA의 중요성은 더욱 강조된다.
결론적으로 HLA class II 항체의 SAB 검사에서의 MFI 값은 C3d 검사 음성인 경우보다 양성인 경우에 더 큰 것으로 나타났다. 하지만 C3d 검사의 양성여부와 SAB 검사에서의 MFI 값의 크기가 상관관계를 보이지 않는 경우도 있었으므로 향후 이에 대한 검증이 필요하며, 임상적 중요성에 대해서도 추가적인 연구가 필요할 것이다.
Go to : 
REFERENCES
1. Tinckam KJ, Chandraker A. 2006; Mechanisms and role of HLA and non-HLA alloantibodies. Clin J Am Soc Nephrol. 1:404–14. DOI: 10.2215/CJN.00270106. PMID: 17699239.

2. Valenzuela NM, Reed EF. 2013; Antibodies in transplantation: The effects of HLA and non-HLA antibody binding and mechanisms of injury. Methods Mol Biol. 1034:41–70. DOI: 10.1007/978-1-62703-493-7_2. PMID: 23775730. PMCID: PMC3879955.

3. Loupy A, Suberbielle-Boissel C, Hill GS, Lefaucheur C, Anglicheau D, Zuber J, et al. 2009; Outcome of subclinical antibody-mediated rejection in kidney transplant recipients with preformed donor-specific antibodies. Am J Transplant. 9:2561–70. DOI: 10.1111/j.1600-6143.2009.02813.x. PMID: 19775320.

4. Schönemann C, Groth J, Leverenz S, May G. 1998; HLA class I and class II antibodies: monitoring before and after kidney transplantation and their clinical relevance. Transplantation. 65:1519–23. DOI: 10.1097/00007890-199806150-00024. PMID: 9645818.
5. Jung S, Oh EJ, Yang CW, Ahn WS, Kim Y, Park YJ, et al. 2009; Comparative evaluation of ELISA and Luminex panel reactive antibody assays for HLA alloantibody screening. Korean J Lab Med. 29:473–80. DOI: 10.3343/kjlm.2009.29.5.473. PMID: 19893358.

6. Joo DJ, Huh KH, Kim YS, Yoon SJ, Kim HJ, Sohn SS, et al. 2011; Predictive value of donor specific antibody measured by Luminex single antigen assay for antibody mediated rejection after kidney transplantation. J Korean Soc Transplant. 25:169–75. DOI: 10.4285/jkstn.2011.25.3.169.

7. Aubert V, Venetz JP, Pantaleo G, Pascual M. 2009; Low levels of human leukocyte antigen donor-specific antibodies detected by solid phase assay before transplantation are frequently clinically irrelevant. Hum Immunol. 70:580–3. DOI: 10.1016/j.humimm.2009.04.011. PMID: 19375474.

8. Vlad G, Ho EK, Vasilescu ER, Colovai AI, Stokes MB, Markowitz GS, et al. 2009; Relevance of different antibody detection methods for the prediction of antibody-mediated rejection and deceased-donor kidney allograft survival. Hum Immunol. 70:589–94. DOI: 10.1016/j.humimm.2009.04.018. PMID: 19375470.

9. Zeevi A, Lunz J, Feingold B, Shullo M, Bermudez C, Teuteberg J, et al. 2013; Persistent strong anti-HLA antibody at high titer is complement binding and associated with increased risk of antibody-mediated rejection in heart transplant recipients. J Heart Lung Transplant. 32:98–105. DOI: 10.1016/j.healun.2012.09.021. PMID: 23142561. PMCID: PMC3628631.

10. Loupy A, Lefaucheur C, Vernerey D, Prugger C, Duong van Huyen JP, Mooney N, et al. 2013; Complement-binding anti-HLA antibodies and kidney-allograft survival. N Engl J Med. 369:1215–26. DOI: 10.1056/NEJMoa1302506. PMID: 24066742.

11. Llorente S, Boix F, Eguia J, López M, Bosch A, Martinez H, et al. 2012; C1q-fixing human leukocyte antigen assay in immunized renal patients: correlation between Luminex SAB-C1q and SAB-IgG. Transplant Proc. 44:2535–7. DOI: 10.1016/j.transproceed.2012.09.084. PMID: 23146446.

12. Kamburova EG, Wisse BW, Joosten I, Allebes WA, van der Meer A, Hilbrands LB, et al. 2018; Pretransplant C3d-fixing donor-specific anti-HLA antibodies are not associated with increased risk for kidney graft failure. J Am Soc Nephrol. 29:2279–85. DOI: 10.1681/ASN.2018020205. PMID: 30049681. PMCID: PMC6115667.

13. Moreno Gonzales MA, Mitema DG, Smith BH, Schinstock CA, Stegall MD, Wakefield LL, et al. 2017; Comparison between total IgG, C1q, and C3d single antigen bead assays in detecting class I complement-binding anti-HLA antibodies. Transplant Proc. 49:2031–5. DOI: 10.1016/j.transproceed.2017.09.040. PMID: 29149956.

14. Lee H, Han E, Choi AR, Ban TH, Chung BH, Yang CW, et al. 2018; Clinical impact of complement (C1q, C3d) binding de novo donor-specific HLA antibody in kidney transplant recipients. PLoS One. 13:e0207434. DOI: 10.1371/journal.pone.0207434. PMID: 30427941. PMCID: PMC6235372.

15. Comoli P, Cioni M, Tagliamacco A, Quartuccio G, Innocente A, Fontana I, et al. 2016; Acquisition of C3d-binding activity by de novo donor-specific HLA antibodies correlates with graft loss in nonsensitized pediatric kidney recipients. Am J Transplant. 16:2106–16. DOI: 10.1111/ajt.13700. PMID: 26725780.

16. Sicard A, Ducreux S, Rabeyrin M, Couzi L, McGregor B, Badet L, et al. 2015; Detection of C3d-binding donor-specific anti-HLA antibodies at diagnosis of humoral rejection predicts renal graft loss. J Am Soc Nephrol. 26:457–67. DOI: 10.1681/ASN.2013101144. PMID: 25125383. PMCID: PMC4310653.

17. Laboratory standardization of reporting HLA typing. http://www.ksdi-lm.org/rang_board/list.html?.num=50&code=lib. Updated on Feb 2017.
18. Malheiro J, Santos S, Tafulo S, Dias L, Martins S, Fonseca I, et al. 2018; Detection of complement-binding donor-specific antibodies, not IgG-antibody strength nor C4d status, at antibody-mediated rejection diagnosis is an independent predictor of kidney graft failure. Transplantation. 102:1943–54. DOI: 10.1097/TP.0000000000002265. PMID: 29757900.

19. Ko SY, Lee W, Jung CW, Cho Y. 2018; C3d assay in correlation with single antigen bead assay for human leukocyte antigen antibodies. Transplant Proc. 50:2354–8. DOI: 10.1016/j.transproceed.2018.03.056. PMID: 30316357.

20. Claisse G, Absi L, Cognasse F, Alamartine E, Mariat C, Maillard N. 2017; Relationship between mean fluorescence intensity and C1q/C3d-fixing capacities of anti-HLA antibodies. Hum Immunol. 78:336–41. DOI: 10.1016/j.humimm.2017.02.003. PMID: 28189573.

21. Morales-Buenrostro LE, Terasaki PI, Marino-Vázquez LA, Lee JH, El-Awar N, Alberú J. 2008; "Natural" human leukocyte antigen antibodies found in nonalloimmunized healthy males. Transplantation. 86:1111–5. DOI: 10.1097/TP.0b013e318186d87b. PMID: 18946350.

22. El-Awar N, Lee JH, Tarsitani C, Terasaki PI. 2007; HLA Class I epitopes: recognition of binding sites by mAbs or eluted alloantibody confirmed with single recombinant antigens. Hum Immunol. 68:170–80. DOI: 10.1016/j.humimm.2006.11.006. PMID: 17349872.

23. Pelletier RP, Balazs I, Adams P, Rajab A, DiPaola NR, Henry ML. 2018; Clinical utility of C3d binding donor-specific anti-human leukocyte antigen antibody detection by single antigen beads after kidney transplantation-a retrospective study. Transpl Int. 31:424–35. DOI: 10.1111/tri.13106. PMID: 29265514.

24. Schwaiger E, Wahrmann M, Bond G, Eskandary F, Böhmig GA. 2014; Complement component C3 activation: the leading cause of the prozone phenomenon affecting HLA antibody detection on single-antigen beads. Transplantation. 97:1279–85. DOI: 10.1097/01.TP.0000441091.47464.c6. PMID: 24621535.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download