초록
배경
반코마이신과 아미노글리코사이드 계열 항생제는 좁은 치료범위와 고농도에서의 신독성 부작용 때문에 약물농도 측정 (therapeutic drug monitoring)이 추천된다. 이 연구는 주요 국내 임상검사실의 약물농도 측정 현황을 분석하기 위해 수행되었다.
방법
총 10개 기관이 연구에 참여했다. 반코마이신, 아미카신, 겐타마이신, 토브라마이신에 대해 5-6개의 농도로, 각 농도당 3개씩의 검체를 제조하였다. 각 측정값을 이용하여 전체 기관의 평균, 표준편차를 구하고 개별기관의 정밀도를 평가하였으며, 다양한 방법으로 기관별 결과 차이를 분석하였다.
결과
세 회사의 여섯 가지 장비가 약물농도 측정에 사용되었다. 대부분의 기관이 최저농도 검체의 값은 최소정량한계 미만으로 보고하였다. 검사실 내 변이계수는 반코마이신에서 1.05-10.89%, 아미카신에서 0.80-18.16%, 겐타마이신에서 1.19-7.80%, 토브라마이신에서 1.27-6.05%였다. 전체 참여기관 결과를 기준으로 할 때 한 기관의 반코마이신 검체에서만 3 SDI를 초과했고 그 외에는 2 SDI 미만이었다. CAP 기준은 모든 기관에서 통과하였지만, 반코마이신에서 한 기관, 겐타마이신에서 세 기관이 RCPA 허용기준을 충족시키지 못했다.
Abstract
Background
Therapeutic drug monitoring (TDM) is clinically recommended for vancomycin and aminoglycoside antibiotics owing to their narrow therapeutic range and nephrotoxicity at high concentrations in the blood. This study was conducted to investigate the current status of TDM of vancomycin and aminoglycosides in Korean clinical laboratories.
Methods
Ten organizations participated in this survey. Vancomycin, amikacin, gentamicin, and tobramycin were prepared in three samples of five or six different concentrations. Data from each institution were calculated for the mean, standard deviation, within-day, between-day, and within-laboratory precision. The results from each institution were compared in various ways.
Results
Six instruments from three manufacturers were used. Samples with the lowest drug concentration were reported as below the lower limit of quantitation in most laboratories. Coefficients of variation for within-laboratory values ranged from 1.1% to 10.9% for vancomycin, 0.8% to 18.2% for amikacin, 1.2% to 7.8% for gentamicin, and 1.3% to 6.1% for tobramycin. Based on the overall results of the participants, only one institution’s vancomycin samples standard deviation index exceeded 3, with all other values below 2. The College of American Pathologist criteria were met by all institutions; however, measurement of vancomycin in one laboratory and of gentamycin in three laboratories failed to meet the Royal College of Pathologists of Australasia acceptance criteria.
치료적 약물농도 모니터링(therapeutic drug monitoring)은 항암제, 정신과 약물, 항생제 등과 같이 체내 농도가 중요한 약물에서 치료의 효과를 최대화하고 독성을 최소화하기 위해 추천되고 있다[1-3]. 항생제 중 베타락탐계열, 마크로라이드와 퀴놀론 계열 등은 넓은 치료범위를 가지고 있기에 약물농도 측정의 필요성이 낮다. 하지만 반코마이신과 아미노글리코사이드 계열 항생제와 같이 치료범위가 좁고 혈중 고농도에서 신독성의 위험이 있는 약물은 부적절한 용량을 사용할 경우 치료효과가 미흡하거나 독성 부작용이 나타날 수 있어 약물농도 측정의 필요성이 높다[3, 4]. 반코마이신은 메티실린 내성 황색 포도상 구균(methicillin-resistant Staphylococcus aureus)의 첫 번째 치료제로 사용되고 있으며[5],아미노글리코사이드 계열 약물은 대부분 비슷한 항균범위를 보이면서 그람 음성 장내세균 및 포도상 구균에 강력한 항균작용을 갖고 있다[6]. 이처럼 반코마이신과 아미노글리코사이드 항생제는다양한 감염증의 치료에 많이 사용되고 있어서 임상적으로 약물농도 측정이 추천되고 있다[7, 8]. 특히, 이러한 항생제들은 전신적 상태가 저하된 집중치료실(intensive care unit)의 환자와 면역저하자 등에서 흔하게 사용되므로 적절한 혈중농도 유지를 위한 약물농도 측정의 중요성이 크다[9].
약물농도 측정에는 다양한 검사방법이 있으며, 검사법이 임상검사실 간 일치화(harmonization)되거나 표준화(standardization) 되지 않은 경우, 동일한 임상 시료에 대해 다른 수치 결과를 얻을 수 있다. 기존 영국 및 독일에서 시행된 반코마이신과 아미노글리코사이드 항생제 등을 여러 회사의 다양한 장비를 사용하여 측정한 연구에서 제조사별로 유의한 차이가 있음이 보고된 바 있으며[4, 10], 외부정도관리에서도 제조사별 차이가 관찰되고 있다[11]. 그러나 이러한 임상검사실 간 검사 결과값의 차이에도 불구하고, 대부분의 의료기관에서는 사용하는 검사법과 관계없이 동일한 목표치료범위(therapeutic target range)를 사용하고 있다. 임상적으로의미 있는 수치 이상의 차이가 발생한다면, 환자의 질병 진단과 추적 진료에 영향을 미칠 수 있으므로 약물농도 측정의 일치화 및표준화가 요구되고 있다[12].
국내에서는 1995년부터 대한임상검사정도관리협회에서 주관하여 일반치료적약물 검사에 대한 신빙도조사를 시행해오고 있으며, 2019년 현재 연간 2회, 매 회차마다 3가지의 검체를 발송하고 있다. 그러나 신빙도조사를 통해 다른 기관들과의 결과 비교는 가능하지만, 1회 조사 시 3개의 검체만 평가하므로 이를 통해 얻을 수 있는 정보가 제한적이다. 이 연구에서는 국내 의료기관의 항생제 약물농도 측정 현황을 조사하였으며, 대한임상검사정도관리협회 신빙도조사와 비교하여 다양한 농도의 많은 검체를 발송하였다. 이를 통해 국내 의료기관들의 임상검사실 간 약물농도 결과값에 차이가 있는지 조사하고, 임상검사실 결과값에 차이가 있는 경우 이에 대한 원인 분석과 대안을 제시하고자 하였다.
반코마이신을 비롯하여 아미노글리코사이드 계열 항생제 중 아미카신, 겐타마이신, 토브라마이신 등 총 4가지 약물을 평가하였다. 연구 참여 대상은 2018년 11월을 기준으로 대한임상검사정도관리협회에서 시행하는 일반치료적약물 신빙도조사에 참여한 기관들 중 검사기관의 규모와 검사장비 및 시약의 대표성을 감안하여 선정하였다. 2018년 2차 반코마이신 신빙도조사 프로그램에 참여한 기관은 총 70기관이었으며, 이 중 10개의 기관(한림대학교 강남성심병원, 국립중앙의료원, 녹십자의료재단, 분당서울대학교병원, 삼성서울병원, 서울대학교병원, 서울성모병원, 서울아산병원, 세브란스병원, 충남대학교병원)이 연구에 참여하였다. 아미카신, 겐타마이신, 토브라마이신에 대한 일반치료적약물 신빙도조사 프로그램에 참여한 기관은 각각 5기관(분당서울대학교병원, 삼성서울병원, 서울대학교병원, 서울아산병원, 세브란스병원), 4기관(분당서울대학교병원, 삼성서울병원, 서울대학교병원, 서울아산병원), 3기관(분당서울대학교병원, 삼성서울병원, 서울대학교병원)이었으며 모든 기관들이 이 연구에 참여하였다.
반코마이신, 아미카신, 겐타마이신, 토브라마이신 등의 농도 측정을 위한 참고물질(reference material)은 Sigma-Aldrich (St. Louis, MO, USA)에서 구매하였으며, 해당 약물을 복용하지 않은 사람의 잔여 혈청으로 제조한 혈청 풀(pooled serum)에 참고물질을 첨가하여 제조하였다. 임상적으로 의미가 있는 것으로 알려진 혈중 약물농도 측정범위를 포함하도록 반코마이신, 겐타마이신, 토브라마이신은 다섯 가지의 농도로, 아미카신은 여섯 가지의 농도로, 각 농도당 3개씩의 검체를 제조하였다. 가장 낮은 농도는 레벨1로, 가장 높은 농도는 레벨5(아미카신은 레벨6)로 설정하였다.
2018년 11월 12일부터 23일까지 참여기관들의 검사 현황 및 평가용 물질 측정 결과를 수집하였다. 평가용 물질은 배송 전까지 영하 70°C에 보관하였다가, 동일한 날짜에 드라이아이스가 포함된액상 냉동 상태로 퀵서비스를 이용하여 연구 참여기관으로 운송하였다. 각 기관에는 약물 측정값과 함께 측정 원리, 검사장비 제조사, 검사장비 모델, 검사시약명, 시약 Lot 번호, 보정물질명, 보정물질 lot 번호, 측정가능범위를 기입해 달라고 요청하였다. 검체 발송 전 이메일로 참여 기관의 약물농도 측정 담당 검사자 및 전문의에게 결과 입력 양식을 발송하였으며, 약물농도 측정 후 결과지를회수하였다. 모든 검체는 두 번씩 반복 측정하였으며, 반코마이신,겐타마이신, 토브라마이신의 경우 하루에 다섯 개씩, 아미카신은여섯 개씩 3일에 걸쳐서 총 15개와 18개 검체를 각각 측정하도록하였다. 취합된 측정값을 이용하여 각 약물의 농도별로 평균과 표준편차 등을 구하였다.
정밀도는 각 검사실에서 측정하여 보고한 반코마이신, 아미카신, 겐타마이신, 토브라마이신 등의 결과를 이용하여 검사일 내 변이계수(within-day coefficient of variation, CV), 검사일 간 변이계수(between-day CV), 검사실 내 변이계수(within-laboratory CV) 등을 계산하였다.
대한임상검사정도관리협회 신빙도조사 프로그램은 표준편차지수법을 사용하여 기관별 결과 차이를 분석하고 있으며 기준분류, 세분류의 3 표준편차지수(standard deviation index, SDI) 이내의 결과를 적합하다고 판정하고 있다. 그러나 아미카신, 겐타마이신, 토브라마이신 등의 경우 전체 참여기관의 수가 10개 미만이기에 대한임상검사정도관리협회 원칙에 따라 평균, 표준편차, 변이계수, 표준편차지수 등의 통계값이 제시되지 않으며, 중앙값과의 비교만 가능한 상태로 보고서가 제공되고 있다. 이 연구에서는 약물농도 측정의 경우 측정값의 일치도 향상 및 표준화가 중요하다고 생각되어, 다른 검사장비와 시약을 사용하여 측정되었어도 참여 기관에서 측정한 모든 값에 대해 평균과 표준편차를 기준으로 하여 표준편차지수법으로 평가하였다.
한편, College of American Pathologist (CAP)에서 주관하는 국외 외부정도관리 프로그램은 허용 가능 범위를 반코마이신과 아미카신은 동료 그룹의 ±3 SD 혹은 ±10% 이내로 제시하고 있으며, 겐타마이신과 토브라마이신은 동료 그룹의 ±25%로 제시하고 있다. 또한 다른 국외 외부정도관리 프로그램인 Royal College of Pathologists of Australasia (RCPA)의 약물농도 측정에서는 허용 가능 범위를 각각 낮은 농도와 높은 농도로 나눠 제시하고 있다[13]. 반코마이신은 20.3 µg/mL 이하 농도에서는 ±2.0 µg/mL이고, 20.3 µg/mL를 초과하는 농도에서 ±10%로 허용기준을 제시하고 있고, 아미카신의 허용기준은 ≤19.9 µg/mL의 농도에서 ±2.0 µg/mL이며, 19.9 µg/mL을 초과하는 경우 ±10% 이내이다. RCPA에서 제시한 겐타마이신과 토브라마이신의 허용기준은 ≤2.0 µg/mL에서 ±0.2 µg/mL이고, 2.0 µg/mL을 초과하는 경우 ±10%이다. 각 기관에서 측정한 값에 대해 평균값과 비교한 결과를 CAP과 RCPA 허용기준에 따라 평가하였다.
취합된 측정값 중 이상치 탐지는 Grubbs 방법에 따라 시행하였다[14]. 기관별 또는 장비 간 측정된 값에 유의한 차이가 있는지는 두 군 간에는 Mann-Whitney U test, 세 군 이상에는 Kruskal-Wallis test를 이용하여 평가하였으며, P-value가 0.05 미만인 경우에 통계적으로 유의하다고 판정하였다. 통계 분석은 Microsoft Excel (Microsoft Corporation, WA, USA), Med-Calc version 11.5.1 (Med-Calc Software, Mariakerke, Belgium), R version 3.6.1 (R Foundation for Statistical Computing, Vienna, Austria) 등을 사용하여 분석하였다.
연구에 참여한 기관은 상급종합병원 7기관, 종합병원 2기관, 진단검사 전문 수탁 기관 1곳이었다. 설문에 참여한 기관의 각 약물 별 측정에 사용한 검사장비, 측정 원리, 측정가능범위(analytical measurement range) 등을 Table 1에 정리하였다. 참여 기관들은 세 회사의 여섯 가지 검사장비를 사용하고 있었다. 동일한 검사장비를 사용하는 곳은 많지 않았으며, 세 기관에서 Architect i2000 (Abbott Laboratories, Abbott Park, IL USA)으로 반코마이신을 측정하는 경우가 최대 동료 그룹을 형성하였다.
제조한 물질의 목표 값, 참여한 기관의 수, 물질 별로 측정된 항생제 농도 값의 평균과 표준편차 등을 Table 2에 정리하였다. 측정값이 정량하한 값 미만이나 측정가능범위 초과였던 경우는 통계 분석에서 제외하였다. 반코마이신의 경우 레벨1 검체는 Siemens사의 ADVIA Centaur XP (Siemens Healthcare Diagnostics, Deerfield, IL, USA)와 Dimension EXL 2000 (Siemens Healthcare Diagnostics)에서만 측정되었고, 다른 검사장비를 사용하는 기관에서는 정량한계 미만으로 보고하였다. 아미카신과 토브라마이신은모든 기관에서 하나 이상의 값을 정량한계 미만으로 보고하였고겐타마이신의 레벨1 검체는 Cobas c702 (Roche Diagnostics, Mannheim, Germany)에서만 측정되었다. 아미카신은 Cobas c501 (Roche Diagnostics)에서 레벨6 검체의 값이 측정가능범위의 상한값을 초과하는 것으로 보고되었다.
장비별 검사결과는 상자 수염 그림(box and whisker plot)으로 Fig. 1에 나타냈으며, 최댓값, 최솟값, 중앙값, 사분편차 및 분포도 등을 표시하였고 약물별 참여기관의 전체적인 통계를 비교하기 위하여 장비 종류에 따른 평균, 표준편차, 변이계수 등을 Fig. 2로 나타내었다. 반코마이신은 Integra 800 (Roche Diagnostics)에서의 측정값이 모든 레벨에서 중앙값보다 높았으며, 레벨2, 3, 4 검체에서는 가장 높은 농도로 측정되었다. 레벨5 검체의 평균 농도는 AD-VIA Centaur XP에서 65.70 μg/mL, Integra 800에서 80.43 μg/mL로 측정되어 장비 간 차이가 가장 컸다. 아미카신은 저농도인 레벨2, 3 검체에서 Cobas c501, c702가 Integra 800보다 더 높게 측정되었다. 겐타마이신의 경우 Architect i2000에서 측정된 대부분의 값이 중앙값보다 높았으며, 레벨3, 4, 5 검체에서 가장 높은 값이 측정되었다. 반면 Cobas c702는 모든 검체에서 가장 낮은 값이 측정되었다. 반코마이신과 겐타마이신의 경우 모든 레벨에서 장비 별로유의한 차이가 관찰되었으나, 아미카신은 레벨2, 3 검체와 토브라마이신의 레벨2, 4 검체에서만 장비 간 유의한 차이가 관찰되었다.
동일 장비를 사용하는 기관별 측정 값 차이가 있는지를 Fig. 3에 정리하였다. Cobas c501, c702를 사용하는 기관 사이에서는 반코마이신과 토브라마이신의 레벨3 검체에서 기관별 유의한 차이가 관찰되었으며, 아미카신의 경우 레벨2, 4, 6 검체에서 유의한 차이가 관찰되었다. Architect i2000을 사용하는 기관 사이에서 반코마이신은 유의한 차이가 관찰되지 않았으나 아미카신의 레벨3, 4 검체에서 유의한 차이가 관찰되었다. ADVIA Centaur XP를 사용하는 두 기관에서 반코마이신 측정 결과는 유의한 차이가 관찰되지않았다.
개별 검사실에서 측정한 결과를 바탕으로 계산한 검사일 내 변이계수, 검사일 간 변이계수, 검사실 내 변이계수의 범위를 Table 3에 정리하였다. 검사일 내 변이계수는 아미카신의 레벨2 (CV, 20.96%) 검체를 제외하면 모두 10% 미만이었다. 검사일 내 변이계수는 반코마이신의 경우 5.60% 이내였으며, 겐타마이신은 6.64%, 토브라마이신은 5.60% 이내였다. 검사일 간 변이계수는 반코마이신의 레벨2 검체와 아미카신의 레벨2, 3 검체에서 각각 10%를 초과하였으며, 그 외의 약물과 다른 모든 농도에서는 10% 미만이었다. 검사실 내 변이계수는 반코마이신의 레벨2 검체와 아미카신의 레벨2, 3 검체에서 10%를 초과하였다. 반코마이신의 경우 레벨 2 검체에서 10.89%를 보인 것 이외에는 6.60% 이하의 검사실 내 변이계수를 보였다. 아미카신의 검사실 내 변이계수는 레벨3 검체에서 4.05-18.16% 범위였으나, 레벨5 검체에서 0.80-3.78%의 범위로 감소하여 고농도에서 정밀도가 향상되는 경향을 보였다.
참여한 모든 기관의 검체별 결과 및 허용기준을 벗어난 결과를Fig. 4에 나타내었다. 반코마이신은 한 기관에서 Integra 800으로 측정한 레벨3 검체 결과가 3 SDI를 초과하였지만, 그 외의 모든 경우에서는 2 SDI 미만의 양호한 결과를 보였다. CAP 허용기준에 맞춰 평가했을 때에는 모든 기관의 항생제 농도가 허용가능 범위 내에 있었다. RCPA 기준을 참고했을 때 반코마이신은 레벨3 검체(평균 22.19 µg/mL)와 레벨4 검체(평균 45.06 µg/mL)에서 한 기관만 각각 25.73 µg/mL, 54.60 µg/mL로 허용기준을 벗어났으며 그 외의 모든 결과는 허용기준에 부합하였다. 아미카신과 토브라마이신에 대해서는 모든 결과가 허용기준을 충족시켰다. 겐타마이신은 레벨4 검체와 레벨5 검체에서 네 기관 중 각각 두 기관과 세 기관이 허용기준에서 벗어났다.
이 연구는 국내 의료기관의 항생제 약물농도 측정 현황을 파악하기 위해 시행되었다. 반코마이신과 아미노글리코사이드 항생제는 치료범위가 좁고 혈중 고농도에서 신독성의 위험이 있어 치료 목표 농도를 유지하면서 독성 농도가 되지 않도록 조절하는 것이 중요한 약물로, 결과값의 차이가 있는 경우 임상적 치료 및 약물용량이 달라지게 되므로 정확한 값을 측정하는 것이 중요하다. 아미노글리코사이드 항생제의 경우 1일 1회 요법(once-daily dosing)과 1일 다회 요법(multiple-daily dosing)이 질병에 따라 사용되고 있는데, 두 요법의 경우 목표 값과 독성 농도 값이 서로 달라 사용하는 요법에 따라 여러 농도를 측정하는 것이 요구된다[15]. 따라서 이 연구에서는 기존 신빙도조사보다 많은 농도의 검체를 제조하여 평가하였다. 반코마이신은 선별된 10개 기관이, 아미노글리코사이드 항생제 3종은 국내에서 측정 중인 모든 기관이 참여하였고, 항생제별로 5-6가지의 농도에 대해 평가하여 다양한 분석을 시도하였다. 전체 의료기관 중 일부만 반코마이신 평가 대상 기관으로 선정했지만 이 연구에 참여한 기관들에서 사용된 검사장비가대부분의 국내 의료기관에서 사용되고 있었다.
반코마이신의 변이계수는 15% 이내가 바람직한 목표로 제시된 바 있는데[10], 모든 기관에서 해당 기준을 만족하였다. 반코마이신은 임상적으로 최저농도(trough level) 10-20 µg/mL를 유지하는것이 중요한 의미를 가지는데[16, 17], 그에 해당하는 레벨2, 3 검체에 대해 대부분의 기관이 검사실 내 변이계수 6% 이내(range, 1.33-5.56%cv)로 우수한 결과를 보였지만, ADVIA Centaur XP로측정한 한 기관의 경우 레벨2, 3 검체에 대해 각각 10.89, 6.60%의검사실 내 변이계수를 나타냈다. 해당 기관의 검사일 내 변이계수는 4.50% 이하였으며, 검사일 간 변이계수는 10.41%였다. 동일한 검사장비를 사용하는 다른 기관에서 측정된 레벨2, 3 검체의 검사실내 변이계수가 5.56% 이하였고, ADVIA Centaur XP를 사용하는두 기관의 반코마이신 측정 값 사이에서 유의한 차이가 발견되지않은 것을 고려할 때 해당 검사실의 상대적 정밀도 개선이 필요할수 있다. 동일 장비를 사용하는 기관 사이의 비교에서 반코마이신은 Cobas c501, c702에서 레벨3 검체가 차이를 보인 것 외에는 유의한 차이가 발견되지 않았다.
아미노글리코사이드 항생제의 경우 1일 1회 요법(once-daily dosing)을 하는 경우 최저농도를 1 µg/mL 이하로 유지하는 것이 추천되고 있지만, 대부분의 임상검사실에서 해당 농도를 측정하기 어려워서 투약 후 12시간째 농도를 측정하고 있다. 이 연구에서는 최저농도의 아미노글리코사이드를 측정할 수 있는지 알아보고자 레벨1 검체의 농도를 1 µg/mL 이하로 제조하였다. 각 기관에서 보고한 아미노글리코사이드 검사장비의 측정가능범위 하한값은 모두 레벨1 검체의 목표값 이상이었음에도 불구하고, 대부분의 기관에서 제일 낮은 농도의 검체를 정량한계 미만으로 보고하였다. 또한 제조한 검체의 목표 값과 각 기관에서 측정한 값은 레벨3, 4, 5 검체에서는 대체로 비슷한 값이 측정되었으나 레벨1, 2 검체의 경우 차이가 많이 관찰되었다. 측정가능범위의 하한보다 높은 농도임에도 각 기관에서 정량한계 미만으로 보고한 원인은 제조 검체의 기질적 특성에 기인한 것이거나, 검사장비의 측정가능범위의 하한값이 제조사에서 제시하는 것보다 더 높을 가능성이 있다[18]. 이 연구에서 사용한 검체는 혈청 풀에 참고물질을 첨가하여 제조한 것이므로 낮은 농도에서 목표 값과의 차이는 기질 관련 바이어스(matrix-related biases)의 가능성을 배제할 수 없으나, 1 µg/mL 이하의 낮은 농도도 정확하게 정량 가능한 검사장비의 개발이 필요할 것으로 생각된다. 아미카신의 경우 1-4 µg/mL 내의 농도인 레벨2와 레벨3 검체의 경우 모든 기관이 측정값을 보고하였으나 검사실 간 변이계수가 10%를 초과하는 기관들이 각각 2 기관씩 있어 낮은 농도 측정에 어려움을 보였다. 1 µg/mL 이하의 저농도로 제조한 겐타마이신과 토브라마이신 레벨1 검체는 대부분의 기관에서 정량적으로 측정하지 못했지만 1-3 µg/mL 구간의 농도인 레벨2와 레벨3 검체에서는 각각 모든 기관의 검사실 간 변이계수가 7.80%와 4.32% 이하의 양호한 결과를 보였다.
한편, 검사장비별 결과 분석에서 Integra 800으로 측정된 반코마이신은 높은 측정값을 보였는데, 대한임상검사정도관리협회 신빙도조사 프로그램에서도 중앙값이 가장 높아서 대체로 유사한 결과를 보였다. 독일에서 시행한 항생제 비교평가 연구 논문에 따르면 Integra 800은 Cobas c501과 결과 비교 시 약간 낮은 값이 관찰되었지만(slope 0.95, intercept -0.22) [4] 본 연구와 국내 신빙도조사 프로그램에서는 Integra 800이 대체로 더 높은 경향을 보였는데, 연구에서 사용한 검체의 차이와 정도관리물질 및 보정물질의 차이로 인해 다른 경향을 보였을 가능성이 있다. 이 연구에서 Integra 800과 ADVIA Centaur XP로 측정한 반코마이신 농도는 최대 30%까지 차이가 나는 것으로 관찰되어 검사장비 간의 일치화가 필요하였다. 또한 Integra 800은 과거 연구에서 다른 장비에 비해 겐타마이신은 높게 측정되고 아미카신은 낮게 측정된다고 보고된 바 있는데[10], 본 연구에서의 결과도 유사하였다. 반코마이신과 겐타마이신의 경우 장비 간 유의한 차이가 모든 검체에서 관찰되었으며, 아미카신과 토브라마이신도 각각 2개의 검체에서 유의한 차이가 관찰되어 검사장비 간 일치화가 필요하였다. 동일 장비를 사용하는 기관 사이의 비교에서 반코마이신과 토브라마이신은Cobas c501, c702를 사용하는 기관 사이에서의 레벨3 검체를 제외하고는 동일 장비를 사용하는 기관별 유의한 차이가 관찰되지 않았으나 아미카신은 Cobas c501, c702와 Integra 800 모두 3개의 검체에서 유의한 차이를 보였으며, 겐타마이신도 Architect i2000을사용하는 기관 간 2개의 검체에서 유의한 차이를 보여 동일한 장비를 사용하는 기관 사이에서도 검사실에 따라 측정값의 차이가있음을 확인하였다. 아미카신과 겐타마이신의 경우 정밀도의 변이 계수 및 측정값의 표준편차가 다른 항목에 비해 상대적으로 높았는데, 동일 검사법을 사용함에도 임상검사실 간에 결과값 차이가 많은 항목은 해당 검사실 문제의 가능성이 있으므로 검사실 내 정밀도 개선이 필요할 것이다. 이처럼 각 기관별로 측정한 항생제 농도의 차이는 장비 별 차이만이 아닌 동일 장비를 사용하는 경우에도 발생할 수 있으므로 항생제 농도 측정에 있어 일치화의 필요성은 더욱 크다.
CAP 허용기준을 적용했을 때에는 모든 참여기관이 허용범위 내에 있었지만, RCPA에서 제시한 허용기준을 적용했을 때에는 Integra 800으로 반코마이신을 측정한 기관이 2개 검체에서 허용가능 범위를 벗어난 결과를 보였으며, 한 검체에서는 대한임상검사정도관리협회에서 제시한 허용가능 범위인 3 SDI를 초과하여 검사장비 간 일치화가 필요함을 확인할 수 있었다. 아미카신과 토브라마이신의 경우 모두 허용가능 범위에 위치하였지만, 겐타마이신의 경우 RCPA에서 제시한 허용가능 범위를 넘는 기관이 많아 항생제 측정값의 일치도 향상 및 표준화를 위한 노력이 더 필요할 것으로 보인다.
이 연구는 질량 분석법이나 참고방법(reference method) 등을이용하여 항생제 치료적 약물농도감시를 시행하는 기관의 정확성을 평가하는 것은 아니었지만 각 기관의 정밀도를 추정하고, 전체 참여 기관의 평균값을 이용하여 표준편차지수를 평가하였으며, 대한임상검사정도관리협회, CAP 및 RCPA에서 제시한 허용기준을 사용하여 허용가능 범위를 평가할 수 있었다. 아쉬운 점은 낮은 농도부터 높은 농도까지 5가지 이상의 검체를 제조하여 각 기관에서 측정한 결과가 직선성을 갖는지에 대해서도 평가하고자 하였으나, 대부분의 기관에서 제일 낮은 농도의 검체를 정량적으로 측정하지 못하고 측정하한값 미만으로 보고하여 직선성 평가를 시행하지 못한 것이다. 동일 장비를 사용하는 기관 간의 결과를 통계분석 시행하였으나 표본 크기가 작아 검정력이 약한 것과 연구에 사용된 검체가 측정 교환가능성을 보장할 수 없었다는 것은 이 연구의 제한점이다.
성공적인 약물동력학자문을 위해서 약물농도 측정은 매우 중요하다. 또한 약물농도 측정을 통해 항생제 사용을 최적화하면 개별 환자에서 치료 효과를 극대화하고 독성을 최소화할 수 있다. 그러나 국내 임상검사실 중에서는 매우 적은 수의 기관에서만 아미노글리코사이드 계열 항생제를 측정하고 있으며, 사용하는 장비도 다양하여 비교 분석이 어렵다. 서로 다른 기관에서 측정한 검사결과의 불일치를 줄이기 위해서 항생제 약물농도 측정의 일치화가 필요하다.
감사의 글
연구에 참여하여 도움을 주신 아래 기관의 선생님들께 감사드립니다.
강남성심병원 박민정, 국립중앙의료원 김소연, 녹십자의료재단 최리화, 분당서울대학교병원 이경훈, 서울대학교병원 송상훈, 서울성모병원 채효진, 서울아산병원 전사일, 세브란스병원 이상국, 충남대학교병원 임진숙.
이 연구는 2017년도 산업통상자원부 및 산업기술평가관리원(KEIT) 연구비 지원에 의한 연구임(NO.10080648).
REFERENCES
1. Guo W, Guo GX, Sun C, Zhang J, Rong Z, He J, et al. 2013; Therapeutic drug monitoring of psychotropic drugs in China: a nationwide survey. Ther Drug Monit. 35:816–22. DOI: 10.1097/FTD.0b013e318296a2ff. PMID: 24263641.
2. Joerger M, Kraff S, Jaehde U, Hilger RA, Courtney JB, Cline DJ, et al. 2017; Validation of a commercial assay and decision support tool for routine paclitaxel therapeutic drug monitoring (TDM). Ther Drug Monit. 39:617–24. DOI: 10.1097/FTD.0000000000000446. PMID: 28937535.

3. Qin X, Rui J, Xia Y, Mu H, Song SH, Raja Aziddin RE, et al. 2018; Multi-center performance evaluations of tacrolimus and cyclosporine electrochemiluminescence immunoassays in the Asia-Pacific region. Ann Lab Med. 38:85–94. DOI: 10.3343/alm.2018.38.2.85. PMID: 29214751. PMCID: PMC5736684.

4. Shipkova M, Petrova DT, Rosler AE, Orth M, Engelmayer J, Wieland E, et al. 2014; Comparability and imprecision of 8 frequently used commercially available immunoassays for therapeutic drug monitoring. Ther Drug Monit. 36:433–41. DOI: 10.1097/FTD.0000000000000043. PMID: 24646729.

5. Cataldo MA, Tacconelli E, Grilli E, Pea F, Petrosillo N. 2012; Continuous versus intermittent infusion of vancomycin for the treatment of gram-positive infections: systematic review and meta-analysis. J Antimicrob Chemother. 67:17–24. DOI: 10.1093/jac/dkr442. PMID: 22028203.

6. Jenkins A, Thomson AH, Brown NM, Semple Y, Sluman C, MacGowan A, et al. 2016; Amikacin use and therapeutic drug monitoring in adults: do dose regimens and drug exposures affect either outcome or adverse events? A systematic review. J Antimicrob Chemother. 71:2754–9. DOI: 10.1093/jac/dkw250. PMID: 27494904.

7. Ye ZK, Tang HL, Zhai SD. 2013; Benefits of therapeutic drug monitoring of vancomycin: a systematic review and meta-analysis. PLoS One. 8:e77169. DOI: 10.1371/journal.pone.0077169. PMID: 24204764. PMCID: PMC3799644.

8. Streetman DS, Nafziger AN, Destache CJ, Bertino AS Jr. 2001; Individualized pharmacokinetic monitoring results in less aminoglycoside-associated nephrotoxicity and fewer associated costs. Pharmacotherapy. 21:443–51. DOI: 10.1592/phco.21.5.443.34490. PMID: 11310518.

9. Revilla N, Martín-Suárez A, Pérez MP, González FM, Fernández de Gatta Mdel M. 2010; Vancomycin dosing assessment in intensive care unit patients based on a population pharmacokinetic/pharmacodynamic simulation. Br J Clin Pharmacol. 70:201–12. DOI: 10.1111/j.1365-2125.2010.03679.x. PMID: 20653673. PMCID: PMC2911550.

10. Wilson JF, Davis AC, Tobin CM. 2003; Evaluation of commercial assays for vancomycin and aminoglycosides in serum: a comparison of accuracy and precision based on external quality assessment. J Antimicrob Chemother. 52:78–82. DOI: 10.1093/jac/dkg296. PMID: 12805260.

11. Ko DH, Jeong TD, Gu GG, Chun S, Kim JH. 2015; Annual report on the external quality assessment scheme for therapeutic drug monitoring and testing for drugs of abuse in Korea (2014). J Lab Med Qual Assur. 37:12–22. DOI: 10.15263/jlmqa.2015.37.1.12.

12. Myers GL, Miller WG. 2016; The international consortium for harmonization of clinical laboratory results (ICHCLR)-A pathway for harmonization. EJIFCC. 27:30–6. PMID: 27683504. PMCID: PMC4975215.
13. Royal College of Pathologists of Australasia. 2014. August. Allowable limits of performance. http://www.rcpaqap.com.au/docs/2014/chempath/ALP.pdf. accessed Jun 2019.
14. Grubbs FE. 1969; Procedures for detecting outlying observations in samples. Technometrics. 11:1–21. DOI: 10.1080/00401706.1969.10490657.

15. Avent ML, Rogers BA, Cheng AC, Paterson DL. 2011; Current use of aminoglycosides: indications, pharmacokinetics and monitoring for toxicity. Intern Med J. 41:441–9. DOI: 10.1111/j.1445-5994.2011.02452.x. PMID: 21309997.

16. Ye ZK, Li C, Zhai SD. 2014; Guidelines for therapeutic drug monitoring of vancomycin: a systematic review. PLoS One. 9:e99044. DOI: 10.1371/journal.pone.0099044. PMID: 24932495. PMCID: PMC4059638.

17. Martin JH, Norris R, Barras M, Roberts J, Morris R, Doogue M, et al. 2010; Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Clin Biochem Rev. 31:21–4. PMID: 20179794. PMCID: PMC2826264.
18. Naito HK, Kwak YS, Hartfiel JL, Park JK, Travers EM, Myers GL, et al. 1993; Matrix effects on proficiency testing materials. Impact on accuracy of cholesterol measurement in laboratories in the nation's largest hospital system. Arch Pathol Lab Med. 117:345–51. PMID: 8466396.
FIGURES AND TABLES
Fig. 1
Box-and-whisker plots of instrument test values for vancomycin (A), amikacin (B), gentamicin (C), and tobramycin (D). The vertical dashed line across each plot represents the median of all participating institutions.
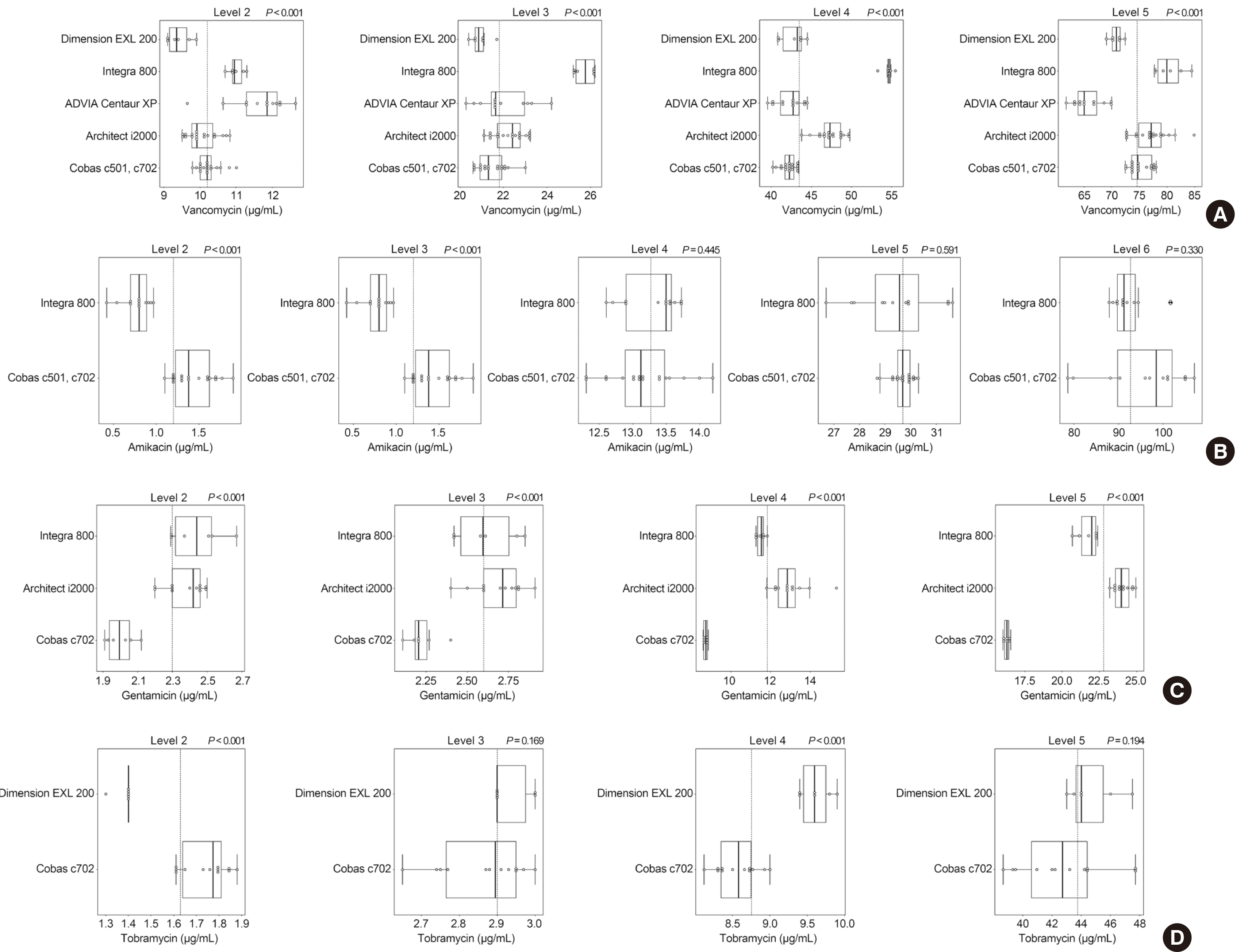
Fig. 2
Mean, standard deviation (SD), and coefficient of variation (CV) of measurements from different instruments. The mean (A), SD (B), and CV (%) (C) for vancomycin. The mean (D), SD (E), and CV (%) (F) for amikacin. The mean (G), SD (H), and CV (%) (I) for gentamicin. The mean (J), SD (K), and CV (%) (L) for tobramycin.
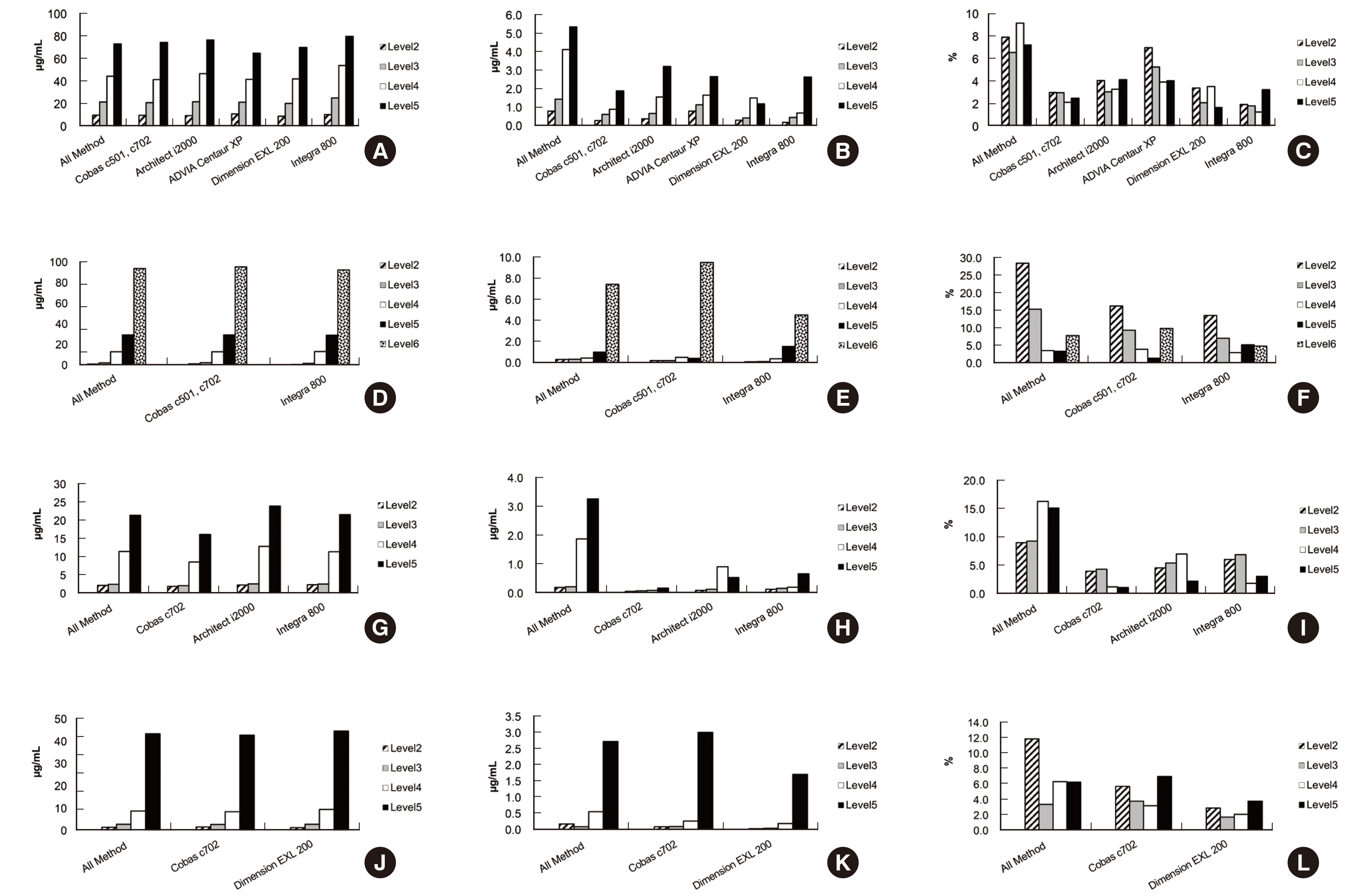
Fig. 3
Box-and-whisker plots for concentration measured on the same instrument. Cobas c501, c702 (A), Architect i2000 (B), ADVIA Centaur XP (C), and Integra 800 (D). The horizontal line inside the box indicates the median value of the measured concentrations in each group.
Fig. 4
Measured concentration of antibiotics in all participating institutions. Vancomycin (A), amikacin (B), gentamicin (C), and tobramycin (D) at each institution. Horizontal dashed lines represent the Royal College of Pathologists of Australasia (RCPA) allowable limits of performance. Asterisks indicate values that exceed the RCPA allowable limits of performance, daggers indicate values below the RCPA allowable limits of performance, and double asterisks indicate values that exceed the RCPA and Korean Association of External Quality Assessment Service (KEQAS) allowable limits of performance.
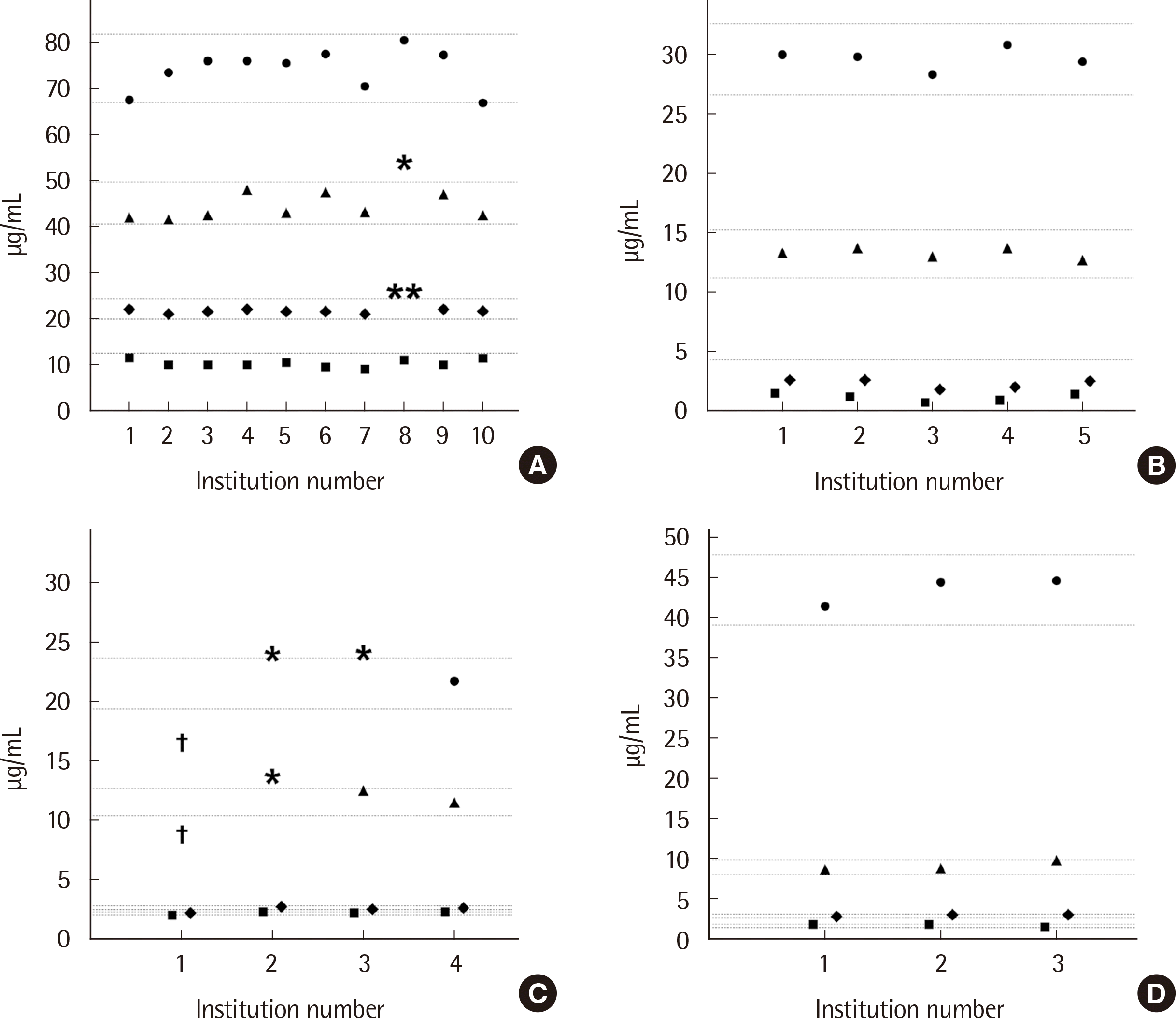
Table 1
Characteristics of instruments with measuring principles and analytical measurement range in this study
| Antibiotics | Instrument used | Manufacturer | Test principle | AMR (μg/mL) | RR (μg/mL) | Therapeutic range (μg/mL) |
|---|---|---|---|---|---|---|
| Vancomycin | ADVIA Centaur XP | Siemens Healthcare | CLIA | 0.67–90.0 | 0.2–450.0 | Trough 10–20 Peak 25–40 |
| ADVIA Centaur XP | Siemens Healthcare | CMIA | 0.67–90.0 | 0.67–450.0 | ||
| Architect i2000 | Abbott Laboratories | CMIA | 0.24–100.0 | 0.24–200.0 | ||
| Architect i2000 | Abbott Laboratories | CMIA | 0.24–100.0 | 0.24–200.0 | ||
| Architect i2000 | Abbott Laboratories | CMIA | 0.30–100.0 | 0.30–200.0 | ||
| Cobas c501 | Roche Diagnostics | TIA | 4.0–80.0* | 4.0–160.0* | ||
| Cobas c702 | Roche Diagnostics | KIMS | 4.0–80.0* | 4.0–160.0* | ||
| Cobas c702 | Roche Diagnostics | KIMS | 4.0–80.0* | 4.0–80.0* | ||
| Dimension EXL 200 | Siemens Healthcare | PETINIA | 2.0–50.0* | 2.0–100.0* | ||
| Integra 800 | Roche Diagnostics | FPIA | 1.39–80.0* | Not available | ||
| Amikacin | Cobas c501 | Roche Diagnostics | KIMS | 0.8–40.0* | 0.8–80.0* | Once daily dosing: Trough <1.0, Peak 55–65 Multiple daily dosing: Trough 5–10, Peak 15–30 |
| Cobas c702 | Roche Diagnostics | KIMS | 0.8–40.0* | 0.8–80.0* | ||
| Cobas c702 | Roche Diagnostics | KIMS | 0.8–40.0* | 0.8–80.0* | ||
| Integra 800 | Roche Diagnostics | FPIA | 0.6–40.0 | 0.6–200.0 | ||
| Integra 800 | Roche Diagnostics | FPIA | 0.3–40.0 | Not available | ||
| Gentamicin | Architect i2000 | Abbott Laboratories | CMIA | 0.3–10.0 | 0.3–50.0 | Once daily dosing: Trough <1.0, Peak 15–25 Multiple daily dosing: Trough 1.0–2.0, Peak 5–10 |
| Architect i2000 | Abbott Laboratories | CMIA | 0.3–10.0 | 0.3–50.0 | ||
| Cobas c702 | Roche Diagnostics | KIMS | 0.6–10.0 | 0.6–20.0 | ||
| Integra 800 | Roche Diagnostics | FPIA | 0.14–10.0 | Not available | ||
| Tobramycin | Cobas c702 | Roche Diagnostics | EMIT | 0.33–10.0 | 0.33–20.0 | Once daily dosing: Trough <1.0, Peak 15–25 Multiple daily dosing: Trough 1.0–2.0, Peak 5–10 |
| Cobas c702 | Roche Diagnostics | EMIT | 0.33–10.0 | 0.33–20.0 | ||
| Dimension EXL 200 | Siemens Healthcare | PETINIA | 0.6–12.0* | 0.6–48.0* |
Abbreviations: AMR, analytical measurement range; RR, reportable range; CMIA, chemiluminescent microparticle immunoassay; CLIA, chemiluminescence immunoassays;EMIT, homogeneous enzyme immunoassay; FPIA, fluorescence polarization immunoassay; KIMS, kinetic interaction of microparticles in a solution; PETINIA, particle-enhanced turbidimetric inhibition immunoassay; TIA, thin layer immunoassay.
Table 2
Survey results for therapeutic drug monitoring of vancomycin, amikacin, gentamicin, and tobramycin
Table 3
Precision test results for therapeutic drug monitoring of vancomycin, amikacin, gentamicin, and tobramycin




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download