서 론
Prohibitin (PHB) 단백질은 세포 내 미토콘드리아와 핵, 세포질, 세포막 등에 존재하며, 기본적으로 미토콘드리아의 기능 및 형태 유지에 매우 중요한 역할을한다고 알려져 있다[
1].
PHB는 이러한 기본적인 기능외에 핵수용체를 포함한 다양한 전사인자와 직간접적으로 상호작용함으로써 전사활성을 조절한다고 알려져 있다[
2].
PHB 단백은 두가지 형태(type I과 II)로 존재하는데 이들을 코딩하는 유전자는 각각
PHB1과
PHB2이다.
PHB1과
PHB2단백은 미토콘드리아 내막에 고리모양의 구조로 존재한다[
1].
PHB1과
PHB2 유전자는 각각 17번 염색체 장완(17q21.33)과 12번 염색체 단완(12p13.31)에 존재하며, 이들 단백의 분자량은 각각 32 kDa와 34 kDa이다[
3].
PHB 기능 이상은 노화[
4], 증식성 질환[
5], 퇴행성 질환[
6] 그리고 대사질환[
7] 등과 연관이 있다고 알려져 있다.
종양발생과 병태생리에
PHB의 역할에 대한 연구 보고가 주로 고형장기 종양에서 보고되고 있다. 위암, 식도암, 대장암, 전립선암, 고위험 유방암, 방광암 및 갑상선암 등에서
PHB 단백 및 mRNA가 높게 발현됨이 보고되었다. 이들 종양세포에서 과발현된
PHB는 세포고사 회피의 주된 인자로 작용할 뿐만 아니라 항암제에 내성을 야기하는 주요인자임이 밝혀졌다[
3]. 혈액질환에서
PHB의 역할에대한 연구보고는 많지 않았으나, 최근 이에 대한 연구가 활발히 이루어지고 있으며, 다른 고형장기 종양에서와 마찬가지로 혈액질환에서의
PHB의 역할에 대한 관심이 증가하고 있다. 백혈병에서
PHB1 및
PHB2 단백은 과발현됨이 보고되었고, 과발현된
PHB 단백은 백혈병세포 증식과 세포고사 회피에 역할을 함이 보고되었다[
8]. 이상과 같이
PHB가 다양한 종양에서 그 병태생리적 의의가 속속 밝혀지고 있음에도 불구하고,
PHB유전자 발현량을 정량적으로 검출할 수 있는 분자진단키트가 시장에 소개되고 있지 않는 실정이다. 따라서 본 연구에서는 실험실 수준에서뿐만 아니라 실제 검사현장에서도 손쉽게
PHB1과
PHB2 유전자를 정량검출할수 있는 역전사 중합효소연쇄반응 키트를 개발하여 백혈병환자 검체와 관리물질을 이용한 간략한 성능평가와 함께 보고하는 바이다.
Go to :

재료 및 방법
1. PHB1 및 PHB2 유전자 정량검출 역전사 중합효소연쇄반응 키트 제작
PHB 유전자 발현량 정량검출을 위한 역전사 중합효소연쇄반응 키트는 TaqMan 화학 기술을 기본으로 하여 개발하였다.
PHB1,
PHB2 및
ABL 유전자 각각에 대한 프로브 및 시발체 염기서열은
Table 1과 같다.
PHB1 프로브에는 FAM 형광물질과 이를 제어하는 EBQ quencher를 사용하였고,
PHB2 프로브에는 TET 형광물질과
PHB1 프로브에서 사용한 동일한 EBQ quencher를 부착하여 제작하였다. 전혈 또는 골수 검체에서 추출한 total RNA 또는 mRNA로부터
PHB1 (또는
PHB2) 유전자와
ABL 유전자 발현량을 동일한 한 개의 튜브에서 한번에 역전사(reverse transcription, RT) 과정과 정량중합효소연쇄반응(quantitative polymerase chain reaction, qPCR)이 진행되는 one-step RT-qPCR 키트로 개발하였다(GeneMedikit
®PHB1 RT-qPCR kit 및 GeneMedikit
®PHB2RT-qPCR kit; GeneMedica, Gwangju, Korea).
Table 1
Nucleotide sequences for primers and probes
|
Primers/Probes |
Sequence*
|
|
PHB1 Probe |
[FAM]TGTGGXXXXXXXXXXCAGAGCTG[EBQ] |
|
PHB1 Reverse |
GGAGXXXXXXXXAACTCTG |
|
PHB1 Forward |
CTGGXXXXXXXXGTGGTCGA |
|
PHB2 Probe |
[TET]TGACATXXXXXXXXXXCCTCGA[EBQ] |
|
PHB2 Reverse |
CTTGGTXXXXXXXXCCCATT |
|
PHB2 Forward |
CGAGAXXXXXXXXCAGGG |
|
ABL Probe |
[FAM]TCTAAXXXXXXXXAAAGGT[EBQ-dT]GAAAAXXXXXXXXTCTT[Phosphate] |
|
ABL Reverse |
AAAATGXXXXXXXXCTTTTCG |
|
ABL Forward |
CCATTCCXXXXXXXXATTATAGC |

2. 검체와 인간유래 RNA 관리물질
신체검사와 다양한 검사를 통해 정상으로 판명된 20명의 말초 혈액을 채혈하여 정상인에서 PHB1 및 PHB2 유전자 발현량의 분포를 Bayesian법으로 구하였다.백혈병 환자의 경우 진단시 골수 검체를 이용하였는데, 급성골수성백혈병 20예, 만성골수성백혈병 13예, 그리고 급성림프구성백혈병 7예를 이용하였다. 이들 검체에서 total RNA의 추출은 상품화 키트(Invitrogen™ RNAqueous Total RNA Isolation Kit; Thermo Fisher Scientific, Waltham, MA, USA)를 이용하였다. Total RNA의 농도는 분광광도법(Micro UV-VIS spectrophotometer; Malcom, Tokyo, Japan)으로 측정하여 PCR반응에 이용하였다.
개발된 키트의 검사능 평가를 위해, 추가적으로 상품화된 인간유래 RNA 관리물질(Thermo Fisher Scientific)을 이용하였다. 환자유래 검체는 검사 후 잔여검체로부터 획득하여 사용하였고, 이와 관련하여 기관윤리위원회 승인(CNUHH-2019-001)을 얻어 본 연구를 수행하였다. 한편 본 연구는 임상검사 후 폐기예정인 잔여검체를 이용하는 연구로서 체외진단용 의료기기 임상시험 피험자 동의면제 요건에 해당됨을 기관윤리위원회로부터 승인받았다.
3. 검사성능 평가
검출 한계를 결정하기 위하여 위의 표준물질(2×105 copies/μL)을 이용하여 DEPC 처리 증류수로 희석하여 2×104 copies/μL, 2×103 copies/μL와 2×102 copies/μL 농도의 희석액을 만들어 사용하였다. 각 농도당 4번 반복검사를 실시하여 검출한계를 검증하였다. 특이도 평가를 위해 정량증폭 음성 대조검체로서 DEPC처리 증류수를 사용하였다. 양성 대조검체로는 상품화된 인간유래 total RNA control (ThermoFisher Scientific)을 이용하였다. 정밀도 평가는 상품화된 인간유래 total RNA control (ThermoFisher Scientific)을 이용하여, 측정 내 정밀도(intra-assay precision)와 측정간 정밀도(inter-assay precision) 평가를 위해 4일간 하루 10번씩 반복검사를 수행하여 평가하였다.
검사능 분석은 병원종사자와 검진센터에서 혈액검사를 포함하여 다양한 검사에서 비정상적인 소견이 관찰되지 않은 정상인 20 명의 혈액검체를 이용하여 PHB1 및 PHB2 mRNA 정량 발현량의 cutoff 수치를 결정하였다. 골수 조직검사와 염색체검사를 포함한 다양한 분자생물학적 검사로 급성골수성백혈병(acute myeloid leukemia, AML)으로 확진된 환자의 진단 시 골수검체를 이용하여 민감도, 특이도, 양성예측률, 음성예측률 및 검사효능(일치율)을 구하였다.
4. 백혈병환자 검체 적용
개발한 GeneMediKit®PHB1 및 PHB2 RT-qPCR (GeneMedica) 키트의 임상검체 적용과 백혈병 진단 효율성을 평가하기 위해 정상인 20명의 말초혈액 검체와 백혈병환자 40명(급성골수성백혈병 20예, 만성골수성백혈병 13예 및 급성림프구성백혈병 7예)의 진단시 골수검체에 적용하여 보았다.
5. 통계분석
통계분석에 이용한 통계 소프트웨어는 SPSS version 13.0 (SPSS Inc., Illinois, USA)을 이용하였다. 직선성을 평가하기 위해 다항회귀분석을 시행하였고, t-test로 검정하였다.
Go to :

결 과
1. 키트 개발 결과
본 연구에서 개발된 키트는 검사현장에서 이용되는 실시간 중합효소연쇄반응기인 CFX96 (Bio-Rad, Hercules, CA, USA)과 ABI 7500 (Applied Biosystems, Waltham, MA, USA)에 바로 적용할 수 있게 하였다. 설명서에 명시된 반응액의 조성은 시발체와 프로브 혼합물(5 μL), 2x RT-qPCR 반응액(12.5 μL), 증류수(2.5 μL), ROX 형광물질(0.5 μL, ABI 7500 사용할 경우에 추가), 그리고 검체에서 추출한 RNA (5 μL)이다. PCR 반응 조건은 역전사반응 과정을 위해 50°C에서 30분간 반응시키고, 95°C에서 5분간 변성(denaturation) 과정을 거친 후, 95°C에서 20초, 55°C에서 30초 반응을 40회 수행하는 과정으로 구성되었다.
개발된 키트에는 내부대조 ABL 유전자와 PHB1 또는 PHB2 유전자 각각에 해당되는 표준 유전자물질이 2×102 copies/μL부터 2×106 copies/μL까지 10배 농도 구배로 5개가 포함되어 있어 quantification cycle (Cq) 값에 기초한 상대정량 보고뿐만 아니라 표준 유전자 물질을 이용한 상대정량도 가능하게 하였다.
2. PCR 증폭효율평가
PHB1 및
PHB2 유전자 표준물질 2.0×10
6 copies/μL 농도부터 2.0×10
2 copies/μL 농도까지 5개의 표준물질에 대한 증폭결과는
Fig. 1과 같다.
PHB1 및
PHB2 표준물질을 7번 반복 측정한 기대치에 대한 관측치의 회수율은 각각 101.55±10.50% (평균±표준편자) 및 102.09±10.88%였고, 기울기는 -3.31 및 -3.30이었다. 한편
PHB1 및
PHB2 표준물질의 기대치에 대한 R
2값은 각각 0.996 및 0.995이었다(
Fig. 2).
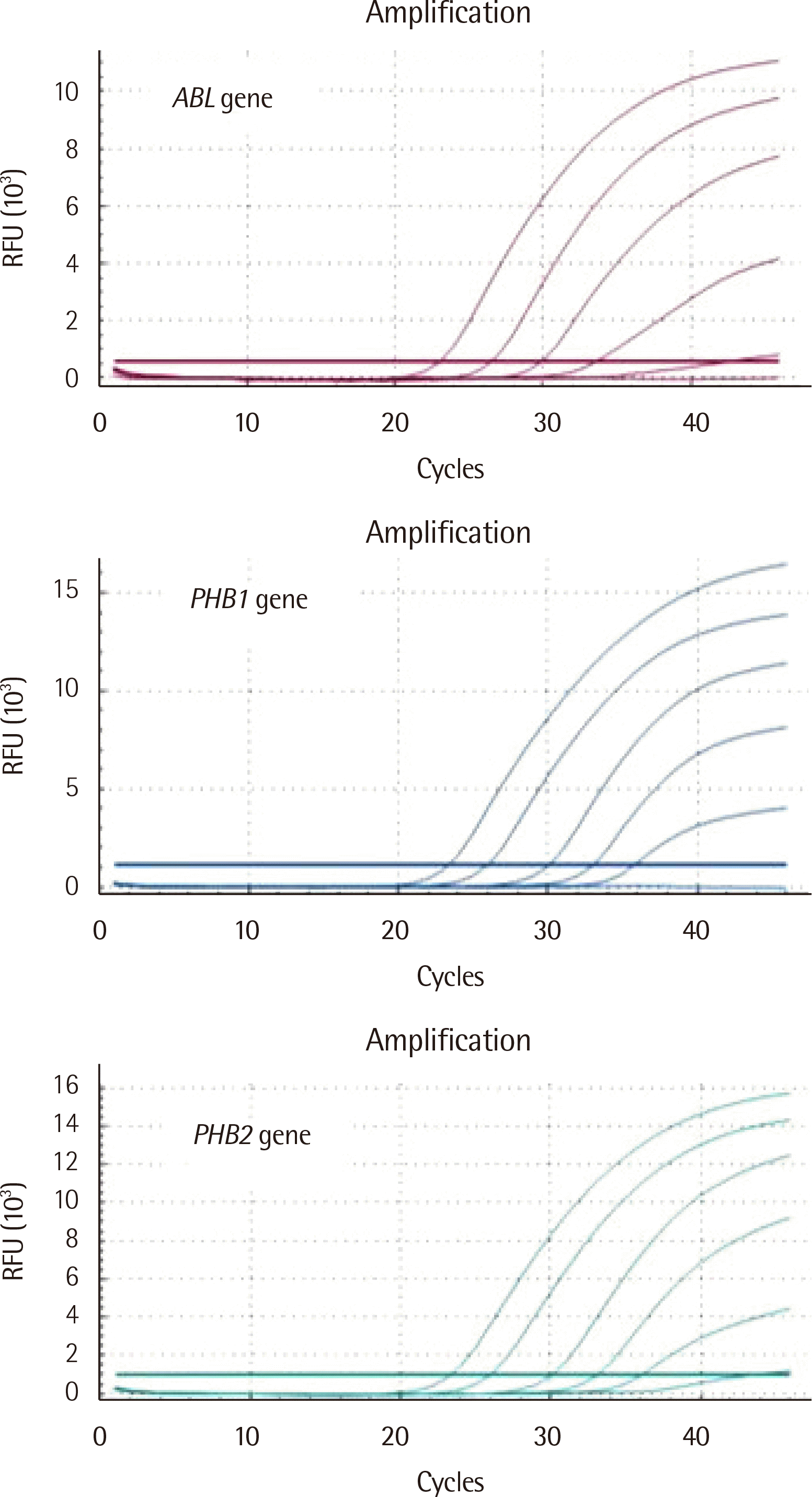 | Fig. 1Amplification plots of standards for ABL (upper panel), PHB1 (middle panel), and PHB2 (lower panel) genes. Five standards of ABL, PHB1, and PHB2 genes were used in each experiment with the same number of copies (Standard 1: 2×102 copies/μL, Standard 2: 2×103 copies/μL, Standard 3: 2×104 copies/μL, Standard 4: 2×105 copies/μL, Standard 5: 2×106 copies/μL). 
|
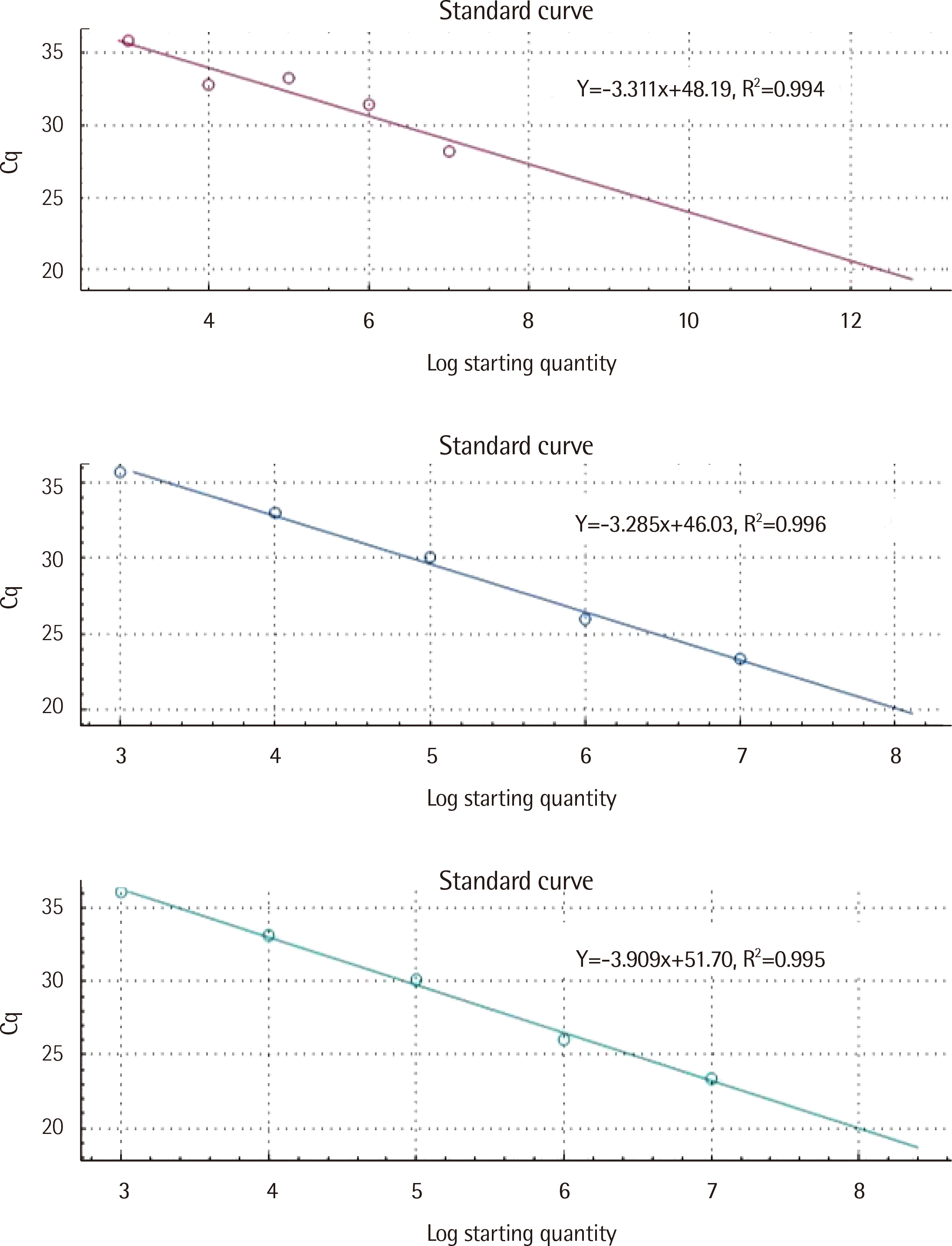 | Fig. 2Theslope of the standard curve used toestimate PCR amplification efficiency of ABL (upper), PHB1 (middle), and PHB2 (lower) genes. A standard curve is graphically represented as a semi-log regression line plot of the Cq value versus log of standard nucleic acid copies. 
|
3. 검출한계 평가
검출한계를 검증하기 위해 시행한 검사에서 GeneMediKit PHB1 RT-qPCR은 회수율 93% 수준에서 검출 한계는 200 copies/μL이었다. GeneMediKit PHB2 RT-qPCR 키트는 회수율 92% 수준에서 검출 한계는 2,000 copies/μL이었다.
4. 특이도 평가
개발한 키트를 사용하여, 양성 대조검체로 사용한 상품화된 인간유래 total RNA control로써 PHB1 및 PHB2 mRNA 정량 증폭을 20번 실시해 보았는데, 모든 반응에서 검출되었으나, 20번 독립적으로 음성 대조검체를 이용한 실험에서는 해당 유전자 증폭반응이 검출되지 않아 100% 특이도를 보였다.
5. 정밀도 평가
상품화된 인간유래 total RNA control (ThermoFisher Scientific)을 이용하여 검증한 측정내 정밀도는
PHB1 및
PHB2 유전자에서 각각 2% 이내의 매우 양호한 정밀도를 보였다.
PHB1과
PHB2 유전자 정량발현 검출의 측정 간 정밀도는 2% 이내의 우수한 정밀도를 보였다(
Table 2).
Table 2
Precision evaluation of the GeneMediKit®PHB1 and PHB2 RT-qPCR using human total RNA as a control
|
Gene |
Test No. |
Intra-assay precision |
Inter-assay precision |
|
|
|
Mean |
SD |
CV |
Mean |
SD |
CV |
|
PHB1
|
40 |
0.983 |
0.010 |
1.095 |
0.983 |
0.011 |
1.150 |
|
PHB2
|
40 |
0.890 |
0.014 |
1.613 |
0.891 |
0.015 |
1.689 |

6. 정상인 및 백혈병환자에서 PHB1 및 PHB2 유전자 발현양
정상인과 각종 백혈병환자에서
PHB1과
PHB2 유전자 발현량에 대한 실험 결과를
Fig. 3에 제시하였다. 매우 제한된 수이지만 정상인 20명을 대상으로 한 말초혈액 단핵구세포에서
PHB1 유전자 발현량의 분포는 0.864-0.931 (중앙값 0.906)이었고,
PHB2 유전자 발현량의 분포는 0.962-0.988 (중앙값 0.970)이었다. 표본수가 적어 Bayesian법(2.5 percentile-97.5 percentile)을 적용하여 참고치를 설정하였을때,
PHB1과
PHB2 유전자 발현량의 참고범위는 각각 0.892-0.930 및 0.966-0.986이었다. 한편 백혈병환자에서
PHB1 유전자 발현량의 분포는 급성골수성백혈병(N=20), 만성골수성백혈병(N=13) 및 급성림프구성백혈병(N=7) 환자에서 0.898-0.993 (중앙값 0.936), 0.817-0.976 (중앙값 0.918), 0.844-1.074 (중앙값 0.973)이었다.
PHB2 유전자 발현량의 분포는 급성골수성백혈병(N=20), 만성골수성백혈병(N=13) 및 급성림프구성백혈병(N=7) 환자에서 각각 0.957-1.024 (중앙값 0.985), 0.988-1.047 (중앙값 1.002), 0.937-1.059 (중앙값 1.004)이었다.
PHB1 유전자 발현량은 정상인의 백혈구세포보다 급성골수성백혈병이나 급성림프구성백혈병 세포에서 유의하게 더 높이 나타나는 점을 관찰할수 있었다(
P<0.05;
Fig. 3). 한편,
PHB2 유전자 발현량은 정상인의 백혈구세포보다 급성골수성백혈병 또는 만성골수성백혈병세포에서 유의하게 더 높이 나타나는 것을 알 수 있었다(
P<0.05;
Fig. 3).
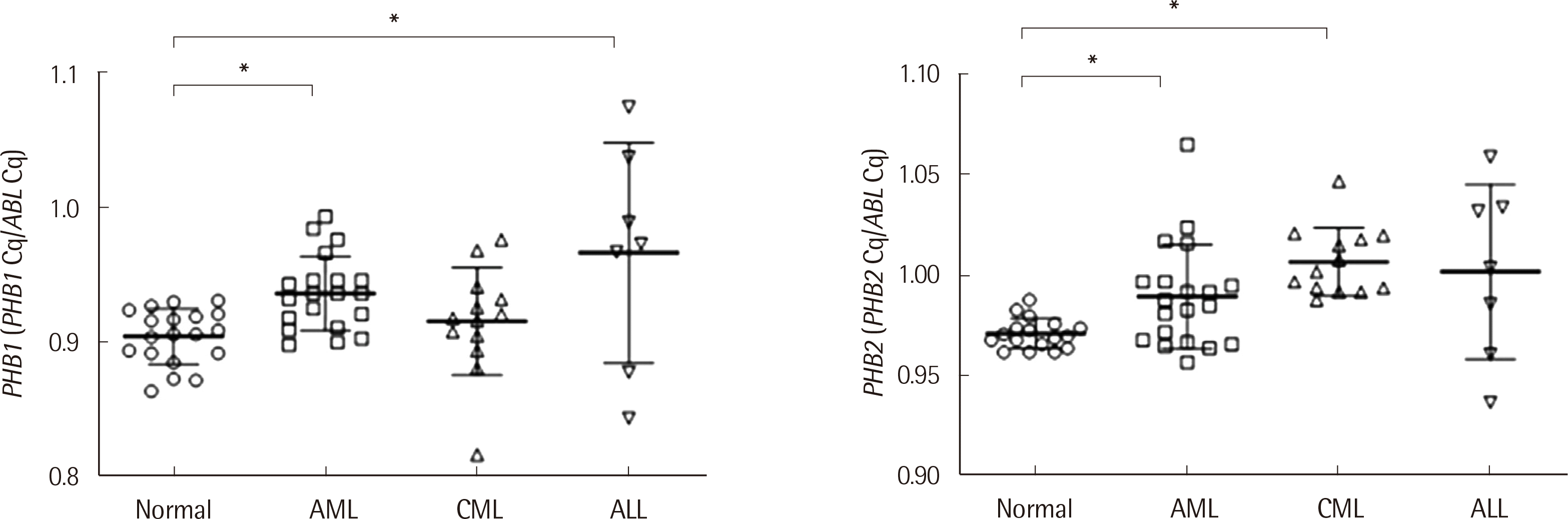 | Fig. 3Distribution of PHB1 and PHB2 mRNAexpressionin healthy individuals and individuals with acute myeloid leukemia (AML), chronic myeloid leukemia (CML), and acute lymphoid leukemia (ALL).*, P<0.05. 
|
7. 검사능(진단효율)검증
GeneMediKit
®PHB1 RT-qPCR (GeneMedica) 키트에 의한
PHB1유전자 정량 발현량 검사의 백혈병에 대한 민감도, 특이도, 양성예측률, 음성예측률 및 검사 효능은 각각 62.5%, 78.9%, 86.2%, 50.0% 및 50.4%였다. 한편 GeneMediKit
®PHB2 RT-qPCR (GeneMedica) 키트에 의한
PHB2 유전자 정량검사는 백혈병에 대해 민감도, 특이도, 양성예측률, 음성예측률 및 검사 효능은 각각 80.0%, 70.6%, 86.5%, 60.0% 및 53.1%였다(
Table 3).
Table 3
Diagnostic efficacy of the GeneMediKit®PHB1 and PHB2 RT-qPCR kit
|
PHB1
|
PHB2
|
|
|
|
Leukemia (N) |
Healthy (N) |
Total (N) |
Leukemia (N) |
Healthy (N) |
Total (N) |
|
PHB quantification |
|
Out of RI (+) |
25 |
4 |
29 |
32 |
5 |
37 |
|
Within RI (-) |
15 |
15 |
30 |
8 |
12 |
20 |
|
Total (No) |
40 |
19 |
59 |
40 |
17 |
57 |
|
Laboratory performance for leukemia |
|
Sensitivity |
62.5 |
|
|
80.0 |
|
|
|
Specificity |
78.9 |
|
|
70.6 |
|
|
|
PPV |
86.2 |
|
|
86.5 |
|
|
|
NPV |
50.0 |
|
|
60.0 |
|
|
|
TE |
50.4 |
|
|
53.1 |
|
|

Go to :

고 찰
PHB 단백의 기능은 세포내 존재 위치에 따라 그 기능이 결정된다.
PHB가 세포막에 존재할 경우 세포막 전달에 관여하는 세포신호를 조절하고, 핵내에서
PHB는 전사활성화와 세포주기를 조절한다. 미토콘드리아
PHB는 미토콘드리아 유전체를 안정화시킬 뿐만 아니라 미토콘드리아 형태유지, 미토콘드리아 생성과 내인성 세포고사 경로를 조절한다[
9].
PHB는 세포 내 세포고사 신호에 따라 핵이나 미토콘드리아에 그 위치를 변경하게 된다. 따라서
PHB는 세포생존과 세포고사에서 매우 중요한 역할을 하고 있음이 알려지고 있다.
종양발생을 포함한 종양병태생리에서
PHB의 분자기능에 대해서는 확실히 규명되어있지 않지만 최근 연구결과들을 살펴보면,
PHB가 전립선암, 난소암, 방광암 및 위암의 발생에서 그 역할이 규명되고 있다[
5]. 혈액암, 특히 백혈병의 분자병태 생리에서
PHB의 역할에 대한 연구보고는 이제 시작단계라고 할수 있는데, 최근 미토콘드리아
PHB가 혈액암세포에서 과발현됨이 보고되었고, 이들 세포에서
PHB가 세포고사를 회피하는데 중요한 역할을 함이 보고되었다. 한편
PHB1 및
PHB2 단백은 정상인으로부터 분리된 말초혈액 단핵구세포보다는 백혈병과림프종 세포에서 매우 높게 발현되어
PHB가 백혈병 등 혈액암에서 새로운 표적치료제 개발을 위한 중요한 분자적 표적임이 제시되었다[
8]. 본 연구에서도 제한된 수의 백혈병환자의 진단시 검체를 이용하여
PHB1과
PHB2 유전자 발현량의 분포와 진단적 가치를 평가하여 보았는데,
PHB1 유전자와
PHB2 유전자는 각각 급성골수성백혈병/급성림프구성백혈병, 급성골수성백혈병/만성골수성백혈병 세포에서 발현량이 더 높이 나타남을 확인하였다. 그러나
PHB1은 만성골수성백혈병에서,
PHB2는 급성골수성백혈병에서 정상인과 통계적으로 유의한 차이를 보이지 않았는데, 이는 분석한 검체수가 적었기 때문에 이에 대한 추가적인 연구분석이 필요할 것으로 판단되었다. 한편,
PHB1 및
PHB2 유전자 정량 발현량 검사의 각각의 검사 효능은 50.4% 및 53.1% 였다.
한편, Mishra와 Nyomba의 연구에서는, 생쥐의 지방조직과 대식세포에서 야생형(wild-type)
PHB 유전자의 과발현을 유도한 생쥐 실험을 해보았을 때, 암컷과 수컷 생쥐 모두에서 공통적으로 비만이 발생하였으나, 수컷 생쥐에서만 당뇨병과 간암이 추가로 발생하였다. 또, 유전변이
PHB 단백(tyrosine-114)을 지방세포와 대식세포에 과발현시킨 암컷과 수컷 모두에서 비만이 발생하였는데, 흥미롭게도 간암은 발생하지 않았으나 수컷 생쥐에서는 림프절종양이 발생했다. 따라서
PHB는 비만, 당뇨병, 종양발생과의 연관성을 시사하는 중요한 인자임이 판명된 바 있다[
10]. 따라서 본 연구에서 개발한
PHB 유전자 정량발현검사 키트는 이러한 비만, 당뇨병, 종양 발생과의 연관성 및 분자병태 생리를 규명하는 데에도 매우 유용하게 이용될수 있을 것으로 판단된다.
PHB는 진화론적으로 잘 보존된 세포내 단백으로서 핵, 세포질 및 세포내소기관등 다양한 세포내 부위에서 다양한 기능을 갖는다.
PHB1은 미토콘드리아 기능유지와 생성과정에 필요한 단백질의 입체구조 형성을 도와주는 단백인자(chaperone)이다[
11].
PHB1과 종양발생과의 연관성에 대해서는 최근 중요한 연구들이 보고되었는데, 특히 간세포암과 간담관암에서
PHB1단백 발현이 현저하게 감소되어 있음이 알려졌고, 이들 종양에서 추가적인 연구를 통해
PHB1이 MAT1A 양성 조절인자로 작용하고, 반면에
c-MYC,
MYFG와
c-MAF 발현은 억제함이 밝혀져서 간 및 담도계에서
PHB1 단백 발현의 감소는 간세포암 및 간담관암의 발병에 중요함이 보고된바 있다[
12]. 본 연구에서 개발한 키트는
PHB1과
PHB2 유전자 발현량을 각각 검사할 수 있어, 아직 간암으로 이행하지 않은 간전구암 병변조직이나 만성 염증성 간조직에 적용한다면 간암의 발생을 예측할수 있는 중요한 검사키트로도 사용할 수 있을 것으로 판단된다.
PHB2 단백은 미토콘드리아 내막에 위치하며 이의 기능은 개체 발달과정, 수명조절 등을 포함한 미토콘드리아 동력학(dynamics)을 포함한 다양한 세포 내 조절대사 과정에 중요하다[
13]. 손상되었거나 필요하지 않은 미토콘드리아 제거과정(mitophage)은 종양발생 억제, 신경퇴행성질환/노화예방, 세포기능 항상성 유지를 위해 필수적이다. 최근
PHB2는 mitophage 수용체로서 그 역할이 명확히 규명되었고, 정상적인 세포기능 유지에도 매우 중요한 단백이고,
PHB2 관련 병태생리는 종양 및 노화 병태생리를 비롯한 다양한 질환에서 그 중요성이 강조되고 있다[
14,
15]. 본 연구에서 개발한 GeneMediKit
®PHB2 RT-qPCR (GeneMedica)는 이러한
PHB2 유전자 발현량 뿐만 아니라,
PHB1 유전자 발현량 또한 모든 인체세포나 조직에 적용하여 검출할 수 있고 병원의 검사현장에서도 쉽게 이용할 수 있도록 개발되었다.
Go to :






 PDF
PDF Citation
Citation Print
Print





 XML Download
XML Download